Vastaisku tutkimuskadolle
TAYS houkuttelee varhaisvaiheen kliinisiä syöpälääketutkimuksia uuden tutkimusyksikön avulla. Kansainvälinen kilpailu tutkimuksista on kovaa.
Tässä se nyt on, Tampereen yliopistollisen sairaalan uusi ylpeydenaihe.
Syöpätautien osastolla, pitkän käytävän varrella on huone, jossa on rinnakkain kaksi sänkyä ja monitori. Täällä, aivan tavallisessa hoitohuoneessa toimii sairaalan uusi tutkimusyksikkö, joka keskittyy faasin I ja II kliinisiin syöpälääketutkimuksiin.
– Tämä on vastaisku sille, että kliinisten lääketutkimusten määrä on viime vuosina vähentynyt, kiteyttää naistentautien ja synnytysten ylilääkäri, professori Johanna Mäenpää.
Lääketehtaiden tutkimuksista käydään kansainvälisesti kovaa kilpailua. Pieni ja kallis Suomi ei pysty kilpailemaan hinnalla tai potilasmäärillä. Siksi sen täytyy kilpailla laadulla.
– Toimeksiantajia selvästi houkuttelee se, että meillä on tarjota tilat ja koulutettu henkilökunta tutkimusten toteuttamiseksi. Tutkimusyksikkö perustettiin syyskuussa, ja tutkimusten määrä kääntyi kasvuun jo vuoden lopulla, kertoo yksikön vastaava lääkäri, syöpätautien osastonylilääkäri Minna Tanner.
Hallinnollisesti yksikkö toimii TAYS:n tiedekeskuksen alla. Syöpätautien lisäksi siellä tehdään naistentautien, urologian ja hematologian alan syöpälääketutkimuksia. Haaveena on toteuttaa tutkimuksia myös lapsilla.
Useimmiten toimeksiantajana on lääketehdas, mutta tulevaisuudessa yksikköön pyritään saamaan myös omia, tutkijalähtöisiä tutkimuksia.
Pieni säästö, iso tappio
Kliinisten lääketutkimusten ansiosta potilaat saavat käyttöönsä uusimpia lääkekeksintöjä. Lääkärit ja hoitajat voivat kehittää ammattitaitoaan, ja sairaala säästää jopa miljoonia euroja lääkekustannuksissa.
– Ainoa haitta on se, että työtä on valtavasti. Jos tähän lähtee, täytyy olla motivoitunut. Lääketutkimuksia ei tehdä kahdeksasta neljään, Mäenpää naurahtaa.
Tanner ja Mäenpää korostavat, että yliopistosairaalan tehtävä on olla lääketieteellisen tutkimuksen kärjessä. Se ei kuitenkaan synny ilmaiseksi, vaan kuntien tulisi osoittaa toimintaan resursseja.
Uusi tutkimusyksikkö on saanut hankerahaa Pirkanmaan sairaanhoitopiiriltä ja TAYS:n tiedekeskukselta. Tulevaisuudessa sen on tarkoitus kattaa omat menonsa.
Suurin kuluerä yksikössä ovat tutkimushoitajien palkat.
– Kunnilta ei tule tähän lainkaan pysyvää rahoitusta. Kuitenkin jo yhden tutkimushoitajan vuosipalkalla voitaisiin saada lääkekustannuksissa miljoonasäästöt, Tanner huomauttaa.
Valtion tutkimusrahoitus on vähentynyt viime vuosina. Kunnat puolestaan katsovat, että tutkimus ei kuulu niille.
– Kaikki yrittävät säästää eikä kukaan ajattele kokonaisuutta. Joskus pienestä säästöstä tulee iso tappio, Mäenpää harmittelee.
Eettinen arviointi uusiksi?
Myös byrokratia ja viranomaisten tiukat laintulkinnat voivat estää kliinisten lääketutkimusten toteuttamista Suomessa.
Tämä ilmenee selvityksestä, jonka työ- ja elinkeinoministeriö teetti viime vuonna. Tarkoituksena oli kuvata, millaisia haasteita yritykset ja elinkeinoelämä näkevät terveysalan tutkimus- ja innovaatiotoiminnan säädösympäristössä.
Erityisesti esiin nousi alueellisten eettisten toimikuntien toiminta. Vastaajien mukaan toimikunnat kokoontuvat liian harvoin ja niiden ratkaisut, ohjeet ja prosessit vaihtelevat toisistaan.
Neuvotteleva virkamies Ulla Närhi sosiaali- ja terveysministeriöstä toteaa, että eettisten toimikuntien asemaa pohditaan parhaillaan, kun Suomessa toimeenpannaan EU:n kliinisten lääketutkimusten asetusta. Asetus kiristää muun muassa eettisen arvioinnin aikarajoja ja yhdenmukaistaa lupakäytäntöjä EU:ssa.
Johtaako tämä siihen, että Suomessa on tulevaisuudessa vain yksi kliinisiä lääketutkimuksia arvioiva eettinen toimielin?
– Tämä on vielä työn alla, mutta uskon, että alueelliset toimikunnatkin säilyvät, Närhi vastaa.
Ylilääkäri Johanna Honkalammi Fimeasta sen sijaan ennustaa, että näitä toimielimiä on tulevaisuudessa vain yksi. Honkalammi vastaa Fimeassa kliinisten lääketutkimusten arvioinnista.
– Eettiset toimikunnat ovat antaneet erilaisia lausuntoja, vaikka ohjeiden pitäisi olla kaikille samat. Uskon ja toivon, että uudistus saadaan toteutettua asetuksen toimeenpanon yhteydessä.
Kyse on priorisoinnista
Entä onko Suomen sairaaloissa riittävästi aikaa ja resursseja tehdä kliinistä lääketutkimusta?
– Se onkin hyvä kysymys. On varmasti ongelma, onko kumpaakaan, Ulla Närhi toteaa.
Viime kädessä on Närhen mukaan poliitikkojen tehtävä ratkaista, onko kliiniseen lääketutkimukseen edellytyksiä myös tulevaisuudessa.
– Kyse on priorisoinnista: mikä tässä valtakunnassa on tärkeää ja mihin halutaan satsata, hän pohtii.
Minna Tanner ja Johanna Mäenpää toivovat, että kliinisen tutkimuksen rahoitus turvattaisiin sote-uudistuksessa. Alku ei tosin näytä lupaavalta, sillä yliopistosairaalat uhkasivat unohtua edellisestä lakiluonnoksesta kokonaan.
Pattitilanne ratkesi
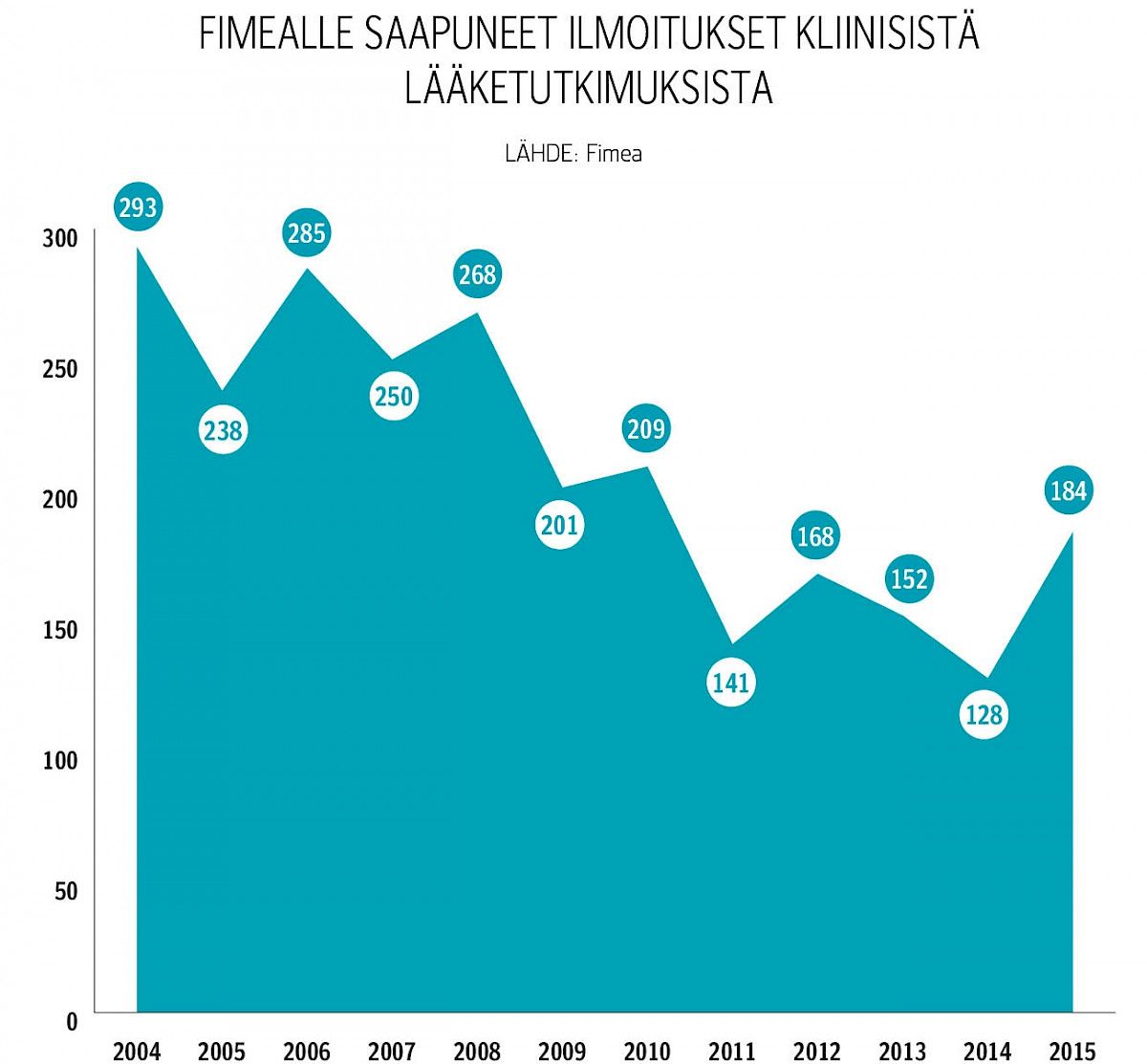
Kliinisten lääketutkimusten määrä on laskenut viime vuosina. Aallonpohja nähtiin vuonna 2014, jolloin Fimeaan ilmoitettiin vain 128 uutta lääketutkimusta.
Viime vuonna tilanne parani: ilmoituksia tehtiin 184, joista 129 koski kaupallisia ja 55 akateemisia tutkimuksia.
Yksi syy aallonpohjaan oli erimielisyys tietosuojalain tulkinnasta.
Yksi HUS:n tutkimuseettisistä toimikunnista linjasi keväällä 2012, että tutkittavan henkilötietoja ei saa säilyttää suostumuksen peruuttamisen jälkeen. Eduskunnan oikeusasiamies ja osa muidenkin sairaaloiden eettisistä toimikunnista asettui samalle kannalle. Fimea kuitenkin edellytti, että tietoja ei saa poistaa.
– Meille tuli tutkimusilmoituksia, joihin jouduimme pyytämään korjauksia. Sitten ne eivät menneetkään läpi eettisissä toimikunnissa. Siitä tuli pattitilanne, kuvailee ylilääkäri Johanna Honkalammi Fimeasta.
Helmikuussa 2015 lakia lääketieteellisestä tutkimuksesta muutettiin siten, että tutkittavan henkilötietoja saa käsitellä tutkimuksessa myös suostumuksen peruuttamisen jälkeen, jos se on tutkimuksen kannalta välttämätöntä.
Ranskan tapaus herättää kysymyksiä
Honkalammi pitää henkilötietoja koskevaa lakimuutosta hyvänä.
– Jos esimerkiksi Ranskan lääketutkimusonnettomuudessa vakavan haittavaikutuksen saanut henkilö haluaisi peruuttaa suostumuksensa, miten tiedot poistettaisiin? Eihän tuollaisia tietoja voi poistaa, se olisi tutkimuksen manipulointia, hän huomauttaa.
Viranomaiset ja asiantuntijat selvittävät parhaillaan, mitä Ranskan kohtalokkaassa lääketutkimuksessa tapahtui ja onko syytä muuttaa ohjeistusta, joka koskee ensimmäistä kertaa ihmisillä tehtäviä lääketutkimuksia.
Yksi henkilö kuoli ja useat saivat vakavia vammoja tutkimuksessa, jossa testattiin elimistön endokannabinoidijärjestelmään vaikuttavaa lääkettä.
– Itsekin haluaisin kovasti tietää, mikä meni vikaan ja missä voitaisiin parantaa, että tällaista ei pääsisi tapahtumaan, Honkalammi toteaa.
Oikaisu kuvatekstiin 14.3.2016 kello 9. Kuvassa olevan potilaan nimi on Hilkka Koivuniemi, ei Olkinuora.