Haimakirurgia ja haimasyövän diagnostiikka Pohjois-Karjalan keskussairaalassa 2014–2019
Lähtökohdat Suomessa haimakirurgiaa tekevistä yksiköistä leikkaushoidon tulokset on aiemmin julkaistu vain kahdesta.
Menetelmät Selvitimme rekistereistä Pohjois-Karjalan keskussairaalassa tehtyjen haimaleikkausten tulokset vuosilta 2014–19 käyttäen vertailukohtana huippukeskusten vähäisen riskin (Asa-luokka 1–2) potilaiden viiteaineistoa (n = 2 375). Seuranta-ajan mediaani oli 27,5 kuukautta.
Tulokset Haimaleikkauksia tehtiin yhteensä 89 ja niistä 55 kohdistui haiman päähän; näistä potilaista 66 % oli Asa-luokkaa 3–4 (vs. 0 %). Komplikaatioita ilmeni 45 %:lla (vs. 65 %) potilaista, ja niistä 18 % (vs. 20 %) oli vakavia. Sairaalakuolleisuus oli 1,8 % (vs. 1,6 %). Syöpäpotilaiden yhden vuoden tauditon elossaolo-osuus oli 55 % (vs. 42 %, p < 0,001) ja kolmen vuoden 25 % (vs. 0 %, p < 0,001). Imusolmukesaanto (13 vs. 18, p = 0,025) ja R1-resektioiden määrä jäi vertailuaineistosta (42 % vs. 27 %, p = 0,042). Vuosina 2018–2019 levinneisyysasteen I–II syövistä leikattiin 94 %. Mediaaniaika lähetteestä leikkaukseen oli 21 vrk.
Päätelmät Keskikokoisessa keskussairaalassa on mahdollista saavuttaa kansainvälisesti vertailukelpoiset hoitotulokset haimakirurgiassa.

Haimakirurgiaa pidetään yleisesti vaativana herkästi komplisoituvana kirurgian lajina. Tuoreessa 23 huippukeskuksen pienen leikkausriskin potilaiden aineistossa (1) jopa 70 %:lla potilaista oli 6 kuukauden seurannassa merkkejä leikkauskomplikaatiosta ja leikkauskuolleisuus oli 1,6 %. Toisaalta suuremman kirurgi- ja laitoskohtaisen volyymin yhteys leikkaustulokseen ja komplikaatioiden määrään on osoitettu. Suomessakin Kirurgiyhdistyksen nimissä on esitetty leikkausten keskittämistä jopa vain kahteen yksikköön.
Laaja asiaa koskeva kirjallisuus sisältää kuitenkin erittäin heterogeenisia tutkimuksia (2). Mittarina käytetään useimmiten leikkauskuolleisuutta. Taustadata ja volyymi-tulossuhde on esitetty jatkuvana muuttujana vain kahdessa tutkimuksessa (2,3). Niissä huomiota kiinnittää tulosten suuri vaihtelu jopa yli 50 leikkausta vuodessa tekevissä yksiköissä.
Haimapotilaiden diagnostiikka ja leikkauspäätöksen teko on perehtyneisyyttä vaativaa työtä. Haimasyöpä on biologisesti aggressiivinen, ja aikaikkuna, jolloin kasvain ylipäänsä on leikattavissa, on lyhyt (4). Tamperelaiset ovat tutkineet suomalaista haimasyövän hoitoa vuosien 2002–2003 ja 2008 kohorteissa (5,6). Histologisesti varmennetuista levinneisyysasteen I–III syövistä 24–49 % päätyi leikattaviksi. Kuuden maan kansainvälisessä vertailussa (7) osuudet levinneisyysasteen I–II syövistä olivat 38–70 % vuosina 2013–2014 ja Heidelbergin haimakeskuksessa 97 %. Myöhästyneitä diagnooseja mikään tutkimus ei toistaiseksi ole arvioinut.
Keskitetyn kirurgian yksiköistä leikkaustuloksensa on julkaissut vain Helsingin yliopistosairaala (8). Lisäksi Keski-Suomen keskussairaalasta on onkologiset tiedot sisältävä aineisto, josta kuitenkin puuttuvat leikkaustekniset ja komplikaatiotiedot (9). Tampereen yliopistosairaalasta on paljon takautuvia tutkimuksia vaihtelevin ryhmäjaoin pääosin 10–20 vuotta vanhoista kohorteista (5,6,10), mutta tuloskuvaukset ovat suppeita. Haimakirurgia on Suomessa keskittynyt merkittävästi tämän jälkeen, ja jäljellä on enää 7 yksikköä 19:n sijaan. Näin ollen tuloksia on syytä pitää pitkälti historiallisina. Kokonaisprosessia käsitteleviä julkaisuja ei ole.
Aineisto ja menetelmät
Pohjois-Karjalan keskussairaalassa kaikki raskas kirurgia on rekisteröity etenevästi vuodesta 2008 alkaen ja haimakirurgia vuodesta 1993. Nykyinen kahden kirurgin leikkaustiimi on vastannut toiminnasta 2014 alkaen, ja esitämme seuraavassa tulokset haimaleikkauksista sekä haiman ja pohjukaissuolen syövän hoidosta sen jälkeiseltä ajalta oppimiskäyräksi luettava vaihe mukaan lukien.
Leikattujen potilaiden tiedot on saatu sairaalan 129 muuttujaa sisältävästä haimaleikkausrekisteristä. Lähes kaikki tietokonetomografian perusteella paikallisesti edenneiksi tai levinneiksi arvioitua syöpää sairastavat potilaat käyvät sairaalassamme endoskooppisessa kaikututkimuksessa histologisen näytteen otossa ja neurolyyttisessä keliakussalpauksessa. Endoskooppisten kaikututkimusten rekisteri perustettiin vuoden 2018 alussa, ja siten kattavat tiedot kaikista haiman alueen syövistä mukaan lukien diagnostiikan kokonaisonnistuminen on saatavissa vuosilta 2018–2019. Endoskooppisten kaikututkimusten tulokset on julkaistu aiemmin (11).
Aineisto on analysoitu käyttäen R-ohjelmistoa (v.4.0.1). Aina kun mahdollista, tulokset on esitetty jatkuvina muuttujina ja koko aineiston kuvaavina pistediagrammeina. Aineisto on koottu intention-to-treat-periaatteella ja mukana ovat myös eksploraatioksi jääneet leikkaukset. Komplikaatiot on luokiteltu Clavien–Dindon luokituksella (12), haimafistelit ISGPS-luokituksella (International Study Group for Pancreatic Surgery) (13) ja syöpien levinneisyys on määritetty version 8 TNM-luokituksella. Hoitoprosessin kesto on arvioitu perusterveydenhuollon lähetteestä leikkaukseen ja sairaalahoidon kesto leikkauksesta kotiutumiseen mahdollinen terveyskeskusaika mukaan lukien. Onkologinen hoito katsottiin onnistuneeksi, mikäli yli 90 % suunnitelluista hoitokerroista toteutui. Annosten tarkistaminen ja hoidon vaihtaminen hyväksyttiin.
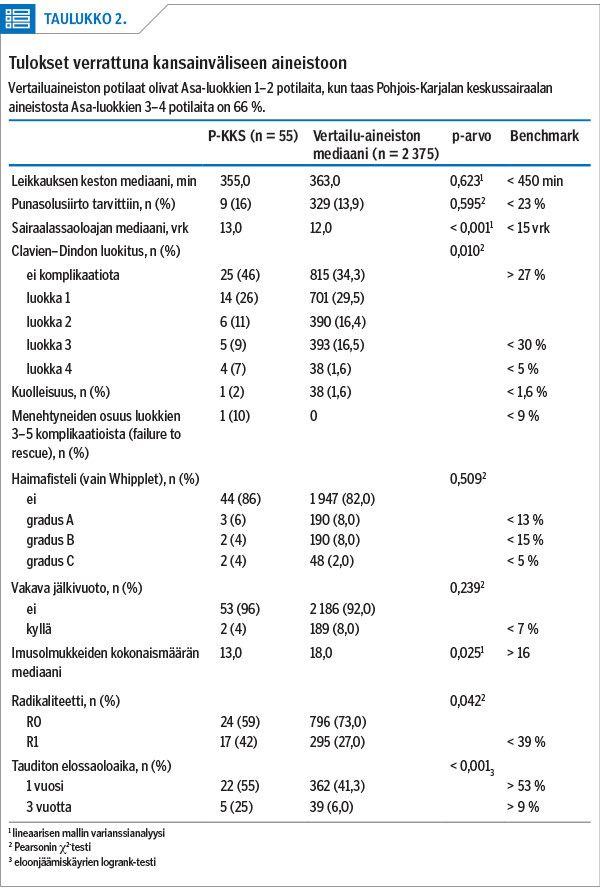
Laatuvertailussa on mukana haimaan pään kirurgia (mukana myös koko haiman poistot), koska tämän potilasryhmän laatustandardi on selvästi tarkimmin määritelty. Vertailuaineistona on tuore 23 kansainvälisen huippukeskuksen American Society of Anesthesiologyn (14) Asa-luokkien 1–2 potilaiden tuloksista muodostettu kokonaisuus (1). Tästä aineistosta on suljettu pois kaikki leikkausteknisesti hyvin vaativat tapaukset, sydänsairaat ja antikoagulaatiohoitoa saavat potilaat eli vertailukohtaa voi pitää kireänä. Elinaikavertailu tehtiin simuloimalla vertailuaineisto mediaanien mukaan kalibroiden. Comprehensive Complication Index -indeksi (CCI) jätettiin pois, koska sen mittaamiseen riittävää dataa ei ole rekisterissä. Kattavuuden maksimoimiseksi mukaan otettiin kaikki histologiset alatyypit, koska näiden levinneisyysvakioitu ennuste on hyvin identtinen (15,16,17,18).
Preoperatiivisen prosessin tasoa arvioitiin vertaamalla aineistoa kuuden maan rekisteritietoihin (7) sekä kotimaiseen historialliseen dataan (5). Mittarina käytettiin sitä osuutta potilaista, joiden levinneisyysasteen I–II syöpä leikattiin.
Tulokset
Pohjois-Karjalan keskussairaalassa tehtiin tutkimusaikana yhteensä 89 haimaleikkausta, joista 84 oli elektiivisiä toimenpiteitä ja 5 päivystyksellisiä haiman hännän poistoja; näistä kolmeen oli syynä katkennut haima, yhteen revennyt pernavaltimoaneurysma ja yhteen haimaan kiinni kasvanut, tukoksen aiheuttanut paksusuolisyöpä. Haimatiimin kirurgit vastasivat kaikista leikkauksista.
Tutkimusaikana kolme potilasta (2014, 2015 ja 2019) lähetettiin yliopistosairaalaan. Perusteena oli todennäköiseltä vaikuttanut teknisesti hyvin vaativa verisuonirekonstruktio.
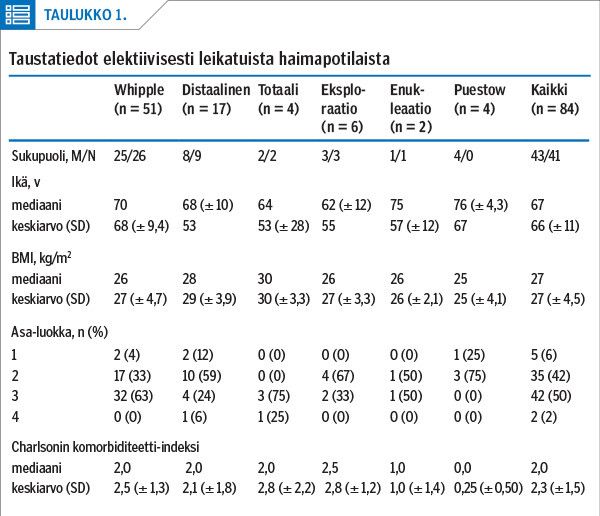
Leikkaukset lisääntyivät tutkimusaikana huomattavasti, ja 2019 tehtiin jo 24 toimenpidettä (liitekuvio 1 artikkelin sähköisessä versiossa, www.laakarilehti.fi > Sisällysluettelot > 40/2021). Potilaat olivat entistä sairaampia ja iäkkäämpiä (liitekuvio 2) ja 66 % kuului Asa-luokkiin 3–4. Elektiivisten potilaiden leikkauskohtaiset taustatiedot on esitetty taulukossa 1 ja ennen leikkausta käytettävissä olleet tiedot liitetaulukossa 1.
Onkologista hoitoa (liitetaulukko 2) annettiin syöpäpotilaista 63 %:lle, valtaosalle (91 %) leikkauksen jälkeisenä adjuvanttihoitona. Yleisimmin (59 %) käytettiin gemsitabiinia monoterapiana. Sädehoitoa ei käytetty. Hoidoista 76 % toteutui suunnitellusti.
Syöpäpotilaalla kesti perusterveydenhuollon lähetteestä (mistä tahansa syystä tehdystä) keskimäärin 21 vrk diagnoosiin, hoitoarvioon ja leikkaukseen pääsyyn (liitekuvio 3). Neoadjuvanttihoidossa olleet (3 potilasta) pois lukien prosessi kesti alle 6 viikkoa 90 %:lla potilaista.
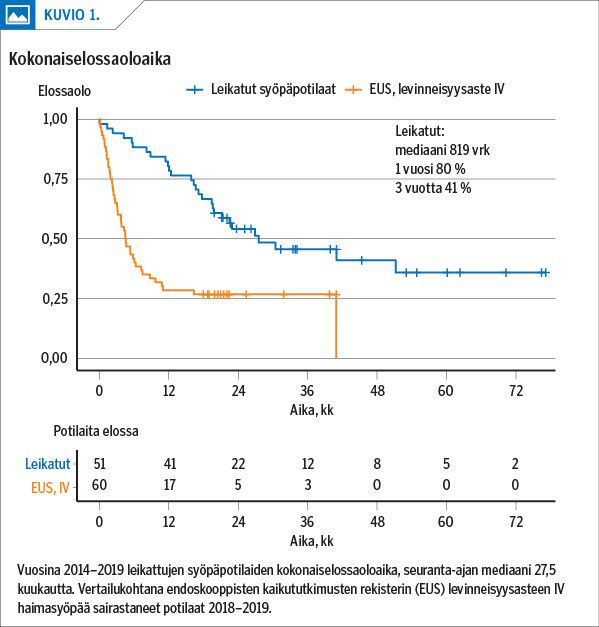
Keskimääräinen seuranta-aika oli 27,5 kuukautta. Leikatuista syöpäpotilaista oli elossa kolmen vuoden kohdalla 41 % (kuvio 1). Vuoden kohdalla taudittomia oli 55 % ja kolmen vuoden kohdalla 25 % (liitekuvio 4). Levinneisyysasteen I potilaita mukana aineistossa oli 8 ja heistä 2 menehtyi seuranta-aikana. Levinneisyysasteen II–III potilaiden elossaoloajan mediaani oli 23 kuukautta.
Vuosina 2018–19 diagnosoiduista 18 paikallisesta haimasyövästä leikattiin 17 (94 %). Leikkaamatta jääneellä potilaalla oli vaikea keuhkosairaus, jonka vuoksi hän oli keuhkonsiirtoarviossa (FEV1 0,47 l). Aineistossa ei ollut yhtään havaitsematta jäänyttä, myöhemmin paikallisesti edenneenä tai levinneenä löytynyttä syöpää, jota olisi pitänyt pystyä epäilemään esimerkiksi pitkäaikaisen vatsakivun, epäselvän haimatulehduksen, ikteruksen tai kuvantamislöydöksen vuoksi.
Lopulliset histopatologiset diagnoosit on esitetty liitekuviossa 5, täsmälliset leikkaustekniset tiedot liitetaulukoissa 3 sekä 4 ja komplikaatiot liitetaulukossa 5.
Laatuvertailuaineisto
Haiman pään resektioita tehtiin yhteensä 55, ja niistä neljään sisältyi haiman totaalipoisto. Viidesosa oli teknisesti monimutkaisia tapauksia, joissa tehtiin myös porttilaskimoresektio. Yhdelle potilaalle tehtiin lyhyt maksa-valtimoresektio suoralla saumalla.
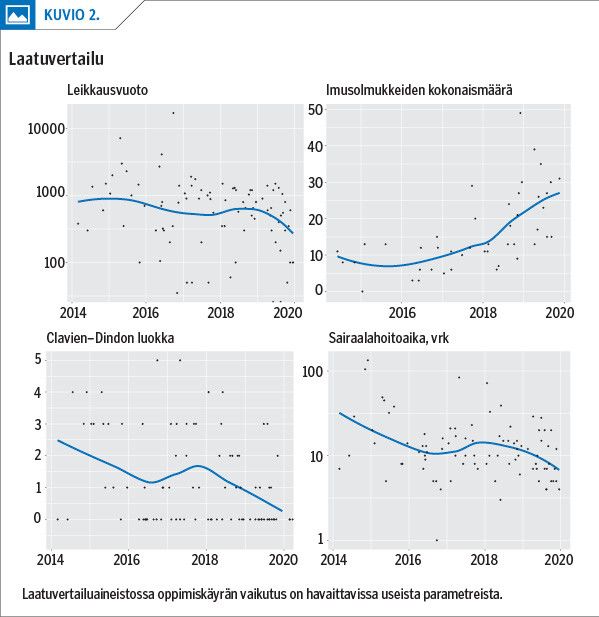
Leikkausten keskimääräinen kesto oli 360 minuuttia, ja se lyheni tutkimusaikana koko ajan huolimatta yhä monimutkaisempien tapausten hoidosta. Sama kehitys oli havaittavissa komplikaatioiden määrässä, lymfadenektomian laadussa, leikkausvuodossa sekä sairaalahoitoajan kestossa (kuvio 2).
Komplikaatioita ilmeni laatuvertailuainestossa 55 %:lla. Näistä 18 % oli vakavia yli Clavien–Dindon luokkaa 3. Yksi potilas menehtyi leikkauskomplikaatioon (porttilaskimotukos), ja sairaalakuolleisuus oli 1,8 %.
Syöpäkasvainten poistoista yli 1 mm:n marginaalin R0-resektioita oli 52 %. Imusolmukepositiivisia suuren uusimisriskin syöpiä oli 76 % (vertailuaineistossa 49 %).
Kasvainten keskimääräinen koko oli 4 cm ja imusolmukkeita oli histologisessa tutkimuksessa keskimäärin 16. Leikkaustekniikkaa muutettiin radikaalimmaksi 2017 ja sen seurauksena 2019 imusolmukkeiden määrä oli keskimäärin 25 (kuvio 2). Myös histopatologisen tutkimuksen protokolla päivitettiin samaan aikaan ja siirryttiin rakenteisen lausuntopohjan käyttöön.
Huippukeskusten aineistoon verrattuna laatukriteerit (taulukko 2) saavutettiin kaikilta osin paitsi R1-resektioiden ja imusolmukkeiden määrissä, jotka poikkesivat hieman vertailuaineistosta. Jos oppimiskäyrä huomioiden verrataan vain vuosia 2017–2019, myös nämä saavuttivat standardin. Samoin jos Asa-luokkien 3–4 potilaat huomioidaan, leikkauskuolleisuus oli alle vertailuaineiston (1,8 % vs. 3 %).
Pohdinta
Suomessa on viime vuodet käyty vilkasta keskustelua vaativan kirurgian työnjaosta. Keskittämisasetuksen perusteluissa tuodaan toistuvasti esiin suuremman leikkausvolyymin merkitys tuloksissa. On kuitenkin ilmeistä, ettei laatu synny pelkästään määrästä, vaan siihen vaikuttavat muutkin tekijät.
Kansainvälinen tutkimustyö yhä parempien kirurgian laatua arvioivien työkalujen kehittämiseksi on aktiivista. Nähdäksemme tässä käytetty useiden muuttujien yhdistelmä (1) minimoi tehokkaasti tilastokäsittelyyn sekä parametrien valintaan liittyvät manipulaatiomahdollisuudet. Esimerkiksi kuolleisuuden määritelmä tuottaa huomattavia eroja lukuihin (19). Leikkausresekaatin tutkimisella on suuri vaikutus oikeaan levinneisyysmääritykseen ja R1-resektioiden määrään (20). Histopatologisen tutkimuksen laatua parantaa hyvä kirurgin ja patologin välinen yhteistyö. Preparaatin etukäteismerkintä, käsittely ja näytteenotto tehdään vakioidusti (21) ja tuloksista annetaan myös rakenteinen vastaus.
Tutkimuksen vahvuutena pidämme aineiston kattavuutta. Alueellamme on ollut käytössä yhtenäinen potilastietojärjestelmä vuodesta 2010 alkaen. Vuosilta 2018–2019 on endoskooppisten kaikututkimusten rekisterin ansiosta käytettävissä kattavat tiedot kaikista haiman ja sappiteiden alueen syövistä. Puuttuvien potilaiden riskiä tässä prospektiivisessa aineistossa ei ole.
Tutkimukseen sisältyy myös epävarmuuksia. Leikkausmäärä on seuranta-aikana muuttunut merkittävästi ja keskimääräinen seuranta-aika jää siksi vaatimattomaksi elossaoloanalyysin kannalta. Toisaalta huippuyksiköitä vastaavat onkologiset (tauditon elinaika, R0-resektiot, lymfadenektomia) ja leikkaustekniset parametrit huomioon ottaen emme usko tämän vaikuttavan tuloksiin merkittävästi.
Näkemyksemme haimapotilaiden hoidon työnjaosta ei eroa merkittävästi yleisestä kansainvälisestä konsensuksesta. Potilaita on syytä hoitaa keskitetysti haimasairauksiin syvällisesti perehtyneiden ihmisten moniammatillisessa tiimissä yksiköissä, joissa hoidetaan riittävä määrä potilaita vuodessa.
Nähdäksemme parhaat tulokset ovat saavutettavissa vain, mikäli nämä samat ihmiset vastaavat kokonaisprosessista diagnostiikasta hoitotoimenpiteisiin ja jälkihoitoon, mukaan lukien mahdollisten komplikaatioiden hoito päivystysaikana. Potilaan näkökulmasta taas on suureksi eduksi, että hoitavan lääkärin asetelma on selkeä, päätöksillä on kasvot ja potilas-lääkärisuhde on horjumaton läpi vaikean sairauden hoitoprosessin.
Taustalla yksikössämme on ollut tietoinen valinta panostaa tähän potilasryhmään mm. kansainvälisissä huippuyksiköissä tapahtuvan kouluttautumisen ja laaja-alaisten endoskooppisten kaikututkimusten avulla (11). Jos samankaltaiset potilaat saavat teknisesti vastaavan hoidon, on tulosten oltava samoja.
Keskitetyn kirurgian ja hajautetun diagnostiikan järjestelmissä näyttää olevan ongelmana potilaiden ohjautuminen leikkauksiin. Suomellekin keskittämiskeskusteluissa esimerkkinä pidetyssä Norjassa vuosina 2013–2014 edelleen vain 38 % pääsääntöisesti leikattavissa olleista syövistä leikattiin (7). Verrattaessa lukuja Suomessa vuosiin 2003 ja 2008 (5) ei tilanne näytä juuri valoisammalta.
Haimasairauksien hoito on vaativaa, perehtyneisyyttä edellyttävää työtä. Suomessa työnjakoa säädettäessä hoidon kokonaisuutta tulee arvioida huolellisemmin etenkin diagnostiikan ja hoitoon ohjautumisen näkökulmasta. Pidämme erittäin tärkeänä, että toiminnan tuloksellisuutta arvioidaan paljon nykyistä laajemmin ja tarkemmin kansallisten rekisterien kautta. Pienemmän yksikkökoon tuomat edut, kuten saatavuus ja matala konsultaatiokynnys, eivät saa jäädä huomiotta.
Lauri Pautola, Risto Pirinen, Tanja Hulmi, Heikki Ahtola, Liisa Sailas, Johanna Turtiainen: Ei sidonnaisuuksia.
Ulla-Mari Arkko: Koulutus- ja kongressikulut (Pfizer, Pierre Fabre, Roche).
Tämä tiedettiin
Haimakirurgia on riskialtista ja vaativaa.
Kirurgi- ja yksikkökohtainen leikkausvolyymi vaikuttaa merkittävästi tuloksiin, mutta ei yksin ratkaise niitä.
Haimasyövän leikkaushoitoon ohjautumisessa on huomattavia eroja kansallisesti ja kansainvälisesti.
Tutkimus opetti
Haimaleikkausten määrä on merkittävästi kasvanut kymmenen viime vuoden aikana.
Pienessä yksikössä on mahdollista saavuttaa haimasyövän diagnostiikassa ja hoidossa huipputulokset.
- 1
- Sánchez-Velázquez P ym. Benchmarks in pancreatic surgery: a novel tool for unbiased outcome comparisons. Ann Surg 2019;270:211–8.
- 2
- Hata T ym. Effect of hospital volume on surgical outcomes after pancreaticoduodenectomy: a systematic review and meta-analysis. Ann Surg 2016;263:664–72.
- 3
- Yoshioka R ym. Impact of hospital volume on hospital mortality, length of stay and total costs after pancreaticoduodenectomy. Br J Surg 2014;101:523–9.
- 4
- Chari ST ym. Early detection of sporadic pancreatic cancer: summative review. Pancreas 2015;44:693–712.
- 5
- Ahola R ym. Access to radical resections of pancreatic cancer is region-dependent despite the public healthcare system in Finland. J Epidemiol Community Health 2018;72:803–8.
- 6
- Ahola R ym. Effect of centralization on long-term survival after resection of pancreatic ductal adenocarcinoma. Br J Surg 2017;104:1532–8.
- 7
- Huang L ym. Resection of pancreatic cancer in Europe and USA: an international large-scale study highlighting large variations. Gut 2019;68:130–9.
- 8
- Seppänen H ym. The results of pancreatic resections and long-term survival for pancreatic ductal adenocarcinoma: a single-institution experience. Scand J Surg 2017;106:54–61.
- 9
- Tahkola K ym. High immune cell score predicts improved survival in pancreatic cancer. Virchows Arch 2018;472:653–65.
- 10
- Ahola R ym. Pancreatic resections are not only safest but also most cost-effective when performed in a high-volume centre: A Finnish register study. Pancreatology 2019;19:769–74.
- 11
- Pautola L ym. Endoskooppinen kaikukuvaus keskussairaalassa. Duodecim 2019;135:2345–51.
- 12
- Clavien PA ym. The clavien-dindo classification of surgical complications: Five-year experience. Ann Surg 2009;250:187–96.
- 13
- Bassi C ym. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after. Surgery 2017;161:584–91.
- 14
- Mayhew D ym. A review of ASA physical status – historical perspectives and modern developments. Anaesthesia 2019;74:373–9.
- 15
- Kim BH ym. Long-term outcome of distal cholangiocarcinoma after pancreaticoduodenectomy followed by adjuvant chemoradiotherapy: A 15-year experience in a single institution. Cancer Res Treat 2017;49:473–83.
- 16
- Jiang Q-L ym. Prognostic factors and clinical characteristics of patients with primary duodenal adenocarcinoma: a single-center experience from China. Biomed Res Int, verkossa 27.12.2016. doi: 10.1155/2016/6491049
- 17
- You MS ym. Lymph node ratio as valuable predictor in pancreatic cancer treated with R0 resection and adjuvant treatment. BMC Cancer 2019;19(1):1–8.
- 18
- Williams JL ym. Association of histopathologic phenotype of periampullary adenocarcinomas with survival. JAMA Surg 2016;36:1592–608.
- 19
- Swanson RS ym. The 90-day mortality after pancreatectomy for cancer is double the 30-day mortality: more than 20,000 resections from the National Cancer Data Base. Ann Surg Oncol 2014;21:4059–67.
- 20
- Esposito I ym. Most pancreatic cancer resections are R1 resections. Ann Surg Oncol 2008;15:1651–60.
- 21
- Verbeke CS, Gladhaug IP. Resection margin involvement and tumour origin in pancreatic head cancer. Br J Surg 2012;99:1036–49.
Pancreatic surgery and diagnosis of pancreatic cancer in North Karelia Central Hospital 2014–2019
Background Currently two hospitals performing pancreatic surgery in Finland have published their results. We compared results from our mid-sized central hospital to previously published benchmark data (n = 2375) from low risk patients (ASA 1–2).
Methods Perioperative data were prospectively collected to a database. Data from patients with non-operable pancreatic region malignancy were imported from a separate endoscopic registry.
Results A total of 89 operations were done during the study period, 55 involving the pancreatic head. Altogether 66% of patients were ASA 3–4. Median follow-up time was 27.5 months. Complications occurred in 45% (vs 65%) of patients and 18% (vs 20%) were classified as serious. In-hospital mortality was 1.8% (vs 1.6%). One-year disease free survival for cancer patients was 55% (vs 42%, p < 0.001) and corresponding 3-year survival 25% (vs 0%, p < 0.001). Median lymph node yield (13 vs 18, p = 0.025) and number of R1 resections (42% vs 27%, p = 0.042) were under benchmark. During the years 2018–19 94% of stage I–II cancers were operated on. Median time from referral to operation was 21 days.
Conclusions It is possible to achieve similar results of diagnosis and treatment for operable pancreatic disease in a mid-sized hospital compared to high volume international centres.