Lääkkeiden saatavuushäiriöissä korvaava valmiste löytyy useimmiten
Lähtökohdat Lääkevalmisteiden saatavuushäiriöt ovat lisääntyneet voimakkaasti viime vuosina. Selvitimme saatavuushäiriölääkkeiden ominaisuuksia, kriittisyyttä ja korvaavia valmisteita Suomessa keväällä 2020.
Menetelmät Aineistona olivat Fimealle ilmoitetut saatavuushäiriöt (n = 879), joihin yhdistettiin tiedot Kelan lääketietokannasta, Fimean keskenään vaihtokelpoisten lääkkeiden luettelosta ja lääkevalmistetietokannasta. Lääkevalmiste arvioitiin kriittiseksi, jos se kuului WHO:n kriittisten lääkkeiden listalle tai Fimean velvoitevarastointiluetteloon.
Tulokset Suurin osa saatavuushäiriövalmisteista kuuluu avohoidossa yleisesti käytettyihin lääkeryhmiin, kuten sydän- ja verisuonisairauksien lääkkeisiin ja hermostoon vaikuttaviin lääkkeisiin. Tyypillisesti kyseessä oli elinkaarivaiheeltaan vanhempi ja hinnaltaan edullisempi valmiste, jolle on markkinoilla rinnakkaisvalmisteita. Kriittisiä lääkevalmisteita oli noin viidennes. Valtaosa (73 %) saatavuushäiriövalmisteista on mahdollista vaihtaa apteekissa rinnakkaisvalmisteeseen.
Päätelmät Lääkkeiden saatavuushäiriöt ovat lisääntyneet, mutta valtaosalle valmisteista on saatavilla korvaava lääke.

Lääkkeiden saatavuushäiriöt ovat kasvava ongelma niin Suomessa kuin maailmanlaajuisesti (1,2,3). Vuonna 2019 Fimealle ilmoitettiin ennätykselliset 1 694 saatavuushäiriötä, ja sama kehitys jatkui COVID-19-pandemian aiheuttaman lääkkeiden kysyntäpiikin kiihdyttämänä myös vuonna 2020 (4,5,6).
Saatavuushäiriöllä tarkoitetaan tilannetta, jossa valmisteen tarjonta ei pysty vastaamaan sen kansalliseen kysyntään ja tarpeeseen (7). Pahimmillaan ne voivat aiheuttaa katkoksia potilaan lääkehoitoon ja uhkan potilasturvallisuudelle. Ne myös lisäävät terveydenhuollon henkilöstön, lääkeyritysten ja viranomaisten työtä sekä aiheuttavat usein lisäkustannuksia (8,9,10).
Erityisen ongelmallisia voivat olla tilanteet, joissa saatavuushäiriö kohdistuu kriittiseksi luokiteltuihin valmisteisiin tai valmisteisiin, joille ei ole tarjolla korvaavaa vaihtoehtoa.
Lääkkeiden saatavuushäiriöitä on tutkittu vasta vähän. Pääosin Yhdysvaltoihin kohdistuneissa tutkimuksissa on kuitenkin todettu, että esimerkiksi pitkä markkinoilla oloaika sekä matala hintataso lisäävät niiden esiintymistä (3,11,12,13).
Tämän tutkimuksen tavoitteena on antaa yleiskuva avoterveydenhuollossa käytettävien lääkkeiden saatavuushäiriöistä Suomessa alkuvuonna 2020. Tutkimuksessa selvitetään, minkälaisia lääkevalmisteita häiriöt koskevat: mihin lääke- ja hintaryhmiin ne kuuluvat, kuinka suuri osuus on kriittisiä lääkevalmisteita, ja mihin lääkkeen elinkaarivaiheeseen häiriöiden kohteena olevat valmisteet kuuluvat. Lisäksi tarkastellaan häiriöiden ilmoitettuja kestoja sekä korvaavien valmisteiden olemassaoloa ja toimintavaihtoehtoja, joita on käytettävissä potilaan hoidon toteuttamiseksi.
Aineisto ja menetelmät
Aineistona käytettiin saatavuushäiriöilmoitusten tietoja, jotka lääkevalmisteiden myyntiluvan haltijat ovat toimittaneet Lääkealan turvallisuus- ja kehittämiskeskus Fimealle (14) ja jotka Fimea on julkaissut sivustollaan 14.2.–15.4.2020.
Ihmislääkkeet luokiteltiin sairaalassa tai avohoidossa käytettäviksi. Valmiste luokiteltiin sairaalavalmisteeksi, jos se on lääkemuotonsa tai antotapansa vuoksi käytössä pääasiassa ainoastaan terveydenhuollon toimintayksiköissä. Avohoidon valmisteeksi luokiteltiin lääkkeet, joita toimitetaan apteekeista suoraan asiakkaille. Eläinlääkkeitä ei tarkasteltu.
Saatavuushäiriöilmoituksista saatuja tietoja olivat valmisteen nimi ja valmistenumero, anatomis-terapeuttis-kemiallinen luokitus (ATC) (15), vaikuttavat lääkeaineet, vahvuus, pakkauskoko, lääkemuoto, maahantuoja, häiriön arvioitu alkamis- ja päättymispäivämäärä sekä tieto velvoitevarastoinnista.
Fimean aineistoon liitettiin lääkevalmisteiden hinta- ja korvattavuustiedot Kelan lääketietokannasta saatavuushäiriön alkaessa. Aineistoa täydennettiin tiedoilla vaihtokelpoisista lääkevalmisteista, pakkauskoista ja vahvuuksista. Täydennetyn aineiston perusteella määriteltiin toimintavaihtoehdot, jotka pyrkivät noudattamaan apteekin toimintamalleja saatavuushäiriötilanteissa. Ensisijainen vaihtoehto on suoraan vaihtokelpoinen valmiste. Tämän jälkeen tarkastellaan vaihtoehtoisen pakkauskoon tai vahvuuden olemassaoloa. Viimeisenä vaihtoehtona on samaan lääkeaineryhmään tai muuhun vaihtoehtoon vaihtaminen.
Lääkevalmiste määriteltiin kriittiseksi, jos se kuului Maailman terveysjärjestön WHO:n (16,17) kriittisten lääkkeiden listalle tai Fimean (18) velvoitevarastointiluetteloon. Valmisteen elinkaarivaihe luokiteltiin sen tai sitä vastaavan alkuperäisvalmisteen ensimmäisen myyntiluvan myöntämisvuoden perusteella Fimean lääkevalmistetietokannan tiedoista (19). Luokittelussa uuden lääkkeen vaihe käsittää myyntiluvan myöntövuodet 2010–2020, kilpailuvaihe vuodet 2000–2009 ja vanhan lääkkeen vaihe ajan ennen vuotta 2000.
Aineisto analysoitiin IBM SPSS Statistics -ohjelmistolla (v25.0). Menetelmänä käytettiin kuvailevia tilastollisia menetelmiä eli perustunnuslukujen ja jakaumien osaryhmittäistä analyysiä. Kaikki aineistot olivat avoimesti saatavilla.
Tulokset
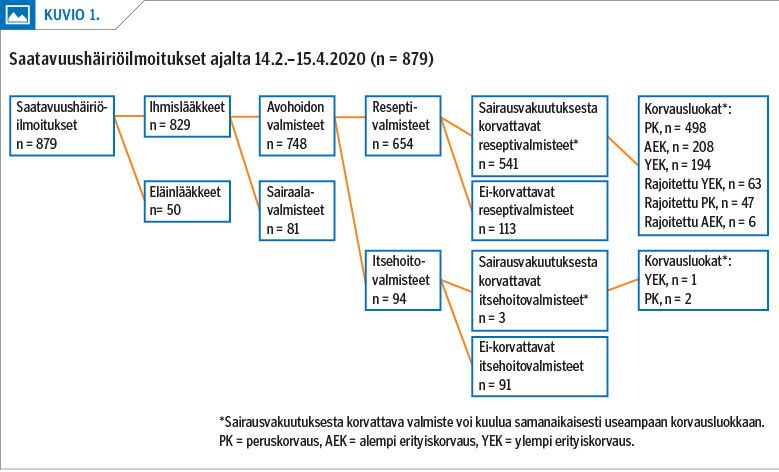
Tarkastelujakso sisälsi 829 ihmislääkkeiden saatavuushäiriöilmoitusta 329 lääkeaineesta tai lääkeaineiden yhdistelmästä. Suurin osa valmisteista (65 %) oli sairausvakuutuksesta korvattavia avohoidon reseptivalmisteita. Ei-korvattavia reseptivalmisteita oli 14 %, itsehoitolääkkeitä 11 % ja avohoidon ulkopuolella, pääasiassa sairaalavalmisteina käytettäviä lääkkeitä 10 % (kuvio 1).
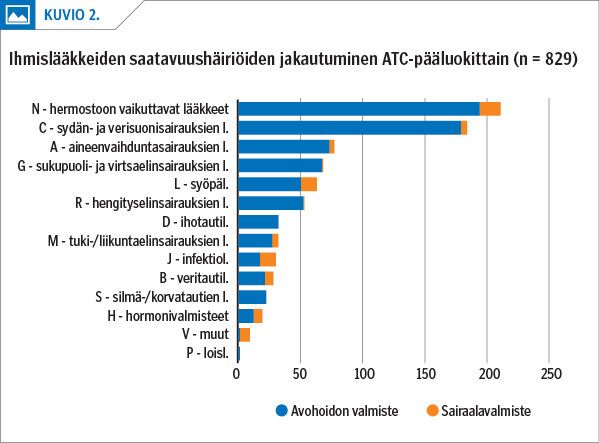
Saatavuushäiriöitä oli eniten hermostoon vaikuttavilla lääkkeillä ja sydän- ja verisuonisairauksien lääkkeillä (kuvio 2). Lääkeaineryhmistä eniten häiriöitä ilmoitettiin reniini-angiotensiinijärjestelmään vaikuttavista lääkeaineista, masennuslääkkeistä ja keskushermostoa stimuloivista lääkeaineista.
Avohoidon reseptivalmisteiden saatavuushäiriöilmoituksista kriittisten valmisteiden osuus oli kohtalaisen pieni, 19 %, kun huomioidaan sekä velvoitevarastoitavien että WHO:n kriittisten valmisteiden lista (taulukko 1). Yksittäisistä kriittisten valmisteiden lääkeaineista eniten ilmoituksia oli olantsapiinista ja parasetamolista.
Avohoidon reseptivalmisteiden saatavuushäiriöilmoituksista 53 % koski rinnakkaisvalmistajien tuotteita. Elinkaarivaiheeltaan vanhojen lääkkeiden osuus ilmoituksista oli suuri, 54 % (taulukko 1). Ensimmäinen myyntilupa elinkaarivaiheeltaan vanhoille lääkkeille oli myönnetty keskimäärin 30 vuotta sitten. Vanhojen lääkkeiden saatavuushäiriöissä alkuperäisvalmisteiden osuus oli 33 % ja rinnakkaisvalmisteiden 50 %. Kilpailuvaiheen valmisteista 17 % oli alkuperäisvalmisteita ja 67 % rinnakkaisvalmisteita. Rinnakkaistuontien osuus oli kilpailuvaiheessa 16 % ja vanhojen lääkkeiden vaiheessa 17 %. Uusien eli vuonna 2010 tai myöhemmin myyntiluvan saaneiden valmisteiden saatavuushäiriöistä 59 % koski alkuperäisvalmisteita, 29 % rinnakkaistuonteja ja 12 % rinnakkaisvalmisteita.
Avohoidon reseptilääkkeiden saatavuushäiriöilmoitukset koskivat pääosin edullisia valmisteita, ja yli 76 % niistä oli vähittäismyyntihinnaltaan alle 50 euron hintaisia (taulukko 1). Elinkaarivaiheeltaan vanhojen lääkkeiden vähittäismyyntihinnan mediaani oli häiriön alkaessa 17,6 euroa (ka 48,4 euroa), kilpailuvaiheen lääkkeiden 25,0 euroa (ka 122,5 euroa) ja uusien lääkkeiden 100,8 euroa (ka 324,8 euroa). Yli 300 euron hintaisten avohoidon valmisteiden (n = 33) saatavuushäiriöistä 52 % koski rinnakkaistuojien, 27 % alkuperäisvalmistajien ja 21 % rinnakkaisvalmistajien valmisteita.
Yli vuoden pituisiksi arvioitujen häiriöiden osuus avohoidon reseptivalmisteiden saatavuushäiriöistä oli 7,8 %. Rinnakkaisvalmisteiden saatavuusongelmien arvioidut kestot olivat keskimäärin pidempiä kuin alkuperäisvalmisteiden ja rinnakkaismaahantuontien (ka 154 vrk vs. 102 vrk alkuperäisvalmisteilla ja 114 vrk rinnakkaistuonneilla). Vain pieni osa (3 %) häiriöilmoituksista oli tehty Fimealle lääkelain määrittämää kahta kuukautta ennen myynnin keskeyttämistä; noin puolet ilmoituksista oli tehty vasta häiriön alkamispäivänä tai sen jälkeen.
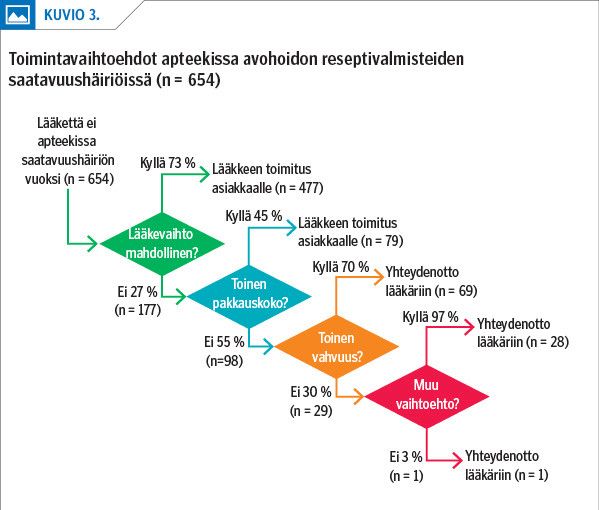
Saatavuushäiriöissä valtaosa (73 %) avohoidon reseptilääkkeistä oli mahdollista vaihtaa apteekissa rinnakkaisvalmisteeseen (kuvio 3). Toisaalta usein vaihtoehtoisia valmisteita oli vain yksi (12 %) tai kaksi (19 %). Keskimääräisesti eniten vaihtokelpoisia valmisteita oli sydän- ja verisuonisairauksien lääkeryhmässä (ka 3,5) ja vähiten ihotautilääkkeiden ryhmässä (ka 0,8). Lääkkeen elinkaarivaiheella on vaikutusta keskenään vaihtokelpoisten valmisteiden lukumäärään. Se oli suurin kilpailuvaiheessa (ka 4,2 vs. 3,3 vanhoilla lääkkeillä ja 1,8 uusilla lääkkeillä). Vähintään yksi vaihtokelpoinen valmiste löytyi saatavuushäiriöissä 39 %:lle uusista lääkkeistä, 79 %:ssa kilpailuvaiheen saatavuushäiriöistä ja 73 %:ssa vanhojen lääkkeiden saatavuushäiriöistä.
Niissä 27 %:ssa saatavuushäiriöistä, joissa rinnakkaisvalmistetta ei löytynyt, valmiste oli mahdollista korvata 45 %:ssa toisella pakkauskoolla. Mikäli toista pakkauskokoa ei ollut, 70 %:lle valmisteista oli saatavilla toinen vahvuus samasta lääkeaineesta. Muita mahdollisia korvaavia vaihtoehtoja löytyi kaikille paitsi yhdelle valmisteelle (Escherichia coli -kantainen ripulilääke) (kuvio 3). Muut vaihtoehdot tarkoittivat pääosin vaihtoa saman lääkeaineen tai lääkeaineryhmän valmisteeseen, mutta myös vaihtoa toiseen pakkausmuotoon, erityisluvalliseen valmisteeseen tai toiseen lääkemuotoon.
Kuitenkin vähintään 15 %:ssa avohoidon reseptilääkkeitä koskevista saatavuushäiriöistä korvaavan valmisteen löytäminen vaatii yhteydenottoa lääkäriin. Nämä koskivat muita useammin uudempia valmisteita, joille ei vielä ole kilpailijoita tai niitä on vasta vähän, tai ne olivat lääkemuodoltaan sellaisia, että vaihtomahdollisuuksia on saatavilla heikommin, kuten injektioita ja lääkelaastareita.
Pohdinta
Saatavuushäiriöt koskevat etenkin lääkevalmisteita, joilla hoidetaan väestössä yleisiä kansantauteja, kuten sydän- ja verisuonisairauksia ja mielenterveyden ongelmia. Näihin lääkeryhmiin kuuluvilla lääkkeillä on paljon käyttäjiä, joten saatavuushäiriöt koskettavat monen potilaan ja terveydenhuollon ammattilaisen arkea.
Tyypillisesti saatavuushäiriö koskee elinkaarivaiheeltaan vanhempaa ja hinnaltaan edullisempaa valmistetta, jolle on markkinoilla yksi tai useampia rinnakkaisvalmisteita. Myös aiemman tutkimuksen perusteella (11,12,13) saatavuushäiriöiden on todettu olevan todennäköisempiä hinnaltaan edullisemmilla rinnakkaisvalmisteilla. Hintasääntelyn ja toteutuneen hintakilpailun seurauksena tällaiset valmisteet eivät ole lääkeyrityksille yhtä kannattavia kuin uudemmat tai vähemmän aikaa markkinoilla olleet valmisteet, eikä yritysten kannata sitoa tuotantokapasiteettiaan näihin.
Kriittisten valmisteiden osuus ilmoitetuista avohoidon reseptilääkkeiden saatavuushäiriöistä oli 19 %, kun tarkastelussa huomioidaan sekä WHO:n kriittisten valmisteiden lista että Fimean velvoitevarastointiluettelo, ja 13 %, mikäli huomioidaan vain WHO:n kriittisten valmisteiden lista. Tämä on selvästi vähemmän kuin seitsemää EU-valtiota koskeneessa tutkimuksessa vuodelta 2014 (3) havaittu (30 %). Vertailussa on kuitenkin huomioitava lääkemarkkinoiden muuttuminen sekä WHO:n valmistelistan päivittyminen.
Saatavuushäiriöt vaikuttavat terveydenhuollon toimintaan yhä useammin. Useimmiten tilanteeseen pystytään reagoimaan vaihtamalla lääke rinnakkaisvalmisteeseen tai toiseen pakkauskokoon apteekissa. Yhteydenotot lääkäriin uuden reseptin määräämiseksi tai lääkkeiden jääminen tilattavaksi aiheuttavat sekä lisää työtä eri ammattilaisille että tyytymättömyyttä potilaissa (2).
Tämän tarkastelun perusteella 15 %:ssa avohoidon reseptilääkkeiden saatavuushäiriöistä yhteydenotto lääkkeen määränneeseen lääkäriin on välttämätön korvaavan valmisteen löytämiseksi. Todennäköisesti apteekin tulee kuitenkin olla yhteydessä lääkäriin useammin. Lääkevaihto ei esimerkiksi ole mahdollinen, jos lääkäri on kirjannut reseptiin lääkevaihtokiellon tai asiakas ei halua vaihtaa lääkettä. Lääkettä ei myöskään voida toimittaa asiakkaalle heti, jos vaihtokelpoista valmistetta ei juuri sillä hetkellä ole apteekin valikoimassa. Myöskään pientä pakkauskokoa ei voida vaihtaa merkittävästi suurempaan pakkauskokoon apteekissa.
Saatavuushäiriöiden yleisyys huomioon ottaen terveydenhuollon ammattilaisilla ja potilailla tulisi olla niiden ennakointiin nykyistä toimivampia työkaluja. Lisäksi osassa tapauksista voisi harkita apteekeissa tehtävän lääkevaihdon laajentamista koskemaan eri lääkemuotoja, jolloin esimerkiksi puikkovalmiste voitaisiin vaihtaa voiteeseen tai silmätippapipetit pullovalmisteeseen tai suurempi lääkevahvuus pienempään annosohjetta muokkaamalla.
Lääkkeiden apteekkikohtaisen saatavuustilanteen tarkistaminen onnistuu nykyään verkossa (20,21), ja maahantuojien ilmoittamat saatavuushäiriöt löytyvät Fimean (14) hakukoneesta ja Fimean julkaisemana avoimena datana. Saatavuushäiriötiedon tulisi kuitenkin olla myös suoraan lääkärin käytettävissä lääkettä määrättäessä, sillä se säästäisi niin lääkärin, potilaan kuin farmaseuttisen henkilökunnankin aikaa.
Tässä tutkimuksessa tarkasteltiin saatavuushäiriöitä Suomessa keväällä 2020. Aineiston keruun loppuvaiheessa Suomessa alkaneella COVID-19-pandemialla on todennäköisesti ollut jonkinlaista vaikutusta aineiston muodostumiseen.
Tulokset vastaavat aikaisempien kansainvälisten tutkimusten havaintoja (11,12,13), mikä oli odotettavaa, koska lääkemarkkinat ovat maailmanlaajuiset. Tutkimuksemme perusteella keväällä 2020 ilmoitetuissa saatavuushäiriöissä korvaava lääkevalmiste löytyi useimmiten. Tilanne voi kuitenkin muuttua jatkossa, joten lainsäädäntöä ja tietojärjestelmiä tulisi kehittää etupainotteisesti lääkehoidon jatkuvuuden turvaamiseksi.
Tiina Tapanila, Heini Kari, Hanna Koskinen: Ei sidonnaisuuksia.
Tämä tiedettiin
Lääkkeiden saatavuushäiriöt ovat yleistyneet sekä Suomessa että kansainvälisesti.
Saatavuushäiriöt lisäävät terveydenhuollon ammattilaisten työtä ja uhkaavat lääkehoidon jatkuvuutta.
Tutkimus opetti
Saatavuushäiriöt koskevat etenkin lääkevalmisteita, joilla hoidetaan väestössä yleisiä kansantauteja.
Tyypillisesti saatavuushäiriövalmiste on elinkaarivaiheeltaan vanhempi ja hinnaltaan edullisempi lääkevalmiste, jolle on markkinoilla yksi tai useampia rinnakkaisvalmisteita.
Valtaosalle löytyy markkinoilta korvaava valmiste.
- 1
- Council of the European Union. Note from the general secretariat of the council to permanent representatives committee. Preparation of the Employment, Social Policy, Health and Consumer Affairs Council session on 9 December 2019 European pharmaceutical policy - strengthened cooperation and coordination with the aim to improve access to medicines – policy debate. 22 November 2019.
- 2
- Heiskanen K, Ahonen R, Karttunen P, Kanerva R, Timonen J. Medicine shortages – A study of community pharmacies in Finland. Health Policy 2015;119:232–8.
- 3
- Pauwels K, Huys I, Casteels M, Simoens S. Drug shortages in European countries: a trade-off between market attractiveness and cost containment? BMC Health Serv Res 2014;14(438).
- 4
- Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Fimean tilinpäätös ja toimintakertomus 2019. Lääkealan turvallisuus- ja kehittämiskeskus Fimea, 2020.
- 5
- Paaskoski S, Linnolahti J, Luhtanen P. Lääkkeiden saatavuus poikkeuskeväänä 2020. Sic! 3/2020.
- 6
- Heino P, Kainu M, Kari H, Koskinen H, Rättö H, Saastamoinen LK. Uusi sovellus lääkekulutuksen seurantaan – lääkkeiden hamstraus suurimmillaan viikolla 12. Kelan tutkimusblogi 3.4.2020. https://tutkimusblogi.kela.fi/arkisto/5254
- 7
- Euroopan lääkevirasto EMA. Guidance on detection and notification of shortages of medicinal products for Marketing Authorisation Holders (MAHs) in the Union (EEA). EMA/674304/2018, 2019.
- 8
- De Oliveira GS, Theilken LS, McCarthy RJ. Shortage of perioperative drugs: implications for anesthesia practice and patient safety. Anesth Analg 2011;113:1429–35.
- 9
- Lau B, Khazanie U, Rowe E, Fauman K. How a drug shortage contributed to a medication error leading to baclofen toxicity in an infant. J Pediatr Pharmacol Ther 2016;21:527–9.
- 10
- Said A, Goebel R, Ganso M, Zagermann-Muncke P, Schulz M. Drug shortages may compromise patient safety: Results of a survey of the reference pharmacies of the Drug Commission of German Pharmacists. Health Policy 2018;122:1302–9.
- 11
- U.S. Food and Drug Administration FDA. Drug shortages: root causes and potential solutions. A report by the drug shortages task force. U.S Food and Drug Administration 2019.
- 12
- Dave CV, Pawar A, Fox ER, Brill G. Predictors of drug shortages and association with generic drug prices: A retrospective cohort study. Value Health 2018;21:1286–90.
- 13
- Alevizakos M, Detsis M, Grigoras CA, Machan JT, Mylonakis E. The impact of shortages on medication prices: Implications for shortage prevention. Drugs 2016;76:1551–8.
- 14
- Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Saatavuushäiriöt. (siteerattu 6.10.2020). https://www.fimea.fi/laakehaut_ja_luettelot/saatavuushairio-uusi
- 15
- WHO Collaborating Centre for Drug Statistics Methodology. ATC. Structure and principles. (päivitetty 15.2.2018). www.whocc.no/atc/structure_and_principles/
- 16
- World Health Organization Model List of Essential Medicines, 21st List, 2019. Geneva: World Health Organization 2019.
- 17
- WHO. The Selection and use of essential medicines: report of the WHO Expert Committee on Selection and Use of Essential Medicines, 2019 (including the 21st WHO Model List of Essential Medicines and the 7th WHO Model List of Essential Medicines for Children). WHO Technical Report Series 1021. Geneva: World Health Organization; 2019.
- 18
- Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Velvoitevarastointiluettelo. (siteerattu 6.10.2020). https://www.fimea.fi/valvonta/velvoitevarastointi/velvoitevarastointiluettelo
- 19
- Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Lääkehaku. (siteerattu 6.10.2020). https://www.fimea.fi/laakehaut_ja_luettelot/laakehaku
- 20
- Suomen Apteekkariliitto. (siteerattu 15.2.2021). https://www.apteekki.fi/laakehaku.html
- 21
- Yliopiston Apteekki. (siteerattu 15.2.2021). www.ya.fi
A replacement medicine is available in most drug shortage cases
Background Drug shortages have increased sharply in recent years. We investigated the characteristics and criticality of the drugs in shortage, as well as the existence of substitution products, in Finland in spring 2020.
Methods The data comprised drug shortages reported to the Finnish Medicines Agency (Fimea) (n = 879), which were combined with information from Kela’s pharmaceutical database, Fimea’s list of interchangeable medicines and Fimea’s pharmaceutical database. A drug was considered critical if it was listed on the World Health Organization’s list of essential medicines and/or on Fimea’s list of products to be stocked as mandatory reserve supplies.
Results Most of the drugs in shortage are medicines commonly used in outpatient care, such as medicines for cardiovascular diseases and medicines that affect the nervous system. The typical drug in short supply is an older and more affordable product for which there are one or more generics on the market. About one-fifth of the medicines were considered critical. The majority (73%) of drugs in short supply can be substituted by an interchangeable product at community pharmacies.
Conclusions Although there has been an increase in the amount of drug supply shortages, a replacement medicine is available in most short supply cases.