Levinneen suonikalvoston melanooman hoito on kautta Suomen kansainvälistä tasoa
LähtökohdatSilmän suonikalvoston levinneen melanooman (uveamelanooma) hoitosuositukset vaihtelevat. Keräsimme väestöpohjaisen aineiston, jonka avulla selvitimme, onko yliopistopiirien välillä eroa elossaoloajassa tai hoitolinjoissa.
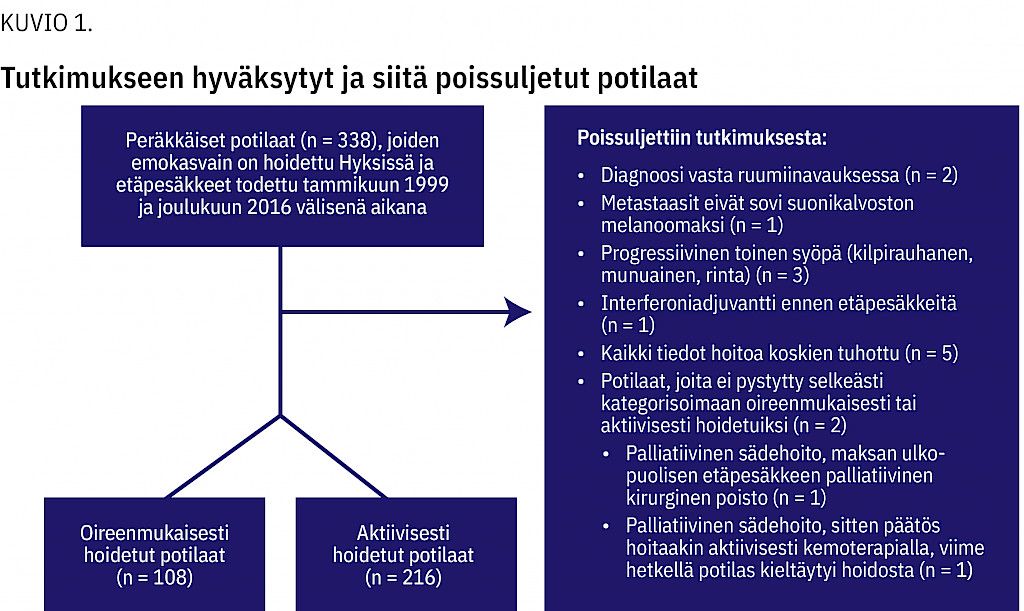
MenetelmätAineistona oli 338 potilasta, joiden emokasvain oli hoidettu keskitetysti Hyksissä ja joiden levinnyt tauti todettiin 1999–2016 ja hoidettiin hajautetusti eri sairaanhoitopiireissä. Potilaat jaoteltiin Suomessa kehitetyn levinneisyysluokituksen, ensilinjan hoidon ja yliopistosairaalapiirin mukaan.
TuloksetOireenmukaista hoitoa sai 33 % potilasta ja aktiivista 67 %, yliopistosairaalapiireittäin 21–40 % ja 60–79 %. Vastaavat elossaoloajan mediaanit olivat 1,6 kk ja 12 kk ja koko kohortissa 9,0 kk. Aktiivisesti hoidetusta leikattiin 9 %. Hoitotutkimuksiin osallistui 4 % potilaista. Suotuisimmassa levinneisyysluokassa IVa (ennuste ≥ 12 kk) oireenmukaisesti ja aktiivisesti hoidettujen elossaoloajat olivat 12 kk ja 18 kk. Levinneisyysluokissa IVa ja IVb (6–12 kk) elossaoloajat yliopistopiireittäin olivat toisiinsa verrattavat (p = 0,90 ja 0,91). Luokassa IVc (< 6 kk) oli eroa, mutta se hävisi tarkemmassa analyysissä (p = 0,33).
PäätelmätYliopistosairaalapiirien tulokset vastaavat toisiaan ja kansainvälistä tasoa.

Suonikalvoston eli uvean melanooma on aikuisten yleisin silmäsyöpä. Siihen luetaan värikalvon, sädekehän ja suonikalvon melanoomat. Tautiin sairastuu vuosittain maailmassa noin 7 000 ja Suomessa noin 65 potilasta (1,2). Se poikkeaa epidemiologialtaan, kasvaingenetiikaltaan ja lääkeherkkyydeltään merkittävästi limakalvojen ja ihon melanoomista.
Uveamelanoomat kasvavat hitaasti mutta leviävät varhain, jopa neljä vuotta ennen emokasvaimen löytymistä (3). Leviäminen tapahtuu veriteitse ensisijaisesti maksaan. Puolet sädekehän tai suonikalvon melanoomaan sairastuneista menehtyy etäpesäkkeisiin (4).
Levinneen uveamelanooman ensilinjan hoidosta ei ole yksimielisyyttä. Hoitoon on käytetty solunsalpaajia usein yhdistelmänä tai maksavaltimoon annettuna, immunologisia hoitoja, ihomelanooman hoitoon kehitettyjä täsmälääkkeitä ja maksapesäkkeiden radioembolisaatiota. Minkään hoidon ei ole voitu osoittaa pidentävän elossaoloaikaa (5,6). Elossaoloajan mediaani on 13 kk, ja ani harvoin elossaoloaika on yli 5 v (5,6,7). Etäpesäkkeiden kirurginen poisto on mahdollisesti poikkeus, mutta se sopii vain niille potilaille, joilla leviäminen maksaan on rajoittunutta (5,6). Liitännäishoitojenkaan hyödyllisyydestä ei ole näyttöä (8).
Toisin kuin emokasvaimen hoitoa, levinneen uveamelanooman hoitoa ei ole Suomessa keskitetty. Tuoreessa väitöskirjatutkimuksessa kerättiin valtakunnallinen aineisto levinnyttä tautia sairastavista kokonaiskuvan saamiseksi (5,6,9,10,11). Tässä artikkelissa pyrimme selvittämään, eroavatko hoitolinjat ja elossaoloaika yliopistopiirien välillä.
Aineisto ja menetelmät
Tutkimussuunnitelmaa puollettiin Helsingin ja Uudenmaan sairaanhoitopiirin eettisessä toimikunnassa, Valvirassa ja osallistuneissa sairaanhoitopiireissä.
Lähtöaineistona ovat potilaat, joiden levinnyt uveamelanooma todettiin 1.1.1999–31.12.2016 välisenä aikana ja joiden emokasvain hoidettiin Hyksin silmätautien klinikassa, minne sen hoito on valtakunnallisesti keskitetty. Lähdeaineiston 338 potilaasta valintakriteerit täytti 324 potilasta (kuvio 1). Yleisin poissulkusyy oli potilasasiakirjojen tuhoaminen (n = 5): lain mukaan säilytysaika on 12 v kuolemasta (Sosiaali- ja terveysministeriön asetus potilasasiakirjoista 298/2009). Tilasimme asiakirjat hoitoon osallistuneista toimintayksiköistä. Tarkistimme Syöpärekisteristä, että aineisto kattoi kaikki sairastuneet. Seuranta-ajan lopussa 31.12.2018 elossa oli yksi oireenmukaisesti ja 14 aktiivisesti hoidettua potilasta.
Jotta vertaisimme mahdollisimman samankaltaisia potilaita keskenään ja elossaoloaikojen vertailu olisi siten mahdollisimman asianmukaista, jaoimme potilaat kolmeen luokkaan kokonaiselossaoloajan odotteen mukaan. Helsinki University Hospital Working Formulation -luokitus on kehitetty Hyksissä aikaisemman väitöskirjatyön yhteydessä (12). Luokituksen osuvuus varmennettiin Euroopan silmäkasvainryhmän monikeskustutkimuksella (13). Luokittelu perustuu potilaan suorituskykyyn (ECOG, Eastern Cooperative Oncology Group asteikko), plasman alkaalisen fosfataasin pitoisuuteen (AFOS) ja suurimman mitattavissa olevan etäpesäkkeen suurimpaan läpimittaan, ja sen voi tehdä laskurilla (www.prognomics.org/huhwf.aspx). Näiden levinnyttä tautia kuvaavien luokkien IVa, IVb ja IVc kokonaiselossaoloajan odotteen mediaanit ovat ≥12, < 12–6 ja < 6 kk.
Jaottelimme potilaat toissijaisesti sen mukaan, oliko ensilinjan hoito oireenmukainen (14,15) vai aktiivinen. Oireenmukaisesti hoidetuista potilaista viisi sai kipusädehoidon. Aktiiviset hoitomuodot jaottelimme ennen aineiston analysoimista. Lopuksi jaottelimme potilaat sen mukaan, missä yliopistosairaalapiirissä hoitomuodosta oli päätetty.
Tutkimuksen päätetapahtuma on kokonaiselossaoloaika hoitopäätöksestä laskettuna. Vertasimme aktiivisesti hoidettujen potilaiden elossaoloaikaa avoimesti julkaistuun meta-analyysiaineistoon, johon sisältyi 2494 aktiivisesti hoidettua potilasta (5). Seuraavaksi vertasimme elossaoloaikaa eri yliopistosairaalapiireissä huomioiden levinneisyysluokat. Käytimme Kaplan–Meierin menetelmää sekä log-rank-testiä ja sen trendiversiota (Stata versio 17). Pidimme p-arvoa < 0,05 tilastollisesti merkitsevänä. Monivertailut korjasimme Bonferronin menetelmällä.
Tulokset
Oireenmukaisesti hoidettujen potilaiden seuranta-ajan mediaani oli 3,2 v melanooman leviämisestä (vaihteluväli 0,2–17 v) ja aktiivisesti hoidettujen 3,8 v (vaihteluväli 0,1–24 v) (taustatiedot liitetaulukossa 1). Edeltävä etäpesäkkeettömän ajan mediaani oli 2 v 4 kk (vaihteluväli 0–22 v, kvartaaliväli 13–52 kk). Etäpesäkkeiden vuosittainen seulonta oli ollut säännöllistä 97 %:lla (n = 314). Oireenmukaista hoitoa sai 108 potilasta ja aktiivisesti hoidettiin 216.
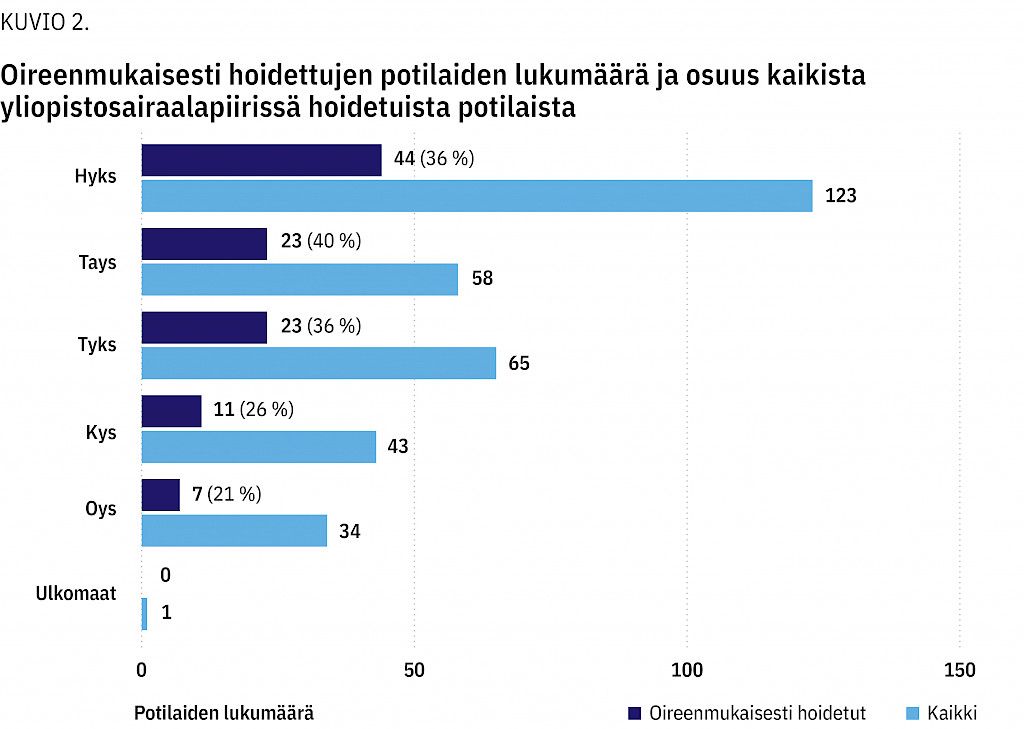
Oireenmukaisesti hoidettiin kaikista potilaista Oysissa 21 % (n = 7), Kysissä 26 % (n = 11), Tyksissä 36 % (n = 23), Hyksissä 36 % (n = 44) ja Taysissa 40 % (n = 23) (kuvio 2).
Aktiiviset hoitomuodot olivat eri solunsalpaajat (n = 43, yleisimmin dakarbatsiini yksinään), DOBC-hoito (dakarbatsiini, vinkristiini, bleomysiini ja lomustiini) interferonin kanssa tai ilman (n= 104), maksan radioembolisaatio (SIRT) (n = 22), kirurginen poisto (n = 19), interferoni tai interleukiini-2 (n = 14), tarkistuspisteen estäjät (n = 8), transarteriaalinen kemoembolisaatio (n = 3), maksan termoterapia (n = 2) ja imatinibi (n = 1). Lääketutkimuksiin ensilinjassa osallistui 12 potilasta.
Aktiivisesti hoidetuista potilaista leikattiin Tyksissä 10 % (n = 4), Hyksissä ja Taysissa 9 % (n = 7 ja 3), Oysissa 7 % (n = 2) ja Kysissä 6 % (n = 2). Yksi potilas leikattiin ulkomailla.
Etäpesäkkeiden toteamishetkellä oireettomia oli 64 % kaikista potilaista (n = 208). Hoitopäätöshetkellä 93 %:lla (n = 297) oli maksaetäpesäkkeitä. Suurimman pesäkkeen suurimman halkaisijan mediaani oli 30 mm (vaihteluväli 2–270 mm). AFOS ylitti viiteylärajan 38 %:lla (n = 119; tulos käytettävissä 313 potilaalla). Suorituskyky oli hyvä (ECOG 0–1) 67 %:lla, kohtalainen (ECOG 2) 12 %:lla ja heikko (ECOG 3–4) 20 %:lla. Oireenmukaisesti hoidetuista se oli hyvä 32 %:lla (n = 35) ja heikko 51 %:lla (n= 55) ja vastaavasti aktiivisesti hoidetuista 83 %:lla (n = 180) ja 4 %:lla (n = 8). Oireenmukaisesta hoidosta päätettiin nopeammin (viipeen mediaani etäpesäke-epäilystä oli 29 päivää, kvartaaliväli 7,5–63) kuin aktiivisesta hoidosta (56 päivää, kvartaaliväli 34–92). Yleisin yksittäinen syy pitkään viiveeseen oli ei-diagnostinen ensimmäinen kudosnäyte (n = 26).
Oireenmukaisesti hoidetuista 24 % (n = 26) kuului levinneisyysluokkaan IVa, 19 % (n = 20) luokkaan IVb ja 55 % (n = 59) luokkaan IVc. Aktiivisesti hoidetuista vastaavat prosenttiosuudet olivat 66 % (n = 143), 17 % (n = 37) ja 15 % (n = 33). Kuuden potilaan tiedot eivät riittäneet levinneisyysluokan määrittämiseen. Levinneisyysluokan IVa potilaista hoidettiin oireenmukaisesti Oysissa 14 % (n = 1), Hyksissä 20 % (n = 9), Tyksissä 23 % (n = 5), Taysissa 26 % (n = 6), ja Kysissä 36 % (n = 4).
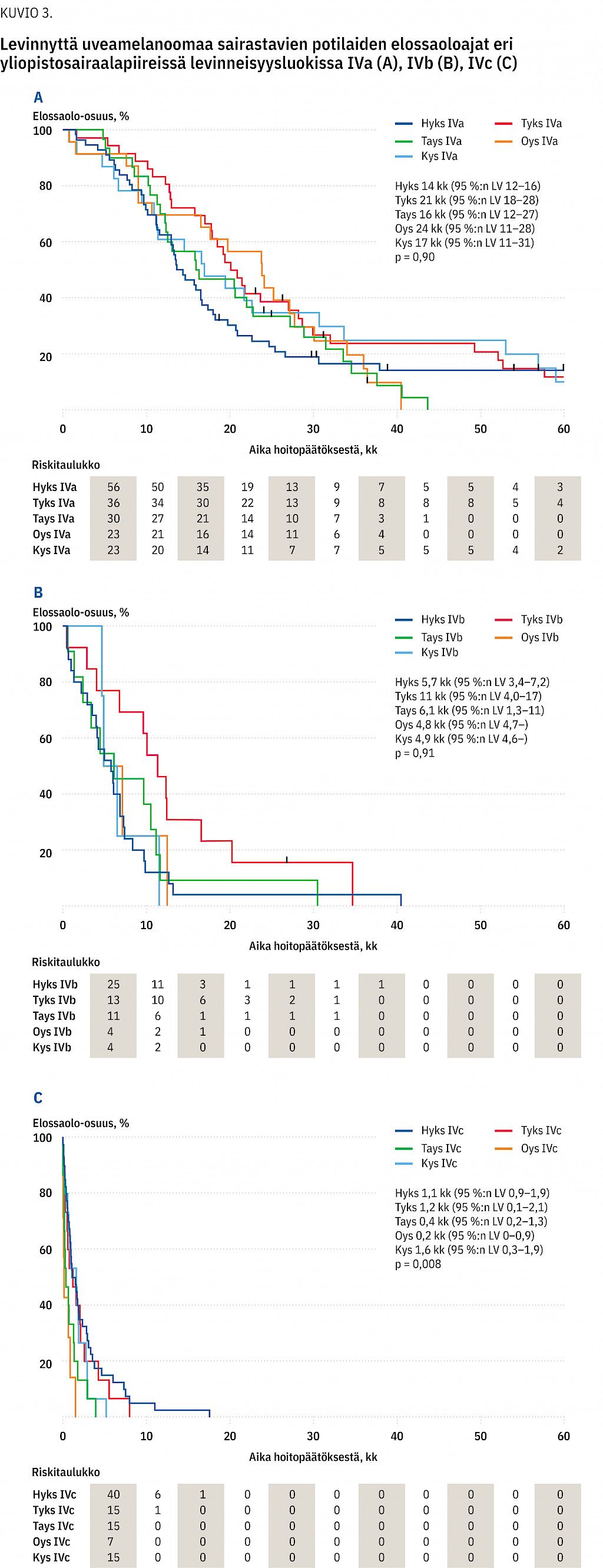
Oireenmukaisesti hoidettujen kokonaiselossaoloaika oli 1,6 kk (95 %:n luottamusväli, LV 0,9–2,9; p < 0,001 verrattuna aktiivisen hoitoon, log-rank-testi), mutta levinneisyysluokassa IVa se oli 12 kk (95 %:n LV, 9,5–21) ja levinneisyysluokassa IVb 5,7 kk (95 %:n LV, 0,7–11; p < 0,001, log-rank-trenditesti). Aktiivisesti hoidettujen kokonaiselossaoloaika, 12 kk (95 %:n LV, 11–14), vastasi kansainvälistä meta-analyysiaineistoa (13 kk; p = 0,80, log-rank-testi) (5). Levinneisyysluokassa IVa se oli 18 kk (95 %:n LV, 16–21), luokassa IVb 7 kk (95 %:n LV, 4,8–9,7) ja luokassa IVc 1,9 kk (95 %:n LV, 1,6–2,9; p < 0,001, log-rank-trenditesti).
Kokonaiselossaoloaika ei vaihdellut merkittävästi yliopistosairaalapiirien välillä levinneisyysluokassa IVa (p = 0,90, Bonferroni-korjattu log-rank testi) ja IVb (p = 0,91) (kuviot 3 a ja b), mutta luokassa IVc p-arvo oli merkitsevä 0,008 (kuvio 3 c). Ero aiheutui potilaista, jotka elivät alle viisi päivää. Heidän suorituskykynsä arvioitiin heikoksi, levinneisyysluokka oli IVc ja ensilinjan hoito oli oireenmukainen. Alle viisi päivää eläineitä potilaita oli kaikkiaan 17; Hyksissä 4, Tyksissä 3, Taysissa 4, Kysissä 2 ja Oysissa 4. P-arvo ei ollut merkitsevä, kun alle 5 päivää eläneet poistettiin analyysistä (p = 0,33).
Päätelmät
Aktiivisesti hoidettujen levinnyttä uveamelanoomaa sairastavien potilaiden kokonaiselossaoloaika (12 kk) oli kansainvälistä tasoa (5). Elossaoloajat olivat samankaltaiset levinneisyysluokissa IVa–IVb eri yliopistosairaalapiireissä. Yliopistosairaalapiireissä hoidetaan oireenmukaisesti 21–40 % potilaista.
Suomessa etäpesäkkeiden seuranta oli säännöllistä 97 %:lla potilaista. Seurannasta ja seurantamenetelmistä ei ole kansainvälistä yhteisymmärrystä. Koska ensisijainen leviämispaikka on maksa, sen kuvantaminen on olennaisin osa seurantaa (16). Ylävatsan kaikututkimuksen herkkyys on 96 % (11). Lisäksi seurataan maksaentsyymipitoisuuksia. Kun kaikukuvaus tai maksa-arvot antavat aiheen epäillä maksaetäpesäkettä, ohjelmoidaan maksan magneettikuvaus (2,11,17). Aihetta epäilylle antaa uusi maksamuutos kaikututkimuksessa tai maksaentsyymipoikkeavuudet (erityisesti AFOS, laktaattidehydrogenaasi) vailla muuta selittävää syytä.
Kun etäpesäkkeitä epäillään, pyritään leviäminen varmistamaan histologisesti karkeaneulanäytteellä etenkin, jos suunnitellaan aktiivihoitoa (4,18). Kudosnäyte oli otettu 73 %:lta suomalaisia potilaita (9). Näyte palvelee myös molekyyligenetiikkaa mahdollisia uusia täsmälääkkeitä ajatellen. Tietokonekuvaus ei ole yhtä herkkä havaitsemaan uveamelanooman maksaetäpesäkettä kuin magneettikuvaus (11,19). Ennen maksan paikallishoitoa tarvitaan kuitenkin vartalon tietokonekuvaus, koska hoitoa ei anneta, jos etäpesäkkeitä on muuallakin.
Vaikka levinneen taudin hoidosta ei ole kansainvälistä yhteisymmärrystä, eräät maat ja erikoisalajärjestöt ovat laatineet kansallisia ohjeistuksia (20,21,22,23,24,25,26). Niiden metodologia ja sovellettavuus kliiniseen työhön on arvioitu puutteellisiksi (27). Suomessa 33 % potilaista hoidettiin oireenmukaisesti, mikä on verrattavissa Alankomaihin, jossa osuus oli 39 % (28). Kummankin väestöpohjaisen aineiston prosenttiosuudet olivat verrattavissa ulkomaisten erityistason hoitokeskusten vastaaviin lukuihin (29,30,31).
Tuoreessa väitöskirjassa on jo todettu, että suomalaisten aktiivisesti hoidettujen potilaiden kokonaiselossaoloajan mediaani levinneisyysluokassa IVa vastasi oireenmukaisesti hoidettujen potilaiden elossaoloaikaa, paitsi perinteisellä solunsalpaajahoidolla ja kirurgialla: ensin mainitulla mediaani oli lyhyempi ja viimeksi mainitulla pidempi (6,10). Väitöskirja osoitti, että validoidun levinneisyysluokituksen ja asianmukaisten verrokkien käyttäminen on välttämätöntä tutkimustulosten tulkitsemiseksi (6,10).
Etäpesäkkeen kirurginen poistoyritys tehtiin vain 6 %:lle suomalaisista potilaista. Ranskassa maksakirurgiaan perehtyneissä sairaaloissa prosenttiosuus on suurempi, 32 % (32). Maksaetäpesäkkeiden poistoa suositellaan, jos voidaan tavoitella täydellistä poistoa, edeltävä kaukoetäpesäkevapaa aika on > 24 kk, suorituskyky on hyvä, eikä tautia ole maksan ulkopuolella (32). Täydellinen kirurginen poisto on kuitenkin harvoin mahdollinen maksan useiden etäpesäkkeiden takia.
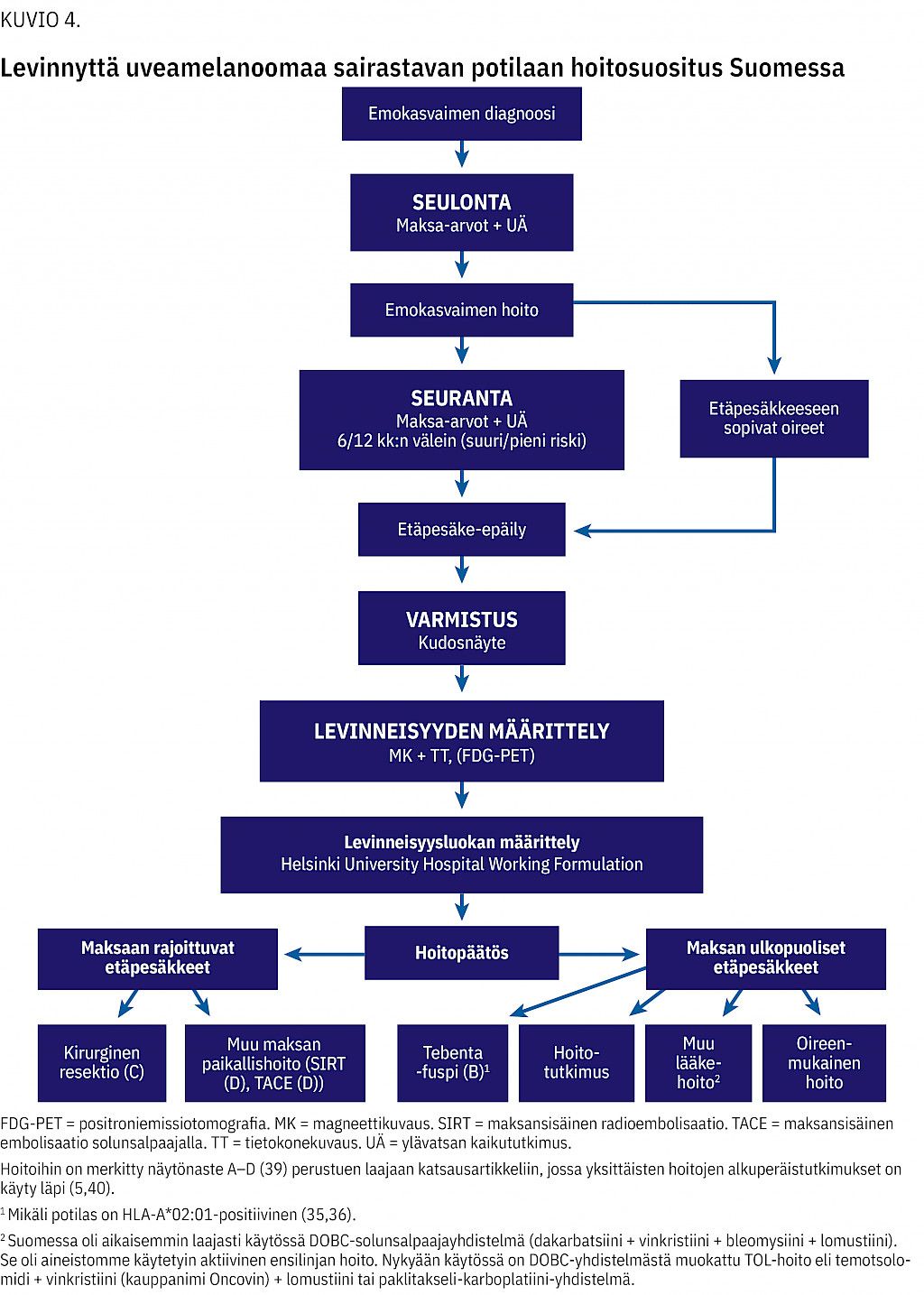
Suomalaisista aktiivisesti hoidetuista potilaista hoitotutkimuksiin osallistui vain 12 %, kun Alankomaissa osuus oli 50 % (28). Hoitotutkimuksiin osallistumista suositellaan, jos etäpesäkkeen poisto tai muut maksan paikallishoidot kuten SIRT eivät tule kyseeseen (20,21,24,33). SIRT on Suomessa nykyisin ensisijainen hoito, jos etäpesäkkeet eivät ole poistettavissa ja potilas soveltuu hoitoon. SIRT:n osuus kaikista hoidoista on siksi nyt suurempi kuin tutkimuksessamme. Kirjoittajien suositus levinnyttä uveamelanoomaa sairastavan potilaan seurannasta ja hoidosta esitetään kuviossa 4.
Immunoterapia on tehnyt läpimurron levinneen ihomelanooman hoidossa, kun anti-PD1-hoidoilla potilaiden pitkän ajan ennuste on merkitsevästi parantunut (34). Sen sijaan uveamelanooman hoidossa vain tebentafuspin on hiljattain julkaistussa satunnaistetussa hoitotutkimuksessa todettu pidentävän elossaoloaikaa (tebentafuspia saaneilla 22 kk ja verrokeilla 16 kk) vaikkakin objektiivisen hoitovasteen sai vain 9 % (35). Tebentafuspi on ensimmäinen lääke, jolla on voitu osoittaa elinaikahyötyä levinneessä uveamelanoomassa ja joka on saanut Euroopan lääkevirastolta myyntiluvan sen hoitoon (36).
Tutkimuksemme vahvuus on tietojen täydellisyys: suorituskykyarvio puuttui 2 %:lta, AFOS 11 %:lta ja suurimman etäpesäkkeen suurin halkaisija 9 %:lta. Heikkous on, että meillä ei ollut tietoa somaattisista geenivirheistä. Hiljattain on todettu, että BAP1-geenivirhe lyhentää ja SF3B1-geenivirhe pidentää elossaoloaikaa (37,38).
Uveamelanooma on yleistynyt väestön vanhetessa, ja Suomessa potilaita on jo noin 65 vuodessa. Levinnyttä tautia sairastavien ennusteen parantamiseksi tarvitaan uusia lääkekeksintöjä. Niiden tuloksia arvioitaessa on tärkeä käyttää validoituja levinneisyysluokituksia.
Kirjoittajien ilmoittama käsikirjoitukseen liittyvä rahoitus:
Evald ja Hilda Nissin Säätiö, Helsinki University Hospital Research Fund, Mary och Georg C. Ehrnrooths Stiftelse, Silmä- ja kudospankkisäätiö, Silmäsäätiö, Suomen Lääketieteen Säätiö
Taulukko 1.Elina S. Rantala: Apurahat (Mary ja Georg C. Ehrnroothin säätiö, Silmäsäätiö, Silmä- ja kudospankkisäätiö, Evald ja Hilda Nissin säätiö, Suomen Lääketieteen säätiö, Helsinki University Hospital Research Fund).
Meri-Sisko Vuoristo: Konsultointi (Novartis), matka-, majoitus- tai kokouskulut (Novartis, Pfizer), muut (Suomen Melanoomaryhmä ry:n hallituksen jäsen 31.12.2019 asti).
Micaela Hernberg: Konsultointi (Novartis, BMS, MSD).
Tero T. Kivelä: Apurahat (Hyksin erityisvaltionosuusrahoitus, Sigrid Juseliuksen säätiö, Syöpäsäätiö), luentopalkkio (Santen Finland), lisenssitulot ja tekijänpalkkiot (Kustannus Oy Duodecim).
Tämä tiedettiin
•Levinnyttä uveamelanoomaa sairastavien kokonaiselossaoloaika on keskimäärin 13 kk.
•Kirurginen poisto on ainoa yksittäinen hoitomuoto, johon liittyy varmuudella pidempi elossaoloaika verrattuna perinteiseen solunsalpaajahoitoon tai oireenmukaiseen hoitoon.
Tutkimus opetti
•Kokonaiselossaoloajat eri yliopistosairaalapiireissä ovat kansainvälistä tasoa ja toisiinsa verrattavissa.
•Validoidun levinneisyysluokituksen ja asianmukaisten verrokkien käyttäminen on välttämätöntä hoitotutkimusten oikean tulkinnan kannalta.
•Ennusteen parantamiseksi tarvitaan uusia lääkekeksintöjä, satunnaistettuja prospektiivisia asetelmia ja tietoa etäpesäkkeiden kasvaingenetiikasta.
- 1
- 15Lee RT, Ramchandran K, Sanft T, Von Roenn J. Implementation of supportive care and best supportive care interventions in clinical trials enrolling patients with cancer. Ann Oncol 2015;26:1838–45.
- 2
- Kivelä T. Incidence, prevalence and epidemiology of ocular melanoma. Kirjassa: Murray TG, Boldt HC, toim. Ocular melanoma: advances in diagnostic and therapeutic strategies. London, UK: Future Medicine Ltd 2014. s. 20–38.
- 3
- Rantala ES, Hernberg MM, Lundin M, Lundin J, Kivelä TT. Metastatic uveal melanoma managed with best supportive care. Acta Oncol 2021;60:135–9.
- 4
- Rantala ES, Peltola E, Helminen H, Hernberg M, Kivelä TT. Hepatic ultrasonography compared with computed tomography and magnetic resonance imaging at diagnosis of metastatic uveal melanoma. Am J Ophthalmol 2020;216:156–64.
- 5
- Eskelin S, Pyrhönen S, Hahka-Kemppinen M, Tuomaala S, Kivelä T. A prognostic model and staging for metastatic uveal melanoma. Cancer 2003;97:465–75.
- 6
- Kivelä TT, Piperno-Neumann S, Desjardins L ym. Validation of a prognostic staging for metastatic uveal melanoma: a collaborative study of the European Ophthalmic Oncology Group. Am J Ophthalmol 2016;168:217–26.
- 7
- Cherny NI, Catane R, Kosmidis P. ESMO takes a stand on supportive and palliative care. Ann Oncol 2003;14:1335–7.
- 8
- Choudhary MM, Gupta A, Bena J, Emch T, Singh AD. Hepatic ultrasonography for surveillance in patients with uveal melanoma. JAMA Ophthalmol 2016;134:174–80.
- 9
- Rantala ES, Peltola E, Helminen H, Hernberg MM, Kivelä TT. Ylävatsan kaikukuvaus löytää suonikalvoston melanooman etäpesäkkeet. Duodecim 2020;136:2257–8.
- 10
- Patel M, Winston CB, Marr BP ym. Characterization of computed tomography scan abnormalities in patients with biopsy-proven hepatic metastases from uveal melanoma. Arch Ophthalmol 2011;129:1576–82.
- 11
- Balasubramanya R, Selvarajan SK, Cox M ym. Imaging of ocular melanoma metastasis. Br J Radiol 2016;89:20160092.
- 12
- Rantala ES, Tulokas S, Kivelä TT, Hernberg M. Silmämelanooma. Duodecim 2019;135:1443–52.
- 13
- Weis E, Salopek TG, McKinnon JG ym. Management of uveal melanoma: a consensus-based provincial clinical practice guideline. Curr Oncol 2016;23:e57–64.
- 14
- Mathis T, Cassoux N, Tardy M ym. Prise en charge des mélanomes oculaires, le minimum pour les oncologues. Bull Cancer 2018;105:967–80.
- 15
- Seth R, Messersmith H, Kaur V ym. Systemic therapy for melanoma: ASCO guideline. J Clin Oncol 2020;38:3947–70.
- 16
- Rao PK, Barker C, Coit DG ym. NCCN Guidelines Insights: Uveal melanoma, version 1.2019. J Natl Compr Canc Netw 2020;18:120–31.
- 17
- Nathan P, Cohen V, Coupland S ym. Uveal melanoma UK national guidelines. Eur J Cancer 2015;51:2404–12.
- 18
- Chadha V, Cauchi P, Kincaid W ym. Consensus statement on metastatic surveillance for uveal melanoma in Scotland 2019. www.nhsggc.org.uk/media/256054/consensus_full_paper_final_version.pdf.
- 19
- Tays. Maksakasvainpotilaan hoitopolku 2021. www.tays.fi/fi-FI/Palvelut/Vatsaelinsairaudet/Maksan_muutokset/Maksakasvainpotilaan_hoitopolku(98610).
- 20
- Steeb T, Hayani KM, Förster P ym. Guidelines for uveal melanoma: a critical appraisal of systematically identified guidelines using the AGREE II and AGREE-REX instrument. J Cancer Res Clin Oncol 2020;146:1079–88.
- 21
- Jochems A, van der Kooij MK, Fiocco M ym. Metastatic uveal melanoma: treatment strategies and survival-results from the Dutch melanoma treatment registry. Cancers (Basel) 2019;11:1007.
- 22
- Lane AM, Kim IK, Gragoudas ES. Survival rates in patients after treatment for metastasis from uveal melanoma. JAMA Ophthalmol 2018;136:981–6.
- 23
- Eskelin S, Pyrhönen S, Summanen P, Hahka-Kemppinen M, Kivelä T. Tumor doubling times in metastatic malignant melanoma of the uvea: tumor progression before and after treatment. Ophthalmology 2000;107:1443–9.
- 24
- Seedor RS, Eschelman DJ, Gonsalves CF ym. An outcome assessment of a single institution's longitudinal experience with uveal melanoma patients with liver metastasis. Cancers (Basel) 2020;12:117.
- 25
- Nicholas MN, Khoja L, Atenafu EG ym. Prognostic factors for first-line therapy and overall survival of metastatic uveal melanoma: The Princess Margaret Cancer Centre experience. Melanoma Res 2018;28:571–7.
- 26
- Mariani P, Piperno-Neumann S, Servois V ym. Surgical management of liver metastases from uveal melanoma: 16 years' experience at the Institut Curie. Eur J Surg Oncol 2009;35:1192–7.
- 27
- National Comprehensive Cancer Network. Uveal melanoma (version 1.2021) 2021. www.nccn.org/guidelines/guidelines-detail?category=1&id=1488.
- 28
- Warner AB, Palmer JS, Shoushtari AN ym. Long-term outcomes and responses to retreatment in patients with melanoma treated with PD-1 blockade. J Clin Oncol 2020;38:1655–63.
- 29
- Nathan P, Hassel JC, Rutkowski P ym. Overall survival benefit with tebentafusp in metastatic uveal melanoma. N Engl J Med 2021;385:1196–206.
- 30
- Oravilahti T, Grönholm E, Hyvärinen A, Lamminsalo M. Tebentafuspi silmän suonikalvoston melanooman hoidossa: Lääkealan turvallisuus- ja kehittämiskeskus Fimea 2022. www.julkari.fi/handle/10024/144992
- 31
- Singh AD, Zabor EC, Radivoyevitch T. Estimating cured fractions of uveal melanoma. JAMA Ophthalmol 2021;139:174–81.
- 32
- Grimes J, Shoushtari AN, Orloff M ym. Clinical characteristics of SF3B1 mutant (mut) uveal melanoma (UM) and response to immune checkpoint inhibition (ICI). J Clin Oncol 2021;39(15_suppl):9535.
- 33
- Käypä hoito. Näytön asteen määrittely. Hoitosuositustyöryhmien käsikirja 2016. www.terveysportti.fi/dtk/khk/khk00007
- 34
- Kujala E, Mäkitie T, Kivelä T. Very long-term prognosis of patients with malignant uveal melanoma. Invest Ophthalmol Vis Sci 2003;44:4651–9.
- 35
- Rantala ES, Hernberg MM, Piperno-Neumann S, Grossniklaus HE, Kivelä TT. Metastatic uveal melanoma: The final frontier. Prog Retin Eye Res 2022:101041.
- 36
- Rantala ES, Hernberg M, Kivelä TT. Overall survival after treatment for metastatic uveal melanoma: a systematic review and meta-analysis. Melanoma Res 2019;29:561–8.
- 37
- Rantala ES, Kivelä TT, Hernberg MM. Impact of staging on survival outcomes: a nationwide real-world cohort study of metastatic uveal melanoma. Melanoma Res 2021;31:224–31.
- 38
- Khoja L, Atenafu EG, Suciu S ym. Meta-analysis in metastatic uveal melanoma to determine progression free and overall survival benchmarks: an International Rare Cancers Initiative (IRCI) ocular melanoma study. Ann Oncol 2019;30:1370–80.
- 39
- Triozzi PL, Singh AD. Adjuvant therapy of uveal melanoma: current status. Ocul Oncol Pathol 2014;1:54–62.
- 40
- Rantala ES. Metastatic uveal melanoma: Diagnosis by imaging and stage-stratified overall survival. Helsingin yliopisto 2020.
Treatment of metastatic uveal melanoma in Finland
BackgroundNo consensus exists regarding the treatment of metastatic uveal melanoma. We report the overall survival (OS) of Finnish patients by treatment and by university hospital district on the basis of a nation-wide dataset.
MethodsThis nation-wide study included 338 patients who were treated for primary uveal melanoma in Helsinki University Hospital and who were diagnosed with metastases between 1999 and 2016. The patients were categorized by the Helsinki University Hospital Working Formulation, the first-line treatment and the university hospital district.
ResultsOf all patients, 33% were managed with best supportive care and 67% received active treatment, the corresponding rates by university hospital district being 21–40% and 60–79%, respectively. Median overall survival was 1.6 months for best supportive care, 12 months for active treatment, and 9.0 months for the whole cohort. Of the actively treated patients, 9% received surgical resection. Of all patients, 5% participated in trials. In stage IVa (predicted OS ≥ 12 months), median OS for actively treated patients was 18 months and for those who received best supportive care 12 months. OS was comparable regardless of university hospital district for stages IVa and IVb (predicted OS 6–12 months), (p = 0.90 and p = 0.91). For stage IVc, the difference disappeared on closer analysis (p = 0.33).
ConclusionsOverall survival rates between the university hospital districts were comparable, and also internationally. Considering the new emerging treatment modalities, biopsy of metastases is recommended.
Elina S. Rantala, Meri-Sisko Vuoristo, Micaela Hernberg, Tero T. Kivelä
Elina S. Rantala
M.D., Ph.D.
University of Helsinki and Helsinki University Hospital, Department of Ophthalmology