Psykoosilääkkeitä käyttävien lasten kasvua tulisi seurata tarkemmin
Lähtökohdat Lasten psykoosilääkehoidon seuranta vaihtelee ja on usein puutteellista. Taysin lastenpsykiatrian vastuualueella otettiin vuonna 2015 käyttöön psykoosilääkehoidon seurantaohjelma. Tutkimus selvitti seurannan toteutumista kolme vuotta ohjelman käyttöönoton jälkeen.
Menetelmät Aineisto koostui 81:stä alle 13-vuotiaasta potilaasta, joille aloitettiin psykoosilääkehoito Taysissa 1.1.2018 alkaen. Potilaskertomuksista kerättiin tiedot lääkehoidon aloitus- ja seurantakäynneistä. Tuloksia verrattiin Taysissa 2013–2014 tehdyn tutkimuksen havaintoihin.
Tulokset Potilaista 82 % oli poikia (mediaani-ikä 9,4 v). Tavallisin aloituslääke oli risperidoni, jonka kohdeoireena oli aggressiivisuus tai käytösoireilu. Aloitusvaiheen tutkimukset ja toistetut laboratoriotutkimukset toteutuivat useammin kuin vertailuaineistossa, mutta kasvua ja verenpainetta mitattiin harvemmin.
Päätelmät Psykoosilääkehoidon aloitusvaiheen tutkimukset ja laboratorioseuranta ovat yhtenäistyneet jonkin verran, mutta kasvun seuranta on edelleen puutteellista. Käytäntöjen yhtenäistyminen vaatii lastenpsykiatrisilta yksiköiltä pitkäjänteistä sitoutumista.

Lasten psykoosilääkehoito on lisääntynyt sekä maailmalla että Suomessa (1,2,3). Psykoosilääkkeiden viralliset käyttöaiheet lapsilla ovat vähäiset (taulukko 1) ja käyttö on usein niiden ulkopuolista (2,3,4). Tavanomaisia käyttöaiheita ovat käytöshäiriöiden ja aggressiivisuuden oireenmukainen hoito diagnoosista riippumatta (4,5,6). Lapsilla yleisimmin käytettyjä psykoosilääkkeitä ovat risperidoni, aripipratsoli ja ketiapiini (2,7). Lääkehoidon tarve on usein pitkäkestoista (6,8).
Lapset ovat erityisen alttiita psykoosilääkkeiden metabolisille haitoille (9). Jopa 60 % psykoosilääkehoitoa käyttävistä lapsista kärsii ruokahalun lisääntymisestä, painonnoususta tai kolesteroli- ja sokeripitoisuuksien muutoksista (10). Myös neurologisia haittavaikutuksia esiintyy (11). Tietoa pitkäkestoisen psykoosilääkehoidon vaikutuksista kasvuun ja kehitykseen ei vielä ole.
Lasten psykoosilääkehoito edellyttää huolellista alkuarviointia ja seurantaa, joiden toteutumisessa on kuitenkin havaittu puutteita ympäri maailmaa (7,12,13). Myös Tampereen yliopistollisen sairaalan (Tays) lastenpsykiatrian vastuualueella 2013–2014 toteutetussa tutkimuksessa käytäntöjen todettiin olevan epäyhtenäisiä (14). Taysissa otettiin 2015 käyttöön psykoosilääkehoidon seurantaohjelma, johon osallistuneiden lasten lääkehoidon seuranta oli järjestelmällisempää (15).
Tämän tutkimuksen tavoitteena oli selvittää, kuinka lasten psykoosilääkehoidon seuranta toteutuu Taysissa kolme vuotta seurantaohjelman käyttöönoton jälkeen.
Aineisto ja menetelmät
Taysin lastenpsykiatrian vastuualueella hoidetaan 0–12-vuotiaita lapsia, jotka tarvitsevat erikoissairaanhoidossa toteutettavaa psykiatrista tutkimusta ja hoitoa. Tämän retrospektiivisen rekisteritutkimuksen sisäänottokriteerit olivat 1) Taysin lastenpsykiatrian vastuualueella 1.1.2018 alkaen aloitettu psykoosilääkitys ja 2) alle 13 vuoden ikä lääkehoidon aloitushetkellä. Nämä kriteerit täytti 81 potilasta (tutkimusaineisto). Otoskoko oli riittävä keskeisimmissä muuttujissa mahdollisesti tapahtuneiden kliinisesti merkittävien muutosten havaitsemiseen. Potilaiden tiedot kerättiin potilaskertomuksista 31.5.2020 asti.
Potilaskertomuksesta kerättiin: potilaan perustiedot (sukupuoli, ikä, diagnoosit, perhetausta), tiedot käytetyistä psykoosilääkkeistä, psykoosilääkehoidon aloitukseen ja seurantaan liittyneistä käynneistä, käynneillä mitatuista kasvutiedoista ja verenpaineesta, tehdyistä laboratoriotutkimuksista (paastosokeri, kolesteroli, EKG) sekä muiden erikoisalojen konsultaatioista. Lapsen iän ja sukupuolen mukaiseen väestöpohjaiseen jakaumaan suhteutetun painoindeksin (standardoitu BMI) (16) ja laboratorioarvojen muutoksen arviointiin vaadittiin vähintään kaksi samanaikaista pituus- ja painomittausta ja verenpaineen muutoksen arviointiin vähintään kolme mittausta seurannan aikana (17).
Tutkimuksen tuloksia verrattiin aiemmin Taysin lastenpsykiatrian vastuualueella 2013–2014 tehdyn rekisteritutkimuksen (vertailuaineisto, n = 128) tuloksiin. Tämä aineisto on kuvattu tarkemmin toisaalla (4,14).
Luokitellut muuttujat kuvaillaan frekvenssijakaumilla, jatkuvat muuttujat jakaumien vinouden vuoksi mediaaneilla (Md) ja kvartiileilla (IQR = Q1–Q3). Tutkimus- ja vertailuaineiston välisiä eroja testattiin khiin neliö -testillä tai Fisherin tarkalla testillä (luokitellut muuttujat) tai Mann–Whitneyn U-testillä (jatkuvat muuttujat). P-arvoa < 0,05 pidetään tilastollisesti merkitsevänä. Analyysit toteutettiin IBM SPSS v27 -ohjelmistolla.
Tulokset
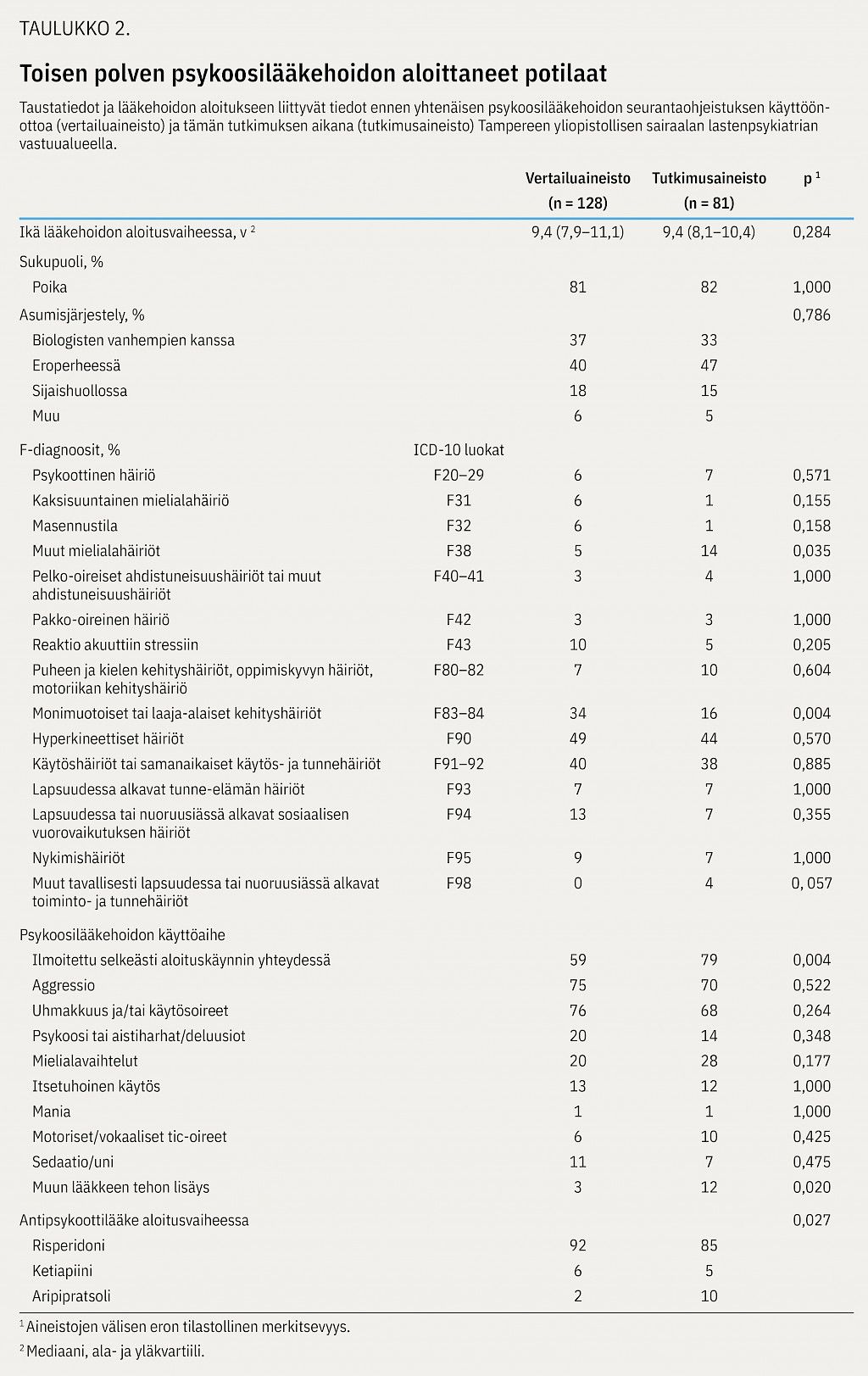
Tutkimus- ja vertailuaineiston potilaiden taustatiedot ja lääkehoidon aloitustiedot on kuvattu taulukossa 2. Molemmissa aineistoissa potilaiden mediaani-ikä oli 9,4 vuotta, neljä viidestä oli poikia ja valtaosa asui joko molempien biologisten vanhempiensa kanssa tai eroperheessä.
Yhtä lukuun ottamatta kaikilla oli vähintään yksi ICD-10:n F-diagnoosi (mielenterveyden ja käyttäytymisen häiriöt), tavallisimmin ADHD tai käytöshäiriö (taulukko 2). Tutkimusaineistossa 27 %:lla ja vertailuaineistossa 39 %:lla (p = 0,100) oli myös vähintään yksi useimmiten perheoloihin tai kielteisiin elämänkokemuksiin liittyvä Z-diagnoosi (terveydentilaan vaikuttavat tekijät).
Psykoosilääkkeen käyttöaihe oli kirjattu selkeästi potilaskertomukseen 79 %:lla tutkimus- ja 59 %:lla vertailuaineistossa. Potilaista 84 %:lla ja 92 %:lla (p = 0,073) käyttöaiheita oli vähintään kaksi, tyypillisimmin aggressiivisuus, uhmakkuus ja käytöshäiriöt (taulukko 2). Tutkimuspotilaista 54 %:lle lääkehoito aloitettiin lastenpsykiatrian poliklinikalla, lopuille osastolla. Lääkehoidon mediaanikesto oli tutkimusaineistossa 9,5 kk (IQR 4,5–15,8), mutta usein lääkehoito jatkui tarkastelujakson jälkeen. Seuranta-ajaltaan pidemmässä vertailuaineistossa hoidon mediaanikesto oli 20,4 kk (9,1–34,6 kk).
Aloitusvaiheessa tavallisin psykoosilääke oli risperidoni (taulukko 2). Tutkimuspotilaista 9 %:lla (n = 7) oli ollut aiemmin käytössä psykoosilääke, joka aloitettiin nyt tauon jälkeen uudelleen. Psykoosilääke vaihdettiin 25 %:lle tutkimus- ja 22 %:lle vertailuaineiston potilaista (p = 0,736) ja lopetettiin 25 %:lta ja 18 %:lta (p = 0,292). Yleisimpiä vaihdon ja lopetuksen syitä olivat molemmissa aineistoissa haitat (painon ja prolaktiinipitoisuuden nousu) ja riittämätön vaste. Tutkimusaineistossa 10 %:lla ja vertailuaineistossa 52 %:lla lääkityksen lopettaneista syynä oli oireilun väheneminen.
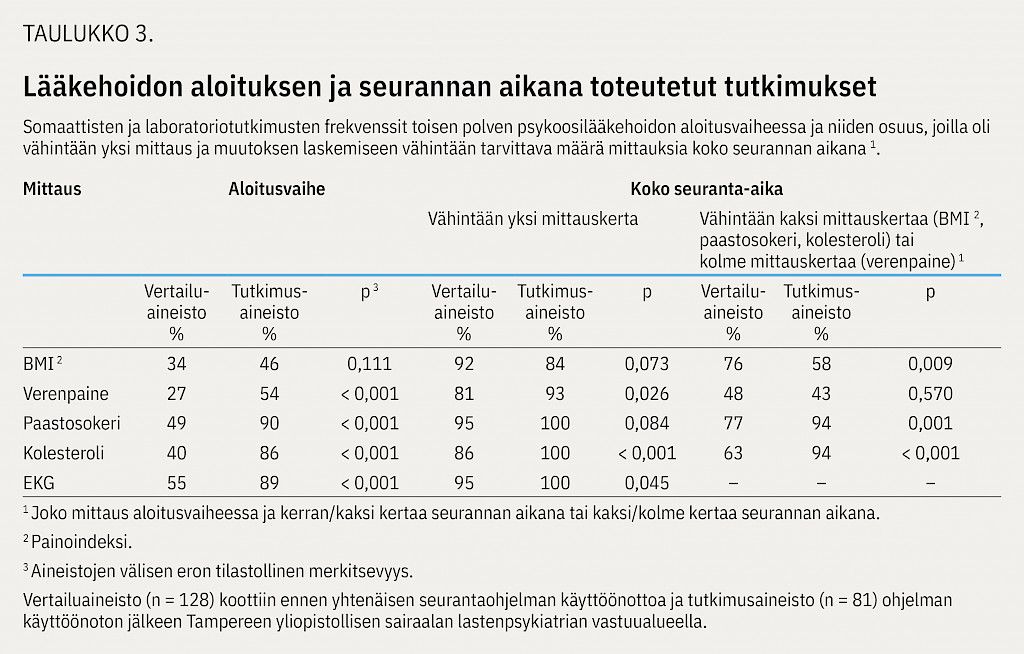
Lääkehoidon aloituksen ja seurannan aikana toteutetut somaattiset tutkimukset on raportoitu taulukossa 3. Lääkehoidon aloitusvaiheessa kaikkia mittauksia oli tehty tutkimusaineistossa useammin kuin vertailuaineistossa. Koko seuranta-aikana (aloitus- ja/tai seurantakäynnillä) vähintään yksi edellä mainittu mittaus toteutui, painoindeksiä (BMI) lukuun ottamatta, tutkimusaineistossa useammin kuin vertailuaineistossa (taulukko 3). Muutosten arviointiin tarvittava määrä toistettuja mittauksia toteutui BMI:n ja verenpaineen kohdalla tutkimusaineistossa harvemmin kuin vertailuaineistossa, mutta paastosokeri- ja kolesterolipitoisuuksien kohdalla useammin kuin vertailuaineistossa (taulukko 3).
Kasvukäyrän käyttö oli mainittu 59 %:lla tutkimuspotilaista ja 21 %:lla vertailuaineiston potilaista (p < 0,001). Tutkimuspotilaiden kasvuseurannan mainittiin toteutuvan muualla (esim. kouluterveydenhuollossa) 23 %:lla, tieto kasvun seurannasta puuttui 31 %:lla.
Lastenkardiologin konsultaatio tehtiin 16 %:lle tutkimus- ja 36 %:lle vertailuaineiston potilaista (p = 0,003). Vastaavat muiden erikoisalojen konsultaatioiden osuudet olivat 21 % ja 31 % (p = 0,151).
Päätelmät
Tutkimuksen havainnot ovat linjassa aiempien lasten psykoosilääkehoitoa kuvaavien tutkimusten kanssa (4,5). Potilaat olivat pääasiassa poikia, joilla psykoosilääkehoidon kohdeoireena olivat diagnoosista riippumatta aggressiivisuus ja käyttäytymisen säätelyn vaikeudet. Tutkimusaineistossa psykoosilääkkeiden käyttö muun lääkehoidon tehostamiseksi oli vertailuaineistoa yleisempää, mikä saattaa kuvata psykiatrisen monilääkityksen yleistymistä lapsilla (18). Kummassakin aineistossa tavanomaisimmat diagnoosit olivat ADHD ja käytöshäiriöt ja samanaikaissairastavuus oli yleistä. Diagnooseissa oli kuitenkin myös eroja. Mielialahäiriön (F38) ja kehityksellisten häiriöiden (F80–82 ja F83–84) osuus oli tutkimusaineistossa suurempi.
Tarkastelupisteiden välissä (2013–2018) erikoissairaanhoitoon päivystyslähetteillä ohjattujen lasten määrä on kasvanut (19). Itsetuhoisuus ja aggressiivisuus ovat tavanomaisia päivystyslähetteiden syitä, ja suurempi F38-diagnoosien määrä selittynee paikallisella ohjeistuksella kirjata itsetuhoisesti oireilevan diagnoosiksi F38.8 (19,20). Kehityksellisten häiriöiden suurempi osuus voi liittyä diagnoosikäytäntöjen tarkentumiseen. Havaitut erot tuskin kuitenkaan vaikuttivat lääkehoidon seurantaan, koska ohjeet ovat Taysin kaikissa yksiköissä samat.
Risperidoni oli yleisin aloituslääke, mutta tuoreemmassa tutkimusaineistossa aripipratsolin käyttö oli yleistynyt, mahdollisesti liittyen sen edullisempaan metaboliseen profiiliin (21). Kuten aiemmissakin tutkimuksissa (3,22), psykoosilääkehoito oli virallisten käyttöaiheiden ulkopuolista. Näyttö psykoosilääkehoidon tehosta ja turvallisuudesta lapsilla painottuu lyhytaikaiseen käyttöön, mutta lääkehoito on usein pitkäkestoista (6,8,23). Tutkimuspotilailla lääkehoidon mediaanikesto oli yli 9 kk, ja hoito jatkui usein tarkastelujakson jälkeen.
Pitkäkestoinen ja virallisten käyttöaiheiden ulkopuolinen psykoosilääkehoito edellyttää erityisen huolellisia lääkehoidon aloituksen ja seurannan käytäntöjä (24). Niiden toteutuminen on kuitenkin usein puutteellista (7, 13). Seurannan toteutumiseen vaikuttavat tekijät ovat moninaisia ja voivat liittyä niin lääkäriin (tiedot, asenteet), potilaaseen ja huoltajaan (puutteellinen tieto, tutkimusten pelko, vaikeus sitoutua hoitoon) kuin käytännön asioihin (tutkimusvälineiden saatavuus) (25,26,27).
Tutkimusten mukaan käytäntöjä voidaan parantaa ohjeiden ja valvonnan avulla (12,25). Tämä havaittiin myös Taysissa aiemmin toteutetussa tutkimuksessa, jonka aikana systemaattinen seurantaohjeistus yhtenäisti tutkimuspotilaiden lääkehoidon seurantaa (15). Seurantaohjelmien vaikutusten on kuitenkin tutkimuksissa havaittu hiipuvan ajan myötä (25,28). Myös tämän noin kolme vuotta seurantaohjelman käyttöönoton jälkeen tehdyn tutkimuksen perusteella Taysissa havaittu käytäntöjen yhtenäistyminen ei ole ollut pysyvää. Taustalla on todennäköisesti monia syitä, kuten aktiivisen keskustelun ja seurannasta muistuttamisen vähittäinen väheneminen.
Somaattisten tutkimusten määrä oli, verenpaineen aloitusmittausten lisääntymistä lukuun ottamatta, palannut seurantaohjelmaa edeltävälle tai jopa heikommalle tasolle. Vasteen arvioinnin kannalta välttämätön käyttöaiheen määrittely toteutui useammin kuin ennen seurantaohjelman käyttöönottoa, mutta harvemmin kuin sen aikana (15). Laboratoriotutkimusten määrä vaikutti kuitenkin lisääntyneen pysyvämmin. Tätä selittänee seurantaohjelman myötä käyttöön otettu, helposti tilattava laboratoriokoepaketti. Kardiologin konsultaatiot olivat tutkimuspotilailla harvinaisempia kuin vertailuaineistossa, mitä selittänevät toimiva erikoisalojen välinen yhteistyö ja koulutukset.
Tässä tutkimuksessa erityisen huomionarvoista on kasvuseurannan vaihteleva ja usein puutteellinen toteutustapa, jonka mahdollisia syitä voivat olla mittausvälineiden huono saatavuus vastaanottotiloissa tai lääkehoidon seurannan jääminen sivuosaan lapsen muita tukitoimia pohdittaessa. Vaikka kasvukäyrää käytettiin useammin kuin ennen seurantaohjelman käyttöönottoa, sen käyttö ei edelleenkään ollut rutiininomaista. Osalla potilaista seurannan mainittiin toteutuvan kouluterveydenhuollossa, mutta kasvutiedot puuttuivat, osalla potilaista tieto kasvusta puuttui kokonaan.
Kasvun seuranta kouluterveydenhuollossa on usein lapsen kannalta hyvä käytäntö. Psykoosilääkehoidon virallisten käyttöaiheiden ulkopuolisen luonteen ja mahdollisten haittojen vuoksi toimintamalli edellyttää kuitenkin toimivaa kodin, kouluterveydenhuollon ja psykiatrisen hoitotahon yhteistyötä. Lääkettä määräävän lääkärin tulee olla tietoinen kasvun etenemisestä, jotta lääkehoito toteutuu turvallisesti.
Painonnousu on psykoosilääkehoidon tunnettu haittavaikutus, joka ilmenee usein jo hoidon alussa, mutta voi myös jatkua pitkäkestoisen hoidon aikana (21,29). Painon seurannan tulisi olla säännöllistä ja erityisesti alkuvaiheessa tiivistä (21,29). Kasvavalla lapsella pelkkä painon seuranta ei riitä, vaan kasvukäyrän tai standardoidun BMI:n käyttö on tärkeää (16). Muuten metaboliset haitat voivat jäädä tunnistamatta tai ne huomataan vasta, kun niihin puuttuminen on vaikeaa.
Haittojen havaitsemisen kannalta asianmukainen laboratorioseuranta on myös välttämätöntä. Hoidon seurannasta ei kuitenkaan saisi aiheutua potilaalle enempää kuormitusta kuin hyötyä (30). Yksinkertaisesti toteutettavia ja kivuttomia menetelmiä kuten pituus- ja painomittauksia tulisikin hyödyntää mahdollisimman paljon (25,30).
Psykoosilääkkeet ovat vakiinnuttaneet paikkansa lastenpsykiatristen häiriöiden hoidossa. Huolellinen seuranta on turvallisen ja tehokkaan lääkehoidon edellytys. Tämä tutkimus osoitti, että erityisesti laboratoriomittausten käytännöissä on tapahtunut Taysissa jonkin verran yhtenäistymistä. Seurantaohjelman aikana nähty kasvu- ja verenpaineseurannan koheneminen (15) ei kuitenkaan ole vakiintunut osaksi kliinistä työtä, ja seurannan toteutuminen on edelleen vaihtelevaa. Jotta lääkehoidon seurantaa voitaisiin pysyvämmin parantaa, tulisi toimenpiteitä kohdistaa seurannan esteisiin. Lääkärien kouluttamisen sekä potilaiden ja huoltajien neuvonnan lisäksi seurannan toteutumista tulisi tukea organisaatiotasolla konkreettisilla työkaluilla, kuten muistutuksilla ja varmistamalla, että käytettävissä on asianmukaiset tutkimusvälineet (25,27). Yhtenäisten käytäntöjen juurruttaminen ja pysyvän muutoksen aikaansaaminen vaatii lastenpsykiatrista hoitoa tarjoavilta yksiköiltä pitkäjänteistä sitoutumista.
Ruut Honkola: Ei sidonnaisuuksia.
Leena Pihlakoski: Työsuhde (PSHP: apulaisylilääkäri), matka-, majoitus- tai kokouskulut (Biocodex).
Kaija Puura: Ei sidonnaisuuksia.
Raili Salmelin: Työsuhde (PSHP ja Tampereen yliopisto: osa-aikainen työsuhde), osakkeet/optiot (Orion Oy).
Kirsi Kakko: Työsuhde (PSHP: apulaisylilääkäri, Tampereen yliopisto: kliininen opettaja), apurahat (Suomen Lääketieteen säätiö: kannustusapuraha 2020), luentopalkkiot (Suomen Lastenpsykiatriyhdistys), muut (Lääkärilehti: Lääketieteen maailmasta -palstan kirjoittajapalkkio)
Tämä tiedettiin
•Lasten psykoosilääkkeiden käyttö on lisääntynyt sekä maailmalla että Suomessa.
• Suurin osa lasten psykoosilääkehoidosta on virallisten käyttöaiheiden ulkopuolista ja edellyttää erityisen huolellisia lääkehoidon aloituksen ja seurannan käytäntöjä.
• Psykoosilääkehoidon seuranta toteutuu vaihtelevasti ja usein puutteellisesti, mutta käytäntöjä voidaan yhtenäistää ohjeistusten ja valvonnan avulla.
Tutkimus opetti
• Kolme vuotta psykoosilääkehoidon seurantaohjelman käyttöönoton jälkeen laboratorioarvojen seuranta oli yhtenäistynyt, mutta pituuden, painon ja verenpaineen seurannassa oli yhä puutteita.
• Erityisesti kasvun seurannan toteutumiseen tulisi kiinnittää huomiota.
• Yhtenäisten seurantakäytäntöjen juurruttaminen kliiniseen työhön vaatii pitkäjänteistä sitoutumista.
- 1
- Steinhausen H. Recent international trends in psychotropic medication prescriptions for children and adolescents. Eur Child Adolesc Psychiatry 2015;24:635–40.
- 2
- Saastamoinen LK, Autti-Rämö I, Tuulio-Henriksson A, Sourander A. Lasten ja nuorten psykoosilääkkeiden käyttö kasvussa. Suom Lääkäril 2017;72:575–9.
- 3
- Varimo E, Saastamoinen LK, Rättö H, Mogk H, Aronen ET. New users of antipsychotics among children and adolescents in 2008–2017: A nationwide register study. Front Psychiatry 2020;11:316.
- 4
- Kakko K. Second-generation antipsychotic medications in child psychiatric patients: prescribing and monitoring practices. Väitöskirja. Tampereen yliopisto 2021. urn.fi/URN:ISBN:978-952-03-2211-3
- 5
- Schröder C, Dörks M, Kollhorst B ym. Outpatient antipsychotic drug use in children and adolescents in Germany between 2004 and 2011. Eur Child Adolesc Psychiatry 2017;26:413–20.
- 6
- Kloosterboer SM, Schuiling-Veninga CCM, Bos JH ym. Antipsychotics in Dutch youth: prevalence, dosages, and duration of use from 2005 to 2015. J Child Adolesc Psychopharmacol 2018;28:173–9.
- 7
- Chen W, Cepoiu-Martin M, Stang A ym. Antipsychotic prescribing and safety monitoring practices in children and youth: A population-based study in Alberta, Canada. Clinical Drug Investigation 2018;38:449–55.
- 8
- Varimo E, Aronen ET, Mogk H, Rättö H, Saastamoinen LK. Antipsychotic treatment duration in children and adolescents: A register-based nationwide study. J Child Adolesc Psychopharmacol 2021;6:421–9.
- 9
- Briles JJ, Rosenberg DR, Brooks BA, Roberts MW, Diwadkar VA. Review of the safety of second-generation antipsychotics: are they really "atypically" safe for youth and adults? Prim Care Companion CNS Disord 2012;14:PCC.11r01298.
- 10
- Libowitz MR, Nurmi EL. The burden of antipsychotic-induced weight gain and metabolic syndrome in children. Front Psychiatry 2021;12:623681.
- 11
- Carbon M, Kapoor S, Sheridan E ym. Neuromotor adverse effects in 342 youth during 12 weeks of naturalistic treatment with 5 second-generation antipsychotics. J Am Acad Child Adolesc Psychiatry 2015;54:718–27.
- 12
- Crystal S, Mackie T, Fenton MC ym. Rapid growth of antipsychotic prescriptions for children who are publicly insured has ceased, but concerns remain. Health Affairs 2016;35:974–82.
- 13
- Hayden JD, Horter L, Parsons T ym. Metabolic monitoring rates of youth treated with second-generation antipsychotics in usual care: Results of a large US national commercial health plan. J Child Adolesc Psychopharmacol 2020;30:119–22.
- 14
- Kakko K, Pihlakoski L, Salmelin R, Puura K. Current follow-up practices often fail to detect metabolic and neurological adverse reactions in children treated with second-generation antipsychotics. Acta Pediatr 2020;109:342–8.
- 15
- Kakko K, Keskinen P, Pihlakoski L, Salmelin R, Puura K. In search of measures to improve the detection of increased cardiometabolic risk in children using second-generation antipsychotic medications. Nord J Psychiatry 2021;25:1–7.
- 16
- Saari A, Sankilampi U, Hannila ML, Kiviniemi V, Kesseli K, Dunkel L. New Finnish growth references for children and adolescents aged 0 to 20 years: Length/height-for-age, weight-for-length/height, and body mass index-for-age. Ann Med 2011;43:235–48.
- 17
- Flynn JT, Kaelber DC, Baker-Smith CM ym. Clinical practice guideline for screening and management of high blood pressure in children and adolescents. Pediatrics 2017;140:e20171904.
- 18
- Kronström K, Kuosmanen L, Ellilä H, Kaljonen A, Sourander A. National time trend changes in psychotropic medication of child and adolescent psychiatric inpatients across Finland. Child Adolesc Ment Health 2018;23:63–70.
- 19
- Friberg V, Kakko K, Salmelin R, Borg A-M. Lastenpsykiatrinen akuuttiosastohoito TAYS:ssa 2017–18. Suom Lääkäril 2019;74:2943–7.
- 20
- Carubia B, Becker A, Levine BH. Child psychiatric emergencies: updates on trends, clinical care, and practice challenges. Curr Psychiatry Rep 2016;18:41.
- 21
- Pozzi M, Ferrentino RI, Scrinzi G ym. Weight and body mass index increase in children and adolescents exposed to antipsychotic drugs in non-interventional settings: a meta-analysis and meta-regression. Eur Child Adolesc Psychiatry 2022;31:21–37.
- 22
- Kornø KT, Aagaard L. Off-label prescribing of antipsychotics in a Danish child and adolescent mental health center: a register-based study. J Res Pharm Pract 2018;7:205–9.
- 23
- Burcu M, Zito JM, Ibe A, Safer DJ. Atypical antipsychotic use among Medicaid-insured children and adolescents: duration, safety, and monitoring implications. J Child Adolesc Psychopharmacol 2014;24:112–9.
- 24
- Annunen P. Jos määräät lapselle lääkettä off label, kerro siitä. Sic!-lehti 4/2018.
- 25
- Melamed OC, LaChance LR, O'Neill BG, Rodak T, Taylor VH. Interventions to improve metabolic risk screening among children and adolescents on antipsychotic medication: a systematic review. J Child Adolesc Psychopharmacol 2021;31:63–72.
- 26
- Rodday AM, Parsons SK, Mankiw ym. Child and adolescent psychiatrists' reported monitoring behaviors for second-generation antipsychotics. J Child Adolesc Psychopharmacol 2015;25:351–61.
- 27
- Aouira N, Khan S, Heussler H, Haywood A, Karaksha A, Bor W. Practitioners’ perspective on metabolic monitoring of second-generation antipsychotics: Existing gaps in knowledge, barriers to monitoring, and strategies. J Child Adolesc Psychopharmacol 2022;32:296–303.
- 28
- Ronsley R, Rayter M, Smith D, Davidson J, Panagiotopoulus C. Metabolic monitoring training program implementation in the community setting was associated with improved monitoring in second-generation antipsychotic-treated children. Can J Psychiatry 2012;57:292–9.
- 29
- van der Esch CCL, Kloosterboer SM, van der Ende J ym. Risk factors and pattern of weight gain in youths using antipsychotic drugs. Eur Child Adolesc Psychiatry 2021;30:1263–71.
- 30
- Minjon L, van den Ban E, de Jong E, Egberts TCG, Heerdink ER. Monitoring of metabolic, cardiac, and endocrine indicators in youth treated with antipsychotics as reported by health care professionals. J Clin Psychopharmacol 2018;38:489–93.
Growth monitoring is often inadequate in children treated with antipsychotics
Background Monitoring practices for antipsychotic medications in children vary and are often inadequate. A medication monitoring protocol was implemented at the Tampere University Hospital (TAUH) child psychiatric unit in 2015. The aim of the present study was to investigate the monitoring practices three years after implementation of the protocol.
Methods The study sample consisted of 81 patients under the age of 13 years who started antipsychotic medication at TAUH after 1.1.2018. The data on baseline and follow-up visits was collected from the patient records. The results were compared with research data obtained at TAUH in 2013–2014.
Results The median age of the study patients was 9.4 years and 82% were boys. The most common antipsychotic was risperidone which was initiated for aggression or conduct problems. Somatic examinations at baseline and laboratory tests during follow-up were more common than in the patients of the reference data. Repeated measurements of growth and blood pressure were less common.
ConclusionsThere has been some systematisation in antipsychotic monitoring practices in terms of baseline examinations and laboratory tests, but growth monitoring is still inadequate. Standardisation of follow-up practices requires long-term commitment from child psychiatric units.
Ruut Honkola, Leena Pihlakoski, Kaija Puura, Raili Salmelin, Kirsi Kakko
Ruut Honkola
B.M.
Tampere University, Faculty of Medicine and Health Technology