Synnynnäisen hypotyreoosin seulonta vastasyntyneiltä kuiva- ja napaverinäytteistä
LÄHTÖKOHDAT Synnynnäisiä aineenvaihduntasairauksia seulotaan kuivaverinäytteistä koko Suomessa. Synnynnäistä hypotyreoosia seulotaan napaverinäytteistä, toisin kuin muissa länsimaissa.
MENETELMÄT Vertasimme synnynnäisen hypotyreoosin seulontaa kuivaverinäytteistä ja napaverinäytteistä 32 038 vastasyntyneen aineistossa.
TULOKSET Kuivaverinäytteen tyreotropiinipitoisuuteen perustuvassa seulonnassa tutkimuksen tarkkuus (99,9 %) ja positiivinen ennustearvo (40,5 %) ovat parempia kuin napaveriseulonnassa (99,2 % ja 5,77 %). Napaveriseulonnassa oli vääriä positiivisia löydöksiä 10 kertaa enemmän kuin kuivaverinäyteseulonnassa. Kaikki hypotyreoosia sairastavat (n = 15) tunnistettiin molemmissa seulonnoissa.
PÄÄTELMÄT Kuivaverinäyte ihopistolla kantapäästä soveltuu hypotyreoosin seulontaan erinomaisesti. Seulonta voitaisiin liittää synnynnäisten aineenvaihduntasairauksien seulontaan.

Kilpirauhasen synnynnäinen vajaatoiminta (hypotyreoosi) on harvinainen sairaus, jonka esiintyvyys vaihtelee väestöissä (1,2). Suomessa esiintyvyys on 1:2 000–1:3 500 (3). Sairaus johtaa hoitamattomana kehitysvammaisuuteen ja kasvun hidastumiseen. Se ei yleensä aiheuta vastasyntyneelle selviä kliinisiä oireita, vaan merkit kilpirauhashormonien puutteesta näkyvät lapsen kehityksessä myöhemmin. Raskauden aikana äidin kilpirauhashormonit läpäisevät istukan ja turvaavat siten erityisesti sikiön keskushermoston kehityksen. Äidiltä saatua tyroksiinia voi olla jäljellä vastasyntyneen verenkierrossa lapsen syntyessä (1,2,4).
Synnynnäinen hypotyreoosi on tavallisesti pysyvä. Tällaisen primaarisen hypotyreoosin yleisin syy on kilpirauhasen puuttuminen, sen poikkeava rakenne tai – harvemmin – kilpirauhashormonien tuotannon häiriö.
Primaarisessa hypotyreoosissa veren aivolisäkeperäinen tyreotropiinipitoisuus (TSH) on suurentunut ja kilpirauhashormoneista yleisimmin määritetty vapaan tyroksiinin (T4V) tai kokonaistyroksiinin (T4) pitoisuus pieni.
Aivolisäke- tai hypotalamusperäiset syyt (sentraalinen hypotyreoosi) ovat harvinaisia. Tällöin tyroksiinipitoisuus on pieni, mutta TSH-pitoisuus voi olla normaali tai pieni (1,2,5). Sentraalinen hypotyreoosi liittyy tavallisesti laajempaan aivolisäkkeen vajaatoimintaan, jota epäillään kliinisten oireiden perusteella. Sen seulonnasta ei ole yhtenäistä kansainvälistä käytäntöä.
Syntymän aiheuttama rasitus voi suurentaa TSH-pitoisuuksia terveelläkin lapsella, mutta pitoisuudet pienenevät yleensä muutamassa vuorokaudessa (2,5). Vastasyntyneen hypotyreoosi voi joskus harvoin olla ohimenevä ja korjaantua itsestään muutaman ensimmäisen elinkuukauden aikana. Se voi aiheutua esimerkiksi äidin lääkityksestä raskauden aikana, äidin tuottamista kilpirauhaseen kohdistuvista vasta-aineista, jodin puutteesta tai sen ylimäärästä (2,5,6).
Vastasyntyneen synnynnäinen hypotyreoosi voidaan tunnistaa oireettomassa vaiheessa vain seulonnalla lapsen verinäytteestä. Lapsen ennuste on erinomainen, jos hormonipuutoksen hoito tyroksiinilla aloitetaan ennen kuin lapsen elimistö ehtii vaurioitua. Hypotyreoosipotilaiden älykkyyden on todettu olevan samalla tasolla kuin terveiden sisarusten ja ikätovereiden, jos sairaus on todettu ja tyroksiinilääkitys aloitettu ajoissa, tavallisesti kahden ensimmäisen elinviikon aikana (5,7).
Seulonta napaverinäytteestä
Synnynnäistä hypotyreoosia on seulottu Suomessa napaverinäytteestä vuodesta 1980 lähtien. Napaveriseulontaan osallistumiseen ei pyydetä suostumusta. Vastasyntyneestä irrotetun istukan napasuonesta on heti syntymän jälkeen otettu napaverinäyte, ja siitä on määritetty eristetyn seerumin tyreotropiinipitoisuus (uS-TSH). Seulonta on kattanut käytännössä lähes kaikki vastasyntyneet (8,9). Jatkotutkimusten tarvetta määrittelevä uS-TSH-pitoisuuden päätösraja vaihtelee hieman eri laboratorioissa analyysimenetelmästä riippuen.
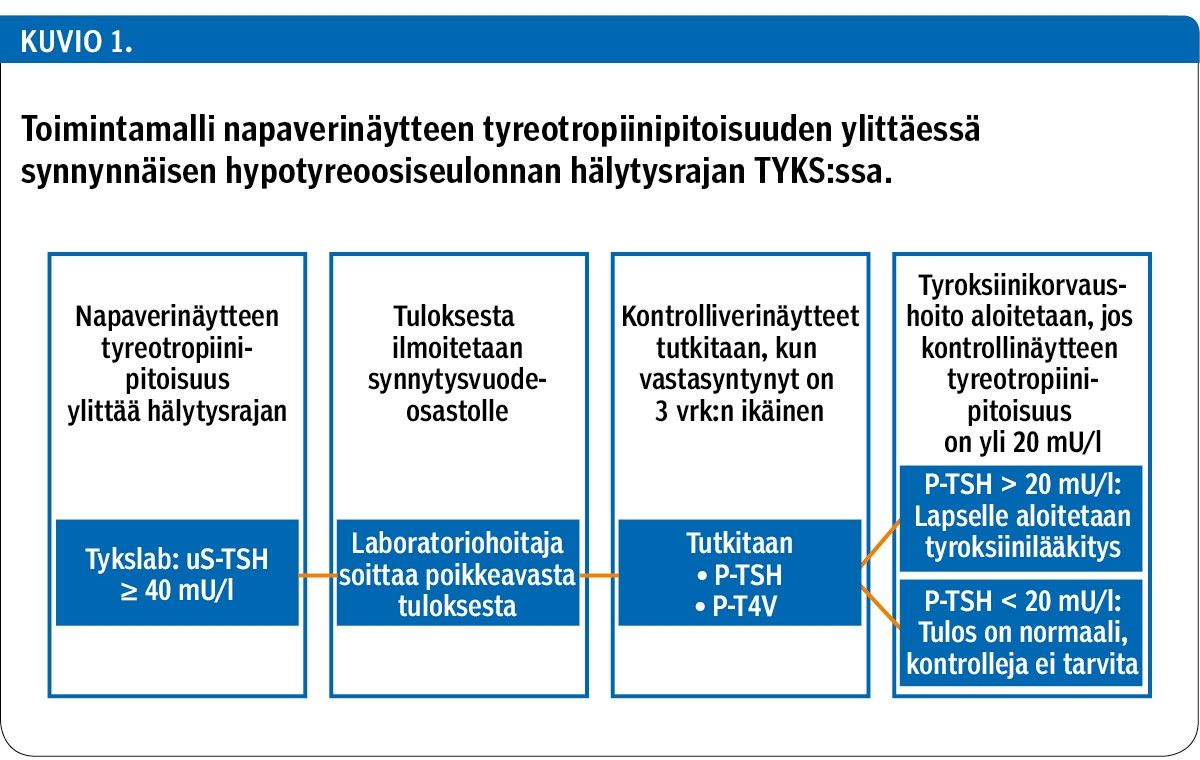
Turun yliopistollisessa keskussairaalassa (TYKS) päätösrajana on uS-TSH-pitoisuus 40 mU/l. Sitä suuremmat TSH-pitoisuudet johtavat jatkoselvityksiin (kuvio 1). TYKS:ssä jatkotutkimuskäytäntönä on määrittää plasman tyreotropiini (P-TSH) ja vapaa tyroksiini (P-T4V) 3 vrk:n ikäisiltä. Tuloksia käytetään päätöksenteon tukena tyroksiinilääkitystä aloitettaessa.
Näin on toimittu 1.10.2017 alkaen. Siihen asti napaverinäytteistä määritettiin TSH-pitoisuuden lisäksi T4- ja T4V-pitoisuudet ja kontrollinäytteistä myös T4-pitoisuus. Niiden ei kuitenkaan havaittu tuovan lisähyötyä seulontaan tai diagnostiikkaan.
Synnynnäinen hypotyreoosi katsotaan poissuljetuksi, jos plasman TSH on < 20 mU/l kontrolliverinäytteessä, joka on otettu 3 vrk:n ikäiseltä. Hypotyreoosia epäiltäessä tyroksiinikorvaushoito aloitetaan heti ja sitä jatketaan kahteen ikävuoteen asti. Silloin pidetään pysyvän hypotyreoosin varmistava tai poissulkeva hoitotauko. Tyroksiinilääkityksessä pidetään kolmen viikon tauko, ja kahden ensimmäisen viikon aikana käytetään lyhytvaikutteista liotyroniinia (T3). Hoitotauon lopussa lapsen verestä määritetään P-TSH- ja P-T4V-pitoisuudet. Hypotyreoosidiagnoosi varmistuu ja lääkitys jatkuu pysyvänä, jos P-TSH-arvo nousee yli viitealueen ylärajan ja P-T4V-arvo laskee sen alapuolelle.
Seulonta kuivaverinäytteestä
Vastasyntyneiden synnynnäistä hypotyreoosia seulotaan lähes kaikissa länsimaissa kuivaverinäytteellä osana laajempaa aineenvaihduntasairauksien seulontaa. Näyte otetaan lapsen kantapäästä ihopistolla näytekortille tavallisesti lapsen ollessa vähintään 2 vrk:n ja enintään 5 vrk:n ikäinen (7,9,10). Näytteet postitetaan seulontakeskukseen. Seulonta tehdään joko määrittämällä kuivaverinäytteen TSH-pitoisuus, T4-pitoisuus tai molemmat.
Yksinomaan T4-pitoisuuteen perustuvaa seulontaa ei yleisesti pidetä riittävän luotettavana, koska äidistä sikiöön istukan kautta siirtynyt tyroksiini voi johtaa virheellisen suureen veren T4-pitoisuuteen hypotyreoosia sairastavalla vastasyntyneellä (4).
Seulonnan päätösrajat vaihtelevat eri maissa mm. väestöjen ja analyysimenetelmien erojen takia. Yleisesti seulontanäytteiden TSH-pitoisuuden päätösrajaksi on valittu laboratoriosta riippuen arvo välillä 9–15 mU/l ja seulonnassa harvemmin käytetyn T4-pitoisuuden päätösrajaksi arvo, jonka alle jää 10 % pitoisuuksista (10. persentiili) (7,9). Jos seulontatulos on poikkeava, suositellaan uutta pitoisuusmääritystä laskimo- tai kapillaariverinäytteestä (5,7).
Seulontasuositukset
Euroopan unioni on antanut jäsenvaltioilleen suosituksen laatia suunnitelma harvinaisten sairauksien nykyistä kattavammasta diagnosoinnista ja hoidosta. Suositukseen sisältyy harvinaisten aineenvaihduntasairauksien seulonta vastasyntyneiltä (11,12).
Sosiaali- ja terveysministeriö (STM) suositteli v. 2014, että tiettyjen synnynnäisten aineenvaihduntasairauksien seulontatutkimuksia kuivaverinäytteistä tarjottaisiin kaikille Suomessa syntyville vuodesta 2015 lähtien (13).
TYKS, Turun yliopisto ja TTW Yhteislaboratorio aloittivat synnynnäisten aineenvaihduntasairauksien seulonnan kuivaverinäytteistä vastasyntyneiltä yhteistyössä ns. NeoPilot-esitutkimuksena v. 2007. Seulonnassa hyödynnettävät poikkeavat aineenvaihduntatuotteet alkavat monissa synnynnäisissä aineenvaihduntasairauksissa kertyä elimistöön vasta, kun lapsen oma aineenvaihdunta on käynnistynyt. Siksi kuivaverinäytteen ottaminen ajoitettiin 2–5 vrk:n ikään kansainvälisten suositusten mukaisesti.
NeoPilot-tutkimuksessa seulottiin synnynnäistä hypotyreoosia, synnynnäistä lisämunuaisen liikakasvua sekä yli 20:tä synnynnäistä amino- ja rasvahappojen aineenvaihduntasairautta. Seulonta perustui aineenvaihduntatuotteisiin, jotka määritettiin kantapäästä ihopistolla otetuista kuivaverinäytteistä.
Nykyään seulonta tehdään synnynnäisten aineenvaihduntasairauksien seulontakeskuksessa Saskessa (14) ja se kattaa koko Suomen. Siihen ei sisälly hypotyreoosin seulontaa.
Aineisto ja menetelmät
Tässä tutkimuksessa selvitettiin ja verrattiin kuivaverinäytteen ja napaverinäytteen soveltuvuutta synnynnäisen hypotyreoosin seulontaan. Tutkimukseen 1.9.2007–31.10.2016 osallistuneista Varsinais-Suomen sairaanhoitopiirissä syntyneistä lapsista (n = 32 038) mitattiin ihopistolla kantapäästä otettujen kuivaverinäytteiden TSH- ja T4-pitoisuudet. Seulonnassa tunnistettujen, hypotyreoosia sairastavien lasten tuloksia verrattiin hypotyreoosiseulonnan tuloksiin samojen lasten napaverestä.
Kuivaverinäytteet otettiin ihopistolla kantapäästä, kun vastasyntyneet olivat 2–5 vrk:n ikäisiä. Näytteet imeytettiin Sasken näytteenottokortteihin (14), joiden annettiin kuivua huoneenlämmössä vähintään kolme tuntia.
Kuivaverinäytteiden tyreotropiini- (B-TSH) ja tyroksiinipitoisuudet (B-T4) analysoitiin immunofluorometrisellä menetelmällä (GSP Instrument, PerkinElmer, Turku) (15,16). Napaverinäytteet ja tarvittaessa otetut kontrolliverinäytteet analysoitiin rutiininomaisesti osana tavanomaista seulontakäytäntöä.
Napaverestä eristettyjen seeruminäytteiden tyreotropiini- (uS-TSH) ja kokonaistyroksiinipitoisuudet (uS-T4) määritettiin aikaerotteisella immunofluorometrisellä menetelmällä (TR-IFMA, AutoDelfia, PerkinElmer/Wallac Oy, Turku). Napaverinäytteiden vapaan tyroksiinin pitoisuudet (uS-T4V) määritettiin immunokemiallisella menetelmällä (ECLIA, cobas 8000, cobas e 602, Roche Diagnostics, Mannheim, Saksa). Tilastollisessa tarkastelussa käytettiin JMP Pro 11.1.1 - ja Microsoft Excel 2010 -ohjelmia.
Tulokset
Tutkimuksen tarkkuus ja positiivinen ennustearvo ovat paremmat kuivaverinäytteestä tehdyssä TSH-pitoisuuteen perustuvassa hypotyreoosiseulonnassa kuin napaverestä tehdyssä seulonnassa (taulukko 1). Kuivaverinäytteestä saadaan hypotyreoosiseulonnassa oleellisesti vähemmän vääriä positiivisia seulontatuloksia. Negatiivinen ennustearvo – ja siten tutkimuksen herkkyys – on sama kuin napaverestä tehdyssä seulonnassa (taulukko 1).
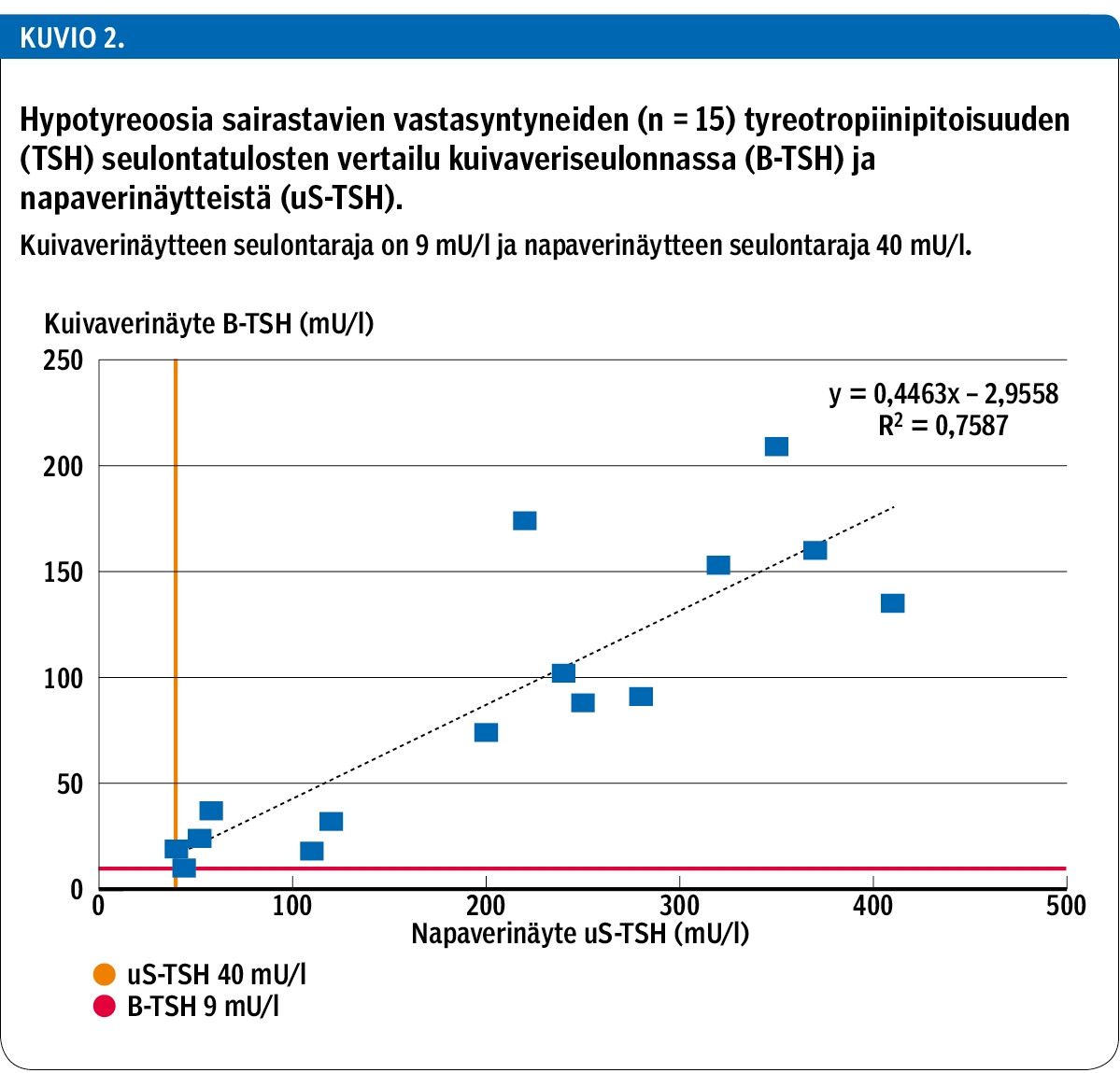
Kummallakin seulontamenetelmällä tunnistettiin samat 15 vastasyntynyttä, jotka sairastivat hypotyreoosia (taulukko 2, kuvio 2). Kummassakaan seulonnassa ei tullut esille yhtään väärää negatiivista seulontatulosta. Tutkimuksessa ei todettu kliinisesti merkitsevää korrelaatiota kuivaverinäytteen TSH-pitoisuuden ja vastasyntyneen raskausviikkojen, syntymäpainon tai näytteenottoajan välillä. Aineiston perusteella kuivaverinäytteen TSH-pitoisuuden päätösrajaksi (seulontarajaksi) määriteltiin 9 mU/l. T4-pitoisuuden 10. persentiilin raja kuivaverinäytteissä oli 70 nmol/l.
Pohdinta
Ihopistolla otettu kuivaverinäyte soveltuu vastasyntyneiden synnynnäisten aineenvaihduntasairauksien seulontaan erinomaisesti. Näytteen edustavuus ja oikeaoppinen näytteenotto on ehdottoman tärkeää.
Seulonta kuivaverinäytteestä on synnynnäisen hypotyreoosin toteamisessa yhtä herkkä kuin seulonta napaverinäytteestä. Napaverinäytteestä tehtävässä seulonnassa on vääriä positiivisia tuloksia – ja siten myös kontrolliverinäytteitä – noin kymmenkertainen määrä verrattuna seulontaan kuivaverinäytteestä.
Seulonta kuivaverinäytteistä on siksi kokonaiskustannuksiltaan huomattavasti halvempi kuin seulonta napaverinäytteistä. Osittain tämä johtuu siitä, että syntymään liittyvä TSH-arvon nousu tasoittuu. Synnynnäisen hypotyreoosin esiintyvyys TYKS:ssä syntyneillä 32 038 lapsella oli 1:2 136. Tämä vastaa kirjallisuudessa laskennallisesti esitettyä (3).
Tulosten perusteella kuivaverinäytteen TSH-pitoisuuden seulontarajaksi valittiin 9 mU/l. Tyroksiinipitoisuuden määrittämisestä ei saada merkittävää lisähyötyä. Tulos on yhteneväinen kansainvälisten suositusten kanssa (7,8,9). Samaa seulontarajaa voidaan käyttää kaikille vastasyntyneille. Poikkeava seulontatulos tulee varmistaa laskimo- tai kapillaariverinäytteestä, kuten on tehty seulonnassa napaverinäytteistä. Jos vastasyntynyt kotiutuu varhain, hänen vointinsa tarkastetaan tavallisesti joka tapauksessa 2–3 vrk:n iässä. Näyte voidaan ottaa silloin.
Kuivaverinäyte- ja napaveriseulonnan vahvuuksia ja heikkouksia arvioidaan taulukossa (taulukko 3). Monisikiöraskauksissa veren vähäinenkin siirtyminen terveestä sikiöstä hypotyreoosia sairastavaan sikiöön voi aiheuttaa näytteeseen virheellisen pienen TSH-pitoisuuden. Tällöin on vaarana, että hypotyreoosi jää toteamatta (17,18,19). Riski korostuu napaveriseulonnassa, joka tehdään ennen kuin vastasyntyneen oma aineenvaihdunta on käynnistynyt. Sairauden mahdollisuus voidaan varmuudella sulkea pois kontrollinäytteillä.
Suositus kontrollinäytteiden ottamisesta monisikiöisistä raskauksista syntyviltä lapsilta kuvataan kahden sairaalalaboratorion ohjekirjoissa (Fimlab ja ISLAB) (20,21). Synnytyssairaaloilla saattaa olla muitakin ohjeistuksia monisikiöraskauksista, mutta suositukset eivät ole kansallisesti yhteneväisiä. Myös kuivaverinäyteseulonnan tulos suositellaan varmistettavan ainakin samaa sukupuolta olevilta vastasyntyneiltä (5,17,19).
Kuivaverinäyteseulonnan haaste napaveriseulontaan verrattuna on se, että seulonnan tulos valmistuu myöhemmin. Synnynnäisten aineenvaihduntasairauksien seulonnan laajentuessa näytelogistiikka on saatu nopeaksi ja tehokkaaksi. Muissa Pohjoismaissa synnynnäistä hypotyreoosia seulotaan vakiintuneen käytännön mukaan kuivaverinäytteistä. Tulos on valmis noin viikon kuluttua näytteenotosta. Nykyään tulokset valmistuvat viikon kuluessa näytteen saapumisesta myös Saskessa.
Tämän pilottitutkimuksen tavoitteena ei ollut optimoida kuivaverinäyteseulonnan aikaviivettä. Viive ei siten ollut arvioitavissa vakiintunutta seulontaa kuvaavalla tavalla. Parhaat hoitotulokset on saatu tyroksiinikorvaushoidolla, joka on aloitettu nopeasti, viimeistään kahden viikon kuluessa lapsen syntymästä. Optimaalista aikaikkunaa ei kuitenkaan ole varmuudella määritelty (7,22,23). Myöskään ei ole tehty satunnaistettua tutkimusta, jossa olisi verrattu kuivaveri- tai napaverinäytteestä tehdyn seulonnan vaikutusta synnynnäistä hypotyreoosia sairastavien lasten kognitiiviseen kehittymiseen. Suomalaisista synnynnäistä hypotyreoosia sairastavista potilaista ei ole tehty kognitiivisia taitoja arvioivaa seurantatutkimusta, jota voisi verrata kansainvälisiin aineistoihin.
Vastasyntyneitä kotiuttavat lastenlääkärit ovat seuranneet hypotyreoosiseulonnan toteutumista sairaaloittain, mutta kattavaa kansallista seurantaa Suomessa ei ole.
Saskessa seurataan synnynnäisten aineenvaihduntasairauksien kuivaverinäyteseulonnan tehokkuutta, sairauksien esiintymistiheyttä ja seulonnan luotettavuutta säännöllisesti. Seuranta kattaa kaikki Suomen vastasyntyneet niissä sairauksissa, jotka sisältyvät ihopistolla kantapäästä otettujen kuivaverinäytteiden analyyseihin. Seulontaan osallistuminen on vapaaehtoista. Tähän liittyy pieni riski seulonnan jäämisestä toteutumatta. Kuivaverinäyteseulontaan osallistumista olisi mahdollista seurata valtakunnallisesti.
Synnynnäisiä aineenvaihduntasairauksia seulotaan kuivaverinäytteistä Suomessa nykyään yhdessä seulontakeskuksessa. Seulonnan keskittäminen on mielekästä osaamisen ja strukturoidun seulontajärjestelmän ylläpitämiseksi. Riskinä ovat poikkeustilanteet, joissa seulontakeskus olisi kyvytön toimimaan tai näytteiden postitusviive kasvaa. Seulontakeskuksen tulee dokumentoidusti arvioida tällaiset riskit ja laatia toimintamalli niiden toteutumisen varalta.
Synnynnäisen hypotyreoosin seulonta voitaisiin liittää osaksi kuivaverinäyteseulontaa koko Suomessa. Kuivaverinäyte- ja napaverinäyteseulonnan tehokkuutta ja toteutumista olisi mahdollista selvittää tätä pilottitutkimusta kattavammin, jos kansalliset seulonnat tehtäisiin määräajan rinnakkain.
Ei sidonnaisuuksia.
Tästä asiasta tiedettiin
Hypotyreoosin seulonta vastasyntyneiltä ja hoidon nopea aloittaminen ehkäisevät kilpirauhasen vajaatoiminnasta johtuvia kehityshäiriöitä.
Synnynnäistä hypotyreoosia seulotaan muissa länsimaissa napaverinäytteen sijasta kuivaverinäytteistä osana laajempaa aineenvaihduntasairauksien seulontaa.
Tämä tutkimus opetti
Seulonta kuivaverinäytteestä on yhtä herkkä menetelmä synnynnäisen hypotyreoosin toteamiseen kuin Suomessa käytössä oleva seulonta napaverinäytteestä.
Hypotyreoosin seulonnassa kuivaverinäytteistä oli vääriä positiivisia tuloksia vain kymmenesosa niiden määrästä napaveriseulonnassa. Tämä vähentää kontrollitutkimusten tarvetta merkittävästi.
- 1
- LaFranchi SH. Newborn screening strategies for congenital hypothyroidism: an update. J Inherit Metab Dis 2010;33(Suppl 2):S225-33.
- 2
- Rastogi MV, LaFranchi SH. Congenital hypothyroidism. OJRD 2010;5:1–22.
- 3
- Niinikoski H, Näntö-Salonen K. Synnynnäinen hypotyreoosi. Tietoa potilaalle ja vanhemmille. Suomen Lastenendokrinologiyhdistys ry kotisivut. (Siteerattu 23.3.2017). http://www.lastenendokrinologit.fi/potilasohjeet/
- 4
- Vulsma T, Gons MH, de Vijlder JJ. Maternal-fetal transfer of thyroxine in congenital hypothyroidism due to a total organification defect or thyroid agenesis. NEJM 1989;321:13–6.
- 5
- Rose SR, Brown RS, Foley T ym. Update of newborn screening and therapy for congenital hypothyroidism. Pediatrics 2006;117:2290–303.
- 6
- Männistö T. Jodin puute Suomessa. Kliinlab 2016; 6:116–8.
- 7
- Léger J, Olivieri A, Donaldson M ym. European Society for Paediatric Endocrinology Consensus Guidelines on screening, diagnosis, and management of congenital hypothyroidism. J Clin Endocrinol Metab 2014;99:363–84.
- 8
- Virtanen M. Finnish national screening for hypothyroidism. Few false positives, early therapy. Eur J Pediatr 1984;143:2–5.
- 9
- Ford G, LaFranchi SH. Screening for congenital hypothyroidism: A worldwide view of strategies Best Pract Res Clin Endocrinol Metab 2014;28:175–87.
- 10
- Smith L. Updated AAP guidelines on newborn screening and therapy for congenital hypothyroidism. Am. Fam. Physician 2007;76:439–44.
- 11
- Autti-Rämö I, Laajalahti L, Koskinen H, Sintonen H, Mäkelä M ja asiantuntijaryhmä. Vastasyntyneiden harvinaisten aineenvaihduntatautien seulonta. FinOHTA 2004, Raportti 22.
- 12
- Cornel M, Rigter T, Weinreich S ym. Newborn screening in Europe Expert Opinion document. EU Network of Experts on Newborn Screening, 2012.
- 13
- STM suosittelee synnynnäisten aineenvaihduntasairauksien seulonnan laajentamista. Sosiaali- ja terveysministeriön tiedote 5.5.2014. http://stm.fi/artikkeli/-/asset_publisher/stm-suosittelee-synnynnaisten-aineenvaihduntasairauksien-seulonnan-laajentamista
- 14
- Synnynnäisten aineenvaihduntasairauksien seulontakeskuksen (Saske) kotisivut. (siteerattu 15.6.2017). www.saske.fi
- 15
- Käyttöohje: GSP, Neonatal hTSH kit. 2013. PerkinElmer.
- 16
- Käyttöohje: GSP, Neonatal Thyroxine (T4) kit. 2013. PerkinElmer.
- 17
- Azam A, Cutfield W, Mouat F ym. Missed congenital hypothyroidism in an identical twin. J Paediatr Child Health 2012;48:936–8.
- 18
- Kempers MJE, Lanting CI, van Heijst AFJ ym. Neonatal screening for congenital hypothyroidism based on thyroxine, thyrotropin, and thyroxine-binding globulin measurement: Potentials and pitfalls. J Clin Endocrinol Metab 2006;91:3370–6.
- 19
- Perry R, Heinrichs C, Bourdoux P ym. Discordance of monozygotic twins for thyroid dysgenesis: Implications for screening and for molecular pathophysiology. J Clin Endocrinol Metab 2002;87:4072–7.
- 20
- Fimlab Laboratoriot Oy verkkosivut. (siteerattu 15.6.2017). http://www.fimlab.fi/sivu.tmpl?sivu_id=32
- 21
- ISLAB verkkosivut. (siteerattu 15.6..2017). https://ekstra1.kuh.fi/csp/islabohje/labohje.csp
- 22
- Bongers-Schokking JJ, de Muinck Keizer-Schrama SMPF. Influence of timing and dose of thyroid hormone replacement on mental, psychomotor, and behavioral development in children with congenital hypothyroidism. J Pediatr 2005;147:768–74.
- 23
- Rahmani K, Yarahmadi S, Etemad K ym. Congenital hypothyroidism: optimal initial dosage and time of initiation of treatment: A systematic review. Int J Endocrinol Metab 2016;14(3): e36080.
Newborn screening for congenital hypothyroidism from dry blood spot samples and umbilical cord blood samples
Background
Newborn screening for congenital metabolic disorders has been performed in Western countries for decades. The screening is commonly done from dry blood spot samples acquired by heel prick. In Finland, newborns have been screened for congenital hypothyroidism from umbilical cord blood samples for over 30 years with excellent results. In other Western countries newborn screening for congenital hypothyroidism is performed from dry blood spot samples at 2−5 days of age as part of the wider screening programme for congenital metabolic disorders. Such a screening programme has recently also been established in Finland while the screening for congenital hypothyroidism from cord blood samples still continues.
Methods
In this study we evaluated the screening for congenital hypothyroidism from dry blood spot samples compared to umbilical cord blood samples in 32,038 Finnish newborns.
Results
The accuracy (99.9%) and the positive predictive value (40.5%) of screening for congenital hypothyroidism were better with dry blood spot samples compared to umbilical cord blood samples (99.2% and 5.77%, respectively). The number of false positive results was ten times higher in umbilical cord blood samples compared to dry blood spot samples. All children (n = 15) with congenital hypothyroidism included in the study were recognised by both screening methods.
Conclusions
The dry blood spot sample taken by heel prick at 2−5 days of age is an excellent method for screening for congenital hypothyroidism in newborns. This screening for congenital hypothyroidism using dry blood spot samples could be included in the screening programme for congenital metabolic disorders covering all newborns in Finland.