Clostridium difficile -löydökset TAYS:n lastenyksiköissä
Pienten lasten Clostridium difficile -löydöksiin on suhtauduttava kriittisesti, sillä heillä oireeton kantajuus on yleistä. C. difficilen tutkimista alle vuoden ikäisiltä on syytä välttää. Kaikissa ikäryhmissä löydöksen merkitystä on arvioitava suhteessa kliiniseen kuvaan.

Clostridium difficile -infektion taudinkuva vaihtelee oireettomasta kolonisaatiosta kuumeiseen veriripuliin (1,2). Suuri osa imeväisistä kantaa bakteeria oireettomana, ja siksi heidän tutkimistaan ei suositella (3,4).
Suomessa lasten C. difficile -infektiosta ei ole tuoreita julkaisuja tartuntatautitilastoja lukuun ottamatta. Selvitimme bakteerin näytteenottoa, esiintymistä Tampereen yliopistosairaalan lastentautien ja lastenkirurgian yksiköissä 10 vuoden aikana sekä toksiinin löytymiselle altistavia tekijöitä.
Aineisto ja menetelmät
Retrospektiiviseen, riskitekijöiden osalta tapaus-verrokkitutkimukseen otettiin TAYS:n alle 18-vuotiaat lastentautien potilaat, joilta oli 1.1.2008–30.11.2017 tutkittu C. difficile toksiinin antigeenin tai nukleiinihapon osoituksella. Nukleiinihapon osoitus otettiin käyttöön 3.11.2014 ja samalla viljely ja toksiinin antigeenin osoitus jäivät pois. Potilaat ja verrokit saatiin Sairaalan antibiootti- ja infektioseurantajärjestelmästä (SAI).
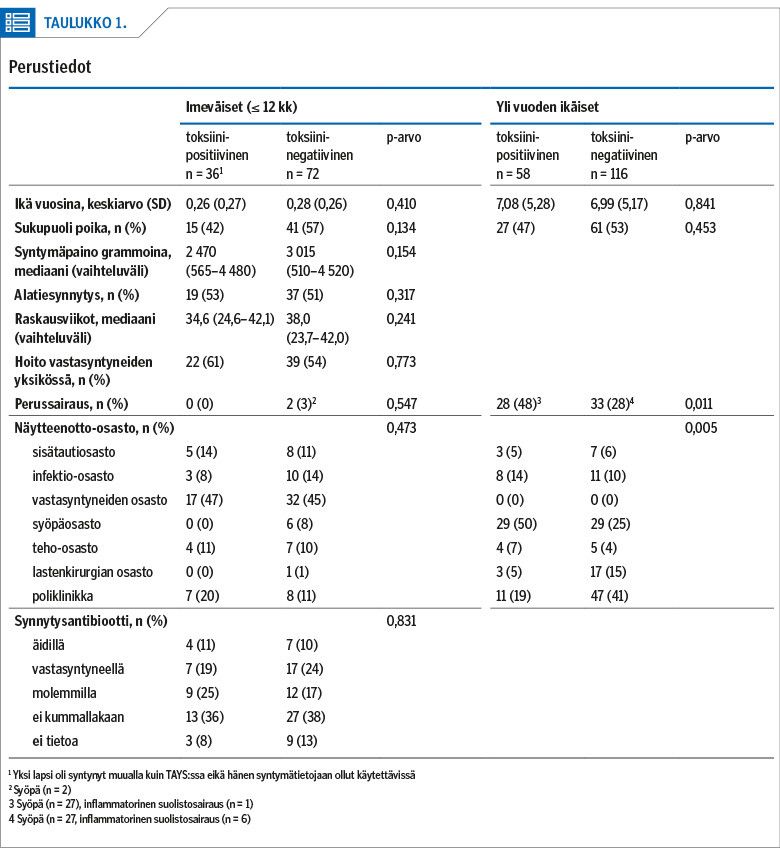
Selvitettäessä altistavia tekijöitä jokaiselle sairastuneelle valittiin kaksi samaan ikäryhmään kuuluvaa verrokkia, joilta samalla menetelmällä tutkitut näytteet olivat negatiiviset (taulukko 1). Yli 12 kuukauden ikäisten potilaiden ja verrokkien ikäero oli korkeintaan 2 vuotta. Jos verrokista oli useampi negatiivinen näyte, analyysissä käytettiin ensimmäistä.
Potilastietojärjestelmästä kerättiin alle vuoden ikäisistä (≤ 12 kk) synnytykseen liittyvät keskeiset tiedot (taulukko 1). Kaikista potilaista kirjattiin antibioottien, nenä-mahaletkun ja happosalpaajien käyttö 1 kuukauden ajalta ennen näytteenottoa ja mikä tahansa kirurginen toimenpide 3 kuukauden ajalta. Potilaskertomuksista selvitettiin näytteenoton perusteet, antibioottihoito positiivisen löydöksen jälkeen, relapsit ja uusintainfektiot. Relapsi oli uusi positiivinen löydös 2–8 viikkoa ja uusintainfektio yli 8 viikkoa ensimmäisen positiivisen näytteen jälkeen.
Jatkuvat muuttujat analysoitiin kahden riippumattoman otoksen t-testillä. Ryhmien vertailuun käytettiin χ2-testiä tai Fisherin tarkkaa testiä. Logistista regressioanalyysiä käytettiin riskitekijäanalyysiin ja tulokset esitetään kerroinsuhteena (OR) ja sen 95 %:n luottamusvälinä. Aineisto analysoitiin SPSS-ohjelmalla (IBM SPSS, versio 22, Inc. Chicago, IL, USA).
Tulokset
Näytteitä otettiin 644 lapselta ja heistä 94:ltä löytyi C. difficile -toksiinia: antigeeninosoitus oli positiivinen 75 lapsella (80 %) ja nukleiinihapon osoitus 19 lapsella (20 %). Kaikista näytteistä 211 (33 %) ja positiivisista näytteistä 36 (38 %) oli imeväisikäisiltä (≤ 12 kk).
Näytteenottohetkellä imeväisikäisistä 31:llä oli vatsaoire ja 2:lta näyte oli otettu C. difficile -altistuksen takia; kolmen tutkimisen syy ei selvinnyt. Kolmella lapsella oli nekrotisoivan enterokoliitin taudinkuva.
Antibioottihoidon sai 14 imeväistä (31 %). Sen saaneet olivat keskimäärin nuorempia kuin imeväiset, joita ei hoidettu (0,14 v vs. 0,34 v; p = 0,026), ja he olivat useammin hoidossa vastasyntyneiden osastolla (86 % vs. 46 %; p = 0,052). 2 lasta sai relapsin ja 2 uusintainfektion.
Näytteenottohetkellä yli vuoden ikäisistä 58 potilaasta 47:llä oli vatsaoire ja 4:llä kuumetta; kuuden lapsen tutkimuksen syytä ei ollut kirjattu. Antibioottihoidon sai 24 lasta (41 %) eivätkä he eronneet lapsista, jotka eivät hoitoa saaneet. 9 lasta sai relapsin ja 11 ainakin yhden uusintainfektion.
Imeväisikäisillä (≤ 12 kk) yksikään tutkituista riskitekijöistä ei lisännyt toksiinin todennäköisyyttä ulosteessa (taulukko 2). Yli vuoden ikäisillä riskiä lisäsivät antibioottihoito, nenä-mahaletku ja kirurgia. Monimuuttuja-analyysissä vain edeltävä antibioottihoito osoittautui merkitseväksi C. difficile -infektion riskitekijäksi. Verrattaessa toksiinipositiivisia ja -negatiivisia syöpäpotilaita tutkitut riskitekijät eivät selittäneet toksiinin löytymistä.
Pohdinta
C. difficile -infektiot ovat lisääntyneet kaikkialla maailmassa, ja syitä ovat laajakirjoisten antibioottien käyttö, infektioille alttiiden potilaiden määrän lisääntyminen sekä uusien virulenttien kantojen leviäminen (5). Osittain muutosta selittää herkempi diagnostiikka (6,7,8): amerikkalaisessa selvityksessä diagnoosimenetelmän vaihtaminen lisäsi sairaaloissa C. difficilen esiintymistä 43–67 % (8).
Suomessa kansallisen prevalenssitutkimuksen mukaan C. difficile aiheuttaa 5,5 % kaikkien osastopotilaiden infektioista (9). Tartuntatautirekisteriin ilmoitetut löydökset eivät ole lisääntyneet vuonna 2008 aloitetun seurannan aikana (10).
Jopa puolet terveistä imeväisistä kantaa oireettomana C. difficileä ulosteessaan (3,4,11). Ei ole täysin selvää, miksi lapset ovat oireettomia. Toksiinimäärä ulosteessa on yhtä suuri kuin oireilevilla aikuisilla (12). Kantajuutta voi selittää mm. toksiinin reseptorien puuttuminen suolistosta, muun suolistoflooran tai mahdollisesti rintamaidon tarjoama suoja (13,14,15).
Kolonisaation yleisyyden vuoksi amerikkalaiset ohjeet eivät suosittele C. difficilen tutkimista vuoden ikäisiltä ja nuoremmilta ripuloivilta imeväisiltä. 1–2-vuotiaiden lasten tutkimista suositellaan silloin, kun muut ripulin aiheuttajat on suljettu pois, ja yli 2-vuotiaiden pitkittyneessä ripulissa tutkimista on syytä harkita, jos lapsella on infektiolle altistava perussairaus (16). Eurooppalainen suositus kehottaa asennoitumaan kriittisesti C. difficileen patogeenina alle 3-vuotiailla lapsilla (1,17). Käytössä olevat tutkimusmenetelmät ovat herkkiä, ja löydöksen merkitystä on kaikissa ikäryhmissä arvioitava suhteutettuna kliiniseen taudinkuvaan.
TAYS:n lastenyksiköissä merkittävä osa (33 %) näytteistä otettiin ja suuri osa toksiinilöydöksistä (38 %) tehtiin vuoden ikäisiltä tai nuoremmilta. Kolmasosa imeväisistä sai antibiootin löydökseen. Retrospektiivisen tutkimusasetelman takia on vaikeaa arvioida, oliko hoito tarpeen. Kansainväliset suositukset huomioiden näytteiden ottamista imeväisiltä olisi syytä välttää.
Imeväisillä mikään tutkittu tekijä ei selittänyt C. difficile -infektiota tai kolonisaatiota. Yli vuoden lapsilla infektiolle altisti edeltävä antibioottihoito. Tämä on havaittu monissa tutkimuksissa ja lähes kaikki antibiootit ovat olleet yhteydessä infektioon (18,19,20).
Tutkimuskohteena olivat yliopistosairaalan lapsipotilaat, joista merkittävällä osalla oli perussairaus, syöpä tai tulehduksellinen suolistosairaus, joiden katsotaan altistavan C. difficile -infektiolle (16). Avohoidossa pienten lasten C. difficile -näytteiden ottamista on syytä välttää. Etenkin alle vuoden ikäisten imeväisten positiivista löydöstä on mahdotonta tulkita, eikä hoitopäätös voi perustua ulostelöydökseen edes sairaalapotilailla. Ehkä olisi hyvä myös harkita, kannattaako THL:n raportoida imeväisten löydöksiä.
Kiitämme hygieniahoitaja Jaana Sinkkosta tutkimusmateriaalin hausta SAI-järjestelmästä.
Nikole Rautiainen, Risto Vuento, Merja Helminen: Ei sidonnaisuuksia.
- 1
- Davidovics ZH, Michail S, Nicholson MR ym. Fecal microbiota transplantation for recurrent Clostridium difficile infection and other conditions in children: a joint position paper from the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2019;68:130–43.
- 2
- Lo Vecchio A, Zacur GM. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012; 28:1–9.
- 3
- Jangi S, Lamont JT. Asymptomatic colonization by Clostridium difficile in infants: implications for disease in later life. J Pediatr Gastroenterol Nutr 2010; 51:2–7.
- 4
- Kubota H, Makino H, Gawad A ym. Longitudinal investigation of carriage rates, counts, and genotypes of toxigenic Clostridium difficile in early infancy. Appl Environ Microbiol 2016;82:5806–14.
- 5
- Khanna S, Pardi DS, Aronson SL ym. The epidemiology of community-acquired Clostridium difficile infection: a population-based study. Am J Gastroenterol 2012;107:89–95.
- 6
- Kang J, Sickbert-Bennett EE, Brown VM, Weber DJ, Rutala WA. Changes in the incidence of health care-associated pathogens at a university hospital from 2005 to 2011. Am J Infect Control 2014;42:770–5.
- 7
- Polage CR, Gyorke CE, Kennedy MA ym. Overdiagnosis of Clostridium difficile infection in the molecular test era. JAMA Intern Med 2015;175:1792–801.
- 8
- Gould CV, Edwards JR, Cohen J ym. Effect of nucleic acid amplification testing on population-based incidence rates of Clostridium difficile infection. Clin Infect Dis 2013;57:1304–7.
- 9
- Sarvikivi E, Toura S, Arifulla D, Lyytikäinen O. Hoitoon liittyvien infektioiden esiintyvyys Suomessa 2016. Suom Lääkäril 2018;73:2641–9.
- 10
- Tartuntatautirekisterin tilastotietokanta – Terveyden ja hyvinvoinnin laitos (THL) (siteerattu 16.6.2019). https://sampo.thl.fi/pivot/prod/fi/ttr/shp/fact_shp?row=area-12260&column=time-12059&filter=reportgroup-12271
- 11
- Rousseau C, Poilane I, De Pontual L, Maherault AC, Le Monnier A, Collignon A. Clostridium difficile carriage in healthy infants in the community: a potential reservoir for pathogenic strains. Clin Infect Dis 2012;55:1209–15.
- 12
- Viscidi R, Willey S, Bartlett JG. Isolation rates and toxigenic potential of Clostridium difficile isolates from various patient populations. Gastroenterology 1981;81:5–9.
- 13
- Eglow R, Pothoulakis C, Itzkowitz S ym. Diminished Clostridium difficile toxin A sensitivity in newborn rabbit ileum is associated with decreased toxin A receptor. J Clin Invest 1992;90:822–9.
- 14
- Naaber P, Lehto E, Salminen S, Mikelsaar M. Inhibition of adhesion of Clostridium difficile to Caco-2 cells. FEMS Immunol Med Microbiol 1996;14:205–9.
- 15
- Rolfe RD, Song W. Immunoglobulin and non-immunoglobulin components of human milk inhibit Clostridium difficile toxin A-receptor binding. J Med Microbiol 1995;42:10–9.
- 16
- McDonald LC, Gerding DN, Johnson S ym. Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018; 66:e1–e48.
- 17
- Crobach MJT, Planche T, Eckert C ym. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016;22:S63–81.
- 18
- Owens RC Jr, Donskey CJ, Gaynes RP ym. Antimicrobial-associated risk factors for Clostridium difficile infection. Clin Infect Dis 2008;46:19–31.
- 19
- Nicholson MR, Thomsen IP, Slaughter JC, Creech CB, Edwards KM. Novel risk factors for recurrent Clostridium difficile infection in children. J Pediatr Gastroenterol Nutr 2015;60:18–22.
- 20
- Wijarnpreecha K, Sornprom S, Thongprayoon C, Phatharacharukul P, Cheungpasitporn W, Nakkala K. The risk of Clostridium difficile associated diarrhea in nasogastric tube insertion: A systematic review and meta-analysis. Dig Liver Dis 2016;48:468–72.
Clostridium difficile at the Department of Paediatrics at Tampere University Hospital
Background Interpretation of positive Clostridium difficile samples in children is difficult because colonization without clinical infection is common.
Methods The study included children who got tested for C. difficile in the paediatric units in Tampere University Hospital during 2008–2017. The case-control study focused on risk factors.
Results Samples were taken from 644 children during 2008–2017 and 94 children had C. difficile toxin in the stool. 32.8% of all the samples and 38.3 % of the positive samples were taken from children ≤ 12-month-old. There were no risk factors in this age group. For older children, antibiotic treatment, nasogastric tube and surgery increased the risk of developing CDI.
Conclusions Significant part of C. difficile samples was taken from ≤ 12 month-old patients and they also had a substantial number of positive results. C. difficile findings in small children have to be interpreted with scrutiny because symptomless carriage is common. In all age groups the importance of positive C. difficile findings should be evaluated in context with clinical manifestations.