Eturauhassyövän kehittyvä diagnostiikka
Eturauhassyöpäepäily perustuu yleensä oireettomalta tai virtsaoireiselta mieheltä otetun verinäytteen PSA-arvon poikkeavuuteen.
Diagnoosi perustuu valtaosin eturauhasen paksuneulabiopsian histologiaan.
Hoito suunnitellaan syövän riskiluokituksen mukaan potilaan perussairaudet ja odotettavissa oleva elinikä huomioiden.
Tuseerauslöydöksen ja PSA-tason lisäksi monimuuttujainen magneettikuvaus kohdennettuine neulanäytteineen, kehittyvät biomarkkerit ja riskilaskurit ovat hyödyllisiä diagnostiikassa ja riskin arvioinnissa.

Eturauhassyöpä on yleisin syöpä (ihon tyvisolusyövät pois luettuina) ja toiseksi yleisin miesten syöpäkuoleman aiheuttaja Suomessa (1). Diagnoosi perustuu tavallisesti virtsaoireiselta tai oireettomalta mieheltä todetun prostataspesifisen antigeenin (PSA) poikkeavan arvon ja/tai eturauhasen poikkeavan tunnustelulöydöksen herättämään epäilyyn ja sen varmentamiseen eturauhasen paksuneulabiopsioilla (2,3).
Magneettikuvausta käytetään entistä enemmän eturauhasdiagnostiikassa, usein jo ennen neulanäytteiden ottoa. Varsinkin lievästi poikkeavan PSA-arvon (< 10 µg/l) selvittelyssä ennen biopsioita suositellaan tarkentamaan riskin arviointia magneettikuvauksen, muiden biomarkkerien tai riskilaskurien avulla (3). Monimuuttujaisella magneettikuvauksella erotetaan suurin osa kohtalaisen ja suuren riskin syövistä ja näytteet voidaan kohdentaa paremmin kasvainalueelle (4). Riskilaskureilla sekä seerumi-, virtsa- ja kudosnäytteiden analysointiin perustuvilla menetelmillä on pyritty parantamaan eturauhassyövän diagnostiikkaa ja ennusteen arviointia.
PSA-verikokeen avulla löydetään syöpiä potilaan terveydelle merkityksettömistä taudeista laajalle levinneisiin syöpiin. Hoito suunnitellaan syövän riskiluokituksen ja levinneisyyden mukaisesti. Pienen riskin eturauhassyövissä suositellaan nykyisin aktiivista seurantaa (3).
Oireet ja kliininen tutkimus
Varhaisvaiheen eturauhassyöpä on oireeton. Paikallinen eteneminen voi aiheuttaa virtsavaivoja, harvemmin eturauhastulehduksen tyyppisiä oireita. Virtsavaivaisilla miehillä ei ilmene enempää eturauhassyöpää tai etenevää eturauhassyöpää kuin oireettomilla (5,6).
Rakon pohjan tai peräsuolen suuntaan levinnyt eturauhassyöpä voi aiheuttaa verivirtsaisuutta, virtsanjohtimien tukkeutuessa munuaistoiminnan heikkenemistä tai peräsuolen ahtautumiseen liittyviä oireita. Erektiohäiriön taustalla eturauhassyöpä on kuitenkin harvoin. Lantion alueen imusolmukkeisiin levinnyt tauti voi edetessään aiheuttaa imunestekierron tukkeutumisen seurauksena alavartalon turvotusta sekä virtsanjohtimien ahtautumista.
Luuston etäpesäkkeet ovat eturauhassyövälle ominaisia. Ne aiheuttavat yleensä luustokipuja ensin lantion ja selän alueella, kuitenkin luonteeltaan pääosin skleroottisina, lyyttisiä metastaaseja harvemmin metastaattisia murtumia. Selkäydinkompressioon viittaavat oireet edellyttävät päivystyksellistä tutkimusta erikoissairaanhoidossa.
Laajalle levinnyt syöpä voi ilmetä myös yleisoireina, kuten laihtumisena, anemiana ja yleiskunnon heikkenemisenä, jopa ilman merkittävää kipua. Pieni osa aggressiivisimmista eturauhassyövistä diagnosoidaan pehmytkudosten, kuten maksan, keuhkojen tai aivojen etäpesäkkeiden oireiden perusteella.
Kliininen perustutkimus eturauhassyövän diagnosoinnissa on edelleen tuseeraus. Tuseerauslöydöksen positiivinen ennustearvo on kuitenkin varsin heikko, sensitiivisyys on huono, ja toistettavuus eri tukijoiden välillä on vaatimaton. Tuseerauksen kliininen arvo on myös riippuvainen tutkijan kokemuksesta (7,8). Se ei kuitenkaan ole merkityksetön tutkimus, sillä matalilla PSA-arvoilla (0–2,9 µg/l) sen positiivinen ennustearvo syövän löytymiselle on 4–14 % (9,10). Tuseerauksessa havaittuun poikkeavuuteen liittyy suurempi riski pahanlaatuisempaan syöpälöydökseen (11). Seulontatutkimuksena tuseerausta ei ole todettu hyödylliseksi (9).
Poikkeava tuseerauslöydös on aihe lähettää potilas urologin arvioon.
Epidemiologian kehitys
Systemaattisessa katsauksessa ruumiinavausaineistoista vuodesta 1948 vuoteen 2013 okkulttia eturauhassyöpää löytyi 60–70-vuotiaista joka kolmannelta ja 70–80-vuotiaista jo lähes puolelta. Tuona ajanjaksona ikävakioitua esiintyvyyden lisääntymistä ei todettu (12).
Diagnosoimattomien tautien reservi on siis suuri ja kasvaa miesten eliniän noustessa. Ruokavalion tai ympäristötekijöiden merkitys eturauhassyövässä on kaikkiaan vähäinen, eikä yleisiä ehkäisyn suosituksia voida antaa (3). Mitä aktiivisemmin ja paremmin menetelmin eturauhassyöpää haetaan, sitä enemmän sitä diagnosoidaan.
Vasta 1900-luvun vaihteessa virtsaoireiden kirurgisen hoidon kehityttyä eturauhassyöpä pystyttiin erottamaan hyvänlaatuisista virtsavaivojen aiheuttajista. Tauti oli yleensä jo paikallisesti levinnyt. Suurin osa eturauhassyövistä diagnosoitiin etäpesäkkeisenä, ja pitkään suurin edistysaskel oli palliatiivisen hormonaalisen hoidon kehittäminen 1940-luvulla (13).
Miesten eliniän piteneminen ja eturauhasen höyläysleikkausten yleistyminen lastuista tehtyine sattumalöydösdiagnooseineen selittivät eturauhassyövän ilmaantuvuuden kasvua jo 1970- ja 1980-luvuilla (14). Myös eturauhaskyhmyistä otetut neulanäytetekniikat kehittyivät.
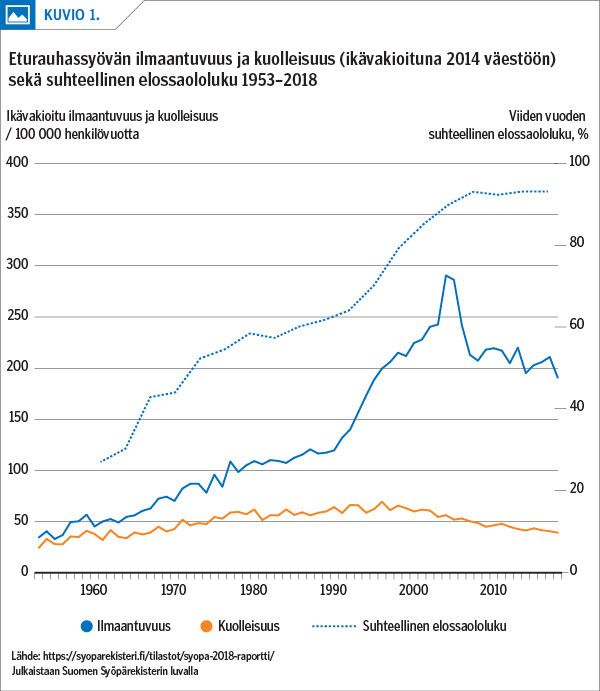
1980-luvulla yleistyi peräsuolen kautta tehtävä kaikututkimus. Tuseeraten tunnetun kyhmyn selvittelyssä diagnostiikka parani, jos kyhmyn lisäksi otettiin systemaattiset eturauhasen paksuneulabiopsiat alkuun 6 ja nykyisin 10–12 kohdasta (15). Paksuneulabiopsioiden laaja käyttö pelkän PSA-poikkeavuuden selvittelyssä johti eturauhassyövän ilmaantuvuuden jyrkkään kasvuun länsimaissa 1990-luvulla (kuvio 1) (16,17).
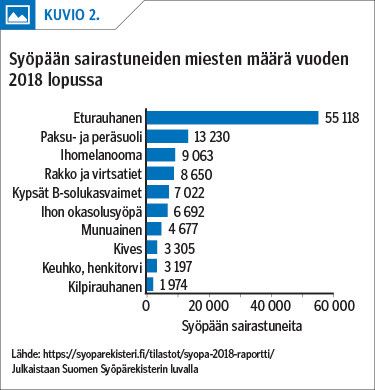
Nykyisin Suomessa diagnosoidaan eturauhassyöpä vuosittain noin 5 000 miehellä. Esiintyvyys on kymmenkertaistunut 1970-luvun vaihteesta. Eturauhassyöpäkuolemia on vuosittain yli 900 (kuvio 1), yli puolet näistä yli 80 vuoden iässä. Eturauhassyöpäpotilaita oli 2018 lopussa yli 55 000, ja heistä neljä viidestä kuolee johonkin muuhun sairauteen taudin hitaan kulun tai kehittyneiden hoitojen vuoksi (kuvio 2) (1).
Systemaattisen PSA-seulonnan ja parantamistavoittein suoritettujen leikkaus- ja sädehoitojen todettiin laajassa eurooppalaisessa seulontatutkimuksessa vähentävän eturauhassyöpäkuolleisuutta 16 vuoden seuranta-aikana noin 20 %. Kuitenkin vain yksi syöpäkuolema voitiin ehkäistä 18 todettua syöpää kohti. Yleisen seulonnan suosituksista onkin luovuttu. Miestä tulisi perusteellisesti informoida ennen seulontaluonteisen PSA-verikokeen ottamista (3,18).
Tavoitteena tarkempi luokittelu
Sekä paikallisen eturauhassyövän parantamistavoitteiset hoidot että levinneen syövän etenemistä estävät hoidot aiheuttavat usein pitkäaikaisia elämänlaadullisia ja terveydellisiä haittoja. Leikkaushoitoon ja sädehoitoon liittyy komplikaatioriskejä. Hormonihoidon seurauksena ainakin olemassa olevat sydän- ja verisuonisairaudet voivat edetä (19).
Diagnostiikan tavoitteeksi on muotoutumassa aggressiivisten syöpien varhainen toteaminen miehiltä, joiden elinajan ennuste on yli 10–15 vuotta, ja kliinisesti merkityksettömien syöpien diagnosoinnin välttäminen. Systemaattiset paksuneulabiopsiat on todettu ongelmallisiksi. PSA-arvon perusteella seulottu syöpä ei yleensä näy kaikututkimuksessa ja lähes 30 % syövistä jää löytymättä ensimmäisistä systemaattisista biopsioista. Hoitovalinnoissa olennaisen pahanlaatuisuus- ja levinneisyysarvion tekemisessä systemaattiset biopsiat ovat epäluotettavia. Kliinisesti merkityksettömiä syöpiä löytyy paljon, mutta niiden luokittelu on epävarmaa (20,21).
Antibioottiresistenssin lisäännyttyä myös vakavien infektiokomplikaatioiden määrä lisääntyy. Se kaksinkertaistui Uudellamaalla 1,2 %:iin vuosina 2005–2013 (22).
Tuorein luokitus jakaa syövät viiteen histologiseen luokkaan (ISUP Grade Group, GG1–5) (23). Luokkaa 1 pidetään merkityksettömänä ja luokkia 3–5 merkityksellisinä. Yleisimmin diagnosoidun luokan, GG2-syöpien, kliininen käyttäytyminen vaihtelee huomattavasti. Huonompi ennuste liittyy ainakin syövän tiettyihin histologisiin alatyyppeihin (24,25).
Pohjoismaisessa tutkimuksessa satunnaistettiin miehiä radikaaliprostatektomia- ja seurantaryhmiin. Tutkimuksen jälkianalyysissä radikaali prostatektomia hyödytti elinaika-analyysissä vain niitä miehiä, joiden eturauhasesta oli todettu GG3–5-luokan syöpä (26).
Eturauhassyövän merkkiaineet
Prostataspesifinen antigeeni
PSA-määrityksen keksiminen ja kliiniseen käyttöön ottaminen 1980- ja 1990-luvun vaihteessa mahdollisti eturauhassyövän löytymisen ennen tunnustelulla kyhmystä todettavaa tai oireista kliinistä tautia. PSA-arvo nousee eturauhasen liikakasvun, prostatiitin ja virtsatietulehduksen sekä esimerkiksi virtsaummen ja katetroinnin seurauksena. Matalakaan PSA-arvo ei varmuudella sulje pois eturauhassyöpää.
Vapaan ja kokonais-PSA:n suhdetta käytetään myös osana diagnostiikassa (27). PSA-suhteen määritys kehitettiin alun perin parantamaan diagnostiikka ns. harmaalla alueella, jossa kokonais-PSA on 4–10 µg/l. Jos PSA-suhde on alle 10 %, paksuneulabiopsioista löytyy syöpä 56 %:lta miehistä. Jos PSA-suhde on yli 25 %, syöpä löytyy vain 8 %:lta (27). Nykyisin useat laboratoriot kuitenkin määrittävät PSA-suhteen myös matalammilla kokonais-PSA-arvoilla.
Normaali eturauhasen liikakasvukudos erittää PSA:ta, eli suurentunut eturauhanen voi aiheuttaa suurentuneen PSA-arvon, vaikka kyseessä ei ole eturauhassyöpä. Tämä huomioidaan PSA-tiheysarvossa (PSAd). Se lasketaan jakamalla PSA-arvo eturauhasen tilavuudella. Ruotsalaisessa tutkimuksessa osoitettiin, että matalan PSAd-arvon (korkeintaan 0,07 µg/l/ml) perusteella voidaan välttää lähes 20 % eturauhasen koepaloista, mutta tällöin jäi löytymättä 6,9 % kliinisesti merkittäviksi luokitelluista vähintään GG2-luokan syövistä (28).
Stockholm 3 -testi (STHLM3)
STHLM3-testissä määritetään verikokeella useita merkkiaineita (PSA, vapaa PSA, intakti PSA, hK2, MSMB, MIC1) ja yli 100 geenin polymorfismi (232 yhden nukleotidin polymorfiaa). Testitulosta varten kerätään kliinisinä tietoina ikä, sukurasitus, finasteridin tai dutasteridin käyttö, sekä tieto, onko eturauhasesta aikaisemmin otettu koepaloja.
Testin vastaus on negatiivinen tai positiivinen. Positiivisen testituloksen jälkeen suositellaan urologin arviota biopsioiden tarpeesta.
Testin avulla voidaan vähentää tarpeettomia biopsioita. Toisaalta voidaan löytää kliinisesti merkittävät syövät. STHLM3-testin suorituskykyä on arvioitu vertaamalla sitä pelkkään PSA-määritykseen 47 688 ruotsalaisella 50–69-vuotiaalla miehellä (29).
Testi on saatavissa joidenkin yksityisten lääkäriasemien ja laboratorioiden kautta Suomessa, ja se maksaa noin 300 euroa.
Muut verinäytteeseen perustuvat testit
Prostate Health Index (PHI) testissä määritetään vapaan PSA:n, kokonais-PSA:n ja [-2]proPSA:n pitoisuudet, joiden perusteella voidaan ennustaan vähintään luokan GG2 eturauhassyöpää miehillä, joiden kokonais-PSA oli 4–10 µg/l. Testin vastaus annetaan lukuarvona, ja suurempi arvo viittaa suurentuneeseen syövän riskiin. Testin hinta Yhdysvalloissa on noin 80 dollaria (30).
4Kscore-testissä määritetään neljän kallikreiiniproteiinin pitoisuudet (kokonais-PSA, vapaa-PSA, intakti PSA, hK2). Testin tulos antaa prosentuaalisen riskin vähintään GG2-luokan eturauhassyövälle. Jos testin tulos on alle 7,5 %, kyseessä on vähäisen riskin löydös. Testi pitäisi ottaa vasta poikkeavan PSA-verikoetuloksen tai poikkeavan tunnustelulöydöksen jälkeen. Vähäisen riskin löydös testissä ennustaa myös hyvin pientä eturauhassyövän etäpesäkkeiden kehittymisen tai eturauhassyöpäkuoleman riskiä (31,32). Testin hinta Yhdysvalloissa on noin 500 dollaria (29).
Virtsanäytteen PCA3-määritys
Eturauhassyöpägeeni 3:n eli PCA3:n lähetti-RNA:n määritys tehdään eturauhasen reunoilta kohti keskiosia tapahtuneen painelun jälkeen otetusta virtsasta. Vastauksena saadaan lukuarvo, joka kertoo eturauhassyövän riskistä.
PCA3:n käyttöä on tutkittu myös eturauhassyövän aggressiivisuuden arvioinnissa. Testi on saatavissa Suomessa noin 500 euron hintaan. Sen käyttö on kuitenkin jäänyt vähäiseksi (33).
Muut virtsanäytteeseen ja kudosnäytteeseen perustuvat testit
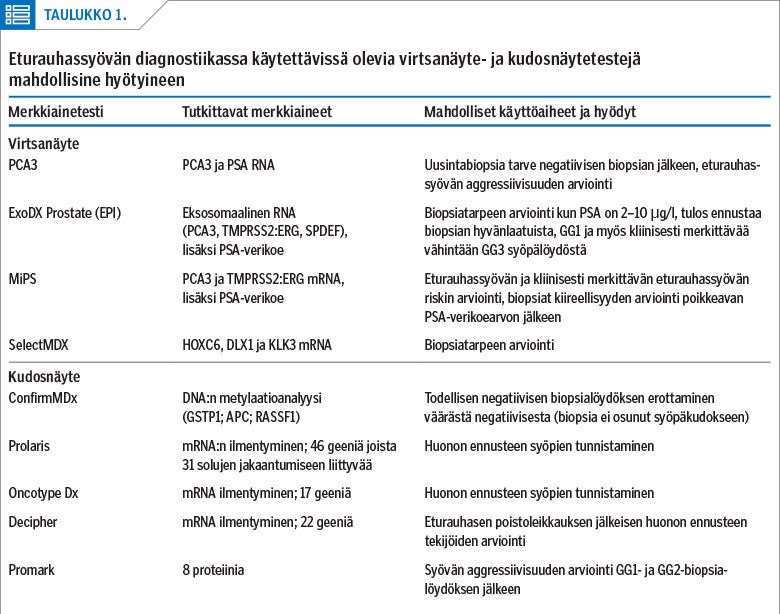
Virtsanäytetestit otetaan eturauhasen tunnustelun jälkeen virtsatusta virtsasta. Lähinnä Yhdysvalloissa käytössä olevat virtsanäyte- ja kudosnäytetestit mahdollisine hyötyineen (34) on esitetty taulukossa 1. Virtsanäytteeseen perustuvat testit maksavat 300–700 dollaria (29). Kudosnäytteeseen perustuvat testit ovat kalliimpia, esimerkiksi Prolaris 3 400 dollaria ja ConfirmMDx 206 dollaria yhtä biopsiaa kohden (35).
Geneettinen alttius
Perinnöllisen eturauhassyövän määritelmänä pidetään kolmea tai useampaa eturauhassyöpään sairastunutta sukulaista tai vähintään kahta alle 55-vuotiaana sairastunutta sukulaista. Vain noin 9 %:lla sairastuneista miehistä on arvioitu olevan perinnöllinen eturauhassyöpä (36).
Kuitenkin jo yhden ensimmäisen asteen sukulaisen eturauhassyöpä lisää miehen riskiä sairastua eturauhassyöpään. Riski on vielä suurempi, mikäli isällä ja veljellä on eturauhassyöpä, ja kahden veljen eturauhassyöpä kasvattaa riskin jopa 7,7-kertaiseksi (37).
Erityisesti BRCA2-geenimutaatio altistaa aggressiiviselle eturauhassyövälle (38). Suomalaisessa väestössä tämän geenin merkitys perinnöllisessä eturauhassyövässä vaikuttaa olevan vähäinen (39).
Eturauhassyövän riskilaskurit
Etenkin laajojen eurooppalaisten (SWOP) ja yhdysvaltalaisten (PBCG) seulontatutkimusaineistojen pohjalta on kehitetty vapaasti käytettäviä sähköisiä riskilaskureita ennustamaan PSA-arvoa paremmin syövän ja kliinisesti merkityksellisen eturauhassyövän olemassaoloa. Nämä riskilaskurit perustuvat ikään, PSA-tasoon, sukuhistoriaan ja eturauhasen tunnustelulöydökseen.
SWOP:n eri versioissa voi lisäksi käyttää tietoja eturauhasen tilavuudesta, syöpäepäilyn asteesta magneettikuvauksessa, aiemmasta biopsiahistoriasta ja PHI-biomarkkeritestistä (40). PBCG-laskuri ottaa huomioon afrikkalaiseen rotuun liittyvän lisääntyneen syöpäriskin (41).
Kuvantaminen ja paksuneulabiopsioiden otto
Transrektaalinen kaikukuvaus on osoittautunut luotettavaksi eturauhasen koon ja muodon arvioinnissa. Syöpäpesäkkeiden tunnistamisessa ja paikallisen levinneisyyden selvittelyssä sen hyöty on vaatimaton (42). Puutteiden takia mm. eturauhas- ja syöpäkudoksen elastisuuseroon, varjoainetehosteiseen kaikukuvaukseen ja korkeataajuiseen kaikukuvaukseen perustuvia tekniikoita on kehitteillä.
Eturauhasen magneettikuvausta tutkittiin jo 1990-luvulla syövän levinneisyystutkimuksena (43). Vasta monimuuttujainen magneettikuvaus, etenkin diffuusiokuvaustekniikoiden kehityttyä, on tuonut mahdollisuuden syöpäkasvainten luotettavampaan tunnistamiseen ja biopsioiden kohdistamiseen poikkeavuusalueelle eli todennäköisesti pahanlaatuisimpiin kasvainalueisiin.
Magneettikuvaus antaa viitteellistä tietoa pääkasvaimen koosta, pahanlaatuisuudesta ja levinneisyydestä. Nopea ja edullisempi kuvaus ilman varjoainetehostesarjaa on lupaava kehityskulku (44). Tekniikan diagnostinen arvo rutiinikäytössä on vielä selvittelyn alla.
Poikkeavan PSA-arvon selvittelyssä magneettikuvauksen avulla jopa 90 % pääkasvaimista näkyy (45). Kuvauslöydös ja siihen kohdennetut paksuneulabiopsiat tarkentavat taudin pahanlaatuisuuden luokittelua (46).
Kohdennetut näytteet otetaan peräsuolen tai välilihan ihon läpi. Kohdentamisessa käytetään kaikuohjausta urologin kolmiulotteiseen hahmottamiseen liitettynä tai tietokoneavusteista magneetti- ja kaikukuvien yhdistämiseen perustuvaa tekniikkaa. Kohdentaminen magneettikuvauslaitteessa vaatii merkittäviä resursseja ja erikoisvälineistön.
2010-luvulla magneettikuvaus ja kohdennetut näytteet osoitettiin hyödyllisiksi syöpäepäilyssä hyvälaatuisten systemaattisten biopsioiden jälkeen (47). Tuoreimman tutkimustiedon valossa magneettikuvaus jo ennen ensimmäisiä biopsioita kohdennettuine näytteineen on osoittautunut diagnostiselta arvoltaan paremmaksi kuin systemaattiset biopsiat (4,48). Paras arvio kliinisesti merkityksellisen syövän olemassaolosta ja syövän pahanlaatuisuuden asteesta saadaan yhdistämällä kohdennetut ja systemaattiset näytteet. Haittapuolena on kliinisesti merkityksettömien syöpien lisääntynyt löytyminen (46).
Kliinisesti merkityksettömien syöpien huono erottuminen magneettikuvauksessa on etu. Aggressiivisistakin kasvaimista alle 1 cm:n kokoiset ja solukuvaltaan harvat erottuvat siinä huonosti (49,50,51). Vaikka magneettikuvassa ei olisi epäilyttävää, systemaattiset näytteet on syytä ottaa, mikäli PSAd, riskilaskuri tai jokin uusista kasvainmerkkiaineista viittaa merkityksellisen syövän riskiin. PSAd:n riskirajana on pidetty mm. arvoa 0,15 (50).
Mikäli syöpäepäily on normaalin magneettikuvauksen ja hyvänlaatuisten systemaattisten biopsioiden jälkeenkin vahva, voidaan käyttää saturaatiobiopsiatekniikkaa välilihan läpi. Kymmeniä näytteitä otetaan yleensä anestesiassa.
Poikkeustapauksissa diagnostiikassa on käytetty prostataspesifistä membraaniantigeenimerkkiainetta PET-TT-kuvauksessa (PSMA-PET-TT). Se voi tulla systemaattisten biopsioiden jälkeen kyseeseen, jos magneettikuvaukselle on vasta-aihe tai kuvaus olisi epädiagnostinen molemminpuolisten lonkkaproteesien takia.
TT-tutkimusta ja luuston isotooppikuvausta herkempi ja spesifisempi PSMA-PET-TT on otettu yliopistosairaaloissa yhä laajemmin käyttöön hoidonjälkeisten, taudin uusiutumisen suhteen epäilyttävien PSA-nousujen selvittelyssä. Menetelmä on lupaava etenkin suuren riskin syöpien primaarivaiheen levinneisyysselvittelyssä ennen hoitolinjauksia (52). Laajoihin potilasaineistoihin pohjautuvat hoitoprotokollat perustuvat kuitenkin edelleen perinteisiin levinneisyystutkimuksiin tapauksissa, joissa PSA-arvon ja histologian perusteella on epäily etäpesäkkeisestä taudista.
Lopuksi
PSA-arvoon ja systemaattisiin paksuneulabiopsioihin perustuvasta diagnostiikasta ollaan tutkimustiedon karttuessa siirtymässä riskin arvion muodostamiseen biomarkkeriyhdistelmien, riskilaskurien ja kohdennetusti tehtyjen magneettikuvausten avulla ennen biopsiapäätöstä. Tämä kehitys toivottavasti selkeyttää keskeistä ongelmaa, PSA-verikokeen käyttöä ensilinjan tutkimuksena eturauhassyövän seulonnassa.
Seulontaluonteiset tutkimukset eivät ole perusteltuja, jos arvio jäljellä olevasta elinajasta on alle 15 vuotta. Seulontaluonteinen PSA-mittaus voi Euroopan urologiyhdistyksen ohjeistuksen mukaan tulla kyseeseen yli 50-vuotiailla miehillä (yli 45 v, jos tiedossa on suku-, rotu- tai geneettinen alttius), mutta se edellyttää potilaan perusteellista informointia tutkimuksen mahdollisista hyödyistä ja selvistä haitoista.
Ruotsalaisen rekisteritutkimuksen mukaan eturauhassyöpäkuolemat keskittyvät miehiin, joilla PSA on 40 vuoden iässä yli 1 µg/l tai 60 vuoden iässä yli 2 µg/l (53). Laajassa tutkimuksessa yksittäisestä seulontaluonteisesta PSA-mittauksesta 50–69 vuoden iässä ei ole kuitenkaan todettu ennusteellista hyötyä (54). PSA:n, uusien biomarkkerien ja magneettikuvauksen yhdistelmien käyttöä seulonnassa tutkitaan parhaillaan mm. Suomessa ja Ruotsissa, tuloksia saadaan vasta vuosien kuluttua (55,56).
Toinen ongelmakohta on kliinisesti merkityksellisen syövän luokittelu. Kehittyneen diagnostiikan ja kuvantamisohjattujen biopsioiden lisäksi tarvitaan parempia keinoja, kuten uusia biomarkkereita, eturauhassyövän ennusteen arviointiin.
Myös magneettikuvauksen, histopatologisen diagnostiikan ja biopsiatoimenpiteiden laatua tulisi pystyä seuraamaan. Magneettikuvauslaitteiston ja -protokollan tulisi olla ajantasainen, ja lausuntoihin suositellaan strukturoitua PI-RADS-luokitusta (57). Kuvien tulkinta ja kohdennettujen biopsioiden ottaminen edellyttää erityisosaamista ja riittävästi toistoja.
Panu Tonttila: Kongressimatkakulut (Orion).
Markku Vaarala: Asiantuntijalausunto (Potilasvakuutuskeskus), luentopalkkio (Ferring), konsultointi (Janssen), kokouskulut (Bayer).
- 1
- Pitkäniemi J, Malila N, Virtanen A, Degerlund H, Heikkinen S, Seppä K. Syöpä 2018. Tilastoraportti Suomen syöpätilanteesta. Suomen Syöpäyhdistyksen julkaisuja nro 93. Suomen Syöpäyhdistys, Helsinki 2020.
- 2
- Cancercentrum R. Regionala Cancercentrum i samverkan. Prostatacancer. Nationell kvalitetsrapport för 2016 (luettu 15.12.2020). https://npcr.se/wp-content/uploads/2017/10/20170922_npcr_nationell_rapport_2016.pdf
- 3
- Mottet N, Bellmunt J, Briers E ym.; members of the EAU – ESTRO – ESUR –SIOG Prostate Cancer Guidelines Panel. EAU – ESTRO – ESUR – SIOG Guidelines on Prostate Cancer. Part 1: Screening, diagnosis, and local treatment with curative intent. Eur Urol 2021;79:243–62.
- 4
- Drost FH, Osses D, Nieboer D ym. Prostate magnetic resonance imaging, with or without magnetic resonance imaging-targeted biopsy, and systematic biopsy for detecting prostate cancer: A Cochrane Systematic Review and Meta-analysis. Eur Urol 2020;77:78–94.
- 5
- Chandra Engel J, Palsdottir T, Aly M ym. Lower urinary tract symptoms (LUTS) are not associated with an increased risk of prostate cancer in men 50-69 years with PSA >/=3 ng/ml. Scand J Urol 2020;54:1–6.
- 6
- Ostero I, Jakupsstovu J, Brodersen J. Do men with lower urinary tract symptoms have an increased risk of advanced prostate cancer? BMJ 2018;361:k1202.
- 7
- Catalona WJ, Richie JP, Ahmann FR ym. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol 2017;197(2S):S200–7.
- 8
- Naji L, Randhawa H, Sohani Z ym. Digital rectal examination for prostate cancer screening in primary care: a systematic review and meta-analysis. Ann Fam Med 2018;16:149–54.
- 9
- Schroder FH, van der Maas P, Beemsterboer P ym. Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 1998;90:1817–23.
- 10
- Carvalhal GF ym. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng./ml. or less. J Urol 1999;161:835–9.
- 11
- Okotie OT, Roehl KA, Han M, Loeb S, Gashti SN, Catalona WJ. Characteristics of prostate cancer detected by digital rectal examination only. Urology 2007;70:1117–20.
- 12
- Bell KJ, Del Mar C, Wright G, Dickinson J, Glasziou P. Prevalence of incidental prostate cancer: A systematic review of autopsy studies. Int J Cancer 2015;137:1749–57.
- 13
- Huggins C, Hodges C. Studies on Prostatic Cancer: I. The effect of castration, of estrogen, and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941;1:293–7. https://doi.org/10.3322/canjclin.22.4.232
- 14
- Merrill RM, Feuer EJ, Warren JL, Schussler N, Stephenson RA. Role of transurethral resection of the prostate in population-based prostate cancer incidence rates. Am J Epidemiol 1999;150:848–60.
- 15
- Hodge KK, McNeal JE, Terris MK, Stamey TA. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989;142:71–5.
- 16
- Kvale R, Auvinen A, Adami HO ym. Interpreting trends in prostate cancer incidence and mortality in the five Nordic countries. J Natl Cancer Inst 2007;99:1881–7.
- 17
- Zhou CK, Check DP, Lortet-Tieulent J ym. Prostate cancer incidence in 43 populations worldwide: An analysis of time trends overall and by age group. Int J Cancer 2016;138:1388–400.
- 18
- Murtola T, Auvinen A. Miten eturauhassyöpää pitäisi seuloa – vai pitäisikö? Suom Lääkäril 2020;75:1569.
- 19
- Shore ND, Saad F, Cookson MS ym. Oral relugolix for androgen-deprivation therapy in advanced prostate cancer. N Engl J Med 2020;382:2187–96.
- 20
- Roehl KA, Antenor JA, Catalona WJ. Serial biopsy results in prostate cancer screening study. J Urol 2002;167:2435–9.
- 21
- Suardi N, Briganti A, Gallina A ym. Testing the most stringent criteria for selection of candidates for active surveillance in patients with low-risk prostate cancer. BJU Int 2010;105:1548–52.
- 22
- Lahdensuo K, Rannikko A, Anttila VJ ym. Increase of prostate biopsy-related bacteremic complications in southern Finland, 2005-2013: a population-based analysis. Prostate Cancer Prostatic Dis 2016;19:417–22.
- 23
- Epstein JI, Egevad L, Amin MB ym. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 2016;40:244–52.
- 24
- Dong F, Yang P, Wang C ym. Architectural heterogeneity and cribriform pattern predict adverse clinical outcome for Gleason grade 4 prostatic adenocarcinoma. Am J Surg Pathol 2013;37:1855–61.
- 25
- Kweldam CF ym. On cribriform prostate cancer. Transl Androl Urol 2018;7:145–54.
- 26
- Bill-Axelson A, Holmberg L, Garmo H ym. Radical prostatectomy or watchful waiting in prostate cancer - 29-year follow-up. N Engl J Med 2018;379:2319–29.
- 27
- Catalona WJ, Partin AW, Slawin KM ym. Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998;279:1542–7.
- 28
- Nordstrom T ym. Prostate-specific antigen (PSA) density in the diagnostic algorithm of prostate cancer. Prostate Cancer Prostatic Dis 2018;21:57–63.
- 29
- Gronberg H, Adolfsson J, Aly M ym. Prostate cancer screening in men aged 50-69 years (STHLM3): a prospective population-based diagnostic study. Lancet Oncol 2015;16:1667–76.
- 30
- Osses DF, Roobol MJ, Schoots IG. Prediction medicine: biomarkers, risk calculators and magnetic resonance imaging as risk stratification tools in prostate cancer diagnosis. Int J Mol Sci 2019;20:10.3390/ijms20071637.
- 31
- Vickers AJ, Gupta A, Savage CJ ym. A panel of kallikrein marker predicts prostate cancer in a large, population-based cohort followed for 15 years without screening. Cancer Epidemiol Biomarkers Prev 2011;20:255–61.
- 32
- Vertosick EA, Haggstrom C, Sjoberg DD ym. Prespecified 4-kallikrein marker model at age 50 or 60 for early detection of lethal prostate cancer in a large population based cohort of asymptomatic men followed for 20 years. J Urol 2020;204:281–8.
- 33
- Taari K, Hotakainen K, Saijonkari M, Grahn R, Leipälä J. PCA3-geenitesti eturauhassyövän diagnostiikassa. Suom Lääkäril 2010;65:1623–9.
- 34
- Kohaar I, Petrovics G, Srivastava S. A rich array of prostate cancer molecular biomarkers: opportunities and challenges. Int J Mol Sci 2019;20:10.3390/ijms20081813
- 35
- Aubry W ym. Budget impact model: epigenetic assay can help avoid unnecessary repeated prostate biopsies and reduce healthcare spending. Am Health Drug Benefits 2013;6:15–24.
- 36
- Hemminki K. Familial risk and familial survival in prostate cancer. World J Urol 2012;30:143–8.
- 37
- Stewart RW, Lizama S, Peairs K, Sateia HF, Choi Y. Screening for prostate cancer. Semin Oncol 2017;44:47–56.
- 38
- Nyberg T, Frost D, Barrowdale D ym. Prostate cancer risks for male BRCA1 and BRCA2 mutation carriers: a prospective cohort study. Eur Urol 2020;77:24–35.
- 39
- Ikonen T, Matikainen MP, Syrjakoski K ym. BRCA1 and BRCA2 mutations have no major role in predisposition to prostate cancer in Finland. J Med Genet 2003;40(8):e98.
- 40
- Ankerst DP, Straubinger J, Selig K ym. A contemporary prostate biopsy risk calculator based on multiple heterogeneous cohorts. Eur Urol 2018;74:197–203.
- 41
- Roobol MJ, Steyerberg EW, Kranse R ym. A risk-based strategy improves prostate-specific antigen-driven detection of prostate cancer. Eur Urol 2010;57:79–85.
- 42
- Pokorny MR, de Rooij M, Duncan E ym. Prospective study of diagnostic accuracy comparing prostate cancer detection by transrectal ultrasound-guided biopsy versus magnetic resonance (MR) imaging with subsequent MR-guided biopsy in men without previous prostate biopsies. Eur Urol 2014;66:22–9.
- 43
- Ikonen S, Karkkainen P, Kivisaari L ym. Magnetic resonance imaging of clinically localized prostatic cancer. J Urol 1998;159:915–9.
- 44
- Jambor I, Verho J, Ettala O ym. Validation of IMPROD biparametric MRI in men with clinically suspected prostate cancer: A prospective multi-institutional trial. PLoS Med 2019;16(6):e1002813.
- 45
- Ahmed HU, El-Shater Bosaily A, Brown LC ym. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017;389:815–22.
- 46
- Ahdoot M, Wilbur AR, Reese SE ym. MRI-targeted, systematic, and combined biopsy for prostate cancer diagnosis. N Engl J Med 2020;382:917–28.
- 47
- Schoots IG, Roobol MJ, Nieboer D, Bangma CH, Steyerberg EW, Hunink MG. Magnetic resonance imaging-targeted biopsy may enhance the diagnostic accuracy of significant prostate cancer detection compared to standard transrectal ultrasound-guided biopsy: a systematic review and meta-analysis. Eur Urol 2015;68:438–50.
- 48
- Kasivisvanathan V, Stabile A, Neves JB ym. Magnetic resonance imaging-targeted biopsy versus systematic biopsy in the detection of prostate cancer: a systematic review and meta-analysis. Eur Urol 2019;76:284–303.
- 49
- Johnson DC, Raman SS, Mirak SA ym. Detection of individual prostate cancer foci via multiparametric magnetic resonance imaging. Eur Urol 2019;75:712–20.
- 50
- Norris JM, Carmona Echeverria LM, Bott SRJ ym. What type of prostate cancer is systematically overlooked by multiparametric magnetic resonance imaging? An analysis from the PROMIS Cohort. Eur Urol 2020;78:163–70.
- 51
- Rosenkrantz AB, Mendrinos S, Babb JS, Taneja SS. Prostate cancer foci detected on multiparametric magnetic resonance imaging are histologically distinct from those not detected. J Urol 2012;187:2032–8.
- 52
- Hofman MS, Lawrentschuk N, Francis RJ ym. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020;395:1208–16.
- 53
- Vickers AJ, Cronin AM, Bjork T ym. Prostate specific antigen concentration at age 60 and death or metastasis from prostate cancer: case-control study. BMJ 2010;341:c4521.
- 54
- Martin RM, Donovan JL, Turner EL ym. Effect of a low-intensity PSA-based screening intervention on prostate cancer mortality: The CAP randomized clinical trial. JAMA 2018;319:883–95.
- 55
- Auvinen A, Rannikko A, Taari K ym. A randomized trial of early detection of clinically significant prostate cancer (ProScreen): study design and rationale. Eur J Epidemiol 2017;32:521–7.
- 56
- Nordstrom T, Jaderling F, Carlsson S, Aly M, Gronberg H, Eklund M. Does a novel diagnostic pathway including blood-based risk prediction and MRI-targeted biopsies outperform prostate cancer screening using prostate-specific antigen and systematic prostate biopsies? - protocol of the randomised study STHLM3MRI. BMJ Open 2019;9:e027816-027816.
- 57
- Turkbey B, Rosenkranz A, Masoom H ym. Prostate Imaging Reporting and Data System Version 2.1: 2019 Update of Prostate Imaging Reporting and Data System Version 2. Eur Urol 2019;76:340–51.
The developing diagnostics of prostate cancer
Prostate cancer is the most frequently diagnosed cancer in Finland and the second most common cause of cancer death among Finnish males. An abnormal PSA blood test from an asymptomatic man or a man seeking help for urinary symptoms is the usual reason for further diagnostic tests. A diagnosis based on symptoms of metastatic cancer is less frequent.
The diagnosis is mainly based on histological analysis of transrectal needle biopsies. To avoid diagnosis of clinically insignificant cancers among men with slightly abnormal PSA values (< 10 µg/l), further risk stratification with other biomarkers, risk calculators or multiparametric magnetic resonance imaging (MRI) is suggested before biopsy.
Most clinically significant cancers are identified with MRI, with the option to perform targeted biopsies of abnormal lesions. This improves the risk classification of cancer. With the PSA test both clinically insignificant and aggressive cancers are diagnosed. The treatment decisions are based on the risk classification of the cancer. Low risk cancers are suggested to be treated primarily by active surveillance.