Farmakogeneettiset laboratoriotutkimukset psyykenlääkkeiden käytön yhteydessä – miten hyödynnät?
Monet masennus- ja psykoosilääkkeet metaboloituvat CYP2C19- ja CYP2D6-entsyymien välityksellä.
Näiden entsyymien aktiivisuudessa tunnetaan yleistä perinnöllistä vaihtelua, joka voi vaikuttaa psyykenlääkkeiden pitoisuuksiin ja tätä kautta tehoon ja haittavaikutusten riskiin.
Tässä katsauksessa kuvataan yleisesti käytettyjen psyykenlääkkeiden tieteelliseen näyttöön perustuvat farmakogeneettiset annossuositukset.
Farmakogeneettinen laboratoriotutkimus voi olla kustannusvaikuttava erityisesti masennuslääkityksen valinnassa.
Psyykenlääkkeiden käyttö on yleistynyt Suomessa 2000-luvulla. Esimerkiksi masennuslääkkeiden käyttö on lähes kaksikertaistunut (1). Arviolta noin 8 % suomalaisista käyttää masennuslääkkeitä ja 2 % psykoosilääkkeitä (2).
Psyykenlääkkeiden yksilöllistä vastetta on vaikea ennakoida, ja lääkkeitä voidaan joutua vaihtamaan jopa toistuvasti. Tämän seurauksena hoito pitkittyy, toipuminen viivästyy ja hoitokulut kasvavat. Yksilöiden välisiä eroja lääkevasteessa selittävät yleisesti potilaan ikä, sukupuoli, tupakointi ja muu päihteiden käyttö, sairaudet, lääkkeiden yhteisvaikutukset ja perinnölliset tekijät (3,4,5,6,7,8,9,10,11).
Perinnöllisiä tekijöitä voidaan selvittää farmakogeneettisillä laboratoriotutkimuksilla. Suomessa käytettyjen testien sisältö, hinta ja tulosten raportointi saattavat poiketa palveluntuottajasta riippuen, mutta psyykenlääkkeiden kannalta tärkeät CYP2D6- ja CYP2C19-geenit sisältyvät yleensä tutkimuksiin. Hus Diagnostiikkakeskus toi alkuvuodesta 2022 käyttöön farmakogeneettisen paneelin, joka sisältää yleisimmät kliinisesti merkittävät lääkehoitoihin vaikuttavat geenit.
Tämän artikkelin tavoitteena on auttaa hyödyntämään farmakogeneettisiä laboratoriotutkimuksia psyykenlääkkeiden käytön yhteydessä.
Farmakogenetiikka lääkärin työkaluna
Perinnölliset tekijät voivat vaikuttaa muun muassa psyykenlääkkeiden vaikutukseen reseptoritasolla, haittavaikutusten riskiin tai aineenvaihduntaan eli metaboliaan. Käytännön merkitystä on lähinnä psyykenlääkkeiden metaboliaan vaikuttavilla perinnöllisillä tekijöillä.
Farmakogenetiikan käyttö kliinisessä työssä on ollut suhteellisen vähäistä laboratoriotutkimusten vaihtelevan sisällön ja saatavuuden, riittämättömän tutkimusnäytön ja tulosten tulkinnan vaikeuksien takia (12,13,14).
Viime vuosina farmakogeneettiset laboratoriotutkimukset ovat tulleet yhä laajemmin saataville. Tulosten hyödyntämisen helpottamiseksi kansainväliset työryhmät, kuten Kliinisen farmakogenetiikan implementaatiokonsortio (CPIC) (15) ja Alankomaiden farmakogenetiikkatyöryhmä (DPWG) (16), ovat julkaisseet näyttöön perustuvia, päivitettäviä farmakogeneettisiä annossuosituksia. Näitä ja muuta kuratoitua tietoa farmakogenetiikasta on koottu Pharmacogenomics Knowledgebase -tietokantaan (17). Ohjeita farmakogenetiikan huomioimisesta löytyy myös erityisesti uusimpien lääkkeiden valmisteyhteenvedoista.
Psyykenlääkkeiden kannalta keskeisten CYP-entsyymien geneettinen vaihtelu
CYP2D6 ja CYP2C19 ovat keskeisimmät psyykenlääkkeiden metaboliaan osallistuvat entsyymit (18). CYP2D6-entsyymin perinnöllinen aktiivisuus voidaan jakaa neljään luokkaan: erittäin nopea metabolia (ultrarapid metabolizer, UM), normaali metabolia (normal metabolizer, NM), normaalia hitaampi metabolia (intermediate metabolizer, IM) ja hidas metabolia (poor metabolizer, PM) (19,20). CYP2C19-entsyymillä on edellä mainittujen lisäksi normaalia nopeampien metaboloijien luokka (rapid metabolizers, RM).
Suomalaisilla CYP2D6- ja CYP2C19-geenien perinnölliset muunnokset ovat varsin yleisiä, mutta muunnosten yleisyydet vaihtelevat väestöittäin. Suomalaisista 3 % on CYP2D6-entsyymin suhteen perinnöllisesti hitaita metaboloijia, 29 % normaalia hitaampia metaboloijia ja 7 % erittäin nopeita metaboloijia (21). CYP2C19-entsyymin suhteen 3 % on hitaita metaboloijia, 29 % normaalia hitaampia metaboloijia, 24 % normaalia nopeampia metaboloijia ja 4 % erittäin nopeita metaboloijia.
Farmakogeneettisten muunnosten vaikutus psykiatriseen lääkehoitoon
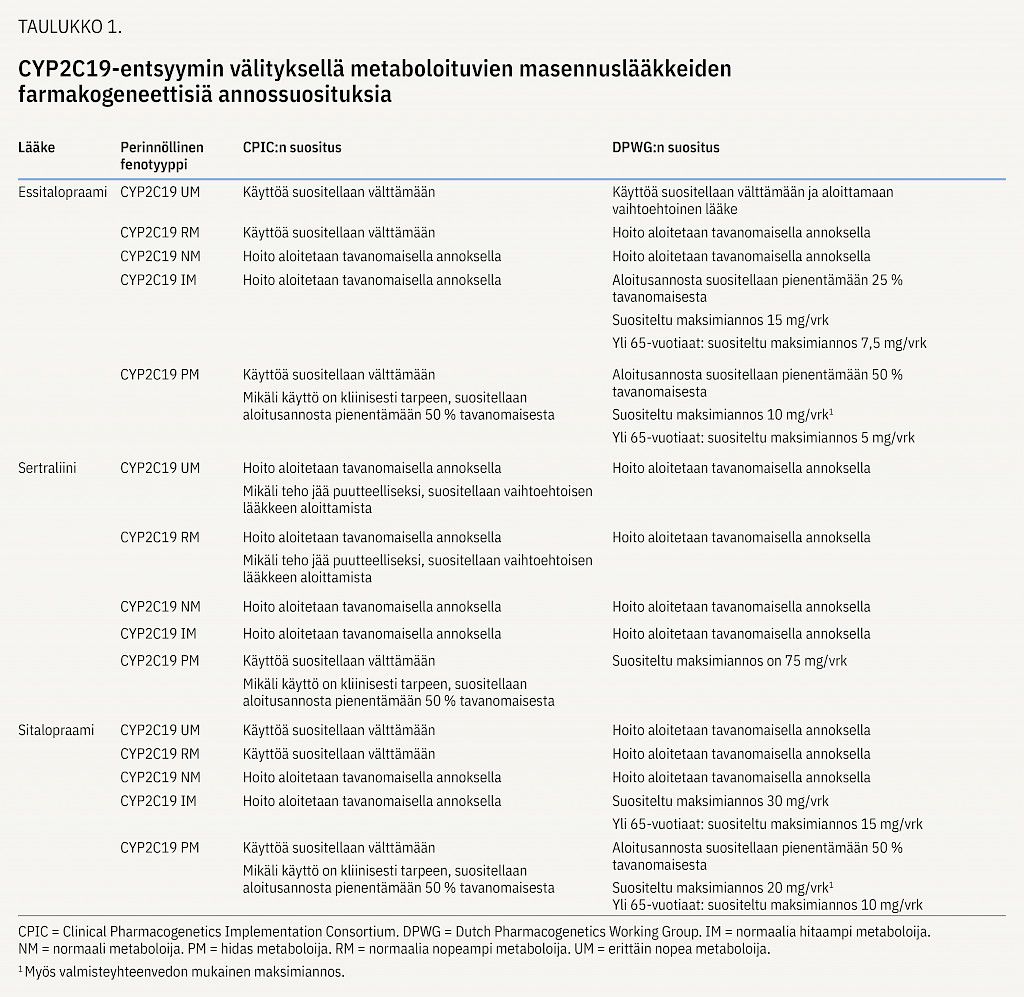
Psyykenlääkkeiden oikean annoksen löytäminen on tärkeää hyvän hoitotuloksen saavuttamiseksi. Liian pienellä annoksella vaikutus jää puutteelliseksi, kun taas suurella annoksella haittavaikutusten riski kasvaa (22). Psyykenlääkkeiden pitoisuudet elimistössä voivat vaihdella merkittävästi perinnöllisen metabolianopeuden mukaisesti. Esimerkiksi perinnöllisesti hitailla CYP2C19-metaboloijilla essitalopraamin altistus on keskimäärin kaksin–kolminkertainen verrattuna normaaleihin CYP2C19-metaboloijiin (23,24). Erittäin nopeilla CYP2C19-metaboloijilla altistus on puolestaan keskimäärin 36 % pienempi kuin normaaleilla CYP2C19-metaboloijilla.
CYP2C19-genotyyppi vaikuttaa myös essitalopraamihoidon epäonnistumiseen ja lääkevaihdon todennäköisyyteen. Vaihto essitalopraamista toiseen masennuslääkkeeseen vuoden sisällä hoidon aloituksesta oli kolme kertaa tavallisempaa hitailla ja erittäin nopeilla CYP2C19-metaboloijilla kuin normaaleilla CYP2C19-metaboloijilla (liitekuvio 1) (25). Suomalaisessa tutkimuksessa todettiin, että sitalopraamia tai essitalopraamia käyttäneiden itsemurhan tehneiden joukossa oli merkittävästi enemmän perinnöllisesti hitaita ja erittäin nopeita CYP2C19-metaboloijia kuin terveiden verrokkien joukossa (26).
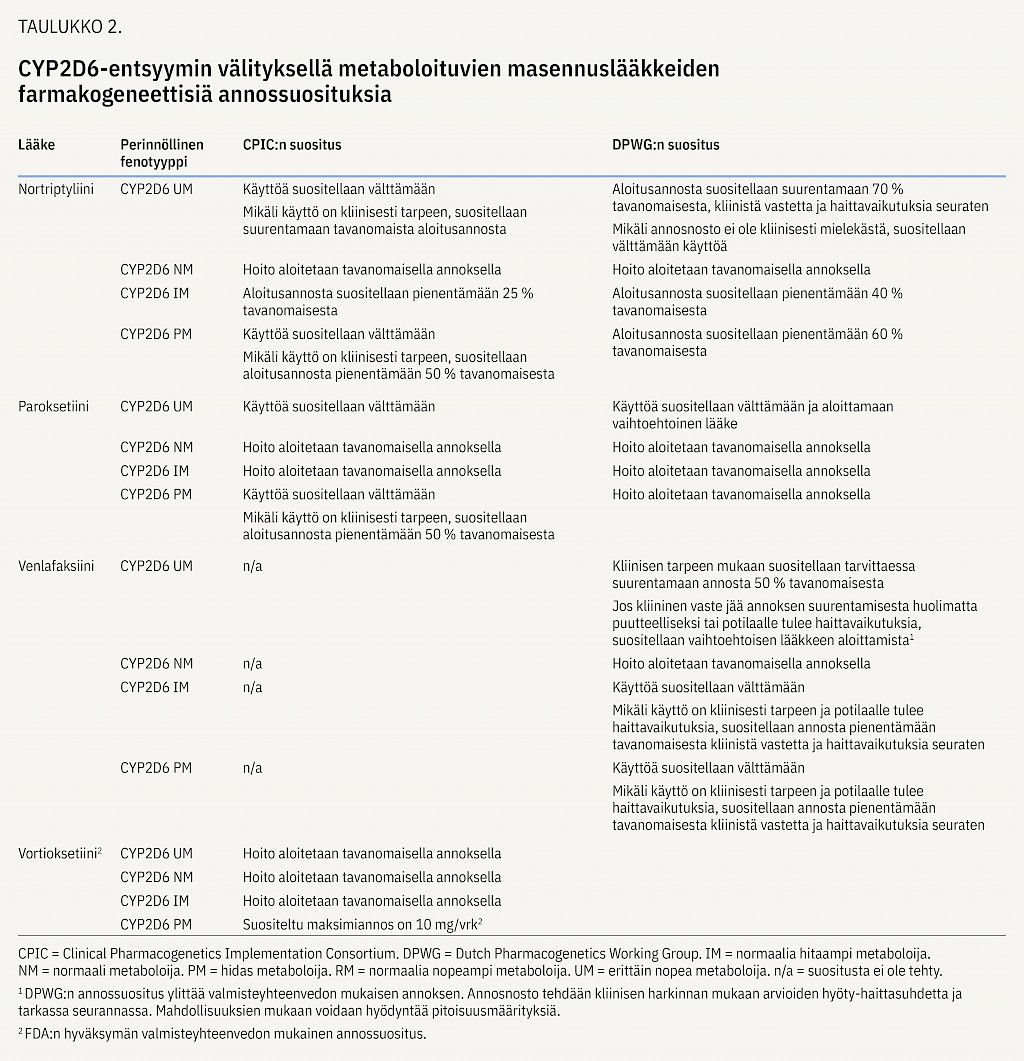
Risperidonia ja aripipratsolia koskevassa rekisteritutkimuksessa todettiin, että niiden pitoisuudet ovat keskimäärin 1,5-kertaisia hitailla ja normaalia hitaammilla CYP2D6-metaboloijilla verrattuna normaaleihin CYP2D6-metaboloijiin (27). Erittäin nopeilla CYP2D6-metaboloijilla puolestaan käytettiin keskimääräistä suurempia lääkeannoksia. Lisäksi risperidoni jouduttiin useammin vaihtamaan toiseen lääkkeeseen hoidon epäonnistumisen tai haittavaikutusten takia hitailla ja erittäin nopeilla CYP2D6-metaboloijilla (liitekuvio 1). CYP-entsyymien perinnöllisellä vaihtelulla on merkitystä myös monen muun psyykenlääkkeen tehon ja haittavaikutusriskin kannalta (11,28).
Kliinisiä annossuosituksia
Kansainvälisten CPIC- ja DPWG-työryhmien laatimat farmakogeneettiset annossuositukset psyykenlääkkeille ovat pääosin yhteneväisiä, mutta niissä on myös pieniä eroavaisuuksia. Sovellettaessa annossuosituksia potilastyössä kannattaa käyttää kliinistä harkintaa (28).
Annossuositukset perustuvat genotyyppitiedon perusteella tehtyyn entsyymiaktiivisuuden ennakointiin (fenotyyppi). Kliinisessä työssä on tärkeää muistaa lisäksi, että monet lääkkeet estävät tai nopeuttavat CYP-entsyymien aktiivisuutta ja sen seurauksena fenotyyppi voi muuttua. Esimerkiksi vahvat CYP2D6-entsyymin estäjät (bupropioni, fluoksetiini ja paroksetiini) muuttavat perinnöllisesti erittäin nopeat, normaalit ja normaalia hitaammat CYP2D6-metaboloijat hitaiksi CYP2D6-metaboloijiksi lääkehoidon ajaksi.
Masennuslääkkeiden annossuosituksia
CPIC- ja DPWG-työryhmät ovat laatineet annossuosituksia CYP2C19-entsyymin kautta metaboloituville essitalopraamille, sitalopraamille ja sertraliinille ja CYP2D6-entsyymin kautta metaboloituville paroksetiinille ja nortriptyliinille (29). CYP2D6-entsyymi osallistuu myös venlafaksiinin ja vortioksetiinin metaboliaan; DPWG-työryhmä on laatinut suosituksen venlafaksiinille, ja vortioksetiinille genotyypin mukainen annossuositus löytyy FDA:n valmisteyhteenvedosta (taulukot 1 ja 2).
Suomessa markkinoilla olevien trisyklisten masennuslääkkeiden metaboliaan osallistuvat, nortriptyliiniä lukuun ottamatta, sekä CYP2D6- että CYP2C19-entsyymi, ja annossuositus perustuu molempien entsyymien perinnölliseen aktiivisuuteen (liitetaulukko 1) (30). Trisyklisiä masennuslääkeitä käytetään esimerkiksi neuropaattisen kivun hoidossa pienemmillä annoksilla kuin mielialahäiriöiden hoidossa, minkä vuoksi neuropaattisen kivun hoidossa ei yleensä ole tarvetta muuttaa suunniteltua annosta CYP2C19- ja CYP2D6-genotyyppien perusteella. Hitaita metaboloijia tulisi kuitenkin seurata mahdollisen lisääntyneen haittavaikutusriskin vuoksi ja erittäin nopeita metaboloijia mahdollisen tehon puutteen vuoksi.
Psykoosilääkkeiden annossuosituksia
CYP2D6-entsyymi on keskeinen monen psykoosilääkkeen metaboliassa. DPWG on antanut annossuosituksia psykoosilääkkeistä aripipratsolille, brekspipratsolille, haloperidolille, risperidonille ja tsuklopentiksolille (liitetaulukko 2).
CYP2D6 osallistuu myös yleisesti käytetyn perfenatsiinin metaboliaan, mutta sille ei ole laadittu farmakogeneettisiä annossuosituksia. Hitailla CYP2D6-metaboloijilla perfenatsiinin pitoisuus on moninkertainen normaaleihin CYP2D6-metaboloijiin verrattuna ja haittavaikutusten riski on lisääntynyt (31). Hitaat CYP2D6-metaboloijat saattavat tarvita huomattavasti pienempiä perfenatsiiniannoksia, ja potilaiden vointia ja mahdollisia haittavaikutuksia kannattaa seurata tarkasti hoidon aikana.
Myös sertindoli metaboloituu CYP2D6-entsyymin välityksellä. Hitailla CYP2D6-metaboloijilla pitoisuus on 2–3-kertainen normaaleihin CYP2D6-metaboloijiin verrattuna. Sertindolipitoisuus ei kuitenkaan ennusta tehoa yksittäisen potilaan hoidossa; yksilölliseen annosteluun päästään parhaiten arvioimalla hoitovastetta ja lääkkeen siedettävyyttä (32).
Klotsapiini metaboloituu pääasiassa maksassa CYP1A2-entsyymin välityksellä. CYP1A2-entsyymissä on kuvattu perinnöllistä vaihtelua, mutta sillä ei ole todettu olevan kliinisesti merkittävää vaikutusta klotsapiinin farmakokinetiikkaan. Sen sijaan klotsapiinin pitoisuuteen voivat vaikuttaa monet muut tekijät, esimerkiksi lääkeyhteisvaikutukset, tupakointi ja kahvin juonti. Sopivan klotsapiiniannoksen löytämiseksi kannattaa hyödyntää pitoisuusmäärityksiä.
ADHD-lääkkeiden annossuosituksia
Aktiivisuuden ja tarkkaavuuden häiriön (ADHD) hoitoon käytetyistä lääkkeistä vain atomoksetiinille on annettu perinnölliseen entsyymiaktiivisuuteen perustuvia annossuosituksia. Atomoksetiini metaboloituu pääasiassa CYP2D6-entsyymin välityksellä.
Erittäin nopeilla CYP2D6-metaboloijilla atomoksetiinin plasmapitoisuus voi olla tavanomaista pienempi, mikä voi johtaa puutteelliseen tehoon. Erittäin nopeille CYP2D6-metaboloijille suositellaan aloittamaan atomoksetiini tavanomaisella annoksella 40 mg/vrk. Annoksen suurentamista voidaan harkita seitsemän päivän kuluttua Euroopan lääkeviraston (Ema) hyväksymän valmisteyhteenvedon mukaan (33) tai CPIC:n mukaan jo kolmen päivän kuluttua (34).
Hitailla CYP2D6-metaboloijilla atomoksetiinin plasmapitoisuus voi olla tavanomaista suurempi, mikä voi lisätä haittavaikutusriskiä. Hitaille CYP2D6-metaboloijille suositellaan harkitsemaan aloitusannoksen pienentämistä ja hitaampaa annoksen suurentamista ylläpitoannokseen (2 viikon välein).
Kenelle farmakogeneettinen testi kannattaa tehdä?
Noin 10 %:lla suomalaisista on sellainen CYP2D6-entsyymin perinnöllinen aktiivisuus (CYP2D6 UM, PM), joka suositusten mukaan toimittaessa edellyttäisi jonkin psykoosilääkkeen annoksen muutosta. Nykytiedon valossa ei voi suositella kaikkien potilaiden perinnöllisen CYP2D6-entsyymiaktiivisuuden tutkimista ennen psykoosilääkkeiden aloitusta, koska näyttöä testauksen kustannusvaikuttavuudesta ei ole riittävästi. Mikäli potilas saa lääkehoidosta herkästi haittavaikutuksia tai lääkehoidon teho jää puutteelliseksi, farmakogeneettisen tutkimuksen käyttöä kannattaa harkita (35,36).
Masennuslääkkeiden kohdalla keskeisiä ovat sekä CYP2C19- että CYP2D6-entsyymit. Noin 36 %:lla suomalaisista on sellainen CYP2C19-entsyymin perinnöllinen aktiivisuus (CYP2C19 UM, RM ja PM), jonka huomioimisesta olisi hyötyä masennuslääkityksen valinnassa. Farmakogeneettisen testauksen mukaanotto voi parantaa erityisesti masennuspotilaiden hoidon tuloksia nopeuttamalla sopivan lääkityksen ja annostuksen löytämistä (37,38,39,40,41,42). Tuoreen systemaattisen katsauksen mukaan farmakogeneettisen paneelitutkimuksen tekeminen liittyen masennuslääkityksen valintaan on kustannusvaikuttavaa tai jopa kustannuksia säästävää (43).
Farmakogeneettisissä laboratoriotutkimuksissa on yleensä mukana muidenkin lääkkeiden kannalta merkittäviä geenejä. Tämä voi parantaa tutkimuksen kustannusvaikuttavuutta, koska kertaalleen tehdyn tutkimuksen tulokset ovat käytettävissä myös jatkossa. Mikäli psyykenlääkitystä käyttävälle potilaalle tehdään farmakogeneettinen testi jostain muusta syystä ja todetaan normaalista poikkeava perinnöllinen CYP2C19- tai CYP2D6-entsyymiaktiivisuus, ei psyykenlääkitykseen yleensä tarvitse tehdä muutoksia, jos hoito on ollut tehokas ja hyvin siedetty. Hitailla metaboloijilla kannattaa kuitenkin harkita annoksen pienentämistä tarvittaessa annossuosituksen mukaiseksi tai seurata mahdollisia haittavaikutuksia ja tarvittaessa hyödyntää pitoisuusmäärityksiä.
Lääkkeen määrääjä voi tarvittaessa konsultoida kliinisen farmakologian yksikköjä farmakogeneettisen testin tulosten tulkinnasta.
Mikko Niemi: Luentopalkkiot (Lundbeck).
Muut kirjoittajat: Ei sidonnaisuuksia.
- 1
- Kalliokoski A, Voipio T, Ruokoniemi P. Psyykenlääkkeidenkäyttö on muuttunut 2000-luvulla. SIC! 2/2016.
- 2
- Suomen lääketilasto 2020.
- 3
- Shiroma PR, Geda YE, Mrazek DA. Pharmacogenomic implications of variants of monoaminergic-related genes in geriatric psychiatry. Pharmacogenomics. 2010;11:1305–30.
- 4
- Mauvais-Jarvis F, Berthold HK, Campesi I ym. Sex- and gender-based pharmacological response to drugs. Pharmacol Rev 2021;73:730–62.
- 5
- Sugarman EA, Cullors A, Centeno J, Taylor D. Contribution of pharmacogenetic testing to modeled medication change recommendations in a long-term care population with polypharmacy. Drugs Aging 2016;33:929–36.
- 6
- Kisor DF, Bodzin AS. Pharmacogenomics in liver transplantation: testing the recipient and the ex-vivo donor liver. Pharmacogenomics 2018;19:753–6.
- 7
- Stanke-Labesque F, Gautier-Veyret E, Chhun S ym. Inflammation is a major regulator of drug metabolizing enzymes and transporters: consequences for the personalization of drug treatment. Pharmacol Ther 2020;215:107627–48.
- 8
- Shah RR, Smith RL. Inflammation-induced phenoconversion of polymorphic drug metabolizing enzymes: hypothesis with implications for personalized medicine. Drug Metab Dispos 2015;43:400–10.
- 9
- Smit C, De Hoogd S, Brüggemann RJM ym. Obesity and drug pharmacology: a review of the influence of obesity on pharmacokinetic and pharmacodynamic parameters. Expert Opin Drug Metab Toxicol 2018;14:275–85.
- 10
- Tarkiainen K, Lehtisalo M, Niemi M. Geenitestit ja lääkehoito. Suom Lääkäril 2021;76:56–9.
- 11
- Jukic M, Milosavljević F, Molden E, Ingelman-Sundberg M. Pharmacogenomics in treatment of depression and psychosis: an update. Trends Pharmacol Sci 2022;43:1055–69.
- 12
- Bousman C, Maruf AA, Müller DJ. Towards the integration of pharmacogenetics in psychiatry: a minimum, evidence-based genetic testing panel. Curr Opin Psychiatry 2019;32:7–15.
- 13
- Lunenburg CATC, Gasse C. Pharmacogenetics in psychiatric care, a call for uptake of available applications. Psychiatry Res 2020;292:113336.
- 14
- Bousman CA, Eyre HA. "Black box" pharmacogenetic decision-support tools in psychiatry. Braz J Psychiatry 2020;42:113–5.
- 15
- Clinical Pharmacogenetics Implementation Consortium. cpicpgx.org
- 16
- Pharmacogenetics. www.knmp.nl/dossiers/farmacogenetica
- 17
- PharmGKB 2019. www.pharmgkb.org
- 18
- Müller DJ, Rizhanovsky Z. From the origins of pharmacogenetics to first applications in psychiatry. Pharmacopsychiatry 2020;53:155.
- 19
- Eichelbaum M, Spannbrucker N, Steincke B, Dengler HJ. Defective N-oxidation of sparteine in man: a new pharmacogenetic defect. Eur J Clin Pharmacol 1979;16:183–7.
- 20
- Caudle KE, Sangkuhl K, Whirl-Carrillo M ym. Standardizing CYP2D6 genotype to phenotype translation: Consensus recommendations from the Clinical Pharmacogenetics Implementation Consortium and Dutch Pharmacogenetics Working Group. Clin Transl Sci 2020;13:116–24.
- 21
- Pietarinen P, Tornio A, Niemi M. High frequency of CYP2D6 ultrarapid metabolizer genotype in the Finnish population. Basic Clin Pharmacol Toxicol 2016;119:291–6.
- 22
- Fabbri C, Tansey KE, Perlis RH ym. Effect of cytochrome CYP2C19 metabolizing activity on antidepressant response and side effects: Meta-analysis of data from genome-wide association studies. Eur Neuropsychopharmacol 2018;28:945–54.
- 23
- Chang M, Tybring G, Dahl ML, Lindh JD. Impact of cytochrome P450 2C19 polymorphisms on citalopram/escitalopram exposure: a systematic review and meta-analysis. Clin Pharmacokinet 2014;53:801–11.
- 24
- Jukić MM, Haslemo T, Molden E, Ingelman-Sundberg M. Impact of CYP2C19 genotype on escitalopram exposure and therapeutic failure: A retrospective study based on 2,087 patients. Am J Psychiatry 2018;175:463–70.
- 25
- Rahikainen AL, Vauhkonen P, Pett H ym. Completed suicides of citalopram users – the role of CYP genotypes and adverse drug interactions. Int J Legal Med 2019;133:353–63.
- 26
- Jukic MM, Smith RL, Haslemo T, Molden E, Ingelman-Sundberg M. Effect of CYP2D6 genotype on exposure and efficacy of risperidone and aripiprazole: a retrospective, cohort study. Lancet Psychiatry 2019;6:418–26.
- 27
- Lisoway AJ, Chen CC, Zai CC, Tiwari AK, Kennedy JL. Toward personalized medicine in schizophrenia: Genetics and epigenetics of antipsychotic treatment. Schizophr Res 2021;232:112–24.
- 28
- Murphy LE, Fonseka TM, Bousman CA ym. Gene-drug pairings for antidepressants and antipsychotics: level of evidence and clinical application. Mol Psychiatry 2022;27:593–605.
- 29
- Hicks JK, Bishop JR, Sangkuhl K ym.; Clinical Pharmacogenetics Implementation Consortium. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for CYP2D6 and CYP2C19 genotypes and dosing of selective serotonin reuptake inhibitors. Clin Pharmacol Ther 2015;98:127–34.
- 30
- Hicks JK, Sangkuhl K, Swen JJ ym. Clinical Pharmacogenetics Implementation Consortium guideline (CPIC) for CYP2D6 and CYP2C19 genotypes and dosing of tricyclic antidepressants: 2016 update. Clin Pharmacol Ther 2017;102:37–44.
- 31
- Waade RB, Solhaug V, Høiseth G. Impact of CYP2D6 on serum concentrations of flupentixol, haloperidol, perphenazine and zuclopenthixol. Br J Clin Pharmacol 2021;87:2228–35.
- 32
- Sertindolin valmisteyhteenveto.
- 33
- Stratteran valmisteyhteenveto.
- 34
- Brown JT, Bishop JR, Sangkuhl K ym. Clinical Pharmacogenetics Implementation Consortium guideline for cytochrome P450 (CYP)2D6 genotype and atomoxetine therapy. Clin Pharmacol Ther 2019;106:94–102.
- 35
- Jürgens G, Andersen SE, Rasmussen HB ym. Effect of routine cytochrome P450 2D6 and 2C19 genotyping on antipsychotic drug persistence in patients with schizophrenia: A randomized clinical trial. JAMA Netw Open 2020;3:e2027909.
- 36
- Bousman CA, Bengesser SA, Aitchison KJ ym. Review and consensus on pharmacogenomic testing in psychiatry. Pharmacopsychiatry 2021;54:5–17.
- 37
- Rosenblat JD, Lee Y, McIntyre RS. Does pharmacogenomic testing improve clinical outcomes for major depressive disorder? A systematic review of clinical trials and cost-effectiveness studies. J Clin Psychiatry 2017;78:720–9.
- 38
- Rosenblat JD, Lee Y, McIntyre RS. The effect of pharmacogenomic testing on response and remission rates in the acute treatment of major depressive disorder: a meta-analysis. J Affect Disord 2018;241:484–91.
- 39
- Greden JF, Parikh SV, Rothschild AJ ym. Impact of pharmacogenomics on clinical outcomes in major depressive disorder in the GUIDED trial: a large, patient- and rater-blinded, randomized, controlled study. J Psychiatr Res 2019;111:59–67.
- 40
- Pérez V, Salavert A, Espadaler J ym. Efficacy of prospective pharmacogenetic testing in the treatment of major depressive disorder: results of a randomized, double-blind clinical trial. BMC Psychiatry 2017;17:250.
- 41
- Bousman CA, Arandjelovic K, Mancuso SG, Eyre HA, Dunlop BW. Pharmacogenetic tests and depressive symptom remission: a meta-analysis of randomized controlled trials. Pharmacogenomics. 2019;20:37–47.
- 42
- Carta A, Del Zompo M, Meloni A ym. Cost-utility analysis of pharmacogenetic testing based on CYP2C19 or CYP2D6 in major depressive disorder: Assessing the drivers of different cost-effectiveness levels from an Italian societal perspective. Clin Drug Investig 2022;42:733–46.
- 43
- Morris SA, Alsaidi AT, Verbyla A ym. Cost effectiveness of pharmacogenetic testing for drugs with Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines: a systematic review. Clin Pharmacol Ther 2022;112:1318–28.
Pharmacogenetic testing and psychiatric medications in clinical practice
Several antidepressants and antipsychotics are metabolized by the enzymes CYP2C19 and CYP2D6. These enzymes show common genetic variability in their activity, which may affect the concentrations, efficacy and adverse reaction risk of psychiatric medications. This review provides evidence-based guidelines on the interpretation of pharmacogenetic test results for antidepressants and antipsychotics. Pharmacogenetic testing may be cost-effective, especially in the selection of an antidepressant medication.
Diana Karpova, Katriina Tarkiainen, Minna Lehtisalo, Taavi Kaartinen, Outi Lapatto-Reiniluoto, Jari Lilja, Janne Backman, Mikko Niemi
Diana Karpova
Licensed physician undergoing specialist training
HUS Diagnostic Center, Genetics and Clinical Pharmacology