Kuulonalenema: sisäkorvaan rajoittuva ongelma vai laajempi neurodegeneratiivinen kokonaisuus?
• Sensorineuraalinen kuulonalenema on yli 70-vuotiaiden yleisimpiä pitkäaikaissairauksia.
• Epidemiologiset tutkimukset ovat osoittaneet merkittävän yhteyden kuulonaleneman ja muistisairauksien riskin välillä.
• Kuulonalenema ei pitäisi tarkastella vain sisäkorvaan rajoittuvana ongelmana vaan osana laajempaa neurodegeneratiivista kokonaisuutta.
• Kuulon kuntoutuksen merkitystä muistisairauksien ehkäisyssä tulisi selvittää kliinisissä tutkimuksissa.
• Laadukas ja näyttöön perustuva kuulonkuntoutus lisää hoidon vaikuttavuutta ja voi näin edistää ikääntyneen ihmisen aktiivisuutta ja toimintakykyisyyttä.

Maailmanlaajuisesti yli 480 miljoonaa ihmistä (noin 6 % maailman väestöstä) kärsii kuntoutusta vaativasta kuulonalenemasta. Määrän arvioidaan kasvavan vuoteen 2050 mennessä yli 900 miljoonaan (1).
Sensorineuraalinen kuulonalenema on yli 70-vuotiaiden yleisimpiä pitkäaikaissairauksia (2). Hoitamattomana tämän tiedetään kasvattavan kognitiivisten, psyykkisten ja sosiaalisten ongelmien riskiä ja hankaloittavan merkittävästi omatoimista arjessa selviytymistä.
Suomen väestö kuuluu maailman vanhimpiin, minkä vuoksi ikäkuulo yleistyy ja muodostaa tulevina vuosina suuren kansanterveydellisen ja -taloudellisen haasteen (3).
Tuoreen, muistisairauksien ehkäisyä käsittelevän Lancet-komission raportin mukaan kuulonalenema on mahdollisesti yksi ehkäistävissä olevista muistisairauksien riskitekijöistä (4). Asia on kuitenkin jäänyt huomioimatta muun muassa Käypä hoito -suosituksissa. Muistisairauksille ei ole parantavaa hoitoa, joten tärkeintä on kaikkien ehkäisykeinojen tuominen käytäntöön.
Tämän katsauksen tavoitteena on laajentaa käsitystä kuulonalenemasta vain sisäkorvaan rajoittuvana ongelmana ja tarkastella tätä osana neurodegeneratiivista kokonaisuutta.
Kuulonalenema muistisairauksien riskitekijänä
Epidemiologiset tutkimukset ovat yhdenmukaisesti osoittaneet kuulonaleneman yhteyden muistisairauksien riskiin (5,6,7,8,9,10,11) (taulukko 1).
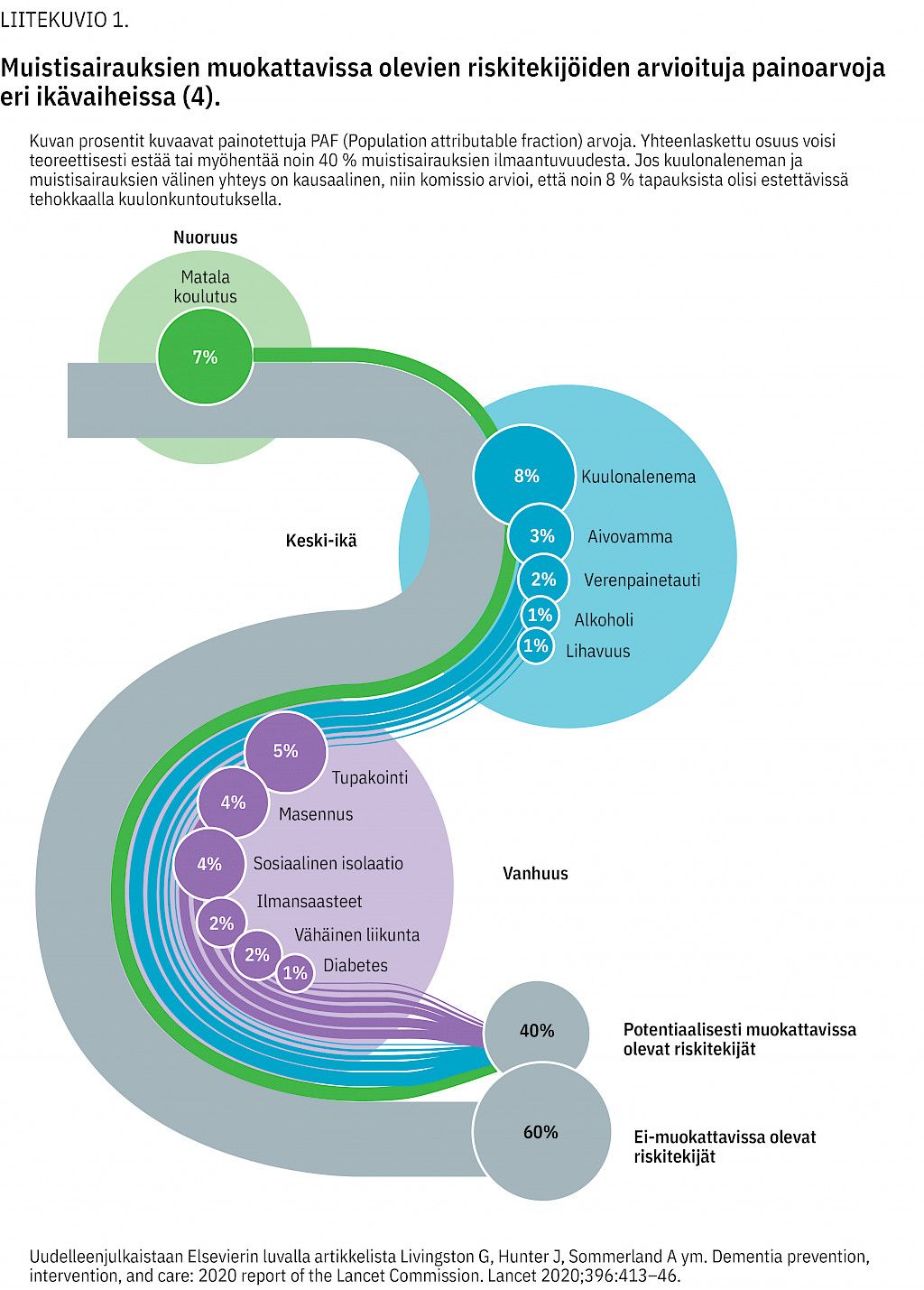
Lancet-komissio tunnisti 12 mahdollisesti muunnettavissa olevaa dementian riskitekijää. Näistä kuulonalenemaa pidettiin yhtenä merkittävimpänä erityisesti keski-ikäisillä (liitekuvio 1). Kuvion prosentit kuvaavat painotettuja PAF (population attributable fraction) -arvoja, joiden yhteenlaskettu osuus voisi teoreettisesti estää tai myöhentää noin 40 % muistisairauksien ilmaantuvuudesta.
Vaikka kuulonaleneman ja kognition välisen yhteyden kausaliteettia ei ole vielä pystytty todistamaan, komissio suosittaa kuulolaitteiden käyttöä kognitiivisen heikkenemisen hidastamiseen ja ehkäisemiseen.
Perifeerinen kuulo
Sensorineuraalisen kuulonaleneman taustalla on tyypillisesti yhdistelmä sisäkorvan karvasolujen ja niiden synapsien tuhoutumista. Tämä voi lopulta johtaa kuulohermon ganglioiden surkastumiseen. Karvasolujen vaurio heikentää sisäkorvan herkkyyttä hiljaisille äänille, joita voidaan mitata perinteisellä äänesaudiometrialla ja jonka tuloksena saadaan ns. kuulokäyrä.
Äänesaudiometria on spesifinen sisäkorvan toiminnan eli perifeerisen kuulon mittari. Se korreloi huonosti vaivan merkittävään haittaan, puheen tunnistuksen vaikeuteen arkipäivän tilanteissa (hälyssä) (12). Sensorineuraaliseen kuulonalenemaan liittyy lisäksi aina myös äänten vääristymistä (suprathreshold distortion). Vaikka äänten akustinen vahvistus kuulokojeilla parantaa hiljaisten äänten havaitsemista, se voi myös lisätä äänten vääristymistä ja siten heikentää puheentunnistusta hälyssä entisestään.
Äänesaudiometriassa jäävät vääristymän aiheuttamat vaikutukset kuuloon kokonaan huomioimatta (12,13). Tarkempi arvio funktionaalisesta kuulosta edellyttää puheentunnistuksen mittaamista ns. hälypuhetestillä, jonka tulokseen vaikuttavat sekä sentraalinen äänten prosessointi että kognitio (12).
Sentraalinen äänten prosessointi
Äänien ja puheen tunnistaminen arjen kuuntelutilanteissa on vaativa ja aktiivinen kognitiivinen prosessi (13). Kuuloterveen kuulojärjestelmä pystyy vaivatta erottamaan ja tunnistamaan puheen, jonka äänenpainotaso on huomattavasti pienempi kuin taustamelun taso.
Terve kuulojärjestelmä pystyy poimimaan äänispektristä heikotkin signaalit (puhe) ja vaimentamaan siitä ei-merkitykselliset osiot (häly). Äänten spektristen ja ajallisten vihjeiden perusteella (ns. auditory scene analysis) muodostuvat kuulo-objektit, joita verrataan opittujen representaatioiden kanssa (14).
Puheentunnistus arkitilanteissa (hälyssä) vaatii siis aktiivista sentraalista prosessointia, joka on riippuvainen työmuistista, tiedonkäsittelyn nopeudesta, kielitaidosta ja muusta sensorisesta informaatiosta, kuten näöstä (13,15). Kuuloaistimuksen automaattisen käsittelyn ja muun kognitiivisen prosessoinnin erottaminen toisistaan on haastavaa. Ei vielä tiedetä, ovatko ongelmat kuuloinformaation sentraalisessa käsittelyssä itsenäinen kuulonalenemasta johtuva prosessi vai onko kyseessä varhainen viite kognitiivisten toimintojen heikkenemisestä (13).
Kuulonaleneman ja dementian syy-yhteyttä selittävät teoriat ovat kuvattu seikkaperäisesti aikaisemmissa tutkimuksissa (15,16) ja myös Lääkärilehdessä (17).
Sensorinen deprivaatio
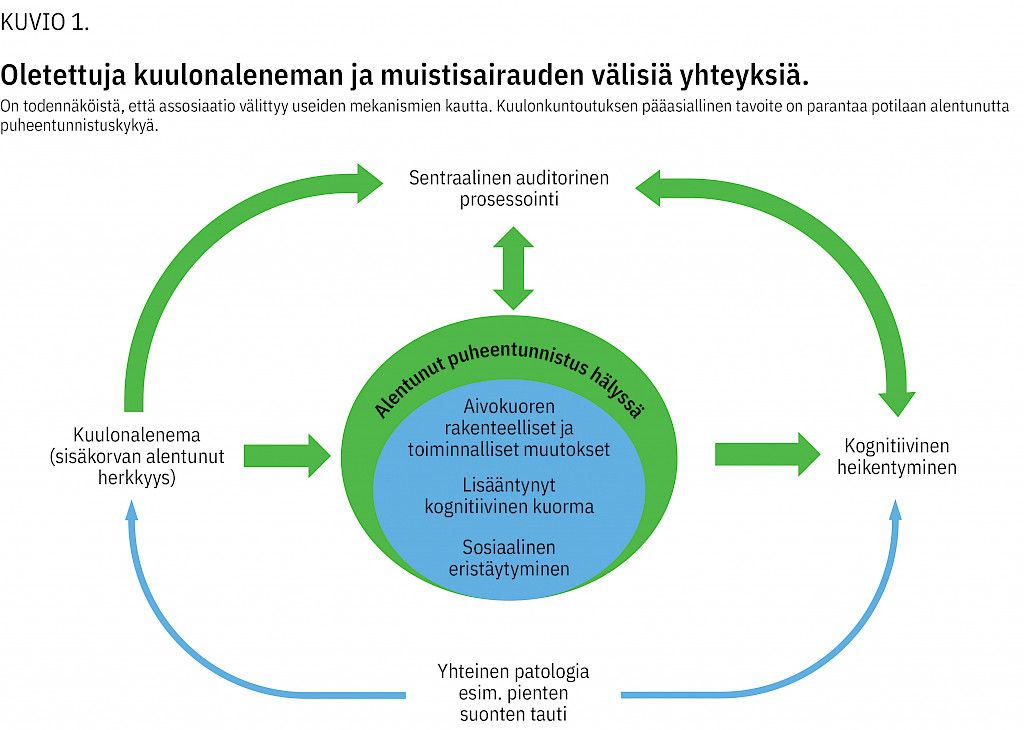
Eniten näyttöä on siitä, että kuulonaleneman aiheuttama pitkittynyt sensorinen deprivaatio johtaa pysyviin rakenteellisiin muutoksiin sekä aivoissa että aivofunktiossa. Puheentunnistuksen vaikeus voi pitkittyessä johtaa aivokuoren toimintojen organisoitumiseen uudelleen sekä muutoksiin aivokuoren tilavuudessa (18) erityisesti ohimolohkon alueella (19,20) sekä vähentyneeseen harmaan aineen tiheyteen ohimolohkossa, otsalohkossa ja hippokampuksessa (19). Huomioitavaa on, että aivojen kortikaalinen uudelleenorganisoituminen käynnistyy todennäköisesti jo kuulonaleneman varhaisessa vaiheessa (21).
Kognitiivinen kuormitus
Hyvissä kuunteluolosuhteissa normaalikuuloisen äänenaistimuksen käsittely on aivojen tasolla lähes automaattista ja vain vähän kognitiivisia resursseja kuluttavaa (22). Kuuloviassa automaattiset puheentunnistusmekanismit eivät enää toimi, ja niiden tueksi joudutaan käyttämään muita kognitiivisia resursseja (18). Lisääntynyt kuulemisen kuormittavuus vie siten resursseja muilta ylemmän tason kognitiivisilta toiminnoilta (työmuisti, prosessointi, tarkkaavaisuus) lisäten näin kognitiivista kuormaa (18,23). Aivot pyrkivät kompensoimaan kuulonalenemasta johtuvaa alentunutta puheentunnistusta lisäämällä kognitiivista prosessointia.
Funktionaaliset kuvantamistutkimukset ovat osoittaneet, että kuulonalenemassa kuuloaivokuoren ulkopuolisia alueita rekrytoidaan laaja-alaisesti puheentunnistuksen tueksi tilanteissa, joissa normaalikuuloisilla aktivaatio rajoittuu ohimolohkon kuuloalueelle (24). Tehokkaalla kuulonkuntoutuksella, eli parantamalla huonokuuloisen puheentunnistusta, voidaan vähentää kuulemiseen liittyvää kognitiivista kuormitusta, jolloin myös kuuloaivokuoren ulkopuolisten aivoalueiden rekrytointi vähenee (23,24).
Yhteinen patologia
On myös mahdollista, että kuulonaleneman ja kognition välinen yhteys johtuu osin yhteisistä ikääntymiseen ja tautien riskeihin liittyvistä tekijöistä (15,16,17). Yhteiset riskitekijät voisivat selittää osan kuulonaleneman ja vaskulaarisen dementian yhteyttä (15). Tosin epidemiologissa tutkimuksissa todettu suurentunut muistisairauksien riski säilyy vaskulaaristen riskitekijöiden vakioinnin jälkeenkin (4,6).
Muut myötävaikuttavat tekijät
Kuulonalenemaan tiedetään liittyvän suurentunut riski sosiaaliseen eristäytymiseen (25). Tämä on tunnettu itsenäinen muistisairauden riskitekijä (26). On kuitenkin todennäköistä, että kuulonaleneman ja muistisairauksien välinen yhteys välittyy usean eri mekanismin kautta, osuuksien vaihdellessa yksilöllisesti (kuvio 1) (15,16).
Vähentääkö kuulonkuntoutus muistisairauksien riskiä?
Kuulonkuntoutuksen yhteys muistisairauksien riskin pienentämiseen riippuu kognition aleneman ja kuulovian yhteyden mekanismeista. Jos yhteys johtuu ikääntymisestä ja yhteisistä riskitekijöistä, kuntoutuksen suora vaikutus muistisairauksien riskiin on rajallinen. Sen sijaan kuulonkuntoutus voisi vähentää sensorista deprivaatiota ja sen aiheuttamaa liiallista kognitiivisesta kuormitusta – ja myös muistisairauksien riskiä (15,16). Siten kuulonaleneman varhainen toteaminen ja kuntoutuksen aloittaminen voisi olla erittäin tärkeää aivojen rakenteen ja toiminnan muutosten hidastamiseksi tai estämiseksi (13,15,16).
Tutkimusten mukaan kuntoutus sekä kuulokojeella että sisäkorvaistutteella ylläpitää kognitiota, mutta toistaiseksi korkealaatuinen tutkimusnäyttö puuttuu (27,28,29,30). Kuulonkuntoutusta voidaan pitää joka tapauksessa hyödyllisenä, sillä se voi vähentää sosiaalista eristäytymistä ja parantavaa toimintakykyä (31).
Kohti vaikuttavampaa kuulonkuntoutusta
Kuulonkuntoutuksessa pyritään kompensoimaan alentunut sisäkorvan herkkyys akustisella vahvistuksella. Lievissä tapauksissa kuulokojeiden akustinen vahvistus parantaa sekä potilaan kuulon herkkyyttä että puheentunnistuskykyä. Vaikeammissa kuulovioissa akustisella vahvistuksella ei välttämättä saavuteta enää parempaa puheen tunnistusta hälyisissä tilanteissa, sillä äänen vahvistus ei poista vaivaan liittyvää äänten vääristymää (32,33). Tämän vuoksi monet kuulokojekäyttäjät eivät koe hyötyvänsä kuulokojeistaan, joten kuulokojeet jäävät epäsäännölliselle käytölle tai usein jopa täysin käyttämättä (32,34).
Jos akustisella vahvistuksella ei saada puheentunnistusta hälyssä riittävälle toiminnalliselle tasolle, hyötyvät useimmat potilaat sisäkorvaistutehoidosta (35). Sisäkorvaistutehoito on edelleen huonosti tunnettu hoitomuoto ja Pohjoismaissa arviolta vain noin 10–15 % sitä tarvitsevista on hoidon piirissä (36).
Nykyaikaisilla kuulonkuntoutusratkaisuilla on mahdollista auttaa suurinta osaa potilaista iästä ja kuulonaleneman asteesta riippumatta. Tarvitaan kuitenkin lisää kliinistä tutkimusta selvittämään kuulokojekuntoutuksen vaikutuksia eri potilasryhmissä ja kuulonaleneman eri vaikeusasteissa. Koska kuulonalenemalla on hyvin moninainen lääketieteellinen ja sosiaalinen ulottuvuus, tarvitaan myös uusia kattavia mittareita, jotka mahdollistavat hoitotulosten luotettavan ja tarkan mittaamisen sekä yksilöllisiä hoitoratkaisuja.
Tuore kansainvälinen ISO-standardi (21388:2020) edellyttää kuntoutustulosten järjestelmällistä mittaamista validoiduilla hälypuhetesteillä ja kuulokyselyillä (37). Kuntoutustulosten mittaamiseen kehitettyjä hälypuhetestejä on myös Suomessa (38,39,40,41). Nämä eivät ole systemaattisessa käytössä rajallisten resurssien takia. Kehittämällä hyviksi havaituista hälypuhetesteistä automatisoituja versioita itsenäisesti tehtäviksi testeiksi voisi kuntoutustulosten seurantaa laajentaa suuremmalle potilasjoukolle.
Vastaavia automatisoituja testejä on jo monissa Euroopan maissa käytössä kuulonseulontamenetelmänä. Suomessa olisikin tärkeää selvittää tehostaisiko helposti saatavilla oleva kuulonseulontatesti kuulonaleneman tunnistamista. Automatisoidut testit voisivat myös vähentää perusterveydenhuollon kuormitusta ja ohjata potilaat nykyistä varhaisemmassa vaiheessa asianmukaisen kuntoutuksen piiriin.
Lopuksi
Tulevaisuudessa tarvitaan korkealaatuisia tutkimuksia selvittämään, onko kuulonalenema itsenäinen riskitekijä muistisairauksille ja voidaanko riittävän varhaisella ja tehokkaalla kuulonkuntoutuksella pienentää riskiä kognition alenemiseen.
Kuulonalenema on merkittävä kansanterveydellinen ongelma, joka vaatii riittävää resursointia kuntoutuksen vaikuttavuuden parantamiseksi järjestelmällisellä laadunseurannalla. Uusien, automatisoitujen kuulotestien laajamittainen käyttöönotto terveydenhuollossa lisäisi kuntoutuksen laatua ja kustannusvaikuttavuutta.
Vain laadukkaalla kuulonkuntoutuksella voidaan lieventää kuulonaleneman lääketieteellisiä, sosiaalisia ja yhteiskunnallisia haittoja ja näin edistää hyvinvointia, toimintakykyä ja elämänlaatua.
Professori Sirpa Hartikainen on kanssakirjoittanut käsikirjoituksen toisen version sekä ehdottanut lisäämään uuteen versioon taulukkoa, jota olemme työstäneet yhdessä. Hän on kriittisesti arvioinut käsikirjoitusta ja tehnyt siihen tarpeellisia korjauksia arvioitsijoiden ehdotukset huomioon ottaen.
Kirjoittajat haluavat kiittää LL Tytti Willbergiä arvokkaista kommenteista käsikirjoituksen ensimmäisen version suunnittelussa sekä FT Pia Linderiä käsikirjoituksen viimeistelyssä.
Aarno Dietz, Matti Iso-Mustajärvi: ei sidonnaisuuksiaSirpa Hartikainen: luentopalkkiot Eisai
- 1
- World Health Organization: World report on hearing, 2021. ISBN 978-92-4-002048-1
- 2
- GBD 2019 Hearing Loss Collaborators. Hearing loss prevalence and years lived with disability, 1990-2019: findings from the Global Burden of Disease Study 2019. Lancet. 2021;397: 996–1009.
- 3
- OECD (2022), Elderly population (indicator). doi: 10.1787/8d805ea1-en
- 4
- Livingston G, Hunter J, Sommerland A, ym. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 2020;396:413–46.
- 5
- Lin FL, Metter J, O´Brien RJ. Hearing loss and incident dementia. Arch Neurol. 2011;68:214–20.
- 6
- Gallacher J, Ilubaera V, Ben-Shlomo Y, ym. Auditory threshold, phonologic demand, and incident dementia. Neurology 2012;79:1583–90.
- 7
- Deal JA, Albert MS, Arnold M, ym. A randomized feasibility pilot trial of hearing treatment for reducing cognitive decline: Results from the Aging and Cognitive Health Evaluation in Elders Pilot Study. Alzheimers Dement 2017;3:410–15.
- 8
- Ford AH, Hankey GJ, Yeap BB, ym. Hearing loss and the risk of dementia in later life. Maturitas 2018;112:1-11. DOI 10.1016/j.maturitas.2018.03.004
- 9
- Liu CM, Lee CT. Association of Hearing Loss With Dementia. JAMA Netw Open. 2019;2:e198112. DOI: 10.1001/jamanetworkopen.2019.8112
- 10
- Stevenson JS, Clifton L, Kuźma E, Littlejohns TJ. Speech-in-noise hearing impairment is associated with an increased risk of incident dementia in 82,039 UK Biobank participants. Alzheimers Dement. 2021;1-12. DOI: 10.1002/alz.12416
- 11
- Loughrey, DG, Kelly ME, Kelley GA, ym. Association of age-related hearing loss with cognitive function, cognitive impairment, and dementia: A Systematic review and meta-analysis. JAMA Otolaryngol. Head Neck Surg 2018;144:115–26.
- 12
- Musiek F, Shinn J, Chermak G, Bamiou D. Perspectives on the pure-tone audiogram. J Am Acad Audiol. 2017;28:655–71.
- 13
- Johnson JCS, Marshall CR, Weil RS, Bamiou DE, Hardy CJD, Warren JD. Hearing and dementia: from ears to brain. Brain. 2021;144:391–401.
- 14
- Bregman A. Auditory scene analysis: The perceptual organization of sound of sound. Cambridge, MA, MIT Press, 1994.
- 15
- Griffths T, Lad M, Kumar S, ym. How can hearing loss cause dementia? Neuron. 2020;108:401–12.
- 16
- Wayne R, Johnsrude I. A review of causal mechanisms underlying the link between age-related hearing loss and cognitive decline. Ageing Res. Rev. 2015;23:154–66.
- 17
- Yli-Pohja P, Pajo K. Kuulovian yhteys kognition heikentymiseen. Suom Lääkäril 2018;73:2707-10.
- 18
- Eckert MA, Teubner-Rhodes S, Vaden KI. Is listening in noise worth it? The Neurobiology of speech recognition in challenging listening conditions. Ear Hear. 2016;37:101–10.
- 19
- Gray D, Umapathy N, Pena N, ym. Auditory processing deficits are selectively associated with medial temporal lobe mnemonic function and white matter integrity in aging macaques. Cerebral Cortex. 2020; 30:2789–803.
- 20
- Armstrong NM, An Y, Doshi,J, ym. Association of Midlife Hearing Impairment With Late-Life Temporal Lobe Volume Loss. JAMA Otolaryngol. Head Neck Surg 2019;145:794–802.
- 21
- Sharma A, Glick H. Cross-modal plasticity in developmental and age-related hearing loss: clinical implication. Hear Res 2017;343:191–201.
- 22
- Rönnberg J, Holmer E, Rudner M. Cognitive hearing science and ease of language understanding. Int J Audiol 2019; 58:247–61.
- 23
- Pichora-Fuller MK, Kramer SE, Eckert MA, ym. Hearing impairment and cognitive energy: the framework for understanding effortful listening (FUEL). Ear Hear 2016; 37:5S–27S.
- 24
- Alain C, Du Y, Bernstein LJ, ym. Listening under difficult conditions: an activation likelihood estimation meta-analysis. Hum. Brain Mapp. 2018;39:2695–709.
- 25
- Shukla A, Harper M, Pedersen E, ym. Hearing loss, loneliness, and social isolation: a systematic review. Otolaryngol Head Neck Surg 2020;162:622–33.
- 26
- Shen C, Rolls ET, Cheng W, ym. Associations of Social Isolation and Loneliness With Later Dementia. Neurology 2022, 99 (2) e164-e175; DOI: 10.1212/WNL.0000000000200583
- 27
- Sarant J, Harris D, Buspy P ym. The Effect of hearing aid use on cognition in older adults: can we delay decline or even improve cognitive function? J Clin Med 2020;9(1):254. DOI: 10.3390/ jcm9010254
- 28
- Mosnier I, Bebear J, Marx M, ym. Improvement of cognitive function after cochlear implantation in elderly patients. JAMA Otolaryngol Head Neck Surg 2015;141:442–50
- 29
- Claes A, Van De Heyning P, Gilles A ym. Cognitive performance of severely hearing-impaired older adults before and after cochlear implantation: preliminary results of a prospective, longitudinal cohort study using the RBANS-H. Otol Neurotol 2018; 39:e765-e773.
- 30
- Sarant J, Harris D, Buspy P ym. The Effect of cochlear implants on cognitive function in older adults: initial baseline and 18-month follow up results for a prospective international longitudinal study. Front Neurosci 2019;13:789. DOI: 10.3389/fnins.2019.00789.
- 31
- Ellis S, Sheik Ali S, Ahmed W. A review of the impact of hearing interventions on social isolation and loneliness in older people with hearing loss. Eur Arch Otorhinolaryngol. 2021 278(12):4653–4661. doi: 10.1007/s00405-021-06847-w. Epub 2021 May 7. PMID: 33963432.
- 32
- Lesica N. Why do hearing aids fail to restore normal auditory perception? Trends Neurosci. 2018;41:174–85
- 33
- Turner C. Hearing loss and the limits of amplification. Audiol Neurootol. 2006;11:2–5
- 34
- Hartley D, Rochtchina E, Newall P, ym. Use of hearing aids and assistive listening devices in an older Australian population. J Am Acad Audiol 2010;21:642-53.
- 35
- Dietz A, Willberg T, Sivonen V, Aarnisalo AA. Sisäkorvaistute – kokeellisesta hoidosta arkipäivän kuntoutukseksi. Suom Lääkäril 2018;73:570–5.
- 36
- Turunen-Taheri SK, Edén M, Hellström S, Carlsson PI. Rehabilitation of adult patients with severe-to-profound hearing impairment—why not cochlear implants? Acta Otolaryngol. 2019;139:604–11.
- 37
- International Organization for Standardization. ISO 21388:2020 Acoustics — Hearing aid fitting management, 2020
- 38
- Dietz A, Buschermöhle M, Aarnisalo A, ym. The development and evaluation of the Finnish Matrix Sentence test for speech intelligibility assessment. Acta Otolaryngol 2014;134:728–37.
- 39
- Dietz A, Buschermöhle M, Sivonen V, ym. Characteristics and international comparability of the Finnish matrix sentence test in cochlear implant recipients. Int J Audiol 2015;54;2:80–7.
- 40
- Willberg T, Buschermöhle M, Sivonen V, ym. The development and evaluation of the Finnish digit triplet test. Acta Otolaryngol 2016;136:1035–40.
- 41
- Willberg T, Kärtevä K, Zokoll M, ym. The Finnish simplified matrix sentence test for the assessment of speech intelligibility in the elderly. Int J Audiol 2020;59:763–71.
Hearing loss: an inner ear problem or a more comprehensive neurodegenerative disorder?
Sensorineural hearing loss (HL) is the most common disability in persons over 70 years of age. When left untreated, HL results in increased anxiety and depression, and impairs social life and autonomy. Finland’s population is rapidly ageing, hence HL is becoming a growing challenge for general health and healthcare. Epidemiological studies show a consistent association between HL and cognitive decline, and the Lancet commission on dementia prevention, intervention and care identified HL as the most significant potentially modifiable risk factor for dementia. Although a causal relationship between HL and dementia has yet to be established, the commission deemed the potential risk high enough for a recommendation of hearing rehabilitation for dementia prevention. Observational studies have suggested that effective treatment of HL can maintain cognitive health, yet no high-quality evidence from randomized studies exists. The exact role of hearing rehabilitation in dementia prevention depends largely on the underlying mechanisms driving this association and warrants further research. Since hearing rehabilitation has been suggested to increase quality of life by reducing social isolation and increasing activity and autonomy, an indirect positive effect on cognition could also be expected. In Finland, the quality of rehabilitation is impaired by the lack of an adequate cost-effective screening programme for age-related HL and a national current care recommendation. Finnish hearing healthcare needs adequate resources for implementing systematic quality monitoring to improve its effectiveness. Only quality rehabilitation can alleviate the medical, social and societal consequences of hearing loss and thus promote health, well-being and quality of life.
Aarno Dietz, Matti Iso-Mustajärvi, Sirpa Hartikainen
Aarno Dietz
Adjunct professor, clinical director, Center of Excellence for Sense Organ Diseases, Department of Otorhinolaryngology, Kuopio University Hospital