Lasten vaikeat A-streptokokki-infektiot
Vaikeat A-ryhmän streptokokki-infektiot lisääntyvät kaikkialla maailmassa.
Vesirokko on lapsilla tärkein yksittäinen altistava tekijä. Myös pienet ihorikkoumat, leikkaus, tylppä vamma tai A-streptokokin aiheuttama tauti perheenjäsenellä lisäävät riskiä.
Infektiofokus voi olla missä kohdassa elimistöä tahansa. Pehmytosan vaikea kipu voi olla diagnostinen vihje invasiivisesta streptokokki-infektiosta.
Nopea hoidon aloitus beetalaktaamin ja klindamysiinin yhdistelmällä ja tarvittaessa kirurginen fokuksen avaus nopeuttavat paranemista ja vähentävät kuolleisuutta.

A-ryhmän streptokokki (Streptococcus pyogenes, StrA) kuuluu maailman kymmenen tappavimman mikrobin joukkoon. Infektioiden ilmaantuvuus, kliininen kuva ja vaikeusaste vaihtelevat merkittävästi eri ajankohtina ja maantieteellisillä alueilla. Syytä vaihteluun ei tunneta.
Vaikeat, invasiiviset A-streptokokki-infektiot (taulukko 1) alkoivat muutamien rauhallisten vuosikymmenten jälkeen yleistyä 1980-luvun lopulla ja lisääntyminen jatkuu edelleen. Tieto bakteerin monista virulenssitekijöistä on lisääntynyt ja auttanut ymmärtämään taudin monimuotoisuutta ja sitä, miksi bakteeri voi siirtyä rauhallisesta nielukantajuudesta nopeasti kudoksia tuhoavaksi lihansyöjäbakteeriksi.
Kuolleisuus näihin infektioihin on teollistuneissa maissa laskusuunnassa kehittyneen tehohoidon ansiosta. Vaikeissa taudeissa infektion eteneminen on niin nopeaa, että kliininen epäily ja varhainen hoidon aloittaminen ovat kliinikoille jatkuva haaste.
Epidemiologia
A-ryhmän streptokokki on todennäköisesti ollut ihmisten vaivana aina. 1800-luvulla ja 1900-luvun alussa se aiheutti laajoja tulirokkoepidemioita, joihin usein liittyi fulminantti sepsis ja paljon kuolleisuutta (1). Esimerkiksi Englannissa alle 5-vuotiaiden kuolleisuus tulirokkoon oli suurimmillaan 1800-luvun puolivälissä (4/1 000/v), mutta taudin vaikeusaste ja kuolleisuus vaihtelivat alueittain paljon (1).
Tulirokon ilmaantuvuus alkoi vähentyä kehittyneissä maissa 1900-luvulla merkittävästi jo ennen antibioottien aikaa, ja väheneminen jatkui aina 1980-luvun alkuun asti (1). Todennäköisesti väheneminen liittyi parantuneeseen hygieniaan, ja mahdollisesti myös bakteerin ominaisuudet muuttuivat.
Ilmaantuvuus lähti uuteen voimakkaaseen nousuun Hongkongissa 2011 (2) ja Britanniassa 2014 (3). Syynä tälle tulirokon uudelle tulemiselle on todennäköisesti ollut bakteerin lisääntynyt kyky tuottaa superantigeeni SpeA:ta (4).
Vaikeita, invasiivisia A-streptokokki-infektioita alkoi taas ilmaantua yhä enemmän 1980-luvun lopulla Australiassa, Kanadassa ja Euroopassa (1). Invasiivisten tautien ilmaantuvuuden on todettu edelleen lisääntyneen esimerkiksi Alaskassa ja Suomessa sekä lapsilla että aikuisilla (5,6,7), mutta esimerkiksi Kanadassa ilmaantuvuuden kasvu näyttää pysähtyneen (8).
Teollistuneissa maissa vaikeiden A-streptokokki-infektioiden ilmaantuvuus on tasoa 2–4/100 000/v, mutta kehittyvissä maissa moninkertainen (8,9). Suomessa vuotuinen ilmaantuvuus lapsilla kasvoi 1990-luvun lopulta tasolta 0,9/100 000/v tasolle 2,5/100 000/v vuosina 2006–2010 (6) ja kasvu on jatkunut myös tämän jälkeen (7). Myös synnytykseen liittyvät A-streptokokki-infektiot ovat lisääntyneet Englannissa kymmenen viime vuoden aikana sekä äideillä että lapsilla (10).
Ilmaantuvuuteen vaikuttavat vaaratekijät
A-ryhmän streptokokki aiheuttaa tauteja vain ihmiselle. Vaikeita infektioita esiintyy kaikenikäisillä, kaikilla roduilla ja sekä terveillä että pitkäaikaissairailla. Isoissa yhdysvaltalaisissa aineistoissa ilmaantuvuus on ollut suurin alle 2-vuotiailla (5), mutta suomalaisessa lapsiaineistossa invasiivisia tauteja esiintyi tasaisesti koko lapsuusiän ja ilmaantuvuus oli suurin 6–7-vuotiailla (6).
Perinteisesti on ajateltu, että A-streptokokki on niin virulentti taudinaiheuttaja, että sen aiheuttaman infektion sairastaneelta ei tarvitse hakea immuunivajausta. Kaikki immuniteettiin vaikuttavat perussairaudet voivat kuitenkin vaikuttaa tartuntariskiin. Aikuisaineistossa on todettu A-streptokokin aiheuttavan immuunipuutteisille enemmän vaikeita taudinkuvia ja kuolleisuutta kuin muuten terveille (11). Suurin osa vaikeista infektioista kuitenkin esiintyy aikaisemmin terveillä (11,12). Vastikään on todettu vaikean A-streptokokki-infektion yhteys HLA-tyyppiin HLA-DQA1*01:03 (13).
Bakteeri kulkeutuu elimistöön useimmiten ihorikkouman kautta (taulukko 1). Suomalaisessa lapsiaineistossa noin puolella potilaista vaikeaa A-streptokokki-infektiota edelsi joko pieni ihon vamma (49 %) tai kirurginen toimenpide edeltäneen kuukauden aikana (4 %) (6). Myös tylppä vamma voi altistaa nekrotisoivalle faskiitille tai muulle syvälle A-streptokokki-infektiolle.
Lapsilla tärkeimpiä vaikealle A-streptokokki-infektiolle altistavia tekijöitä on vesirokko. Se lisää invasiivisen infektion riskin noin 50-kertaiseksi seuraavan kuukauden ajaksi (14). Yleiseen rokotusohjelmaan vuonna 2017 otettu vesirokkorokote voi mahdollisesti jatkossa vähentää vakavien A-streptokokki-infektioiden ilmaantuvuutta lapsilla (15).
Vaikeaa A-streptokokki-infektiota voi edeltää potilaan tai perheenjäsenen streptokokkinielutulehdus (taulukko 1) (6). Samassa taloudessa invasiivista tautia tai tulirokkoa sairastavien kanssa asuvilla vaikean infektion riski on lisääntynyt selvästi, joidenkin tutkimusten mukaan kaksinkertaiseksi (16), joissakin jopa 12-kertaiseksi muun väestön riskiin verrattuna (17). Tartunnan riski on suuri erityisesti äidistä vastasyntyneeseen (16).
Antibioottiprofylaksin merkitystä leviämisen ehkäisyssä ei ole tutkittu. Kanadassa vaikeassa A-streptokokkiepidemiassa kodittomien ja huumeiden käyttäjien keskuudessa epidemian rajoittamiseen on käytetty atsitromysiiniä kerta-annoksena (18).
Vaikeaa A-streptokokki-infektiota sairastavan potilaan kanssa kontaktissa olleita on informoitava suurentuneesta riskistä ja ohjattava hakeutumaan hoitoon mahdollisimman varhain.
NSAID-lääkkeiden on ehdotettu lisäävän vakavan A-streptokokki-infektion riskiä. Yhteys on todettu havainnoivissa tutkimuksissa (19,20). Kaikki ryhmän lääkkeet heikentävät jonkin verran sekä neutrofiilien että lymfosyyttien toimintaa (21), ja eläinkokeissa epäselektiivisten NSAID-lääkkeiden on todettu vaikeuttavan hiirten streptokokki-infektion taudinkuvaa, lisäävän kuolleisuutta ja huonontavan antibioottien tehoa (22). Kuitenkin vakavan A-streptokokkitaudin oire on usein kipu, joten NSAID-lääkitys voi myös kuvastaa vaikeaa taudinkuvaa (23). Prospektiivisessa tutkimuksessa, jossa tarkasteltiin vesirokon komplikaationa nekrotisoivan faskiitin saaneita ja vesirokon ilman komplikaatioita sairastaneita, selvää yhteyttä ibuprofeenin käytön ja faskiitin välillä ei havaittu (24).
Virulenssitekijät
A-streptokokkibakteerin uloin pinta on hyaluronihappoa. Se suojaa bakteeria fagosytoosilta mutta voi aiheuttaa ristireaktioita ihmiselimistön rakenteiden kanssa. Bakteeriseinämän seuraava kerros koostuu proteiineista, joista tärkein on M-proteiini. Se on A-streptokokin tärkein virulenssitekijä, ja se pystyy heikentämään fagosytoosia, häiritsemään komplementin toimintaa ja lisäämään bakteerin adheesiota.
Tarkemmassa tyypityksessä käytetään M-proteiinia koodaavan emm-geenin sekvensointia. emm-tyyppejä on kuvattu yli 220 ja ne vaihtelevat taudinaiheuttamiskyvyltään. Erilaisissa väestöissä ja väestönosissa voi kiertää hyvin erilaisia A-streptokokkikantoja. Vaikeita infektioita aiheuttavat erityisesti tyypit emm1, emm3 ja emm89 (9). Myös yhden emm-tyypin sisällä bakteerien virulenssi voi vaihdella paljonkin johtuen bakteerien välisestä horisontaalisesta geenien vaihdosta (9).
M-proteiinin lisäksi A-streptokokilla on monia muitakin virulenssitekijöitä. Kaikki invasiivisia infektioita aiheuttavat kannat tuottavat ainakin joitakin superantigeeneja, jotka pystyvät stimuloimaan suurta lymfosyyttimäärää nopeasti ja samanaikaisesti (25).
Viime vuosina on selvitetty syitä, miksi vaikeat A-streptokokki-infektiot ovat yleistyneet. 1980-luvulla alkaneen epidemian aiheutti tiettyjen M1T1-kantojen leviäminen (9). Hyvin virulentin M1T1-kloonin muodostumiseen on vaikuttanut kolme geneettistä muutosta, joiden ansiosta bakteerit pystyvät tuottamaan neutrofiileiltä suojaavia ja solutuhoa aiheuttavia eksotoksiineja, kuten deoksiribonukleaasia, NAD-glykohydrolaasia ja streptolysiini O:ta (SLO) (26). Näiden virulenssitekijöiden ja erilaisten proteaasien (esim. SpeA ja SpeB) runsaan tuotannon ansiosta bakteerin kasvumahdollisuudet muuten steriileissä paikoissa lisääntyvät ja infektio pääsee etenemään elimistössä (4).
Myös muut emm-tyypit ovat kokeneet geneettistä muuntumista, joka on vaikuttanut niiden virulenssiin. Samoin kuin M1T1, Suomessakin viime vuosikymmeninä yleistynyt emm89-tyyppi on muuttunut vuosien saatossa (9,27).
Suomalaisessa lapsiaineistossa yleisin emm-tyyppi oli emm1. Sitä on esiintynyt kaikkien yliopistosairaaloiden alueilla ja kaikissa kliinisissä taudinkuvissa. Sen sijaan emm28 on aiheuttanut Suomessa lapsille yleensä pelkän sepsiksen taudinkuvaa, ja sen esiintymisessä oli suuria eroja sairaaloittain (6).
Kliininen taudinkuva
A-streptokokki voi aiheuttaa lapselle infektion missä tahansa kehon osassa. Tavallisimpia invasiivisia taudinkuvia ovat faskiitti tai nekrotisoiva faskiitti, selluliitti, keuhkojen empyeema, imusolmuketulehdus, peritoniitti, kaulan alueen syvät absessit, artriitti ja osteomyeliitti (taulukko 2). Bakteeri voi joskus aiheuttaa myös meningiittiä ja endo- ja perikardiittia, mutta ne ovat harvinaisia.
Kuumeisella ja kivuliaalla lapsella todettava ihon punoitus voi olla diagnostinen vihje. Suomalaisessa aineistossa noin 20–30 %:ssa lasten invasiivisista infektioista ei löytynyt erillistä infektiofokusta, vaan kliininen diagnoosi oli sepsis (6).
Kaikki invasiiviset tautimuodot ovat hengenvaarallisia, mutta erityisen hankala on nekrotisoiva faskiitti (28). Lisäksi mitä tahansa vaikeaa A-streptokokki-infektiota voi komplisoida toksinen sokkioireyhtymä (streptococcal toxic schock syndrome, STSS), jossa kuumeen ja mahdollisen tulirokkoihottuman jälkeen kehittyy hypotensio ja tilanne johtaa nopeasti sokkiin ja monielinvaurioon.
Toksinen sokkioireyhtymä komplisoi noin 10 %:a invasiivisista A-streptokokkitaudeista ja kuolleisuus voi olla jopa 25 % (29). Tämä johtuu superantigeenien ja muiden virulenssitekijöiden aiheuttamasta voimakkaasta inflammaatiomyrskystä. Verrattuna stafylokokkien aiheuttamaan toksiseen sokkioireyhtymään A-streptokokkitaudissa oireyhtymä ilmaantuu nuoremmille ja potilaat tarvitsevat useammin inotrooppeja ja hengitystukea (30).
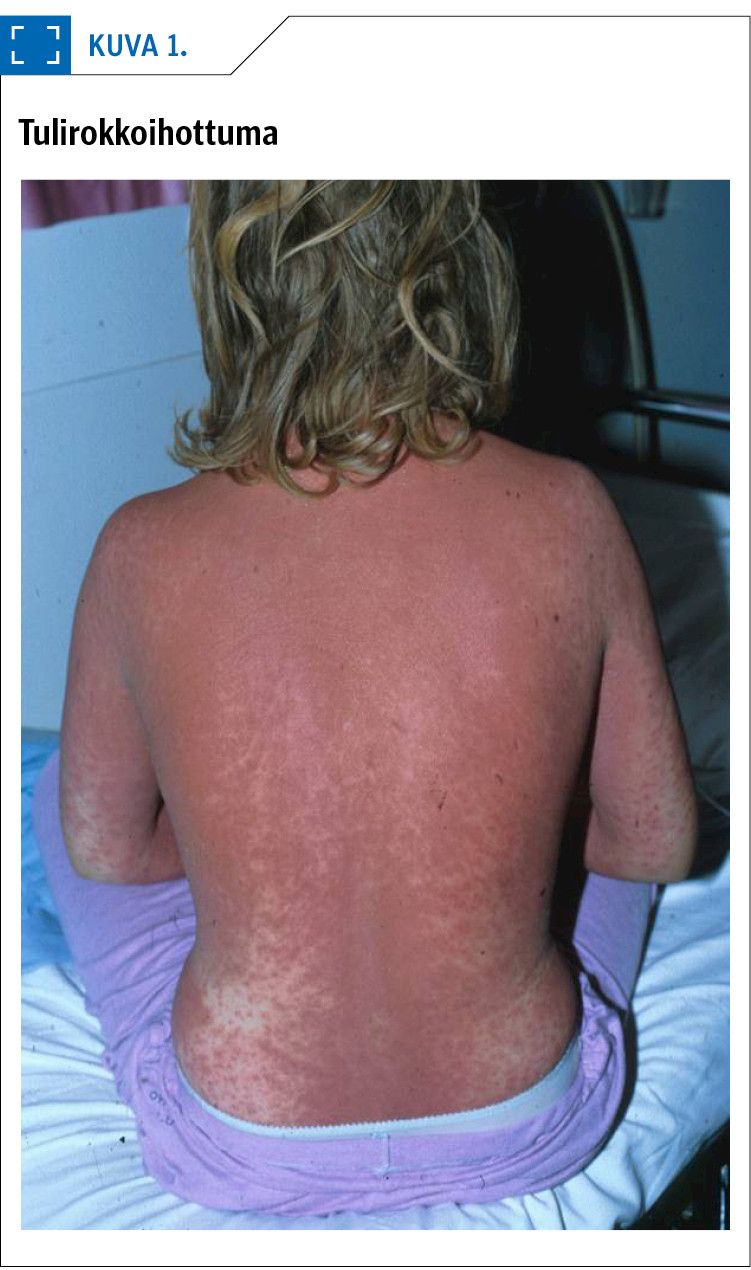
Tulirokkoihottuma liittyy useimmiten faryngiittiin tai ihoinfektioon, mutta se voi liittyä myös syvään A-streptokokki-infektioon. Esimerkiksi A-streptokokin aiheuttamissa pleuriiteissa tulirokkoihottumaa on todettu lähes 2/3:lla (31). Ihottuma alkaa yleensä kaulalta tai rinnan alueelta 1–2 vrk infektio-oireiden alkamisen jälkeen. Tulirokkoihottuma on diffuusisti punoittava, hieman ihosta hiekkapaperimaisesti koholla (kuva 1). Punoitus voi välillä erityisesti ihon taipeissa yhtyä punoittaviksi viivoiksi eli Pastian linjoiksi. Tulirokkoihottumaan voivat liittyä mansikkakieli ja suun ympäristön kalpeus. Iho saattaa hilseillä jälkikäteen (32).
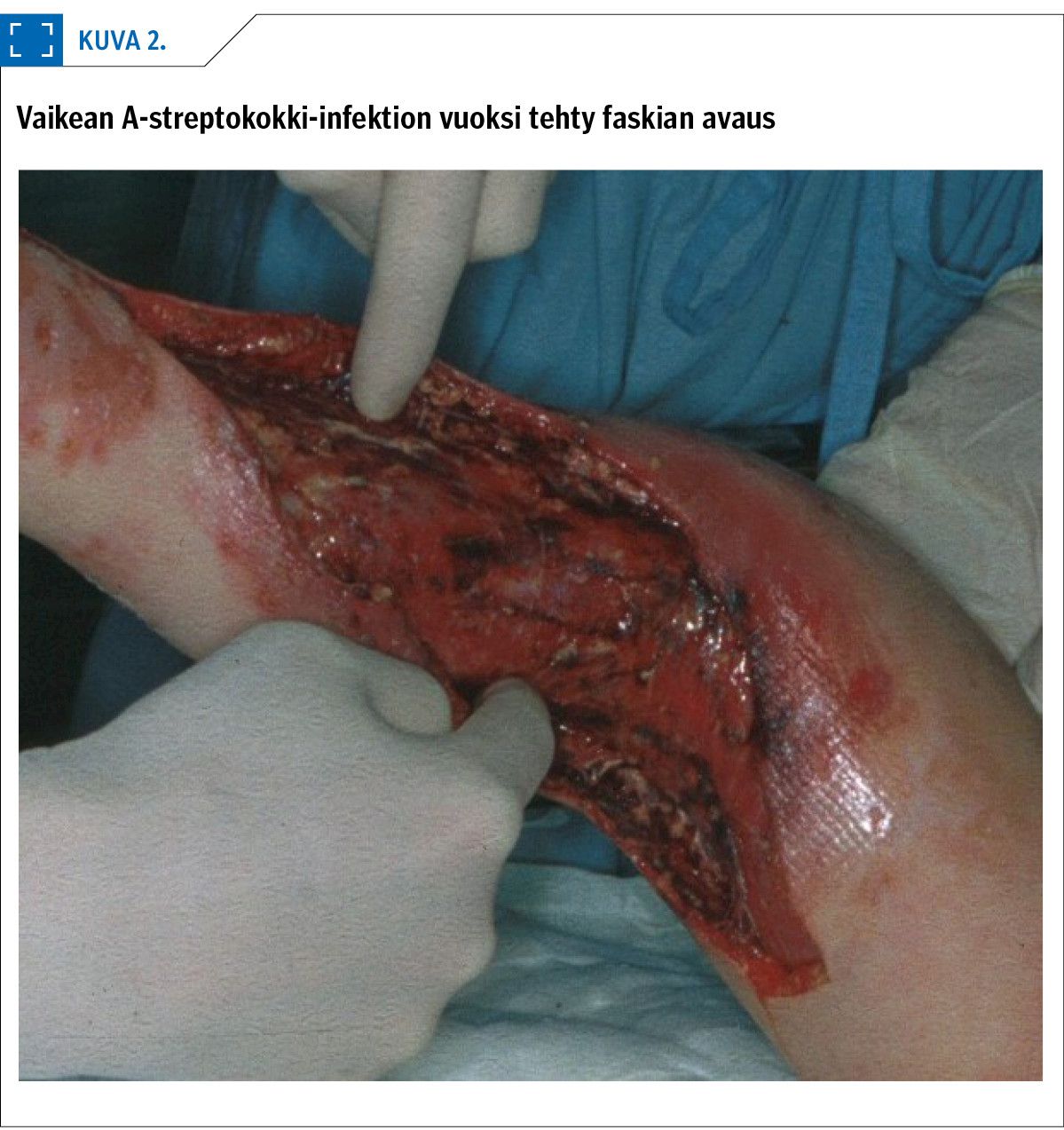
Nekrotisoivassa faskiitissa bakteeritulehdus saa lihaskalvon irtoamaan muista rakenteista, erittämään vesimäistä eritettä ja lopulta hajoamaan. Varsinaisia märkäkertymiä ei yleensä nähdä (33). A-ryhmän streptokokki on lapsilla nekrotisoivan faskiitin tavallisin aiheuttaja (28). Tyypilliset alkuoireet ovat erittäin kova kipu infektoituneella alueella, useimmiten alaraajassa, kuume ja yleinen sairauden tunne (28). Noin puolella potilaista nekrotisoiva faskiitti syntyy syvällä kudoksissa ilman havaittavia trauman merkkejä iholla tai limakalvoilla (33). Tilanteen jatkuessa infektioitunut alue myös ihon pinnalta alkaa punoittaa ja turvota ja siihen voi ilmaantua verenpurkaumia tai rakkuloita.
Nekrotisoivan faskiitin diagnoosi on kliininen. Diagnostiikkaa vaikeuttaa paikallisten infektion merkkien puuttuminen iholta ja kuvantamismenetelmien huono osuvuus. Kipeän kohdan tietokonetomomografiassa tai magneettikuvauksessa näkyy useimmiten epäspesifistä turvotusta tai faskian paksuntumista. Muutokset eivät kuitenkaan ole faskiitille spesifisiä, ja kuvantaminen auttaakin lähinnä infektion paikantamisessa ja operaation suunnittelussa (34). Magneettikuvauksen herkkyys lienee parempi kuin tietokonetomografian (34).
Vaikeista nekrotisoivista pneumonioista tai empyeemista noin 10 % on A-streptokokin aiheuttamia (35). Suomalaisessa aineistossa 10 %:lla invasiivista A-streptokokki-infektiota sairastavista fokus oli keuhkoissa (6). Ranskalaisessa tutkimuksessa A-streptokokin aiheuttamat keuhkoinfektiot olivat vaikeampia kuin pneumokokin aiheuttamat ja 86 % tarvitsi tehohoitoa, puolet dreneerauksen ja 20 % torakoskopian (31). Kuolleisuus oli 4 %.
Diagnostiikka
Invasiivista A-streptokokki-infektiota pitää epäillä taudinkuvan perusteella, ja hoito on aloitettava nopeasti jo epäilyn perusteella. Taudinkuvaa ei kuitenkaan ole aina helppo löytää muiden kuumeisten tautien joukosta.
Australialaisessa aineistossa puolet lapsipotilaista oli käynyt lääkärissä 2 vrk:n aikana ennen sairaalaan tuloa ilman että infektiota tunnistettiin. Näillä potilailla tauti oli vaikeampi kuin niillä, jotka lähetettiin sairaalaan ensimmäisen lääkärikontaktin yhteydessä (36).
Tautiin ei diagnoosivaiheessa lapsilla useinkaan vielä liity matalaa verenpainetta tai perifeerisen verenkierron heikkoutta, sillä nuorilla ja terveillä potilailla kompensaatiomekanismit voivat pitää voinnin kohtalaisena melko pitkään, ennen kuin taudin vakavuus tulee ilmeiseksi ja vointi romahtaa.
Invasiivisen A-streptokokki-infektion diagnoosi varmistuu yleensä empiirisen antibioottihoidon aikana, kun patogeeni löytyy veriviljelystä, nivel- tai selkäydinnesteestä tai syvämärkänäytteestä. Koska bakteeriviljelynkään herkkyys ei ole täydellinen, mahdollisena invasiivisena A-streptokokki-infektiona pidetään tilanteita, joissa yleisoireet ovat vaikeita ja A-streptokokki löytyy esimerkiksi nielusta tai iholta (taulukko 1).
Veren valkosolutasot nousevat A-streptokokki-infektiossa vähemmän kuin pneumokokki-infektiossa (31) ja voivat myös olla matalat. Suomalaisessa 151 lapsen aineistossa CRP oli sairaalaan tullessa keskimäärin 128 mg/l (SD 99) ja korkeimmillaan 180 mg/l (SD 104) (6). Empyeemapotilailla keskimääräiset CRP-tasot ovat olleet korkeampia (250 mg/l, vaihteluväli 43–533) (31).
Hoito
Potilaan hemodynamiikka stabiloidaan nestehoidolla. Nopea antibioottihoidon aloittaminen on välttämätöntä ja usein tarvitaan lisäksi infektiofokuksen kirurginen hoito (37). Empiirisenä hoitona käytetään usein myös stafylokokit kattavaa kefalosporiinia yhdistettynä klindamysiiniin. Taudinaiheuttajan varmistuttua jatketaan penisilliinin ja klindamysiinin yhdistelmällä. Immunoglobuliinihoitoa puoltava tutkimusnäyttö ei ole yksiselitteinen, mutta sitä käytetään harkiten vaikeissa A-streptokokki-infektioissa lisähoitona (37).
A-streptokokin herkkyys penisilliinille on pysynyt hyvänä. G-penisilliiniä käytetään isoin annoksin (200 000–400 000 ky/kg/vrk) (taulukko 3). Koska beetalaktaamiantibioottien vaikutus perustuu bakteeriseinämän rakentumisen estämiseen, penisilliinin teho ei ole paras mahdollinen silloin, kun bakteerimäärä on jo suuri.
Klindamysiini vaikuttaa jo olemassa oleviin bakteereihin estämällä niiden proteiinisynteesiä. Toiseksi klindamysiini vähentää A-streptokokin kykyä tuottaa toksiineja (38). Klindamysiinin on hiirimallissa osoitettu vähentävän A-streptokokin aiheuttamaa kudostuhoa riippumatta siitä, onko infektion aiheuttanut kanta herkkä klindamysiinille vai ei (39).
Klindamysiinin käytöstä ei ole tehty satunnaistettuja tutkimuksia A-streptokokki-infektioiden hoidossa, mutta havainnoivissa asetelmissa sen lisääminen muuhun antibioottihoitoon on parantanut hoitotuloksia ja eloonjäämistä sekä aikuisilla että lapsilla (40,41). Australialaisessa havainnoivassa tutkimuksessa oli 84 erittäin vaikeaa A-streptokokki-infektiota sairastavaa aikuispotilasta, joista osa sai klindamysiiniä beetalaktaamiantibiootin lisäksi (42). Vaikka klindamysiiniä saaneet potilaat olivat vaikeammin sairaita kuin muita antibiootteja saaveet, he jäivät todennäköisemmin eloon (OR 0,28, 95 %:n LV 0,10–0,80). Myös potilailla, jotka saivat klindamysiinin lisäksi immunoglobuliinia suoneen (IVIG), selviytyminen näytti olevan parempi kuin potilailla, jotka eivät saaneet klindamysiiniä (42).
Immunoglobuliinin selviytymistä parantavaa vaikutusta ei ole havaittu kaikissa aikuisilla tehdyissä tutkimuksissa (43), ja lapsilla sen vaikutuksesta vaikeiden A-streptokokki-infektioiden ennusteeseen on tehty hyvin vähän tutkimuksia. Yhdysvaltalaisessa 192 lapsen havainnoivassa aineistossa, jossa kaikilla oli toksinen sokkioireyhtymä, immunoglobuliini ei vaikuttanut kuolleisuuteen tai muihinkaan kliinisiin päätetapahtumiin (44).
Infektiofokuksen nopean kirurgisen avauksen on todettu nopeuttavan toipumista (40) ja parantavan eloonjäämistä (45) nekrotisoivassa faskiitissa (kuva 2). Vaikka satunnaistettuja tutkimuksia ei ole, nopeaa kirurgista interventiota suositellaan (37). Empyeemissa pleuraontelon torakoskooppinen saneeraus on yleistynyt viime vuosina (31).
Ennuste ja komplikaatiot
Vaikeisiin A-streptokokki-infektioihin liittyy hoidosta huolimatta merkittävä kuolleisuus. Suomalaisessa valikoitumattomassa lapsiaineistossa kuolleisuus oli varsin pieni 3/151 (2 %) (6). Sen sijaan toksisen sokkioireyhtymän saaneita potilaita sisältävässä aineistossa, jossa kukaan ei saanut immunoglobuliinihoitoa, kuolleisuus oli 27 % (46). Matala leukosyyttitaso oli yhteydessä kuolleisuuteen (46).
A-streptokokki-infektioilla on asianmukaisen hoidonkin jälkeen taipumus uusiutua. Suomalaisessa aineistossa 10 % potilaista joutui uudelleen sairaalahoitoon, mikä voi johtua antibioottihoidon huonosti tavoittamista solunsisäisistä bakteereista (6). Pitkäaikaissairastavuutta liittyy erityisesti vaikeisiin infektioihin (36).
A-streptokokki-infektion tyypilliset komplikaatiot, kuten reumakuume ja glomerulonefriitti, seuraavat yleensä nielutulehdusta tai ihoinfektiota, mutta voivat joskus ilmaantua myös invasiivisen taudin jälkeen (1). Reumakuumeen vuosittainen ilmaantuvuus on kehittyneissä maissa erittäin vähäinen, 5–14-vuotiailla noin 2/100 000, mutta joissakin Australian osissa, Uudessa-Seelannissa ja Tyynenmeren saarilla jopa satakertainen (47).
Lopuksi
A-streptokokkibakteeri kehittää jatkuvasti ominaisuuksiaan, jotka lisäävät sen leviämistä ja taudinaiheuttamiskykyä. Vaikka vesirokkorokotus saattaa vähentää tautitapauksien määrää lapsilla, A-streptokokki säilyy yhtenä eniten vaikeaa sairastavuutta ja kuolleisuutta aiheuttavista mikrobeista. Taudin viiveetön tunnistaminen, nopea antibioottihoidon aloitus ja tarvittaessa kirurginen interventio parantavat ennustetta merkittävästi.
Marjo Renko: Ei sidonnaisuuksia
Jaana Vuopio: Konsultointipalkkio (ThermoFisher Oy).
Terhi Tapiainen: Konsultointipalkkio (Orion), matka-, majoitus- tai kongressikulut laitokselle (Sanofi Pasteur).
- 1
- Steer AC, Lamagni T, Curtis N, Carapetis JR. Invasive group a streptococcal disease: epidemiology, pathogenesis and management. Drugs 2012;72:1213–27.
- 2
- Lee CF, Cowling BJ, Lau EHY. Epidemiology of reemerging scarlet fever, Hong Kong, 2005-2015. Emerg Infect Dis 2017;23:1707–10.
- 3
- Lamagni T, Guy R, Chand M ym. Resurgence of scarlet fever in England, 2014-16: a population-based surveillance study. Lancet Infect Dis 2018;18:180–7.
- 4
- Lynskey NN, Jauneikaite E, Li HK ym. Emergence of dominant toxigenic M1T1 Streptococcus pyogenes clone during increased scarlet fever activity in England: a population-based molecular epidemiological study. Lancet Infect Dis 2019;19:1209–18.
- 5
- Rudolph K, Bruce MG, Bruden D ym. Epidemiology of invasive group A streptococcal disease in Alaska, 2001 to 2013. J Clin Microbiol 2016;54:134–41.
- 6
- Tapiainen T, Launonen S, Renko M ym. Invasive group A streptococcal infections in children: A nationwide survey in Finland. Pediatr Infect Dis J 2016;35:123–8.
- 7
- Pennanen T. A-streptokokki-infektioiden määrä kasvoi. Suom Lääkäril 2019;74:166.
- 8
- Couture-Cossette A, Carignan A, Mercier A, Desruisseaux C, Valiquette L, Pepin J. Secular trends in incidence of invasive beta-hemolytic streptococci and efficacy of adjunctive therapy in Quebec, Canada, 1996-2016. PLoS One 2018;13(10):e0206289.
- 9
- Barnett TC, Bowen AC, Carapetis JR. The fall and rise of Group A Streptococcus diseases. Epidemiol Infect, verkossa ensin 15.8.2018. doi: 10.1017/S0950268818002285
- 10
- Leonard A, Wright A, Saavedra-Campos M ym. Severe group A streptococcal infections in mothers and their newborns in London and the South East, 2010-2016: assessment of risk and audit of public health management. BJOG 2019;126:44–53.
- 11
- Linder KA, Alkhouli L, Ramesh M, Alangaden GA, Kauffman CA, Miceli MH. Effect of underlying immune compromise on the manifestations and outcomes of group A streptococcal bacteremia. J Infect 2017;74:450–5.
- 12
- Lamagni TL, Darenberg J, Luca-Harari B ym. Epidemiology of severe Streptococcus pyogenes disease in Europe. J Clin Microbiol 2008;46:2359–67.
- 13
- Parks T, Elliott K, Lamagni T ym. Elevated risk of invasive group A streptococcal disease and host genetic variation in the human leucocyte antigen locus. Genes Immun 2019, verkossa ensin 29.8.2019. doi: 10.1038/s41435-019-0082-z
- 14
- Laupland KB, Davies HD, Low DE, Schwartz B, Green K, McGeer A. Invasive group A streptococcal disease in children and association with varicella-zoster virus infection. Ontario Group A Streptococcal Study Group. Pediatrics 2000;105(5):E60.
- 15
- Hasin O, Hazan G, Rokney A ym. Invasive group A Streptococcus infection in children in Southern Israel before and after the introduction of Varicella vaccine. J Pediatric Infect Dis Soc, verkossa ensin 31.3.2019. doi: 10.1093/jpids/piz013
- 16
- Mearkle R, Saavedra-Campos M, Lamagni T ym. Household transmission of invasive group A Streptococcus infections in England: a population-based study, 2009, 2011 to 2013. Euro Surveill 2017;22(19):10.2807/156-7917.ES.2017.22.19.30532.
- 17
- Watts V, Balasegaram S, Brown CS ym. Increased risk for invasive group A Streptococcus disease for household contacts of scarlet fever cases, England, 2011-2016. Emerg Infect Dis 2019;25:529–37.
- 18
- Dickson C, Pham MT, Nguyen V ym. Community outbreak of invasive group A streptococcus infection in Ontario, Canada. Can Commun Dis Rep 2018;44(7-8):182–8.
- 19
- Factor SH, Levine OS, Harrison LH ym. Risk factors for pediatric invasive group A streptococcal disease. Emerg Infect Dis 2005;11:1062–6.
- 20
- Mikaeloff Y, Kezouh A, Suissa S. Nonsteroidal anti-inflammatory drug use and the risk of severe skin and soft tissue complications in patients with varicella or zoster disease. Br J Clin Pharmacol 2008;65:203–9.
- 21
- Brooks PM, Day RO. Nonsteroidal antiinflammatory drugs--differences and similarities. N Engl J Med 1991;324:1716–25.
- 22
- Hamilton SM, Bayer CR, Stevens DL, Bryant AE. Effects of selective and nonselective nonsteroidal anti-inflammatory drugs on antibiotic efficacy of experimental group A streptococcal myonecrosis. J Infect Dis 2014;209:1429–35.
- 23
- Aronoff DM, Bloch KC. Assessing the relationship between the use of nonsteroidal antiinflammatory drugs and necrotizing fasciitis caused by group A streptococcus. Medicine (Baltimore) 2003;82:225–35.
- 24
- Lesko SM, O’Brien KL, Schwartz B, Vezina R, Mitchell AA. Invasive group A streptococcal infection and nonsteroidal antiinflammatory drug use among children with primary varicella. Pediatrics 2001;107:1108–15.
- 25
- Strus M, Heczko PB, Golinska E ym. The virulence factors of group A streptococcus strains isolated from invasive and non-invasive infections in Polish and German centres, 2009-2011. Eur J Clin Microbiol Infect Dis 2017;36:1643–9.
- 26
- Nasser W, Beres SB, Olsen RJ ym. Evolutionary pathway to increased virulence and epidemic group A Streptococcus disease derived from 3,615 genome sequences. Proc Natl Acad Sci U S A 2014;111:1768.
- 27
- Latronico F, Nasser W, Puhakainen K ym. Genomic characteristics behind the spread of bacteremic group A Streptococcus type emm89 in Finland, 2004-2014. J Infect Dis 2016;214:1987–95.
- 28
- Schroder A, Gerin A, Firth GB, Hoffmann KS, Grieve A, Oetzmann von Sochaczewski C. A systematic review of necrotising fasciitis in children from its first description in 1930 to 2018. BMC Infect Dis 2019;19:31–3.
- 29
- Adalat S, Dawson T, Hackett SJ, Clark JE, In association with the British Paediatric Surveillance Unit. Toxic shock syndrome surveillance in UK children. Arch Dis Child 2014;99:1078–82.
- 30
- Chen KY, Cheung M, Burgner DP, Curtis N. Toxic shock syndrome in Australian children. Arch Dis Child 2016;101:736–40.
- 31
- Bellulo S, Sommet J, Levy C ym. When should clinicians suspect group A streptococcus empyema in children? A multicentre case-control study in French tertiary care centres. Arch Dis Child 2016;101:731–5.
- 32
- Dietrich ML, Steele RW. Group A Streptococcus. Pediatr Rev 2018;39:379–91.
- 33
- Stevens DL, Bryant AE. Necrotizing soft-tissue infections. N Engl J Med 2018;378:971.
- 34
- Chaudhry AA, Baker KS, Gould ES, Gupta R. Necrotizing fasciitis and its mimics: what radiologists need to know. AJR Am J Roentgenol 2015;204:128–39.
- 35
- Erlichman I, Breuer O, Shoseyov D ym. Complicated community acquired pneumonia in childhood: Different types, clinical course, and outcome. Pediatr Pulmonol 2017;52:247–54.
- 36
- Ching NS, Crawford N, McMinn A ym. Prospective surveillance of pediatric invasive group A Streptococcus infection. J Pediatric Infect Dis Soc 2019;8:46–52.
- 37
- Committee on Infectious Diseases American Academy of Pediatrics. Red Book: 2018 Report of the Committee on Infectious Diseases. 31th ed. IL: Elk Grove Village; 2018.
- 38
- Waddington CS, Snelling TL, Carapetis JR. Management of invasive group A streptococcal infections. J Infect 2014;69 suppl 1:63.
- 39
- Andreoni F, Zurcher C, Tarnutzer A ym. Clindamycin affects group A Streptococcus virulence factors and improves clinical outcome. J Infect Dis 2017;215:269–77.
- 40
- Zimbelman J, Palmer A, Todd J. Improved outcome of clindamycin compared with beta-lactam antibiotic treatment for invasive Streptococcus pyogenes infection. Pediatr Infect Dis J 1999;18:1096–100.
- 41
- Linner A, Darenberg J, Sjolin J, Henriques-Normark B, Norrby-Teglund A. Clinical efficacy of polyspecific intravenous immunoglobulin therapy in patients with streptococcal toxic shock syndrome: a comparative observational study. Clin Infect Dis 2014;59:851–7.
- 42
- Carapetis JR, Jacoby P, Carville K, Ang SJ, Curtis N, Andrews R. Effectiveness of clindamycin and intravenous immunoglobulin, and risk of disease in contacts, in invasive group a streptococcal infections. Clin Infect Dis 2014;59:358–65.
- 43
- Kadri SS, Swihart BJ, Bonne SL ym. Impact of intravenous immunoglobulin on survival in necrotizing fasciitis with vasopressor-dependent shock: a propensity score-matched analysis from 130 US hospitals. Clin Infect Dis 2017;64:877–85.
- 44
- Shah SS, Hall M, Srivastava R, Subramony A, Levin JE. Intravenous immunoglobulin in children with streptococcal toxic shock syndrome. Clin Infect Dis 2009;49:1369–76.
- 45
- Moss RL, Musemeche CA, Kosloske AM. Necrotizing fasciitis in children: prompt recognition and aggressive therapy improve survival. J Pediatr Surg 1996;31:1142–6.
- 46
- Timmis A, Parkins K, Kustos I, Riordan FA, Efstratiou A, Carrol ED. Invasive group A streptococcal infections in children presenting to a paediatric intensive care unit in the North West of England. J Infect 2010;60:183–6.
- 47
- Karthikeyan G, Guilherme L. Acute rheumatic fever. Lancet 2018;392:161–74.
Invasive group A streptococcal infections in children
The incidence of invasive group A streptococcal (GAS) infections is increasing globally. The changes in the epidemiology and increased severity of the infections have been discovered to be due to several mutations in the strains of GAS. These mutations lead to high production of various superantigens in the bacteria and further to more severe forms of infection as these superantigens act as enzymes and proteases destroying infected tissues.
The majority of childhood invasive GAS infections occur in previously healthy children. Chickenpox, surgery, minor skin trauma and GAS infection in the family increase the risk of serious infections. Necrotizing fasciitis and streptococcal toxic shock syndrome are the most serious clinical pictures of GAS infections with mortality rates of 2–28%. Fasciitis is most commonly located in the lower extremities and severe focal pain may be an important red flag sign in a child with high fever.
Treatment with empiric antibiotics should be started based on suspicion of an invasive GAS infection already, usually with a combination of a beta lactam and clindamycin. When GAS has been proven as a cause of infection, a combination of high dose penicillin and clindamycin are the drugs of choice. Surgical revision of the focus speeds recovery and improves survival.