Mahasyöpä diagnosoidaan usein vasta levinneenä
• Suomessa todetaan noin 600 mahasyöpää vuodessa. Vain noin puolet niistä voidaan hoitaa kuratiivistavoitteisesti.
• Kaikki, joilla todetaan hälyttäviä oireita, tulisi ohjata gastroskopiaan iästä riippumatta. Tärkein mahasyövän ennusteeseen vaikuttava tekijä on kasvaimen levinneisyys toteamishetkellä.
• Leikkaus on tärkein hoitomenetelmä. Solunsalpaajahoitoa suositellaan antamaan sekä ennen leikkaushoitoa että leikkauksen jälkeen, jos kasvain infiltroi lihaskerrokseen tai syvemmälle.
• Mahalaukun poiston jälkeen syöminen voi hankaloitua. Vitamiinien sekä hivenaineiden puutosoireet ovat yleisiä.

Mahasyöpä on maailmanlaajuisesti viidenneksi yleisin syöpätauti. Uusia tapauksia todetaan vuosittain yli miljoona (1). Syöpäkuolleisuuden aiheuttajana se on neljänneksi suurin.
Ilmaantuvuus vaihtelee suuresti, ja suurinta se on Kaukoidässä. Sen sijaan länsimaissa ilmaantuvuus on 1950-luvulta alkaen pienentynyt ja on nykyään vähäinen.
Esimerkiksi Suomessa mahasyöpä on miehillä ilmaantuvuudeltaan vasta kymmenenneksi yleisin syöpä, mutta se aiheuttaa kahdeksanneksi eniten syöpäkuolemia sekä miehillä että naisilla (2). Maahanmuuttajilla ilmaantuvuus voi olla selvästi suurempi kuin suomalaisessa kantaväestössä, koska siihen heijastuvat lähtömaan ilmaantuvuusluvut.
Mahasyövän luokittelu
Mahasyövälle on useita luokituksia. Suomessa on yleisesti ollut käytössä Laurénin luokitus (3), jossa mahasyöpä jaetaan kahteen pääluokkaan: intestinaaliseen ja diffuusiin tyyppiin. Se on edelleen käyttökelpoinen, etenkin epidemiologisissa tutkimuksissa.
Toinen, myös histologiaan perustuva WHO:n luokitus on jonkin verran mutkikkaampi. Siinä mahasyöpä jaetaan viiteen luokkaan: tubulaariseen, papillaariseen, musinoottiseen sekä huonosti kohesiiviseen (sinettisormussolusyöpä mukaan lukien) ja harvinaisiin histologisiin variantteihin (4).
Uusin luokitus on molekulaarinen luokittelu (5), jossa kasvain jaetaan neljään ryhmään geneettisen muutosten perusteella: Epstein–Barrin virusinfektioon liittyvä, mirosatelliitti-instabiili, geneettisesti stabiili ja kromosomaalisesti instabiili tyyppi.
Oireet
Ylävatsavaivat ovat yleisiä: noin 20 % väestöstä kärsii dyspepsiasta (6). Varhaisvaiheessa noin 70 % mahasyövistä on oireettomia tai aiheuttaa vain lieviä epämääräisiä oireita (7).
Käypä hoito -suosituksen (8) mukaan alle 55-vuotiasta potilasta, jolla on uusi, mutta ei hälyttävä ylävatsavaiva, ei tarvitse tähystää, vaan voidaan edetä hoitokokeiluun. Tätä vanhemmat potilaat tulee tutkia, vaikka oire ei olisi hälyttävä. Iästä riippumatta kaikille potilaille, joilla on hälyttäviä oireita (taulukko 1), tulee tehdä gastroskopia. Varhainen täyttymisen tunne on varsin tavallinen, mutta ei hälyttäväksi luokiteltu oire mahasyöpäpotilailla.
Hälyttävienkin oireiden sensitiivisyys syövän suhteen on kuitenkin huono (9). Hyksin aineistossa mahasyöpäpotilaista 92 %:lla oli hälyttäviä oireita tai oirekuvan muutos ennen diagnosointia (10). Ennusteen on todettu olevan parempi, jos potilaalle ei ole kehittynyt hälyttäviä oireita (11). Jos gastroskopia tehdään alle 55-vuotiaille vain hälyttävien oireiden perusteella, voi parannettavissa oleva mahasyöpä jäädä diagnosoimatta (12).
Suuren ilmaantuvuuden maissa mahasyöpää seulotaan ja varhaisvaiheen syöpiä todetaan enemmän kuin maissa, joissa seulontaa ei tehdä (13,14). Seulonnasta ei ole hyötyä, jos ilmaantuvuus on vähäinen. Endoskopiaa harkittaessa pitää huomioida potilaan etninen tausta sekä sukuhistoria mahasyövän suhteen.
Potilaat, joilla on todettu vaikea-asteista atrofiaa tai intestinaalista metaplasiaa laaja-alaisesti tai korkeat mahasyövän riskipisteet (esim. operative link on gastric intestinal metaplasia OLGIM tai topografy of atrophy and intestinal metaplasia TAIM), tulee ohjata seurantaan (15,16).
Diagnoosi ja levinneisyystutkimukset
Tavallisesti mahasyövän diagnoosi tehdään gastroskopian yhteydessä otettavista koepaloista. Kasvain voi näkyä mahalaukun luumeniin pullistuvana kasvaimena, vallireunaisena haavana tai ainoastaan mahalaukun seinämän jäykkyytenä (linitis plastica). Varhaisvaiheen syöpä voi olla hankalasti tunnistettavissa endoskopiassa. Diagnoosi varmistetaan koepaloista.
Joskus erotusdiagnostisia vaikeuksia aiheuttavat muut mahalaukun kasvaimet, kuten lymfoomat, neuroendokriiniset kasvaimet tai ruoansulatuskanavan stroomakasvain GIST. Mahankovettumasta (linitis plastica) voi olla vaikeaa saada histologista varmistusta diagnoosille, koska kasvainsolut sijaitsevat pääosin limakalvon alla. Joskus diagnoosi tehdään muun syyn takia tehdystä tietokonetomografiakuvasta tai vasta leikkauksen yhteydessä.
Levinneisyyden selvittämiseksi tarvitaan ainakin vartalon tietokonetomografia, ja se tehdään laajennetusta mahalaukusta kasvaimen paikan ja infiltraation syvyyden arvioinnin helpottamiseksi. Usein tietokonetomografia ja gastroskopialöydös riittävät kasvaimen sijainnin sekä kliinisen TNM-luokan (17) arviointiin.
Endoskooppista kaikukuvausta voidaan käyttää arvioitaessa kasvaimen infiltraatiosyvyyttä ja paikallisia imusolmukkeita. Jos potilaalle annetaan solunsalpaajahoitoa ennen leikkausta, hänelle tulee tehdä vatsaontelon tähystys kasvaimen levinneisyyden selvittämiseksi ennen hoidon aloittamista (18,19,20).
PET-TT-kuva voi antaa lisätietoa etäpesäkkeistä, joita ei muilla menetelmillä todeta, mutta sen sensitiivisyys pienten metastaasien löytämisessä on huono, kuten myös mahasyövän diffuusissa muodossa (21).
Peruslaboratoriokokeista ei ole hyötyä mahasyövän diagnostiikassa.
Endoskooppinen hoito
Hyvin erilaistuneet, pinnalliset mahasyövät voidaan hoitaa endoskooppisesti. Japanilaisen ohjeen mukaan endoskooppisen toimenpiteen aihe on hyvin erilaistunut, haavautumaton kasvain, joka rajoittuu limakalvoon. Tällaisissa tapauksissa imusolmukemetastasoinnin riski on alle 1 %.
Laajennetun kriteeristön mukaan myös huonosti erilaistuneita, alle 2 cm:n kokoisia, limakalvoon rajoittuneita haavautumattomia kasvaimia voidaan hoitaa endoskooppisesti (22).
Länsimaissa endoskooppisen hoidon kriteereitä on pidetty löysempinä suuren leikkausriskin potilailla (23). Helsingissä on vuosina 2013–21 hoidettu 27 ventrikkelin karsinoomaa tai premalignia muutosta endoskooppisesti (Marianne Udd, henkilökohtainen tiedonanto).
Leikkaushoito
Leikkaus on mahasyövän tärkein hoitokeino. Jos kasvain sijaitsee mahalaukun distaaliosassa, voidaan tehdä mahalaukun osittainen poisto. Jos riittävää proksimaalimarginaalia ei voi saavuttaa osapoistolla, poistetaan koko mahalaukku (22). Proksimaalisten, ruokatorveen jatkuvien kasvainten hoidoksi voidaan tehdä proksimaalinen gastrektomia ja ruokatorven resektio (24). Mahalaukun osapoiston jälkeen ennuste on vastaava kuin koko mahalaukun poiston jälkeen, mutta elämänlaatu on keskimäärin parempi (25).
Imusolmukkeiden poiston laajuudesta on tehty paljon tutkimuksia. D1-leikkauksessa poistetaan perigastriset imusolmukkeet ja D2:ssa lisäksi ylävatsan verisuonia ympäröivät imusolmukkeet. Kaukoidässä laaja D2-poisto on ollut standardi jo pitkään. Eurooppalaisten satunnaistettujen tutkimusten mukaan leikkauskuolleisuus oli D2-toimenpiteissä noin kaksinkertainen perinteiseen leikkaustapaan verrattuna (26,27). Lisääntyneen leikkauskuolleisuuden vuoksi viiden vuoden seurannassa imusolmukkeiden laajemman poiston ei voitu todeta tuoneen elinaikahyötyä. Pidemmässä seurannassa D2-lymfadenektomian on todettu parantavan potilaiden ennustetta (28).
Nykyisin, kun kokemusta on kertynyt myös länsimaissa, laajemmat imusolmukkeen poistot voidaan tehdä lisäämättä kuolleisuutta. D2-lymfadenektomiaa voidaan pitää standardina ja ainoastaan T1-kasvaimia leikattaessa voidaan tehdä suppeampi, D1-tason lymfadenektomia. D2-lymfadenektomiaa laajemman imusolmukkeiden poiston merkitys on epäselvä, eikä sitä pidä tehdä ainakaan profylaktisessa mielessä (29,30).
Metastasoineen mahasyövän ennuste on huono. Ennen leikkausta annetun solunsalpaajahoidon jälkeen voidaan valikoiduille potilaille tarjota leikkaushoitoa, jos vaste solunsalpaajahoitoon on ollut hyvä. Rajoittuneessa peritoneaalisessa metastasoinnissa hypertermisen intraperitoneaalisen kemoterapian (HIPEC) ja sytoreduktiivisen kirurgian ja gastrektomian yhdistäminen perioperatiiviseen hoitoon on osoittautunut lupaavaksi hoitomenetelmäksi valikoiduilla potilailla (31). Myös maksaan tai para-aortaalisiin imusolmukkeisiin levinnyttä mahasyöpää voidaan valikoiduilla potilailla hoitaa operatiivisesti. Lieväoireisessa mutta metastasoineessa taudissa mahalaukun poisto ei näytä parantavan potilaiden ennustetta (32,33).
Satunnaistettujen tutkimusten mukaan mahasyövän mini-invasiivisten (laparoskopia tai robottitekniikka) ja avoleikkausten pitkäaikaistulokset ovat samanlaiset (34,35).
Perioperatiivinen hoito
Valtaosa mahasyövistä todetaan paikallisesti edenneinä. Koska pelkän leikkaushoidon tulokset ovat tällöin vaatimattomat, hoidon tehoa on yritetty parantaa solunsalpaajilla tai solunsalpaajan ja sädehoidon yhdistelmällä.
Nykyisen eurooppalaisen suosituksen mukaan potilaille, joilla on muscularis propriaan tai syvemmälle infiltroiva kasvain tai epäily imusolmukemetastaasista, aloitetaan perioperatiivinen solunsalpaajahoito (19,20,36). Perioperatiivisesti epirubisiinin, sisplatiinin ja fluorourasiilin yhdistelmää (ECF) saaneiden potilaiden viiden vuoden elossaolosennuste oli parempi kuin potilaiden, joille tehtiin leikkaus antamatta preoperatiivista solunsalpaajahoitoa: 36 % vs. 23 % (37). Tutkimuksen julkaisemisen jälkeen Suomessa otettiin käyttöön perioperatiivinen epirubisiinin, oksaaliplatiinin ja kabesitabiinin yhdistelmähoito (EOX).
Tuoreemman tutkimuksen perustella fluorourasiilin sekä leukovoriinin, oksaaliplatiinin ja dosetakselin yhdistelmä (FLOT) vaikuttaa olevan tehokkain perioperatiivisen hoidon menetelmä (38). Tutkimuksessa FLOT-hoitoa saaneiden viiden vuoden elossaoloennuste oli 45 %, ECF/ECX-hoitoa saaneiden 36 %.
Preoperatiivisen solunsalpaajahoidon ei ole todettu lisäävän leikkauskomplikaatioita tai -kuolleisuutta. Postoperatiivisen sädehoidon lisääminen solunsalpaajahoidon rinnalle ei näytä parantavan ennustetta (39).
Nykyisten suositusten perusteella kaikille potilaille annetaan samaa perioperatiivista hoitoa. Sama hoito ei kuitenkaan tehoa yhtä hyvin kaikkiin mahasyövän tyyppeihin; esimerkiksi teho on sinettisormussolutyyppisiin ja mikrosatelliitti-instabiileihin kasvaimiin huono (40,41).
Palliatiivinen hoito
Vain noin puolet mahasyöpää sairastavista on kuratiivistavoitteisen hoidon piirissä (10). Loput saavat palliatiivista hoitoa, joka voi olla jarruttavaa solunsalpaajahoitoa, sädehoitoa sekä erilaisia kirurgisia tai endoskooppisia toimenpiteitä.
Tukostilanne voidaan hoitaa endoskooppisesti asettamalla metalliverkkostentti, tekemällä kirurginen ohitus mahalaukun ja ohutsuolen välille tai tekemällä palliatiivinen resektio tai totaalinen gastrektomia (42). Jos potilaan elinajan ennuste on lyhyt, endoskooppinen hoito on paras vaihtoehto.
Verenvuototilanteessa voidaan primaarikasvain poistaa kirurgisesti tai antaa sädehoitoa, jonka teho vuotoon on noin 70 % (43).
Ennuste
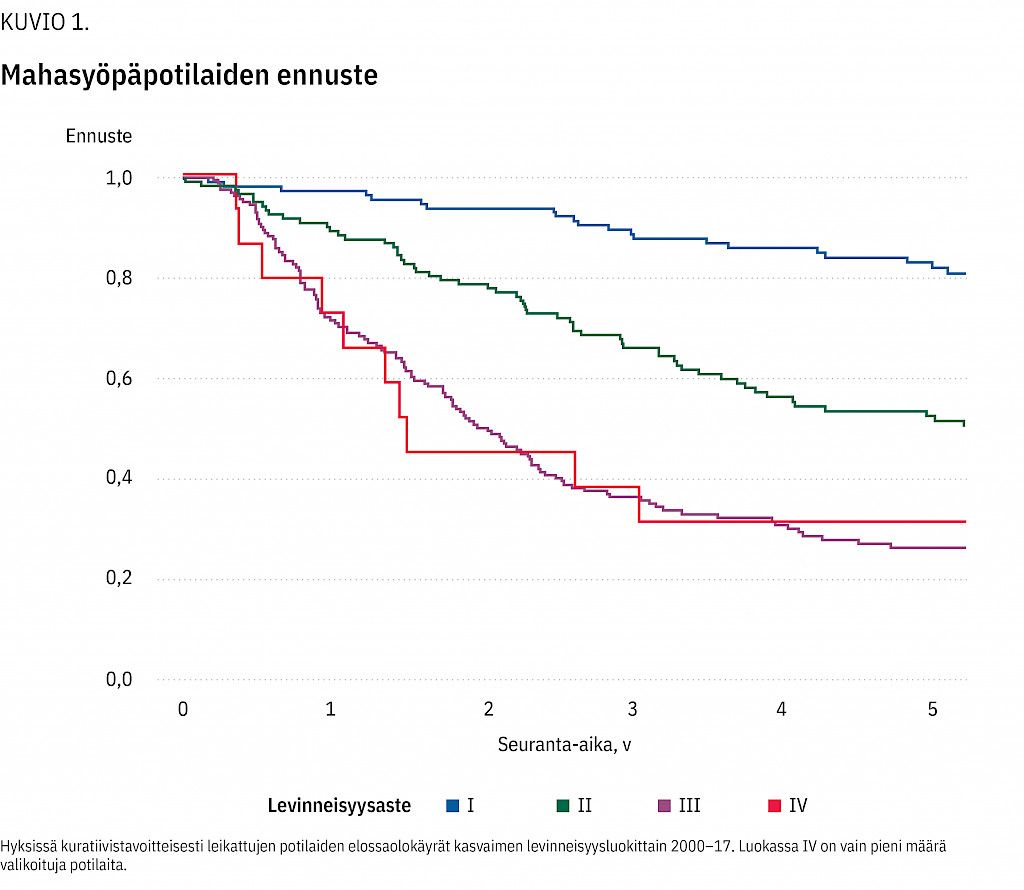
Syöpärekisterin tuoreen tilaston mukaan mahasyöpäpotilaiden viiden vuoden elossaoloennuste on miehillä 26 % ja naisilla 30 % (2). Hyksin aineistossa varhaisvaiheen mahasyövässä ennuste oli 92 % (44). Elossaolokäyrät kasvaimen levinneisyysluokittain on esitetty kuviossa (kuvio 1) (Johan Back, henkilökohtainen tiedonanto). Tuoreessa ruotsalaistutkimuksessa leikkauksella hoidettujen potilaiden viiden vuoden tautispesifinen elossaoloennuste oli 44 % (45).
Seuranta
Gastrektomian jälkeen potilailla voi olla paljon oireita, kuten syömisvaikeutta, laihtumista, dumping-oiretta (aterianjälkeinen vatsakipu, pahoinvointi, ripuli, hikoilu ja sydämentykytys) ja sappirefluksia. Säännöllinen seuranta mahdollistaa oireiden hoidon ja psyykkisen tuen ja auttaa myös toteamaan taudin uusiutumisen (19). Seurannan ei ole kuitenkaan todettu parantavan elinajan ennustetta (19,46).
Gastrektomian jälkeen tiettyjen ravintoaineiden ja vitamiinien imeytyminen on heikentynyttä. Koko mahalaukun poiston jälkeen tulee aloittaa B 12 -vitamiinin korvaushoito. Lisäksi suositellaan rautaa sisältävää monivitamiinivalmistetta ja kalkki-D-vitamiinivalmistetta. Raudan, folaatin kalsiumin ja D-vitamiinin pitoisuuksia on syytä seurata vuosittain syöpäseurannan päättymisen jälkeenkin (47).
Arto Kokkola: Ei sidonnaisuuksia.
- 1
- International Agency for Research on Cancer 14.2.2022. https://gco.iarc.fr
- 2
- Suomen Syöpärekisteri 14.2.2022. https://syoparekisteri.fi/
- 3
- Laurén P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. Acta Pathol Microbiol Scand 1965;64:31–49.
- 4
- Lauwers GY, Carneiro F, GrahamDY ym. Gastric carcinoma. Kirjassa: Bosman FT, Carneiro F, Hruban RH, Theise ND, toim. WHO classification of tumors of the digestive system, 4. painos. Lyon: IARC 2010:48–68.
- 5
- The Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014;513:202–9.
- 6
- Ford AC, Marwaha A, Sood R ym. Global prevalence of, and risk factors for, uninvestigated dyspepsia: a meta-analysis. Gut 2015;64:1049–57.
- 7
- Hallisey MT, Allum WH, Jewkes AJ ym. Early detection of gastric cancer. BMJ 1990;301:513–5.
- 8
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Gastroenterologiayhdistyksen asettama työryhmä. Ylävatsavaivat ja refluksioireet. Käypä hoito -suositus 10.4.2019. https://www.kaypahoito.fi/hoi50093
- 9
- Vakil N, Moayyedi P, Fennerty MB ym. Limited value of alarm features in the diagnosis of upper gastrointestinal malignancy: systematic review and meta-analysis. Gastroenterology 2006;131:390–401.
- 10
- Kokkola A, Sipponen P, Arkkila P ym. Does the eradication of Helicobacter pylori delay the diagnosis of gastric cancer? Scand J Gastroenterol 2008;43:1456–60.
- 11
- Stephens MR, Lewis WG, White S ym. Prognostic significance of alarm symptoms in patients with gastric cancer. Br J Surg 2005;92:840–6.
- 12
- Bowrey DJ, Griffin SM, Wayman J ym. Use of alarm symptoms to select dyspeptics for endoscopy causes patients with curable esophagogastric cancer to be overlooked. Surg Endosc 2006;20:1725e8.
- 13
- Yang L, Ying X, Liu S ym. Gastric cancer: epidemiology, risk factors and prevention strategies. Chin J Cancer Res 2020;32:695–704.
- 14
- Yamashita K, Sakuramoto S, Nemoto M ym. Trend in gastric cancer: 35 years of surgical experience in Japan. Word J Gastroenterol 2011;17:3390–7.
- 15
- Pimentel-Nunes P, Libanio D, Marcos-Pinto R ym. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy 2019;51:365–88.
- 16
- Nieminen AA, Kontto J, Puolakkainen P, Virtamo J, Kokkola A. Comparison of operative link for gastritis assessment, operative link on gastric intestinal metaplasia assessment, and TAIM stagings among men with atrophic gastritis. World J Gastroenterol 2020;26:3447–57.
- 17
- Brierley JD, Gospodarowicz MK, Wittekind C, toim. TNM classification of malignant tumours, 8. painos. Hoboken, NJ: Wiley-Blackwell 2017.
- 18
- Ramos RF, Scalon FM, Scalon MM ym. Staging laparoscopy in gastric cancer to detect peritoneal metastases: A systematic review and meta-analysis. Eur J Surg Oncol 2016;42:1315–21.
- 19
- Smyth EC, Verheij M, Allum V ym. Gastric cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016;27 suppl 5:v38–v49.
- 20
- Zaanan A, Boucgé O, Benhaim L ym. Gastric cancer: French intergroup clinical practice guidelines for diagnosis, treatments, and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO). Dig Liver Dis 2018;50:768–79.
- 21
- Salmanoglu E. The role of [18F] FDG PET/CT for gastric cancer management. Nucl Med Rev 2021;24:99–103.
- 22
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021;24:1–21.
- 23
- Tate DJ, Klein A, Sidhu M ym. Endoscopic submucosal dissection for suspected early gastric cancer: absolute versus expanded criteria in a large Western cohort (with video). Gastrointest Endosc 2019;90:467–79.
- 24
- Nunobe S, Ida S. Current status of proximal gastrectomy for gastric and esophagogastric junctional cancer: a review. Ann Gastroenterol Surg 2020;4:498–504.
- 25
- Bozzetti F, Marubini E, Bonfanti G ym. Subtotal versus total gastrectomy for gastric cancer. Five-year survival rates in a multicenter randomized Italian trial. Ann Surg 1999;230:170–8.
- 26
- Bonenkamp JJ, Songun I, Hermans J ym. Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995;345:745–8.
- 27
- Cuschieri A, Fayers P, Fielding J ym. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. The Surgical Cooperative Group. Lancet 1996;347:995–9.
- 28
- Songun I, Putter H, Kranenbarg E ym. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol 2010;11:439–49.
- 29
- Sasako M, Sano T, Yamamoto S ym. D2 Lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N Engl J Med 2008;359:453–62.
- 30
- Mengardo V, Weindelmayer M, Pavarana J ym. Para-aortic lymphadenectomy in surgery for gastric cancer: current indications and future perspectives. Updates Surg 2018;70:207–11.
- 31
- Boerner T, Piso P. A narrative review of intraperitoneal chemotherapy and cytoreductive surgery (CRS) for peritoneal metastases in gastric cancer. J Gastrointest Oncol 2021;12 suppl 1:S59–67.
- 32
- Kokkola A, Louhimo J, Puolakkainen P. Does non-curative gastrectomy improve survival in patients with metastatic gastric cancer? J Surg Oncol 2012;106:193–6.
- 33
- Fujitani K, Yang H-K, Mizusawa J ym. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncol 2016;17:309–18.
- 34
- Oh Y, Kim MS, Lee YT ym. Laparoscopic total gastrectomy as a valid procedure to treat gastric cancer option both in early and advanced stage: A systematic review and meta-analysis. Eur J Surg Oncol 2020;46:33–43.
- 35
- Beyer K, Baukloh AK, Kamphues C ym. Laparoscopic versus open gastrectomy for locally advanced gastric cancer: a systematic review and meta-analysis of randomized controlled studies. World J Surg Oncol 2019;17:68.
- 36
- Ajani JA, D`Amico TA, Bentrem DJ ym. NCCN Guidelines version 2.2022. Gastric cancer. 11.2.2022. www.nccn.org.
- 37
- Cunningham D, Allum WH, Stenning SP ym. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006;355:11–20.
- 38
- Al-Batran SE, Homann N, Pauligk C ym. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 2019;393:1948–57.
- 39
- Cats A, Jansen EPM, van Grieken NCT ym. Chemotherapy versus chemoradiotherapy after surgery and preoperative chemotherapy for resectable gastric cancer (CRITICS): an international, open-label, randomised phase 3 trial. Lancet Oncol 2018;19:616–28.
- 40
- Voron T, Messager M, Duhamel A ym. Is signet-ring cell carcinoma a specific entity among gastric cancers? Gastric Cancer 2016;19:1027–40.
- 41
- Van Velzen MJM, Derks S, van Grieken NCT ym. MSI as a predictive factor for treatment outcome of gastroesophageal adenocarcinoma. Cancer Treat Rev 2020;86:102024.
- 42
- Keränen I, Kylänpää L, Udd M ym. Gastric outlet obstruction in gastric cancer: a comparison of three palliative methods. J Surg Oncol 2013;108:537–41.
- 43
- Sugita H, Sakuramoto S, Mihara Y ym. Verification of the utility of palliative radiotherapy for hemostasis of gastric cancer bleeding: a case control study. J Gastrointest Cancer 2022;53:420–6.
- 44
- Nieminen A, Kokkola A, Ylä-Liedenpohja J ym. Early gastric cancer: clinical characteristics and results of surgery. Dig Surg 2009;26:378–83.
- 45
- Asplund J, Kauppila JH, Mattsson F, Lagergren J. Survival trends in gastric adenocarcinoma: a population-based study in Sweden. Ann Surg Oncol 2018;25:2693–702.
- 46
- Cardoso R, Coburn NG, Seevaratnam R ym. A systematic review of patient surveillance after curative gastrectomy for gastric cancer: a brief review. Gastric Cancer 2012;15 suppl 1:S164–S7.
- 47
- Malik S, Semrad CE. Nutritional implications in preparing patients for total gastrectomy. Curr Surg Rep 2020;8:27.
Diagnosis and treatment of gastric cancer
Gastric cancer is the fourth most common cause of cancer related deaths. However, the incidence of gastric cancer is low in western countries, which may cause delays in diagnosis of the disease. Most of the gastric cancers are diagnosed at the advanced stage. Immigrants may carry a higher risk of gastric cancer than native citizens. Gastroscopy should be performed in all patients with alarm symptoms. The most important prognostic factor is the stage of the disease at the time of diagnosis. The prognosis correlates with the severity of symptoms.
Some early cancers can be treated endoscopically. However, surgery is the most important treatment modality. Most patients are treated by distal or total gastrectomy. The long-term results of the operation are equal in open and minimally invasive surgery. Perioperative chemotherapy improves survival in patients with advanced cancers, and it is now standard of treatment in cancers invading the muscularis propria or deeper. Unfortunately, not all gastric cancers respond to chemotherapy similarly. In Finland, the overall 5-year survival of gastric cancer is 26–30%.
Arto Kokkola
Senior Lecturer, Head of Department
HUS Abdominal Center, Helsinki University Hospital