MDMA-avusteinen psykoterapia hoitoresistentin traumaperäisen stressihäiriön hoidossa
• Traumaperäinen stressihäiriö on väestössä tavallinen ja usein pitkittyvä häiriö.
• MDMA-avusteinen psykoterapia sisältää kolme valmistelevaa terapiatapaamista, kaksi tai kolme MDMA-avusteista terapiaistuntoa sekä kuusi tai yhdeksän hoitokokemusta integroivaa terapiatapaamista.
• Lupaavien alustavien tulosten perusteella Yhdysvaltojen FDA on jouduttanut etenemistä III tutkimusfaasiin.
• Arvio hoitomuodon tehosta tarkentunee jo lähiaikoina kansainvälisten monikeskustutkimusten valmistuessa.

Trauma voidaan määritellä poikkeuksellisen uhkaavaksi tai tuhoisaksi kokemukseksi, joka on ihmisen säätelykyvylle ylivoimainen (1). Se horjuttaa fysiologisesti elimistön hypotalamus-aivolisäke-lisämunuaisakselin (HPA-akselin) tasapainotilaa ja asettaa psykologisesti yksilön luottamuksen maailmaan kyseenalaiseksi (2). Ihmisen on vaikea käsitellä tapahtunutta, ja traumaa saatetaan tahattomasti kokea uudelleen painajaisina, takaumina tai tunkeutuvina ajatuksina.
Traumassa sympaattinen hermosto jää ylivirittyneeseen ja voimakkaasti reagoivaan tilaan. Kognitiiviset toiminnot häiriintyvät laajasti ja vinoutuvat uhkasignaalien havaitsemiseen. Käyttäytymisessä ja sosiaalisessa vuorovaikutuksessa korostuvat vetäytyneisyys sekä traumasta muistuttavien asioiden välttely.
Traumaperäinen stressihäiriö (post-traumatic stress disorder, PTSD) tarkoittaa tilaa, jossa yllä kuvatut oireet eivät lievity kuukauden kuluessa traumaattisesta kokemuksesta (taulukko 1).
Tyypillisiä traumaattisia kokemuksia ovat fyysinen tai seksuaalinen väkivalta, onnettomuudet, terrorismi ja sotatilat. Trauma voi olla omakohtainen tai toiselle henkilölle tapahtuvana nähty tai kuultu, mutta jollain tapaa siihen liittyy vakavan loukkaantumisen, kuoleman tai psykologisen eheyden rikkoutumisen vaara. Suomessa trauman kokee varovaisen arvion mukaan vuosittain 100 000 henkilöä. Pakolaistaustaisesta väestöstä traumaattisia tapahtumia on kokenut kaksi kolmesta.
Trauman kokeneista henkilöistä 20–30 %:n arvioidaan sairastuvan traumaperäiseen stressihäiriöön (1). Noin puolella tila kroonistuu, jolloin kyse on vakavasta mielenterveyden häiriöstä (3).
Traumaperäinen stressihäiriö heikentää yksilön elämänlaatua ja toimintakykyä monella tapaa. Se lisää verenpainetaudin, ylipainon sekä päihde-, mieliala- ja ahdistuneisuushäiriöiden riskiä (4). Toimintakykyä lamaava oirekuva johtaa myös yhteiskunnallisiin menetyksiin, sillä häiriö lisää riskiä terveyspalvelujen suurkäyttöön, työkyvyttömyyteen, yksinäisyyteen ja itsemurhaan (5,6). Maailmanlaajuisesti traumaperäisen stressihäiriön vallitsevuus on noin 4 % (2).
Traumaperäisen stressihäiriön hoitomuodot ovat psykoterapia ja lääkehoito. Virallinen käyttöaihe se on sertraliinille ja paroksetiinille. Bentsodiatsepiinien hyödyistä ei ole tutkimusnäyttöä, eikä myöskään antipsykootteja tai mielialan tasaajia suositella ensilinjan lääkehoitona. Psykoterapiassa efektikoko on keskisuuri, lääkehoidossa pienen ja keskisuuren välillä. Nykyisillä hoitomuodoilla arviolta puolet potilaista jää ilman riittävää vastetta (1,7).
Käypä hoito -suosituksessa ensisijainen hoito-muoto on traumakeskeinen psykoterapia (1). Näistä tehokkaiksi on osoitettu kognitiivinen käyttäytymisterapia, silmänliiketerapia (eye movement desensitization and reprocessing, EMDR), narratiivinen altistusterapia sekä kognitiivinen terapia (1,7,8).
Traumatyöskentelyssä keskeistä on turvallinen uudelleenaltistuminen (taulukko 2), mutta esteeksi voivat muodostua traumatisoituneen henkilön voimakas ahdistuneisuus, ali- ja ylivireystilat sekä taipumus dissosiaatioon. Viimeksi mainittu tarkoittaa psykologisen eheyden häiriintymistä tavalla, jossa ajatukset, tunteet, kehontuntemukset, muistot ja minäkokemus eivät muodosta johdonmukaisesti jatkuvaa kokonaisuutta (9). Arviolta 30 %:lla traumaperäisestä stressihäiriöstä kärsivistä potilaista psykoterapia jää kesken (8).
MDMA:n farmakologia
3,4-metyleenidioksimetamfetamiini (MDMA) on lääketehdas Merckin vuonna 1912 syntetisoima fenetyyliamiini. Keskushermostossa MDMA sitoutuu monoamiinien kuljettajaproteiineihin lisäten serotoniinin, dopamiinin ja noradrenaliinin määrää synapsiraossa (11). Vaikutus on vahvin serotonergisesti ja perustuu hermoston välittäjäaineiden takaisinoton estoon, lisääntyneeseen vapautumiseen ja vaikutusajan pidentymiseen (12,13). MDMA:n ajallinen vaikutus on itsestään rajoittuva, koska sen farmakokinetiikka ei noudata lineaarista mallia (14).
MDMA:n laaja serotonerginen, dopami-nerginen ja noradrenerginen vaikutus keskushermostossa lisää epäsuorasti useiden neurohormonien pitoisuutta. Näistä keskeiset ovat oksitosiini, vasopressiini, kortisoli ja prolaktiini (13,14). Näiden vapautuminen sentraalisesti ja perifeerisesti mahdollistaa hoidossa farmakologisesti syynmukaisen lähestymistavan eli häiriintyneen HPA-akselin säätelytoiminnan palauttamisen (8).
MDMA:n fysiologisista ja psykologisista vaikutuksista koe-eläimissä sekä ihmisissä on yli puolen vuosisadan aikana kertynyt runsaasti tutkimustietoa. Koe-eläintutkimusten perusteella tappavan annoksen mediaaniksi (LD50) on arvioitu 10–20 mg/kg (15). Kliinisissä tutkimuksissa ihmisillä käytetty annos on välillä 1–2 mg/kg, kerta-annoksen ollessa korkeintaan 125 mg (16). Suun kautta annosteltuna MDMA:n vaikutus alkaa 30–60 minuutissa ja kestää 3–6 tuntia (11,16). Vaikutusaikaa voidaan pidentää 5–8 tuntiin, jos annos toistetaan puolitettuna 1,5–2 tuntia ensimmäisen annoksen jälkeen (17). MDMA:n puoliintumisaika on 7–9 tuntia (14,15).
MDMA:n vaikutukset ja niiden hyödyntäminen traumaterapiassa
Lumekontrolloitujen tutkimusten mukaan MDMA kohottaa koehenkilöiden mielialaa, vireystilaa ja sosiaalisuutta (18). Muista stimulanteista poiketen MDMA lisää ihmisten välistä avoimuutta, luottamusta ja läheisyyttä. Kuvantamistutkimuksissa on todettu, että MDMA vaimentaa mantelitumakkeen toimintaa (19). Koehenkilöiden reaktiivisuus uhkasignaaleihin vähenee, mikä helpottaa työskentelyä pelottavien tai ahdistavien traumamuistojen kanssa (8,20). MDMA:n vaikutuksesta koehenkilöt kokivat suosikkimuistojensa olevan eloisampia ja tunnepitoisempia. Vastaavasti huonoimmat muistot arvioitiin vähemmän negatiivisiksi (21).
Traumaterapian viitekehyksessä MDMA:n oletetaan vaimentavan potilaan pelkoreaktioita, stimuloivan kognitiivisia toimintoja sekä tukevan sosiaalista kanssakäymistä (8,20,22,23). Tämän ohella terapiaan vaikuttavat olennaisesti potilaan odotukset ja hoitoympäristö (10,22).
Onnistunut istunto perustuu terapeuttien taitoon tukea sellaisia olosuhteita, jotka mahdollistavat traumaattisten kokemusten turvallista uudelleenkohtaamista. Tämä edellyttää, että terapeutit valmistelevat potilasta kolmella 90 minuutin tapaamisella ennen ensimmäistä MDMA-istuntoa ja tarjoavat asianmukaista tukea noin 6–8 tuntia kestävän istunnon aikana. Tämän jälkeen potilas saa käsitellä kokemustaan kolmessa 90 minuutin integroivassa terapiatapaamisessa, jotta MDMA-istunnon mahdollisesti tuottamat uudet näkökulmat siirtyvät onnistuneesti osaksi potilaan elämää.
Kaikkia istuntoja hallinnoi terapeuttipari, tavallisesti mies ja nainen. Terapiahuone luodaan viihtyisäksi ja kodinomaiseksi sohvilla, tauluilla ja muulla sisustuksella. Istunnon aikana terapeuttien tehtäväksi muodostuu potilaan kannustaminen ja tukeminen oman sisäisen prosessinsa läpikäymiseen, liiallista ohjaamista välttäen. Usein traumakokemus nousee esiin spontaanisti, mutta tarvittaessa potilasta muistutetaan siitä.
Olennaista on potilaan “vanhemmointi", johon kuuluu esimerkiksi nesteytyksestä, mukavuudesta sekä fyysisestä ja psyykkisestä turvallisuudesta huolehtiminen. MDMA-istunnoissa potilas käyttää usein silmälappuja ja kuuntelee kuulokkeista soitettua musiikkia. Näillä rohkaistaan potilasta luottamaan hoitoprosessiin sekä omien ajatusten, tunteiden ja kehollisten tuntemustensa havainnointiin ja hyväksyntään (10).
Turvallisuus, haittavaikutukset ja vasta-aiheet
Ekstaasi on nimitys katukauppavalmisteelle, jonka oletetaan sisältävän MDMA:ta. Epävarmuus sen todellisesta sisällöstä tai pitoisuudesta sekä toksisten epäpuhtauksien mahdollisuus muodostavat terveysriskin. Viihdekäytössä muiden päihteiden samanaikainen käyttö sekä nesteytyksen ja levon laiminlyönti lisäävät todennäköisyyttä ekstaasin vakaville haittavaikutuksille, kuten akuutille myrkytystilalle, kouristuksille tai psykoosille.
Myös MDMA itsessään saattaa lisätä aivojen oksidatiivista stressiä ja altistaa siten neurologisille pitkäaikaishaitoille. Viime vuosina EU-maissa tavattujen ekstaasitablettien MDMA-pitoisuus on vaihdellut välillä 0–340 mg ollen keskimäärin yli 140 mg. Lisäksi ekstaasia on saatettu jatkaa esimerkiksi muuntohuumeilla, metamfetamiinilla tai kipulääkkeillä (15,22,24,25).
Kontrolloiduissa tutkimusolosuhteissa farmakologisesti puhtaalla MDMA:lla ei ole esiintynyt vakavia tai pysyviä psyykkisiä haittavaikutuksia käytetyillä kerta-annoksilla (≤ 125 mg). Ilmenneet fyysiset haittavaikutukset ovat olleet enimmäkseen lieviä, itsestään ohimeneviä sekä hyvin ennustettavissa. MDMA:lla on sympatomimeettinen, sykettä ja verenpainetta nostava vaikutus, joka vastaa keskiraskaan fyysisen harjoituksen jälkeistä tilaa. Lisäksi MDMA on lievä immunosupressantti. MDMA-avusteisen psykoterapian suurimmat riskit ovat näin ollen todennäköisesti kardiovaskulaarisia (20,26,27).
Tyypillisiä ohimeneviä fyysisiä haittoja ovat leukalukko, päänsärky, ruokahaluttomuus, lievä ruumiinlämmön nousu, väsymys, huimaus ja pahoinvointi. Tyypillisiä ohimeneviä psyykkisiä haittoja ovat ahdistus, alavireinen mieliala, unettomuus, ärtyneisyys sekä paniikkikohtaukset. MDMA-avusteisen psykoterapian ei ole todettu altistavan kognitiivisen tason heikentymiselle tai lisäävän laittomien päihteiden käyttöä (26,28,29,30).
Haitallisten vaikutusten minimoimiseksi vasta-aiheina MDMA-tutkimuksiin osallistumiselle on pidetty kaksisuuntaista mielialahäiriötä, jossa esiintyy maniajaksoja, aikaisempaa tai ajankohtaista psykoottista häiriötä, syömishäiriötä, jossa esiintyy tyhjentämiskäyttäytymistä, aktiivista päihdehäiriötä sekä tutkimusprotokollaan sitoutumista vaikeuttavaa epävakaata persoonallisuushäiriötä. Itsetuhoiset ajatukset ovat traumaperäisestä stressihäiriöstä kärsivillä yleisiä, eivätkä ne ole muodostaneet vasta-aihetta osallistumiselle, ellei ajankohtaista itsemurhariskiä arvioitu suureksi. Muita poissulkukriteerejä ovat olleet raskaus, imetys, alle 48 kg:n kehonpaino, vakavat sydän- ja verenkiertoelimistön sairaudet, vaikea-asteinen maksan tai munuaisten vajaatoiminta sekä kohonnut kouristusriski (28).
Lainsäädäntö ja MDMA-tutkimuksen tausta
Historiallisesta näkökulmasta idea farmakologisesti avustetusta psykoterapiasta ei ole uusi (31). Psykiatrit ja psykoterapeutit käyttivät MDMA:ta terapian täydennyshoitona Sveitsissä ja Yhdysvalloissa 1970-luvun alusta aina vuoteen 1985 saakka, jolloin MDMA:n tieteellinen tutkimus pysähtyi: Ekstaasin lisääntynyt viihdekäyttö sai Yhdysvaltain huumepoliisin DEA:n asettamaan MDMA:n tiukimmin rajoitettuun luokkaan, johon kuuluvilla molekyyleillä katsottiin olevan suuri väärinkäyttöriski, muttei hyväksyttävää lääketieteellistä käyttöä (22). YK:n huumausaineita koskevan yleissopimuksen perusteella viihdekäyttö on Suomessakin kielletty, mutta tutkimus on mahdollista Fimean luvalla (32). MDMA-terapiaa ei ole saatavilla Suomessa.
Vuonna 1986 perustettu The Multidisciplinary Association for Psychedelic Studies (MAPS) on voittoa tavoittelematon tutkimus- ja koulutusorganisaatio, jonka tarkoituksena on edistää psykedeeliavusteisten terapiamuotojen kliinistä tutkimusta (33). Psykedeeleillä tarkoitetaan serotoniinin kaltaisia molekyylejä, jotka tuottavat keskushermoston kautta ihmisen arkitietoisuudesta poikkeavan tajunnantilan (31,34). Tutkimusta kohdistetaan erityisesti sellaisiin mielenterveys- ja päihdehäiriöihin, joissa nykyiset hoitomuodot jäävät vasteeltaan riittämättömiksi (23,31).
Alan kehitystä seuratessa on tärkeää ymmärtää, että nykyaikainen psykedeelitutkimus koskee kokonaista hoitoprotokollaa, jonka keskiössä on psykoterapeuttinen työskentely (35). Farmakologisella tehosteella, kuten MDMA:lla, LSD:llä tai psilosybiinillä, mahdollistetaan toipumista jouduttavat olosuhteet 1–3 terapiaistunnon ajaksi. Hoitoprosessissa potilas kokee ajallisesti rajatun poikkeavan tajunnantilan, joka tarjoaa mahdollisuuden muutokseen. Nämä "terapeuttiset ikkunat" käytetään psykologiseen työskentelyyn ammattilaisen tukemana, turvallisessa ja tätä varten suunnitellussa terapiaympäristössä (10,22,31,35).
Tutkimusnäyttö MDMA-avusteisesta psykoterapiasta
MAPS:n kehittämää MDMA-avusteista psykoterapiaa on tutkittu vuosina 2004–2017 yhteensä kuudessa II faasin kaksoissokkoutetussa ja lumekontrolloidussa tutkimuksessa (n = 103) (28,36). Koehenkilöt olivat sairastaneet erittäin vaikea-asteista PTSD:tä keskimäärin 17,8 vuotta (liitetaulukko 1). Tutkimuksissa hoitoresistentiksi määriteltiin puoli vuotta kestänyt oireilu, joka aiemmasta psykoterapiasta tai lääkehoidosta huolimatta oli kliinisen arvion perusteella edelleen vähintään keskivaikea-asteista (28) (taulukko 3).
Potilaan näkökulmasta tutkimus koostui kolmesta valmistavasta käynnistä, joissa käytiin terapeuttien kanssa läpi hoidon tavoitteet, MDMA-terapian erityispiirteet sekä potilaan odotukset ja huolenaiheet. Tämän jälkeen potilas osallistui sokkoutettuun terapiaistuntoon saaden joko aktiivisen MDMA-annoksen (75–125 mg) tai lumevalmistetta (0–40 mg). Puolentoista tunnin jälkeen potilaalla oli mahdollisuus lisäannokseen, jonka suuruus oli puolet aloitusannoksesta.
MDMA-istunnon kesto oli noin 8 tuntia, minkä jälkeen potilas jäi yöksi sairaalaan seurantaan. Ensimmäinen kolmesta 90 minuutin integroivasta terapiatapaamisesta oli seuraavana aamuna. Tutkimuksesta riippuen potilas osallistui 2–3 MDMA-istuntoon ja vastaavasti 6–9 integroivaan istuntoon. Crossover-protokollan vuoksi sokkoutus purettiin kolmannella istunnolla, jolloin myös verrokkiryhmän potilaille tarjottiin mahdollisuus aktiiviseen annokseen (28).
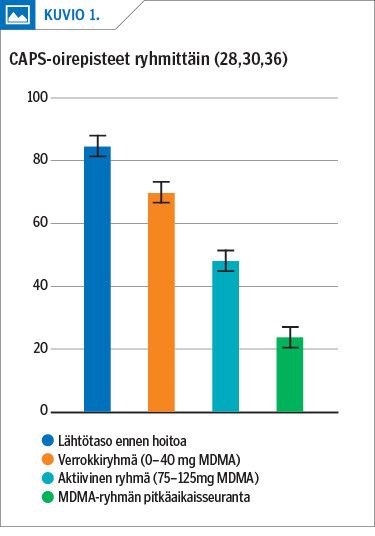
Päätemuuttujana käytettiin ulkopuolisten arvioitsijoiden toteuttamaa CAPS-IV-haastattelua (Clinician-Administered PTSD Scale for DSM-IV). Tutkimuksista tehdyn yhteenvetoanalyysin perusteella traumaperäisen stressihäiriön oireet vähenivät kahden kuukauden seurantapisteessä verrokkiryhmään verrattuna tilastollisesti merkitsevästi (p < 0,001) (28,36). Aktiivisessa ryhmässä CAPS-pisteet vähenivät keskimäärin 37,8 ja remission saavutti 54,2 % potilaista (39/72). Verrokkiryhmässä CAPS-pisteet vähenivät keskimäärin 11,6 ja remission saavutti 22,6 % potilaista (7/31).
Intervention keskeytysprosentti oli pieni (7,6 %) ja ryhmien välinen efektikoko suuri (Cohenin d = 0,8) (28,36). Vuoden seurantapisteessä tutkimusten yleinen remissioprosentti oli 66,2 % (8). Saavutettujen hyötyjen osoitettiin säilyneen ensimmäisen pilottitutkimuksen pitkäaikaisseurannassa (n = 16, seuranta-aika 3,8 v) (30) (kuvio 1).
Tulosten tulkinnassa on huomioitava tutkimusten analysointi yhtenä poolina, etnisen taustan yksipuolisuus pääasiassa kaukasialaisessa tutkimuspopulaatiossa, tutkijaryhmien vähäinen määrä sekä sokkouttamisen vaikeus interventiossa, jossa aktiivinen annos on psykoaktiivinen. Tämän vuoksi verrokkiryhmästä suurin osa (21/31) sai lievästi psykoaktiivisen annoksen (25–40 mg) ja päätemuuttujan arviointi toteutettiin sokkoutetuilla ulkopuolisilla arvioitsijoilla, jotka eivät osallistuneet terapiaistuntoihin.
Analyysissä erisuuruiset annokset yhdistettiin kahdeksi ryhmäksi, mutta crossover-protokollan vuoksi ryhmien vertailu ei enää kolmannen MDMA-istunnon jälkeen ollut mahdollista. Ilmenneet rajoitteet on huomioitu Israelissa, Kanadassa ja Yhdysvalloissa jo käynnistetyissä III faasin tutkimuksissa (28,36,38).
Kliiniset tutkimukset antavat viitteitä siitä, että hoitoresistentti PTSD voidaan saattaa remissioon kahdella tai kolmella MDMA-avusteisella psykoterapiaistunnolla sekä protokollaan kuuluvilla lääkkeettömillä terapiatapaamisilla riippumatta trauman aiheuttaneen tapahtuman luonteesta (28,36). Lupaavien tulosten vuoksi Yhdysvaltojen elintarvike- ja lääkevirasto FDA on antanut MDMA-avusteiselle psykoterapialle breakthrough therapy -luokituksen hoitoresistentin traumaperäisen stressihäiriön hoidossa (36). Luokitus voidaan myöntää potentiaalisille hoitomuodoille markkinalupaan vaadittavan tutkimustyön ja lupakäsittelyn nopeuttamiseksi. Laajemmat monikeskustutkimukset toteutetaan Euroopassa ja Yhdysvalloissa vuosien 2020–2021 aikana (36,38).
Laillistetuille psykoterapeuteille suunnattua MDMA-täydennyskoulutusta on saatavilla vain protokollan kehittäneen MAPS:n kautta. Koulutuksessa painotetaan kehollisen työskentelyn merkitystä sekä kehon ja mielen välisen yhteyden huomioimista. Tämän lisäksi vahvistetaan psykoterapian yleisiä vaikuttavia tekijöitä, joita ovat terapeutin ominaisuudet (autenttisuus, empaattisuus ja tuomitsemattomuus), terapiasuhteen laatu (turvallinen, lämmin ja luottamuksellinen) sekä terapeuttinen yhteistyösuhde (allianssi, yhteisymmärrys keinoista ja tavoitteista). Erityisesti terapeuteilta edellytetään kykyä empaattiseen ja sensitiiviseen läsnäoloon potilaan kanssa, joka voi kokea muuntuneita tajunnantiloja ja käydä läpi intensiivisiä trauma-kokemuksia. Mikäli interventio saa FDA:n ja EMA:n markkinaluvat, voi hoidon rajoitteeksi muodostua pätevien MDMA-terapeuttien saatavuus (8,10).
Lopuksi
Tuoreen meta-analyysin mukaan MDMA-avusteinen psykoterapia vaikuttaa mahdollisesti turvalliselta ja tehokkaalta hoitomuodolta pitkittyneen ja muuhun hoitoon reagoimattoman traumaperäisen stressihäiriön hoidossa (38). Muita satunnaistetuissa kontrolloiduissa tutkimusasetelmissa tutkittavia käyttöaiheita psykedeeliavusteisille terapiamuodoille ovat masennus, pakko-oireinen häiriö, päihdehäiriöt, syömishäiriöt, autismikirjon häiriöön liittyvä sosiaalinen ahdistus, lähestyvään kuolemaan liittyvä eksistentiaalinen ahdistus, migreenit ja sarjoittainen päänsärky (23,38,39). Toistaiseksi hoitomuotoja ei ole saatavilla Suomessa.
Maailmanlaajuisesti mielenterveys- ja päihdehäiriöt ovat sairauden vuoksi menetetyn toimintakyvyn yleisin syy. Vuoden 2010 aikana menetettiin näihin liittyen yhteensä 175,3 miljoonaa toimintakykyistä vuotta. WHO:n arvion mukaan näistä 75 % johtui masennuksesta, ahdistuksesta ja päihdehäiriöistä (40).
Traumaattiset kokemukset ovat väestössä tavallisia ja lisäävät toimintakyvyn pitkäaikaisen heikkenemisen riskiä (1,2,3,4,5). Uusien hoitomuotojen tutkiminen on eettisesti ja taloudellisesti perusteltua, jos niillä voidaan lievittää nykyistä tautitaakkaa. Mikäli MDMA-avusteinen psykoterapia osoittautuu tehokkaaksi ja turvalliseksi myös laajemmissa kliinisissä tutkimuksissa, saattaa se muotoutua osaksi pitkittyneen traumaperäisen stressihäiriön hoitoa 2020-luvun aikana (8,20,23,38).
Kiitämme artikkelin kommentoinnista psykiatrian professori, LT, ylilääkäri Jyrki Korkeilaa (Turun yliopisto ja Satakunnan sairaanhoitopiiri).
Kirjoittajilla ei ole sidonnaisuuksia.
- 1
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Psykiatriyhdistys ry:n asettama työryhmä. Traumaperäinen stressihäiriö. Käypä hoito -suositus 9.1.2020. www.kaypahoito.fi
- 2
- Koenen KC, Ratanatharathorn A, Ng L ym. Posttraumatic stress disorder in the World Mental Health Surveys. Psychol Med 2017;47:2260–74.
- 3
- Morina N, Wicherts JM, Lobbrecht J, Priebe S. Remission from post-traumatic stress disorder in adults: a systematic review and meta-analysis of long term outcome studies. Clin Psychol Rev 2014;34:249–55.
- 4
- Dorrington S, Zavos H, Ball H ym. Trauma, post-traumatic stress disorder and psychiatric disorders in a middle-income setting: prevalence and comorbidity. Br J Psychiatry 2014;205:383–9.
- 5
- Kessler RC, Aguilar-Gaxiola S, Alonso J ym. Trauma and PTSD in the WHO World Mental Health surveys. Eur J Psychotraumatol 2017;8(suppl 5):1353383.
- 6
- Tarrier N, Gregg L. Suicide risk in civilian PTSD patients. Soc Psychiatry Psychiatr Epidemiol 2004;39:655–61.
- 7
- Lee DJ, Schnitzlein CW, Wolf JP, Vythilingam M, Rasmusson AM, Hoge CW. Psychotherapy versus pharmacotherapy for posttraumatic stress disorder: systemic review and meta-analyses to determine first-line treatments. Depress Anxiety 2016;33:792–806.
- 8
- Thal SB, Lommen MJJ. Current perspective on MDMA-assisted psychotherapy for posttraumatic stress disorder. J Contemp Psychother 2018;48:99–108.
- 9
- Bailey TD, Brand BL. Traumatic dissociation: theory, research, and treatment. Clin Psychol Sci Pract 2017;24:170–85.
- 10
- Mithoefer MD, Michael C. A manual for MDMA-assisted psychotherapy in the treatment of posttraumatic stress disorder (päivitetty 22.5.2017). maps.org/research/mdma/mdma-research-timeline/4887-a-manual-~for-mdma-assisted-psychotherapy-in-the-treatment-of-ptsd
- 11
- de la Torre R, Farré M, Roset PN ym. Pharmacology of MDMA in humans. Ann N Y Acad Sci 2000;914:225–37.
- 12
- Verrico C, Miller G, Madras B. MDMA (ecstasy) and human dopamine, norepinephrine, and serotonin transporters: implications for MDMA-induced neurotoxicity and treatment. Psychopharmacol 2007;189:489–503.
- 13
- Schenk S, Abraham B, Aronsen D, Colussi-Mas J, Do J. Effects of repeated exposure to MDMA on 5HT1a autoreceptor function: behavioral and neurochemical responses to 8-OHDPAT. Psychopharmacol 2013;227:355–61.
- 14
- de la Torre R, Farré M, Ortuño J ym. Non-linear pharmacokinetics of MDMA (ecstasy) in humans. Br J Clin Pharmacol 2000;49:104–9.
- 15
- Shulgin AT. The background and chemistry of MDMA. J Psychoactive Drugs 1986;18:291–304.
- 16
- Kolbrich EA, Goodwin RS, Gorelick DA, Hayes RJ, Stein EA, Huestis MA. Physiological and subjective responses to controlled oral 3,4-methylenedioxymethamphetamine administration. J Clini Psychopharmacol 2008;28:432–40.
- 17
- Peiró A, Farré M, Roset PN ym. Human pharmacology of 3,4-methylenedioxymethamphetamine (MDMA, ecstasy) after repeated doses taken 2 h apart. Psychopharmacol 2013;225:883–93.
- 18
- Bershad AK, Miller MA, Baggott MJ, de Wit H. The effects of MDMA on socio-emotional processing: Does MDMA differ from other stimulants? J Psychopharmacol 2016;30:1248–58.
- 19
- Gamma A, Buck A, Berthold T, Liechti ME, Vollenweider FX, Hell D. 3,4-methylenedioxymethamphetamine (MDMA) modulates cortical and limbic brain activity as measured by [H215O]-PET in healthy humans. Neuropsychopharmacol 2000;23:388–95.
- 20
- Sessa B, Higbed L, Nutt D. A review of 3,4-methylenedioxymethamphetamine (MDMA)-assisted psychotherapy. Front Psychiatry 2019;10:138.
- 21
- Carhart-Harris RL, Wall MB, Erritzoe D ym. The effect of acutely administered MDMA on subjective and BOLD-fMRI responses to favourite and worst autobiographical memories. Int J Neuropsychopharmcol 2014;17:527–40.
- 22
- Metzner R, Adamson S. Using MDMA in healing, psychotherapy, and spiritual practice. Kirjassa: Holland J, toim. Ecstasy: the complete guide. A comprehensive look at the risks and benefits of MDMA. Rochester: Park Street Press 2001;182–207.
- 23
- Reiff CM, Richman EE, Nemeroff CB ym. Psychedelics and psychedelic-assisted psychotherapy. Am J Psychiatry 2020;177:391–410.
- 24
- Recent changes in Europe’s MDMA/ecstasy market: results from an EMCDDA trendspotter study. Luxembourg: Publications Office of the European Union 2016. bookshop.europa.eu/uri?target=EUB:NOTICE:TD0116348:EN:HTML
- 25
- Schenk S, Newcombe D. Methylenedioxymethamphetamine (MDMA) in psychiatry: pros, cons, and suggestions. J Clin Psychopharmacol 2018;38:632–8.
- 26
- Vizeli P, Liechti ME. Safety pharmacology of acute MDMA administration in healthy subjects. Psychopharmacol 2017;31:576–88.
- 27
- Doblin R, Greer G, Holland J, Jerome L, Mithoefer MC, Sessa B. A reconsideration and response to Parrott AC (2013) ”Human psychobiology of MDMA or ’ecstasy’: an overview of 25 years of empirical research”. Hum Psychopharmacol 2014;29:105–8.
- 28
- Mithoefer MC, Feduccia AA, Jerome L ym. MDMA-assisted psychotherapy for treatment of PTSD: study design and rationale for phase 3 trials based on pooled analysis of six phase 2 randomized controlled trials. Psychopharmacology 2019;236:2735–45.
- 29
- Liechti ME. Effects of MDMA on body temperature in humans. Temperature 2014;1:192–200.
- 30
- Mithoefer MC, Wagner MT, Mithoefer AT ym. Durability of improvement in post-traumatic stress disorder symptoms and absence of harmful effects or drug dependency after 3,4-methylenedioxymethamphetamine-assisted psychotherapy: a prospective long-term follow-up study. J Psychopharmacol 2013;27:28–39.
- 31
- Rucker JJH, Iliff J, Nutt DJ. Psychiatry & the psychedelic drugs. Past, present & future. Neuropharmacol 2018;142:200–18.
- 32
- Valtioneuvoston asetus huumausaineiden valvonnasta 28.8.2008/548. www.finlex.fi/fi/laki/ajantasa/2008/20080548
- 33
- Emerson A, Ponté L, Jerome L, Doblin R. History and future of the Multidisciplinary Association for Psychedelic Studies (MAPS). J Psychoactive Drugs 2014;46:27–36.
- 34
- Hynninen E, Moliner R, Ekelund J, Korpi ER, Elsilä L. Psykedeelien kliiniset mahdollisuudet ja biologiset mekanismit. Duodecim 2020;136:1531–9.
- 35
- Garcia-Romeu A, Richards WA. Current perspectives on psychedelic therapy: use of serotonergic hallucinogens in clinical interventions. Int Rev Psychiatry 2018;30:291–316.
- 36
- Feduccia AA, Jerome L, Yazar-Klosinski B, Emerson A, Mithoefer MC, Doblin R. Breakthrough for trauma treatment: safety and efficacy of MDMA-assisted psychotherapy compared to paroxetine and sertraline. Front Psychiatry 2019;10:650.
- 37
- Sippel LM, Holtzheimer PE, Friedman MJ, Schnurr PP. Defining treatment-resistant posttraumatic stress disorder: a framework for future research. Biol Psychiatry 2018;84:e37–41.
- 38
- Bahji A, Forsyth A, Groll D, Hawken ER. Efficacy of 3,4-methylenedioxymethamphetamine (MDMA)-assisted psychotherapy for posttraumatic stress disorder: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry 2020;96:109735.
- 39
- Meikle SE, Liknaitzky P, Rossell SL ym. Psilocybin-assisted therapy for depression: how do we advance the field? A NZ J Psychiatry 2020;54:225–31.
- 40
- Whiteford HA, Degenhardt L, Rehm J ym. Global burden of disease attributable to mental and substance use disorders: findings from the Global Burden of Disease Study 2010. Lancet 2013;382:1575–86.
MDMA-assisted psychotherapy for treatment-resistant post-traumatic stress disorder
The most severe consequence of a traumatic experience is post-traumatic stress disorder, a common and often prolonged condition. Current treatments usually provide a reasonable response in mild and moderate cases. Studies in the United States used MDMA-assisted psychotherapy to treat severe and treatment-resistant cases with a median duration of 17.8 years. The treatment protocol included three preparatory therapy sessions, two MDMA treatment sessions and a total of six integrative psychotherapy sessions.
Data was pooled across six double-blind, placebo-controlled phase 2 studies (n = 103). The active group (n = 72) received a dose of 75–125 mg MDMA and the control group (n = 31) a dose of 0–40 mg MDMA. The primary outcome was assessed with the Clinician-Administered PTSD Scale for DSM-IV (CAPS-IV). Independent raters administered the CAPS-IV at baseline, 3–8 weeks after two blinded sessions and at the one-year follow-up..
The active dose group was statistically superior to the control group (p < 0.001). The average drop in CAPS-IV scores was 37.8 for the active group and 11.6 for the control group. The between-group effect size was large (Cohen’s d = 0.8). At one-year follow-up, the overall remission rate was 66.2%. Unlike “ecstasy”, the street drug with unknown content and quantities, the pharmacologically pure MDMA is safe and no permanent or serious adverse effects were identified with the doses used in a clinical setting (≤ 125 mg).
Due to the promising results, the FDA (Food and Drug Administration) has granted the treatment Breakthrough Therapy status. The next research step includes extensive multi-centre studies across Europe and the United States. Marketing approval of MDMA-assisted psychotherapy is anticipated if the safety and efficacy of the treatment is confirmed in phase 3 studies.