Nikotiinin vaikutus sikiön kasvuun ja kehitykseen
Ihmissikiö voi altistua nikotiinille äidin raskaudenaikaisen tupakoinnin tai muiden nikotiinia sisältävien tuotteiden käytön kautta.
Nikotiini on myrkyllinen ja tärkein riippuvuutta aiheuttava aine tupakansavussa.
Koe-eläimillä altistuminen nikotiinille ennen syntymää haittaa monien tärkeiden elinten, varsinkin keskushermoston ja keuhkojen, kehittymistä.
Tieto nikotiinin sikiötoksisuudesta myös ihmisillä on lisääntymässä.
Sikiöhaittojen taustalla on muun muassa epigeneettisiä muutoksia, jotka voivat periytyä sukupolvelta toiselle.

Nikotiinin käyttö eri muodoissaan (tupakointi, nuuska, sähkösavukkeet, nikotiinipussit, nikotiinikorvaustuotteet) on hyvin yleistä. Tupakointi raskauden aikana vähenee (noin 15 % vuonna 2016 ja noin 8 % vuonna 2020) (1), mutta ei ole selkeää käsitystä siitä, kuinka paljon tupakointia korvataan muilla nikotiinituotteilla.
Elleivät muut keinot tehoa tupakoinnin lopettamiseksi raskauden aikana, suositellaan edelleen nikotiinikorvaustuotteita (1). Äidin raskausajan tupakoinnilla on todettu runsaasti sikiöhaittoja, mukaan lukien suurempi riski keskenmenoon. Myös kätkytkuolema ja monet lapsen terveyteen kohdistuvat pitkäaikaishaitat lisääntyvät (2,3,4) (liitetaulukko 1).
Äidin tupakoidessa sekä äiti että kehittyvä sikiö altistuvat nikotiinille ja tuhansille muille tupakan haitta-aineille (5). Pelkän nikotiinin haitallisista sikiövaikutuksista eläimillä on selvää näyttöä, mutta ihmisistä on toistaiseksi riittämättömästi epidemiologisia tutkimuksia (6,7,8). Tämä on luonnollista, koska puhtaat nikotiinituotteet ovat uusia verrattuna tupakkaan. Harvoissa julkaistuissa epidemiologisissa tutkimuksissa on kuitenkin havaittu huolestuttavia viitteitä nikotiinin vaikutuksista myös ihmissikiöön (taulukko 1). Myöskään nikotiinikorvaustuotteiden raskaudenaikaiseen käyttöön liittyviä mahdollisia sikiövaikutuksia ei ole voitu tutkia riittävästi, koska käyttöä ei ole tilastoitu systemaattisesti (1).
Kemiallisten haittojen estämiseksi tehtävässä riskinarvioinnissa eläinkokeet ovat edelleen tärkeä työkalu. Niiden avulla arvioidaan monimutkaisia koko elimistöön kohdistuvia haittoja, kuten sikiöhaitat. Sikiön eri elinten kehitys on hyvin samankaltaista eri eläinlajeilla. Esimerkiksi aivojen (9) ja keuhkojen (10) kehitys on hämmästyttävän samanlaista jyrsijöillä ja ihmisillä.
On huomattava, että sikiövaikutukset ja vaikutukset täysikasvuisilla yksilöillä voivat olla jopa päinvastaisia. Syynä on se, että kehittyvä elimistö käy läpi mullistavan prosessin suhteellisen lyhyessä ajassa, mutta täysikasvuisen yksilön elimistössä suurin osa kehitykseen liittyvistä tapahtumista ja mekanismeista on kokonaan hiljentyneenä tai erilaisessa roolissa normaalissa fysiologiassa.
Tässä katsauksessa tarkastellaan pääasiassa eläinkokeiden tuottaman tiedon valossa nikotiinin mahdollisia vaikutuksia ja vaikutusmekanismeja sikiön kehityksessä. Ihmistutkimuksiin viitataan niiltä osin kuin niitä on saatavilla.
Nikotiinin vaikutusmekanismit
Nikotiini vaikuttaa pääasiassa nikotiinisten asetyylikoliini- eli nikotiinireseptoreiden (nAChR) välityksellä. Nimi pohjautuu Langleyn 1900-luvun alkuvuosina tekemiin havaintoihin nikotiinin stimuloivasta vaikutuksesta sileään lihakseen ja autonomisen hermoston ganglioihin (hermosolmuihin) (11). Asetyylikoliinin luonnollisena välittäjäaineena näissä reseptoreissa julkaisi Henry Dale 1930-luvulla.
Myös nikotiinin metaboliitit (NNN eli N-nitrosonornikotiini, NNK eli metyylinitrosamino-pyridyyli-butanoni, joita muodostuu tupakkakasvissa, mutta vähän jos ollenkaan ihmiskudoksissa) ja kotiniini (tärkein aineenvaihduntatuote ihmisillä) sitoutuvat nikotiinireseptoreihin (12). Nitrosamiinit, mukaan lukien NNK ja NNN, ovat syöpää aiheuttavia eli karsinogeenejä. Ne ovat perimämyrkyllisiä ja voivat nikotiinireseptoreihin sitoutumisen kautta lisätä karsinogeneesiä edistävää solujen lukumäärän kasvua (proliferaatiota) (13).
Nikotiinireseptorit muodostuvat viidestä alayksiköstä, joita on erilaisia. Reseptorit voivat olla joko homoreseptoreita (kaikki alayksiköt samanlaisia) tai heteroreseptoreita (muodostuneet useista erilaisista alayksiköistä). Eri kudosten reseptorityypit vaihtelevat. Sekä reseptorien tyyppi että niiden määrä ovat tärkeitä vaikutusten kannalta. Useat reseptorityypit ovat tekemisissä nikotiiniriippuvuuden kanssa (11). Krooninen nikotiinialtistus muuttaa aivoissa nikotiinireseptorien määrää ja laatua, mikä lisää nikotiiniherkkyyttä.
Normaalisti nikotiinireseptoreihin sitoutuu asetyylikoliini, keskushermoston ja autonomisen hermoston tärkeä välittäjäaine, jota hajottavat koliiniesteraasientsyymit eivät tehoa nikotiiniin (14). Nikotiinireseptoreita on eläimillä ja ihmisillä sekä hermostossa että laajalti hermoston ulkopuolella, muun muassa keuhkoputken epiteelissä ja verisuonten endoteelissa. Nikotiinireseptoreita on paitsi solukalvolla, myös mitokondrioissa, joiden tehtäviä ovat solun energiatuotannon ylläpitäminen ja ohjelmoidun solukuoleman (apoptoosin) säätely.
Sekä ihmissikiössä että koe-eläinten sikiöissä nikotiinireseptoreita löytyy jo raskauden ensimmäisen kolmanneksen aikana, jopa sikiöaikaisista kantasoluista (15). Nikotiinireseptorit ja niitä säätelevät tekijät osallistuvat sikiön kehityksen säätelyyn, muun muassa aivojen ja keuhkojen kehitykseen (3,4,15).
Nikotiinilla on todennäköisesti muitakin vaikutusmekanismeja. Sikiökehityksen kannalta epigeneettiset muutokset näyttävät tärkeiltä. Epigeneettisiä muutoksia, jotka valitettavasti voivat periytyä seuraaville sukupolville, pidetään kehitysalkuisten sairauksien yhtenä todennäköisenä mekanismina (16).
Kantavien rottien käsittely nikotiinilla aiheuttaa poikasilla metylaation ja histonideasetylaasientsyymin aktiivisuuden muutoksia muun muassa keuhkoissa ja sukupuolirauhasissa (4). Solutasolla nikotiini aiheuttaa kehittyvässä elimistössä oksidatiivista ja solulimakalvoston (endoplasminen retikulumi, ER) stressiä sekä inflammaatiota (17).
Aikuisessa elimistössä nikotiini saattaa jopa hillitä tulehdusta. Tämä onkin yksi esimerkki eroista sikiön ja aikuisen välillä. Lisääntynyt oksidatiivinen stressi eli ylimäärä happiradikaaleja huonontaa istukan kehitystä ja toimintaa ja on haitallista sikiön kehitykselle, muun muassa lisääntymisterveydelle (17).
ER-stressi, jossa proteiinien laskostuminen on häiriintynyt, johtaa pitkittyessään solujen kuolemaan. Eläimillä on osoitettu nikotiinin aiheuttaman ER-stressin yhteys istukan huonoon toimintaan ja sikiön kasvun hidastumiseen.
Nikotiinin vaikutukset kehittyvässä elimistössä
Kasvu
Jyrsijöiden altistaminen nikotiinille raskauden aikana pienentää syntymäpainoa ja aivojen kokoa verrattuna altistumattomiin (17,18). Nikotiini estää istukan kehitystä rotilla ja apinoilla (17). Myös soluviljelmissä nikotiini estää trofoblastisolujen erilaistumista, kulkeutumista ja invaasiota, eli tapahtumia, jotka ovat oleellisia hyvin toimivan istukan kehittymiseksi. Lisäksi nikotiini supistaa verisuonia ja näin heikentää myös kohdun ja istukan verenkiertoa sekä sikiön ravinnon- ja hapensaantia (3).
Haitat istukan toimintaan ja sikiön kasvuun on havaittu myös ihmisillä. Nikotiinipitoisuuden ollessa suurimmillaan kohtuvaltimoiden verenvirtaus vähenee selvästi 15 minuutin ajaksi (2).
Raskaudenaikainen tupakka-altistus yhdistettiin ensimmäistä kertaa juuri annosvasteisesti pienentyneeseen syntymäpainoon ihmisillä jo yli 50 vuotta sitten. Vaikka toistaiseksi ei juuri ole näyttöä yksittäisten nikotiinikorvaushoitotuotteiden (NRT) vaikutuksesta syntymäpainoon ihmisillä, on viitteitä NRT-tuotteiden yhteiskäytön tällaisesta vaikutuksesta (19).
Eläimillä nikotiinia saaneiden emojen poikasten kasvu häiriintyy selvästi ja syntymäpaino on normaalia pienempi (17). Kuten raskauden aikana nikotiinille altistuneilla jyrsijöillä, myös tupakalle altistuneilla ihmissikiöillä pään kasvu hidastuu, ja vastasyntyneillä on pienempi päänympärys ja pienentyneet aivotilavuudet (20). Myös muiden tärkeiden elinten (keuhkot, munuaiset, istukka) tilavuudet ovat pienempiä raskauden aikana tupakoineiden äitien lapsilla (3).
Keskushermosto
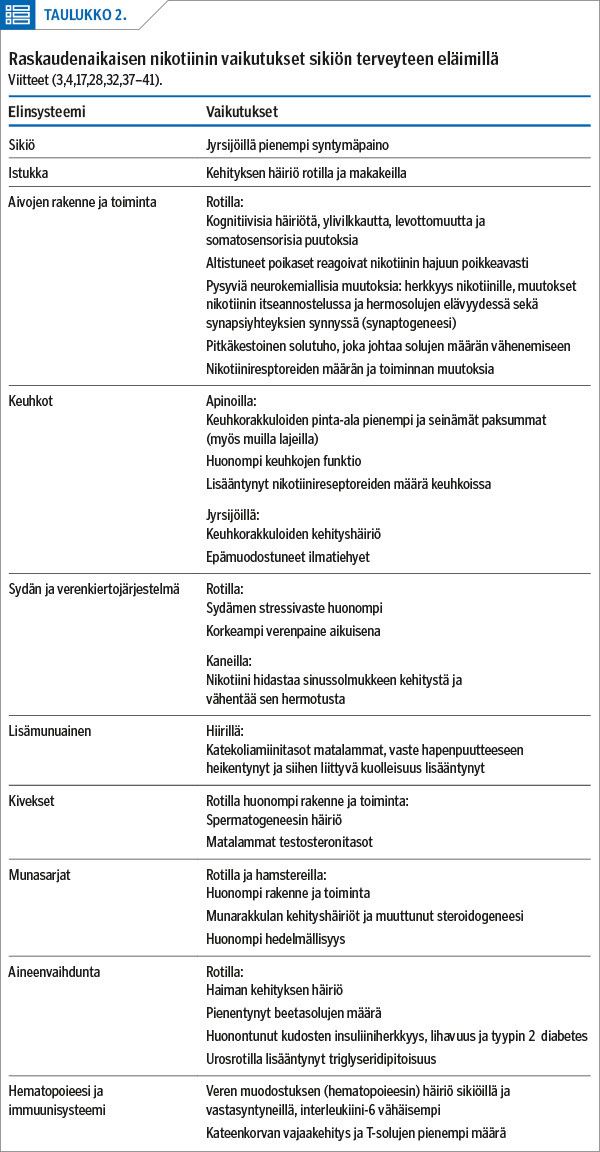
Nikotiini on selvä neuroteratogeeni, jolle altistuminen sikiöaikana häiritsee eläimillä aivojen kehityksen kaikkia vaiheita (4). Eläimillä nikotiinialtistus ennen syntymää johtaa hermosolujen tuhoon sekä nikotiinireseptoreiden määrän ja toiminnan muutoksiin jopa annoksilla, jotka eivät vaikuta kasvuun. Poikaset myös reagoivat nikotiiniin poikkeavasti (taulukko 2).
Eläinkokeissa on osoitettu, että nikotiinireseptorien aktivoituminen nikotiinialtistuksen vuoksi häiritsee aivosolujen kehittymistä ja aiheuttaa pitkäaikaisia muutoksia kolinergisessa, adrenergisessä ja serotonergisessa järjestelmässä sekä nikotiinireseptorien ilmaantumisessa ja toiminnassa (21).
Todennäköisesti nikotiinialtistuksella on vastaavia vaikutuksia ihmissikiöillä, koska nikotiinireseptorien taustalla oleva biologinen kehitys on samanlaista ihmisillä ja eläimillä. Nikotiinireseptoreita on todettu ihmisalkioiden aivojen ja selkäytimen alueilla jo 4.–5. raskausviikolta lähtien, ja niiden normaali toiminta on tärkeää aivojen kehitykselle (20). Tupakalle altistumisen onkin osoitettu aiheuttavan epigeneettisiä muutoksia, jotka johtavat ihmissikiön aivojen hermosolujen määrän vähenemiseen (22,23).
Myös soluviljelyssä nikotiini estää hermosolujen erilaistumista ihmisen aivoista peräisin olevissa soluissa (22). Kotiniinipitoisuuksin varmennetun raskaudenaikaisen tupakalle altistumisen (tupakointi, nuuska, purutupakka) on osoitettu aiheuttavan vastasyntyneille vieroitusoireita, mikä myös viittaa tupakoinnin neurotoksisiin vaikutuksiin ihmisillä (7,20,24).
Lisäksi tupakalle altistuminen raskauden aikana lisää lapsen oppimishäiriöitä (16) ja näyttää aiheuttavan muutoksia aivojen toimintaan vielä teini-ikäisillä toiminnallisella magneettikuvantamisella tutkittuna (25). Tupakoivien äitien lapsilla on havaittu aivojen kuorikerroksen määrän ja tiheyden vähenemistä ja mikrorakenteen muutoksia.
On sekä eläin-, että koko joukko ihmistutkimuksia, jotka tukevat äidin raskaudenaikaisen tupakoinnin merkitystä lapsen myöhemmälle nikotiiniriippuvuuden kehittymiselle. Raskauden aikana tupakoineiden äitien lapset tupakoivat todennäköisemmin kuin muut, ja tupakointi johtaa useammin nikotiiniriippuvuuteen myös äidin synnytyksen jälkeisen tupakoinnin suhteen kontrolloiduissa tutkimuksissa (26).
Eläinkokeissa nikotiinille altistuminen raskauden aikana johtaa ylivilkkauteen ja heikentää kognitiivisia taitoja (21). Ihmisillä äidin tupakointi raskauden aikana on yhdistetty erityisesti lasten ylivilkkauteen ja käytösongelmiin myös geneettiset ja perhetekijät huomioon ottavissa tutkimuksissa (27). Vastaavasti myös nikotiinikorvaushoidon käyttämisen raskausaikana on osoitettu lisäävän lapsen ylivilkkaus- ja käytösongelmia verrattuna tupakalle tai NRT:lle altistumattomiin, vaikkakin äidin tupakointi oli vielä vahvemmin yhteydessä näihin ongelmiin (6).
Keuhkot
Nikotiinin ja tupakoinnin vahingollisesta vaikutuksesta sikiön keuhkojen kehitykseen on vahva näyttö eläintutkimuksista ja lisääntyvässä määrin myös ihmistutkimuksista (4,15,28). Nikotiinin raskaudenaikaiset vaikutukset keuhkoihin näkyvät monella tasolla: molekyylitason muutoksina, keuhkojen pysyvinä rakenteellisina muutoksina, keuhkojen toiminnassa ja hengitystiesairauksien lisääntyneenä määränä. Epänormaalien keuhkofunktiokokeiden lisäksi vakavien sairaalahoitoa vaativien hengitystieinfektioiden ja astman esiintyminen ovat lisääntyneet raskauden aikana tupakoineiden äitien lapsilla muuhun väestöön verrattuna (2).
Suuressa epidemiologisessa tutkimuksessa hengitysteiden epämuodostumien määrä oli selvästi lisääntynyt nikotiinikorvaustuotteita raskauden aikana käyttäneiden äitien lapsilla (6). Tämä ja lukuisat eläintutkimukset osoittavat selvästi, että nikotiini on tärkeä keuhkojen kehitykseen kohdistuvan toksisuuden aiheuttaja.
Nikotiinireseptoreita on keuhkoissa jo sikiökehityksen aikana, jolloin nikotiinireseptoreiden alayksikköjen määrä on tarkasti säädelty. Tähän säätelyyn osallistuvat monet tekijät, joiden tiedetään olevan tärkeitä keuhkojen kehityksessä. Keuhkoissa nikotiinireseptoreita on sekä keuhkorakkuloissa että keuhkoputkissa.
Reesusapinalla nikotiinireseptoreita on runsaasti keuhkojen epiteelisoluissa, sidekudosemosoluissa (fibroblasteissa) (28) ja sikiöaikaisissa kantasoluissa (15). Nikotiinireseptoreiden määrä apinoiden keuhkoissa lisääntyy huomattavasti raskaudenaikaisen nikotiinialtistuksen seurauksena (28). Nikotiinireseptoreiden mRNA:n ilmeneminen eli geeniekspressio lisääntyy, kun taas immuunipuolustukseen liittyvien geenien ilmeneminen vähenee keuhkoissa raskaudenaikaisen nikotiinialtistuksen seurauksena.
In vitro -soluviljelykokeissa sähkösavukenesteiden on havaittu aiheuttavan monenlaisissa keuhkosoluissa solujen elävyyteen, hapetusstressiin, tulehdukseen ja immuunipuolustukseen liittyviä muutoksia (15,29).
Monilla eläinlajeilla (hiiri, rotta, lammas, apina) on osoitettu rakenteellisia ja toiminnallisia häiriöitä keuhkoissa niillä eläimillä, joita on altistettu kohdussa nikotiinille (28). Nikotiinin solunjakaantumista lisäävän eli proliferatiivisen vaikutuksen seurauksena hiirikokeissa on lisäksi havaittu epänormaalia kasvua pienissä hengitysteissä, mikä johtaa pidempiin ja mutkaisempiin ilmatiehyihin. Tämän seurauksena eläimillä on syntymän jälkeen samanlaisia keuhkojen toiminnallisia häiriöitä, kuin tupakoivien äitien lapsilla.
On viitteitä siitä, että ihmisillä isoäidin raskaudenaikaisen tupakoinnin vaikutukset ulottuvat lapsenlapsiin (30). Rotilla F0-sukupolven raskaudenaikainen nikotiinialtistus aiheuttaa yli sukupolven kestävän astmaherkkyyden, joka korostuu, jos myös F1-sukupolven emoja käsitellään nikotiinilla raskauden aikana (31). Sukupuolirauhasten metylaation muutokset näillä rotilla viittaavat epigeneettiseen etiologiaan.
Koska hengitystä säädellään keskushermostosta, jonka kehitys myös häiriintyy nikotiinin vaikutuksesta, häiriintyvät siis sekä hengityksen säätely aivoissa että keuhkojen toiminta. Samoin kuin aivot, myöskään keuhkot eivät ole vastasyntyneellä valmiiksi kehittyneet, vaan niiden kehittyminen kestää pitkälle nuoruuteen (4,15). Sikiöaikana mahdollisesti alkanut aivojen ja keuhkojen kehittymisen häiriintyminen voi siis pahentua edelleen, mikäli nikotiinialtistus jatkuu syntymän jälkeen.
Muita merkittäviä vaikutuksia
Nikotiinin merkittävin vaikutusmekanismi on sitoutuminen nikotiinireseptoreihin, joita on lähes kaikissa elimissä. Ei olekaan yllättävää, että eläinkokeissa nikotiinilla näyttää olevan aivojen ja keuhkojen lisäksi vaikutuksia sikiön kehitykseen ja myöhempään terveyteen myös muissa elinsysteemeissä (18,21) (taulukko 2). Immuunijärjestelmän kehittymistä nikotiini häiritsee monella tasolla.
Jyrsijöillä on todettu nikotiinin aiheuttavan haittoja sukusolujen kehittymisessä sekä uroksilla että naarailla (17). Kivesten paino on pienempi ja sukusolujen kehittyminen häiriintyy. Sekä sukusolujen että tukisolujen määrä on tavallista pienempi, ja hormonituotanto häiriintyy. Gonadotropiinitasot ja testosteronitasot veressä ja kiveksissä ovat normaalia matalammat.
Naaraiden sukupuolirauhasissa on vastaavia muutoksia: Munasarjojen paino on normaalia pienempi ja kehittyvien munasolujen määrä vähentynyt lisääntyneen apoptoosin vaikutuksesta.
Nikotiini eläimillä ja tupakka-altistus ihmisillä heikentävät myös vastasyntyneen autonomisen hermoston toimintaa stressitilanteissa ja sydämen vastetta adrenergiseen ärsykkeeseen, esimerkiksi synnytyksessä kehittyvän hapenpuutteen aikana (4,20). Yhdessä tutkimuksessa raskaudenaikaisen nuuskan käytön on kuvattu vaikuttavan ihmisillä tupakointia vastaavalla tavalla vastasyntyneen sydämen rytmiin (7).
Eläimillä raskaudenaikainen nikotiini aiheuttaa sekä rakenteellisia että toiminnallisia muutoksia sydämessä (32) ja huonontaa myös keuhkojen reaktiota hapenpuutteeseen (30). Ihmisillä raskaudenaikainen tupakointi on yhdistetty lisääntyneeseen perinataali- ja kätkytkuoleman riskiin (3). Myös nuuska (7) ja purutupakka (8) lisäävät perinataalikuolleisuutta. Edellä mainittujen tutkimusten perusteella onkin syytä epäillä nikotiinin tärkeää roolia näissä kuolemissa. Hengityksen säätely, keuhkojen toiminta ja sydämen ja lisämunuaisten vasteet stressireaktioon ovat eläimillä kaikki normaalia huonompia raskaudenaikaisen nikotiinialtistuksen jälkeen (4,15,28,34).
Lopuksi
Nikotiini on eläintutkimuksissa paljastunut erittäin haitalliseksi sikiön kehitykselle. Vaikka epidemiologista näyttöä pelkän nikotiinin vaikutuksista raskauteen ja sikiön kehitykseen ihmisillä on toistaiseksi riittämättömästi lopullisiin johtopäätöksiin, näyttää nikotiinin osuus tupakan raskauteen ja sikiöön kohdistuvien haittavaikutusten tärkeänä aiheuttajana lisääntyvän uusien tutkimusten myötä. Itse asiassa monet äidin raskaudenaikaisen tupakoinnin aiheuttamat haitat ihmissikiössä on voitu eläinkokeissa toistaa pelkällä nikotiinilla (taulukko 2, liitetaulukko 1).
Jotta voitaisiin saada tutkimustietoa nikotiinin käytön vaikutuksista ihmissikiössä, pitäisi nikotiinikorvaustuotteiden, sähkösavukkeiden, nikotiinipussien ja muiden nikotiinia sisältävien tuotteiden raskaudenaikainen käyttö dokumentoida tupakoinnin lisäksi esimerkiksi syntymärekisteriin.
Olisi kuitenkin kyseenalaista jäädä odottamaan epidemiologisten tutkimusten tuloksia. Vahvan kokeellisen ja eläintutkimuksista saadun tutkimustiedon ja jo olemassa olevien ihmistutkimusten perusteella voidaan päätellä, että nikotiini vastaa monista tupakoinnin aiheuttamista sikiöhaitoista. Useissa katsauksissa pidetäänkin nikotiinin haitallisia sikiövaikutuksia osoitettuina (4,8,32,35).
Tupakan lisäksi myös muiden nikotiinituotteiden käytön lopettamiseen kohdistuvat ehkäisevät toimenpiteet nuorilla naisilla jo ennen raskautta ovat ensiarvoisen tärkeitä lasten terveen kehityksen turvaamiseksi.
Kiitokset
Kirjoittajat kiittävät professoreita Hannu Raunio ja Matti Viluksela rakentavista kommenteista käsikirjoitukseen.
Kirsi Vähäkangas: Tutkimuksen rahoitus 2018–2021 (Itä-Suomen yliopisto, Suomen Akatemia, Gilead Sciences, EU-projekti AURORA, tutkimusryhmän jäsenille lisäksi pienempiä apurahoja useista säätiöistä) Savuton Suomi 2030- ja Lääkärit tupakkaa vastaan (DAT) -verkostojen jäsen. Mikael Ekblad: Savuton Suomi 2030 -verkoston tieteellisen neuvottelukunnan puheenjohtaja. Luentopalkkio/asiantuntijapalkkio (Pfizer), postdoc-tutkimuksen rahoitus 2018-2019 (Lastentautien tutkimussäätiö, Orionin Tutkimussäätiö, Emil Aaltosen säätiö, Paulon säätiö, Maud Kuistilan muistosäätiö, Tyks-säätiö).
- 1
- Ekblad M, Vähäkangas K. Kannattaako nikotiinikorvaushoito raskauden aikana? Duodecim 2020;136:23–9.
- 2
- Ekblad M, Gissler M, Korkeila J, Lehtonen L. Sikiön tupakka-altistuksen vaikutukset lapsen terveyteen. Suom Lääkäril 2015;70:629–34.
- 3
- Holbrook BD. The effects of nicotine on human fetal development. Birth Defects Res C Embryo Today 2016;108:181–92.
- 4
- England LJ, Aagaard K, Bloch M ym. Developmental toxicity of nicotine: A transdisciplinary synthesis and implications for emerging tobacco products. Neurosci Biobehav Rev 2017;72:176–89.
- 5
- Myllynen P, Vähäkangas K. Placental transfer and metabolism: an overview of the experimental models utilizing human placental tissue. Toxicol In Vitro 2013;27:507–12.
- 6
- Blanc J, Tosello B, Ekblad MO, Berlin I, Netter A. Nicotine replacement therapy during pregnancy and child health outcomes: a systematic review. Int J Environ Res Public Health 2021;18:4004.
- 7
- Kreyberg I, Nordhagen LS, Bains KES ym. An update on prevalence and risk of snus and nicotine replacement therapy during pregnancy and breastfeeding. Acta Paediatr 2019,108:1215–21.
- 8
- Cardenas VM, Fischbach LA, Chowdhury P. The use of electronic nicotine delivery systems during pregnancy and the reproductive outcomes: a systematic review of the literature. Tob Induc Dis 2019;17:52.
- 9
- Semple BD, Blomgren K, Gimlin K, Ferriero DM, Noble-Haeusslein LJ. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol 2013;106–7:1–16.
- 10
- Lewin G, Hurtt ME. Pre- and postnatal lung development: an updated species comparison. Birth Defects Res 2017;109:1519–39.
- 11
- Papke RL. Merging old and new perspectives on nicotinic acetylcholine receptors. Biochem Pharmacol 2014; 89:1–11.
- 12
- Grando SA. Connections of nicotine to cancer. Nature Rev Cancer 2014;14:419–29.
- 13
- Schuller HM. Nitrosamines as nicotinic receptor ligands. Life Sci 2007; 80:2274–80.
- 14
- Benowitz NL, Hukkanen J, Jacob P 3rd. Nicotine chemistry, metabolism, kinetics and biomarkers. Handb Exp Pharmacol 2009;192:29–60.
- 15
- Gibbs K, Collaco JM, McGrath-Morrow SA. Impact of tobacco smoke and nicotine exposure on lung development. Chest 2016;149:552–61.
- 16
- Knopik VS, Maccani MA, Francazio S, McGeary JE. The epigenetics of maternal cigarette smoking during pregnancy and effects on child development. Dev Psychopathol 2012;24:1377–90.
- 17
- Wong MK, Barra NG, Alfaidy N, Hardy DB, Holloway AC. Adverse effects of perinatal nicotine exposure on reproductive outcomes. Reproduction 2015;150:R185–93.
- 18
- Santiago SE, Huffman KJ. Postnatal effects of prenatal nicotine exposure on body weight, brain size and cortical connectivity in mice. Neurosci Res 2012;73:282–91.
- 19
- Lassen TH, Madsen M, Skovgaard LT, Strandberg-Larsen K, Olsen J, Andersen AM. Maternal use of nicotine replacement therapy during pregnancy and offspring birthweight: a study within the Danish National Birth Cohort. Paediatr Perinat Epidemiol 2010;24:272–81.
- 20
- Ekblad M, Korkeila J, Lehtonen L. Smoking during pregnancy affects foetal brain development. Acta Paediatr 2015;104:12–8.
- 21
- Slikker W Jr, Xu ZA, Levin ED, Slotkin TA. Mode of action: disruption of brain cell replication, second messenger, and neurotransmitter systems during development leading to cognitive dysfunction – developmental neurotoxicity of nicotine. Crit Rev Toxicol 2005;35:703–11.
- 22
- Chatterton Z, Hartley BJ, Seok MH ym. In utero exposure to maternal smoking is associated with DNA methylation alterations and reduced neuronal content in the developing fetal brain. Epigenetics Chromatin 2017;10:4.
- 23
- Nakamura A, François O, Lepeule J. Epigenetic alterations of maternal tobacco smoking during pregnancy: a narrative review. Int J Environ Res Public Health 2021;18:5083.
- 24
- Liska SR. In utero exposure to Black Bull chewing tobacco and neonatal nicotine withdrawal: a review of the literature. Neonatal Netw 2014;33:5–10.
- 25
- Bublitz MH, Stroud LR. Maternal smoking during pregnancy and offspring brain structure and function: review and agenda for future research. Nicotine Tob Res 2012;14:388–97.
- 26
- De Genna NM, Goldschmidt L, Day NL, Cornelius MD. Prenatal tobacco exposure, maternal postnatal nicotine dependence and adolescent risk for nicotine dependence: birth cohort study. Neurotoxicol Teratol 2017;61:128–32.
- 27
- Ekblad MO, Marceau K, Rolan E ym. The effect of smoking during pregnancy on severity and directionality of externalizing and internalizing symptoms: a genetically informed approach. Int J Environ Res Public Health 2020;17:7921.
- 28
- McEvoy CT, Spindel ER. Pulmonary effects of maternal smoking on the fetus and child: effects on lung development, respiratory morbidities, and life long lung health. Paediatr Respir Rev 2017;21:27–33.
- 29
- Solleti SK, Bhattacharya S, Ahmad A ym. MicroRNA expression profiling defines the impact of electronic cigarettes on human airway epithelial cells. Sci Rep 2017;7:1081.
- 30
- Rumrich IK, Hänninen O, Viluksela M, Vähäkangas K. Effect of grandmaternal smoking on body size and proportions at birth. Int J Environ Res Public Health 2021;18:4985.
- 31
- Liu J, Yu C, Doherty TM, Akbari O, Allard P, Rehan VK. Perinatal nicotine exposure-induced transgenerational asthma: Effects of reexposure in F1 gestation. FASEB J 2020;34:11444–59.
- 32
- Bruin JE, Gerstein HC, Holloway AC. Long-term consequences of fetal and neonatal nicotine exposure: a critical review. Toxicol Sci 2010;116:364–74.
- 33
- Sandberg KL, Poole SD, Hamdan A, Minton PA, Sundell HW. Prenatal nicotine exposure transiently alters the lung mechanical response to hypoxia in young lambs. Respir Physiol Neurobiol 2007;156:283–92.
- 34
- Muhammad N, Sharif M, Amin J ym. Neurochemical alterations in sudden unexplained perinatal deaths – a review. Front Pediatr 2018;6:6.
- 35
- Suter MA, Mastrobattista J, Sachs M, Aagaard K. Is there evidence for potential harm of electronic cigarette use in pregnancy? Birth Defects Res A Clin Mol Teratol 2015;103:186–95.
- 36
- Claire R, Chamberlain C, Davey MA ym. Pharmacological interventions for promoting smoking cessation during pregnancy. Cochrane Database Syst Rev 2020;3:CD010078.
- 37
- Mantella NM, Kent PF, Youngentob SL. Fetal nicotine exposure increases preference for nicotine odor in early postnatal and adolescent, but not adult, rats. PLoS One 2013;8:e84989.
- 38
- Ton AT, Biet M, Delabre JF, Morin N, Dumaine R. In-utero exposure to nicotine alters the development of the rabbit cardiac conduction system and provides a potential mechanism for sudden infant death syndrome. Arch Toxicol 2017;91:3947–60.
- 39
- Ma N, Nicholson CJ, Wong M, Holloway AC, Hardy DB. Fetal and neonatal exposure to nicotine leads to augmented hepatic and circulating triglycerides in adult male offspring due to increased expression of fatty acid synthase. Toxicol Appl Pharmacol 2014;275:1–11.
- 40
- Laiosa MD, Tate ER. Fetal hematopoietic stem cells are the canaries in the coal mine that portend later life immune deficiency. Endocrinology 2015;156:3458–65.
- 41
- Qu W, Zhao WH, Wen X ym. Prenatal nicotine exposure induces thymic hypoplasia in mice offspring from neonatal to adulthood. Toxicol Lett 2019;304:30–8.
The effect of nicotine on fetal growth and development
Nicotine is a toxic compound and according to animal studies very harmful to a developing fetus. The human fetus is exposed to nicotine most commonly through maternal smoking but also through maternal use of other nicotine containing products, such as snuff, nicotine-containing electronic cigarettes and nicotine replacement therapy. Although nicotine is only one of the numerous compounds in cigarette smoke, based on animal studies and recent human studies it is feasible to look at its fetotoxicity separately. In experimental animals, prenatal exposure to nicotine significantly disturbs the development of many important organs, especially the central nervous system and lungs. During fetal development nicotine exposure appears to alter epigenetic programming, with effects which may be passed on to subsequent generations.