Sädehoidon haittavaikutukset
Toivotun vaikutuksen lisäksi sädehoito voi aiheuttaa hoidettavan anatomisen alueen kudoksiin haittavaikutuksia.
Osa haitoista tulee esiin jo sädehoitojakson aikana tai pian sen jälkeen.
Valtaosa merkittävistä haitoista ilmaantuu vasta myöhäisseurannassa.
Sädehoitoa suunniteltaessa on oltava tieto tervekudoshaitan riskeistä.

Ionisoivaa terapeuttista sädehoitoa on käytetty syövän hoidossa jo 1900-luvun alkuvuosilta lähtien (1,2), eikä syöpälääkkeiden kehitys ole heikentänyt sädehoidon asemaa.
Hoitojen tarkkuus on parantunut sädehoitolaitteiden tekniikan ja kuvantamisen kehittyessä. Sädehoitosuunnitelma tehdään tietokone- tai magneettikuvauksen perusteella (3). Funktionaalisia PET-kuvauksia (positroniemissiotomografia) hyödynnetään kohdealueiden määrittämisessä (4), ja hoidon kohdentaminen varmistetaan päivittäisellä kuvantamisella (5). Stereotaktista, suuriannoksista sädehoitoa voidaan hyödyntää pienten kasvainten hoidossa yhä useammin (6,7,8).
Ulkoisessa sädehoidossa hoito toteutetaan lineaarikiihdyttimellä tyypillisesti fotonein. Sädekeilat tuodaan haluttuun kohdealueeseen eri suunnista, jotta läheisten kudosten saama annos jäisi mahdollisimman pieneksi (9). Sädehoitosuunnitelmassa määritetään aina paitsi kohdealue, myös läheiset tervekudokset ja niille sallitut enimmäisannokset.
Tervekudosten saama sädeannos ja tähän liittyvä haitta on merkittävin hoitoannosta rajoittava tekijä. Sädehoitoa käytetään rajoitetusti myös hyvänlaatuisissa sairauksissa, jolloin tervekudosten suojaamisen merkitys korostuu entisestään.
Tämä katsaus keskittyy vain aikuispotilaiden ulkoisen sädehoidon akuutteihin ja myöhäishaittoihin. Lapsena tai nuorena toteutettu sädehoito sisältää kasvun ja kehityksen kannalta erityisriskejä, jotka on jätetty katsauksen ulkopuolelle.
Sädehoito
Kun fotonikimppu kulkee kudoksen läpi, käynnistyy ketju fysikaalisia, kemiallisia ja biologisia reaktioita (10) (kuvio 1). Akuuttia sädehoitoreaktiota leimaa yleinen turvotus ja inflammaatio kudoksissa. Inflammaatio jatkuu, hieman kudoksesta riippuen, 2–3 viikkoa sädehoidon jälkeen.
Ihanteellisessa tilanteessa syöpäkasvaimen sädeannos on ollut riittävä kasvaimen täydelliseen tuhoutumiseen ja tervekudosannos riittävän pieni turvaamaan kudoksen korjautumisen.
Akuutti inflammaatioprosessi johtaa usein myöhäishaittana sidekudossolukon (fibroosin) ja solujen surkastumisen (atrofian) lisääntymiseen sädehoidetulla alueella (11,12). Sädehoidon aiheuttama fibroosi ilmenee tavallisesti 4–12 kuukautta hoidon jälkeen ja voi edetä useiden vuosien ajan. Tyypillisiä fibroosin ilmentymiä ovat ihon kireys, nivelen jäykkyys tai sisäelinten striktuurat.
Nopeasti jakautuvat kudokset, kuten limakalvot tai luuydin, reagoivat säteilyyn jo hoitojakson aikana. Hitaasti jakautuvat kudokset, kuten hermosolut, oireilevat vasta kuukausien viiveellä.
Eri elimillä on paitsi erilainen sädeherkkyys, myös erilainen toiminta. Puhutaan joko "sarjaan" tai "rinnakkain" kytketyistä elimistä. Sarjaan kytketty elin ei toimi lainkaan, jos pienikin osa siitä tuhoutuu pysyvästi (esim. selkäydin), kun taas rinnakkain kytketyssä elimessä pienen osan täydellinen toimintavaje ei vaikuta merkittävästi normaaliin toimintaan (esim. keuhkot).
Sädehoitoa suunnitellessa on tiedettävä eri kudosten säteilyn sietokyky. Tervekudosten sietokyvyn määrityksessä hyödynnetään kokemusperäistä, kerättyä tietoa eri kudosten sädeherkkyydestä (Quantec-konsortio, 13). Tiedettyjä, turvallisia tervekudosrajoitteita ei tule ylittää kuin perustelluista syistä.
Akuutit sädehoitohaitat
Limakalvotulehdus (mukosiitti)
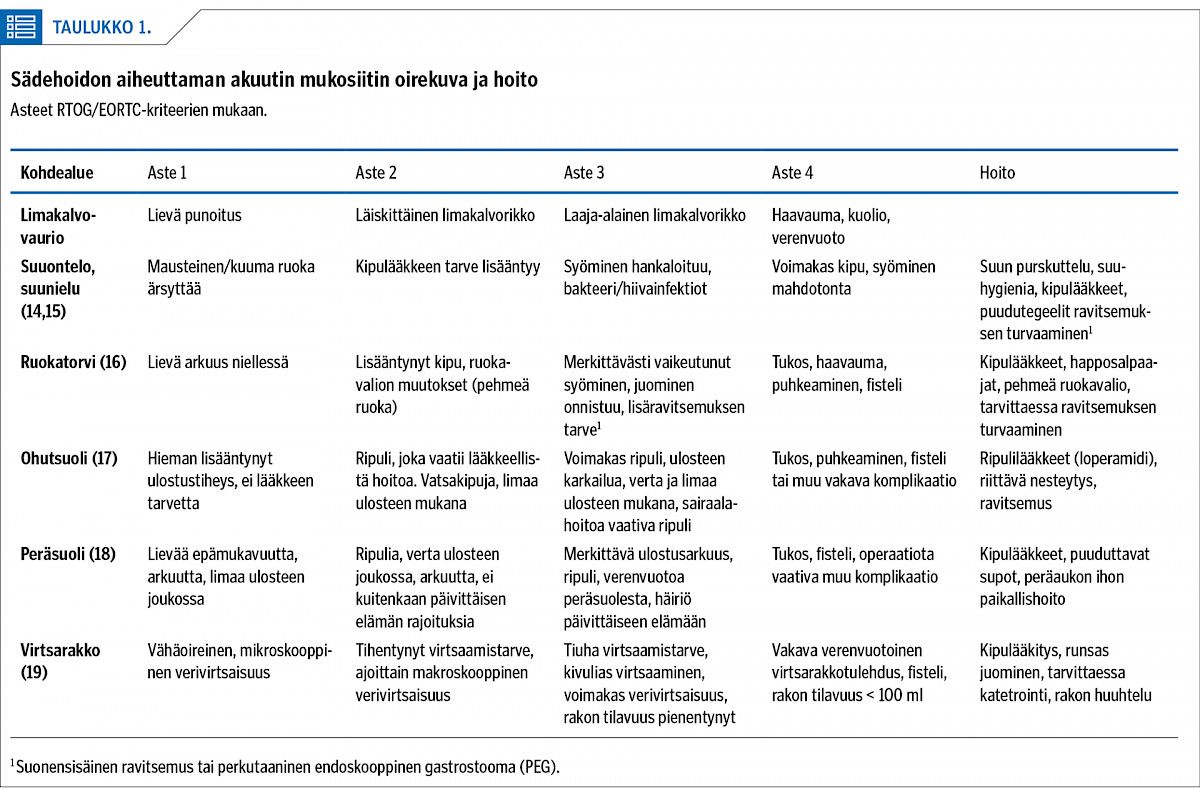
Limakalvot ovat nopeasti uudistuvaa kudosta, jossa sädehoidon haitat ilmaantuvat tyypillisesti jo hoitojakson aikana, 2–3 viikon kohdalla. Vaurioprosessi noudattaa sädehoidon edellä esitettyä kulkua: säteilyn aiheuttama soluvaurio, vaurioalueen inflammaatio, mahdollinen sekundaarinen infektio vaurioalueella normaalin suojatoiminnon puuttuessa sekä myöhemmin viikkojen aikana kantasolujen kautta tapahtuva uudistuminen ja tulehdusprosessin rauhoittuminen.
Vaurion aste ja oirekuva riippuvat paitsi sädehoidon annoksesta, myös hoidettavan alueen laajuudesta (taulukko 1). Lääkkeellisesti mukosiittia on vaikea ehkäistä, mutta tupakoinnin lopettamisesta on hyötyä. Samanaikainen solunsalpaajahoito lisää merkittävästi mukosiitin riskiä.
Hoito on pitkälti oireenmukaista. Ravitsemussuunnittelijan tapaamiset on tärkeä osa potilaiden hoitoa, mikäli hoitojakso on pitkä ja hoidon ennustetaan vaikeuttavan normaalia ravitsemusta.
Ihotulehdus (dermatiitti)
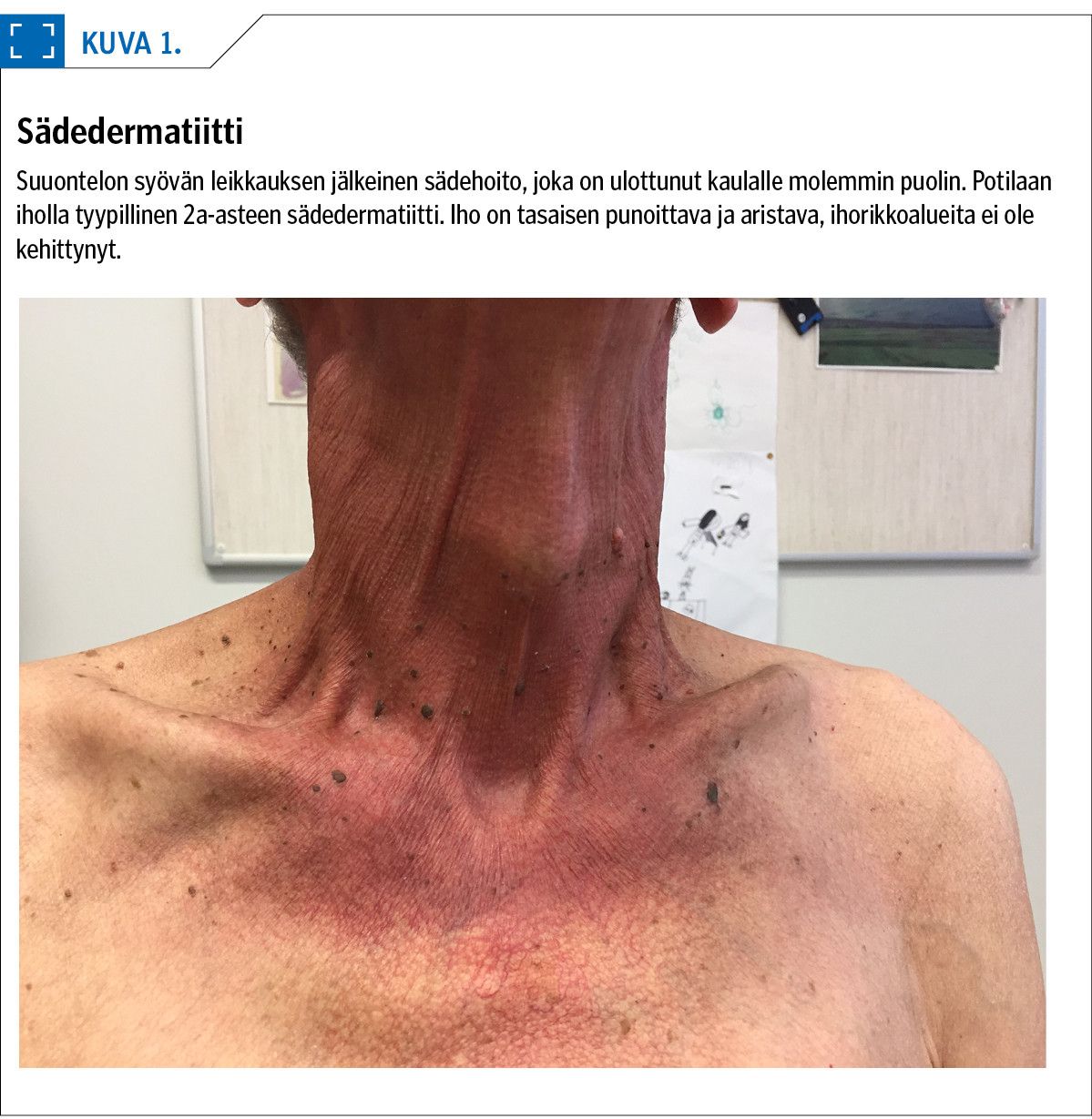
Ihon akuutti sädehoitoreaktio on selkeä kliinisesti havaittava haittavaikutus (kuva 1). Sädedermatiitti alkaa hentona punoituksena ja ihon arkuutena ja saattaa edetä selvemmäksi punoitukseksi ja ihon kiristykseksi tai paikoittain erittäväksi ihorikoksi. Hankalammissa dermatiiteissa erittävät ihoalueet ovat laajoja ja pahimmillaan saattaa kehittyä jopa kuolioitumista tai fistelöintiä.
Valtaosa nykyisin annettavista sädehoidoista toteutetaan tekniikoilla, joissa sädekeilat tulevat useasta eri suunnasta ja ihon sädeannokset jäävät maltilliseksi. Ihotoksisuus voi kuitenkin tulla ongelmaksi esimerkiksi pään ja kaulan alueen syöpien kuratiivisissa sädehoidoissa. Kemosädehoito on myös dermatiitin riskitekijä.
Hoidoksi suositellaan säännöllistä ihon suihkuttelua, kosteuttavaa perusvoidetta tai kevyttä kortisonivoidetta, ilmahoitoa ja tarvittaessa keittosuolahauteita tai silikonivaahtolevyjä (20).
Hiustenlähtö
Hiusjuureen tai karvatuppeen kohdistuva sädehoito voi aiheuttaa annoksesta riippuen joko pysyvän tai hetkellisen karvoituksen lähdön (alopesia) (21).
Sylkirauhasen vaurio
Pään ja kaulan alueen kasvainten sädehoidossa sylkirauhaset määritetään riskielimiksi. Jo verrattain pienillä sädeannoksilla (noin 20 Gy) sylkirauhasten toiminta häiriintyy ja normaali, erityisesti juokseva, syljeneritys vähenee. Syljenerityksen vähäisyys vaikeuttaa syömistä ja lisää osaltaan suun alueen mukosiitin riskiä ja sekundaarisia infektioita.
Kaikkien sylkirauhasten suojaaminen on usein itse syövän hoitamiseksi mahdotonta, ja suun kuivuuden akuutti- ja myöhäishaitta joudutaan hyväksymään (15).
Väsymys
Potilas kokee usein väsymystä tai uupumusta sädehoidon aikana hoitokohteesta riippumatta. Tavallisesti väsymys on lieväasteista, eikä vaikuta päivittäiseen toimintakykyyn. Vaikka haitta on yleinen ja tunnistettu, sen tarkka mekanismi on yhä tuntematon (22). Mahdolliseksi mekanismiksi on arveltu muun muassa inflammaation aiheuttamaa sytokiinin eritystä (23).
Lääkkeellistä apua väsymyksen hoitoon ei ole. Suositeltavin tapa on ylläpitää fyysistä aktiivisuutta ja aerobista liikuntaa hoitojen aikana (24). Väsymys helpottaa hiljalleen sädehoidon jälkeen inflammaation väistyttyä.
Pahoinvointi
Sädehoito aiheuttaa pahoinvointia merkittävästi vähemmän kuin solunsalpaajahoidot. Kohtalainen pahoinvoinnin riski liittyy ylävatsan alueelle kohdistuvaan sädehoitoon (ohutsuolen ja mahalaukun sädeannos) ja suuri riski allogeenisen kantasolusiirron yhteydessä toteutettavaan koko kehon sädehoitoon.
Muissa kohdealueissa pahoinvoinnin riski on vähäinen. Pahoinvointia voidaan ehkäistä ennen sädehoitoa otettavalla lääkkeellä (5-HT3-salpaajat, deksametasoni tai metoklopramidi). Kemosädehoito lisää pahoinvoinnin riskiä ja tällöin ennakoiva oireen hoito korostuu (25).
Aivojen alueella sädehoito saattaa aiheuttaa aivokudoksen turvotuksen kautta päänsärkyä ja pahoinvointia. Turvotuksen ehkäisemiseksi voidaan käyttää deksametasonia. Mikäli hoitokohde aivoissa on pieni, aloitetaan kortisonihoito vasta tarvittaessa, jotta vältetään kortisonin aiheuttamat haitat, kuten turvotukset, univaikeudet ja verensokeritason nousu.
Luuydintoksisuus
Mikäli sädehoitokenttä kattaa laajalti luustoa, saattaa luuytimen toiminta häiriintyä. Veriarvoissa voidaan nähdä laskua hemoglobiini-, valkosolu- ja verihiutaletasoissa. Vaurio on tyypillisesti palautuva ja lieväasteinen.
Viiveellä ilmenevät akuutit haitat
Keuhkotulehdus (pneumoniitti)
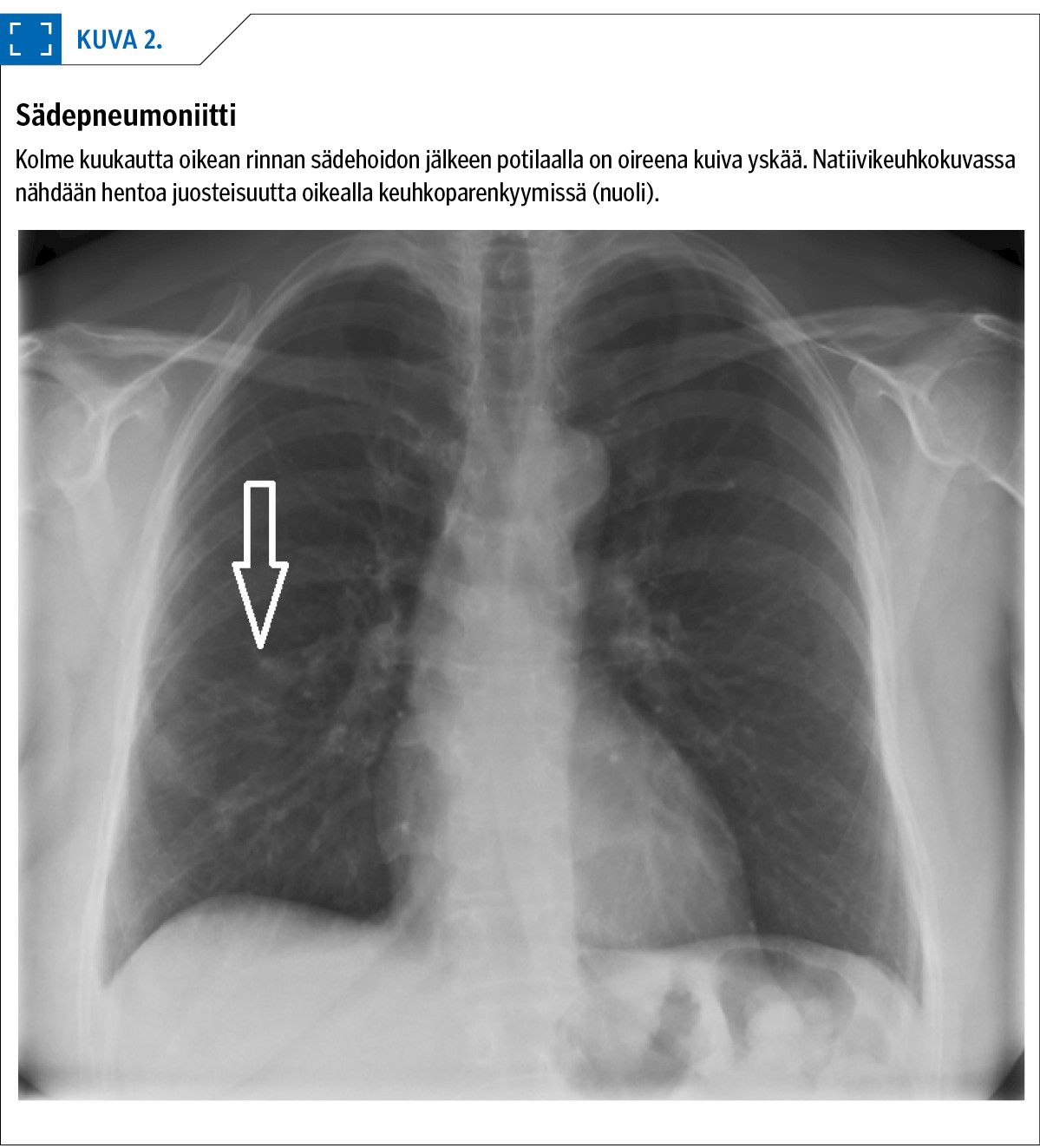
Keuhkokudos ei tyypillisesti reagoi vielä sädehoitojakson aikana. Lievä henkitorven tai keuhkoputkien ärsytys saattaa aiheuttaa hoidon aikana yskänärsytystä, mutta varsinainen keuhkojen sädehoitoreaktio, keuhkotulehdus, ilmaantuu 2–6 kuukauden viiveellä sädehoidosta.
Pneumoniittiriski lisääntyy keuhkon keskisädeannoksen kasvaessa. Oireena esiintyy kuivaa yskää, lievää lämpöilyä ja rasitushengenahdistusta. Rintasyöpäpotilaista pneumoniittia esiintyy alle 5 prosentilla, kun taas keuhkosyövän kemosädehoidossa jopa joka kolmannella.
Natiivikeuhkokuvassa nähdään hentoa juosteisuutta sädehoitoalueella (kuva 2), mutta joskus diagnoosin varmistaminen vaatii tietokonekuvauksen (TT). Oireisen pneumoniitin hoidoksi aloitetaan suun kautta otettava kortisonihoito, jonka keston tulee olla 6–8 viikkoa (26,27).
Myöhäishaitat
Myöhäishaittoja raportoidaan sädehoitotutkimuksissa hyvin vaihtelevasti. Monien syöpien hoidossa käytetään jo lähtötilanteessa useampaa hoitomenetelmää, jolloin yksinomaan sädehoidon aiheuttamien haittojen arviointi on haasteellista.
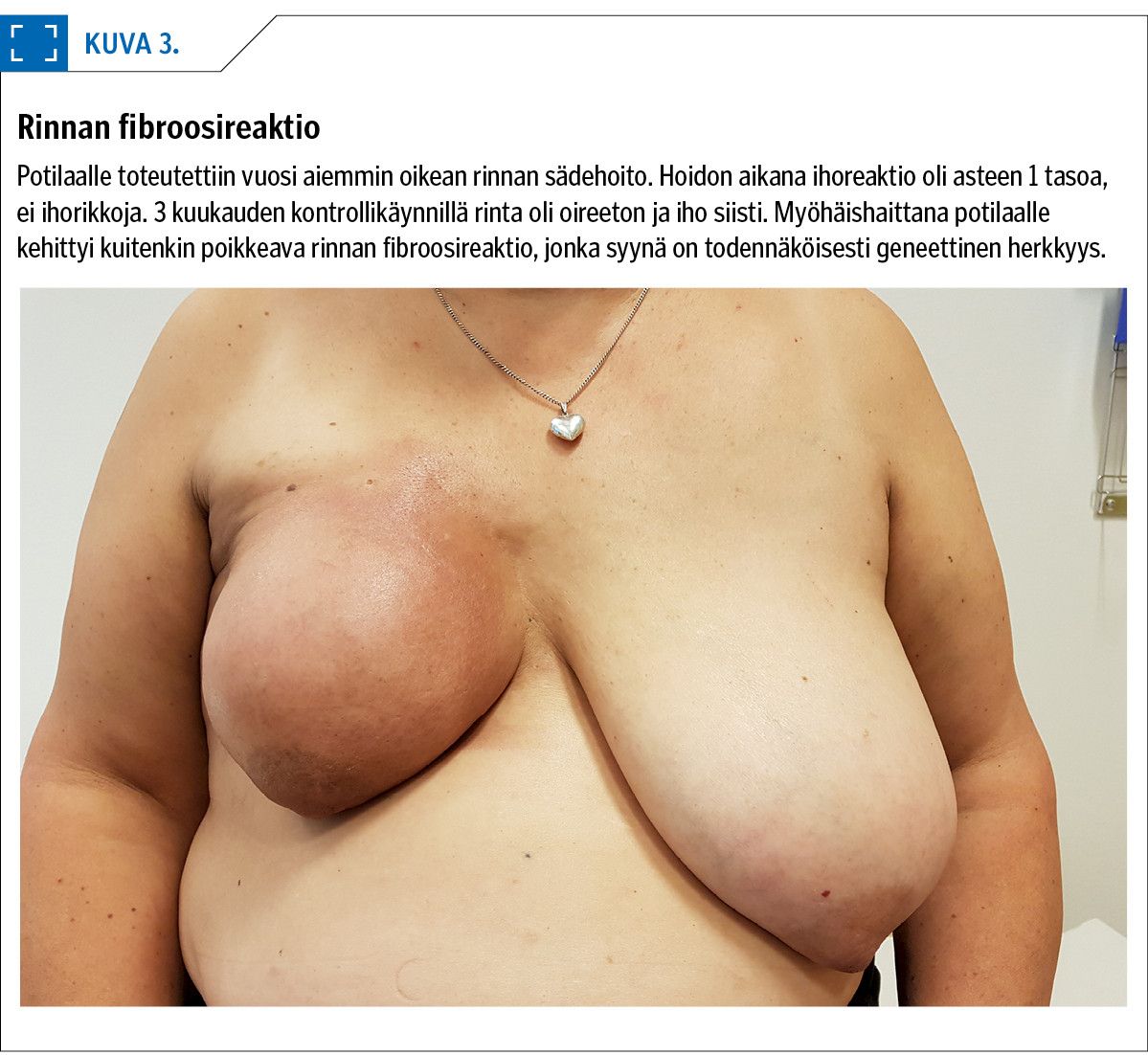
Myöhäishaittojen riski on kuitenkin melko hyvin ennustettavissa, kun tiedetään sädehoidon kohdealueen laajuus, sijainti sekä sädeannos. Yksittäisen potilaan sädeherkkyyttä on sen sijaan lähes mahdotonta ennustaa, mikä voi johtaa odottamattomiin kudoshaittoihin (kuva 3).
Lantion alueen sädehoidon myöhäishaitat
Lantion alueen sädehoidon tyypillisiä myöhäishaittavaikutuksia ovat virtsateiden, peräsuolen sekä sukuelinten toimintaan liittyvät oireet.
Krooninen peräsuolitulehdus voi ilmetä vasta parinkin vuoden kuluttua sädehoidosta. Tyypillisiä oireita ovat ripuli, ulosteen karkailu, peräsuolen verenvuoto ja limaiset ulosteet. Taustamekanismina pidetään fibroosin lisäksi suolen epiteelin ohentumista.
Eturauhassyövän ulkoisen sädehoidon saaneista potilaista 15 prosenttia raportoi suoliston toiminnan häiriöitä viiden vuoden kuluttua diagnoosista. Tavanomaisesti nämä oireet olivat löysävatsaisuutta tai peräaukon ajoittaista verenvuotoa (28). Lisäksi korkea sädeannos peräsuolen sulkijalihaksen alueelle saattaa heikentää puristusvoimaa ja aiheuttaa vähintään lieväasteista pidätyskyvyttömyyttä (29).
Tyypillisiä myöhäisiä virtsatieoireita ovat virtsankarkailu, kirvely, tihentynyt virtsaamistarve, verivirtsaisuus ja virtsaumpi. Sädehoidon saaneista eturauhassyöpäpotilaista 45 % raportoi virtsankarkailua 5 vuoden kuluttua diagnoosista (28). Samoin kohdunkaulan syöpää sairastavilla potilailla pidätyskyvyttömyys ja virtsaumpi lisääntyivät sädehoidon jälkeen (30,31).
Seksuaalielämän vaikeuksia on todettu erityisesti eturauhassyöpäpotilailla: impotenssia raportoi 51–67 prosenttia ja seksuaalielämän muita pysyviä ongelmia 11–20 prosenttia potilaista (28).
Naisilla kohdun/kohdunkaulan syövän sädehoidon jälkihaittoina esiintyy mm. emättimen kuivuutta, ahtautta ja verenvuotoa (31). Kemosädehoito lisää merkittävästi emättimeen kohdistuvien haittojen esiintymistä pelkkään sädehoitoon verrattuna (32).
Lantion alueen sädehoito lisää myös alaraajojen lymfaturvotuksen riskiä pelkkään leikkaukseen verrattuna (esim. gynekologiset syöpäpotilaat 29 vs. 13 %) (33).
Ongelmat hedelmällisyydessä
Kiveksen itusolut ovat erittäin herkkiä säteilyn vaikutuksille. Jo hyvin matalat sädeannokset vahingoittavat siittiöiden tuotantoa. Myös testosteronitason laskua saattaa esiintyä (34). Sädeannoksen raja-arvot pysyvää siittiökatoa ajatellen ovat kirjallisuudessa 1,2–6 Gy (34,35). Sperman pakastaminen ennen hoitojen aloitusta on tärkeää nuoren miehen hedelmällisyyden turvaamiseksi.
Munasarjojen sädeannosta ≥ 2 Gy tai kohdun sädeannosta ≥ 10 Gy pidetään korkean riskin tekijöinä naisen hedelmällisyyden kannalta (36). Lisääntymisikäisen potilaan munasarjat pyritään suojaamaan sädehoidolta mahdollisimman hyvin, ja tarvittaessa ne voidaan siirtää kirurgisesti kauemmaksi hoitoalueesta. Munasarjakudosta voidaan myös ottaa talteen ennen sädehoitoa tai käyttää hormonaalisia lääkityksiä munasarjojen suojaamiseksi onkologisen hoidon aikana.
Hypotalamuksen ja aivolisäkkeen sädehoito voi aiheuttaa myöhäisenä haittana gonadotropiinien tai gonadotropiineja vapauttavan hormonin puutosta ja vaikuttaa tätä kautta hedelmällisyyteen (37).
Rintaontelon elinten myöhäishaitat
Keuhkofibroosi on jatkumo sädepneumoniitille (38). Keuhkofibroosin todennäköisyys on suoraan riippuvainen sädeannoksesta ja sädetetyn keuhkokudoksen tilavuudesta. Useimmiten sädefibroosi keuhkoissa on oireeton ja todetaan vain kuvantaen. Laaja-alaisempi fibroosi on saattaa olla oireinen ja hankalahoitoinen.
Sydämen alueelle osuva sädehoito lisää fibroosin määrää myös sydänlihaksessa, läpissä ja sepelvaltimoiden seinämissä (39). Sädehoito sydämen alueelle lisää riskiä sairastua sepelvaltimotautiin, sydämen vajaatoimintaan, läppävikoihin sekä rytmihäiriöihin.
Myös sydänkuolleisuuden riski on lisääntynyt. Riski on suoraan suhteessa sydämen saamaan sädeannokseen: alle 2 Gy:n keskiannoksilla sydänriski on vähäinen, kun taas yli 10 Gy:n annoksilla jo merkittävä (40). Sydäntä pyritäänkin hoidoissa suojaamaan esimerkiksi hengitystahdistetulla sädehoitotekniikalla.
Ruokatorven alueen sädehoito saattaa johtaa myöhäishaittana ruokatorven ahtautumiseen. Näitä ahtaumia voidaan koettaa laajentaa tähystäen. Hankalimmillaan potilas tarvitsee pysyvää letkuravitsemusta gastrostooman kautta.
Kainalon imusolmukealueiden sädehoito lisää riskiä yläraajan imunestekiertohäiriöön (raajaturvotus, lymfedeema) erityisesti rintasyöpäpotilailla. Imusolmukkeiden laaja-alainen kirurginen poisto ennen sädehoitoa lisää tätä riskiä merkittävästi (41). Hoitona käytetään tukihihoja ja -käsineitä yhdistettynä fysikaaliseen hoitoon.
Pään ja kaulan alueen myöhäishaitat
Tavallisimpia myöhäishaittavaikutuksia ovat suun kuivuminen ja nielemisfunktion heikentyminen. Suun kuivumista aiheuttaa sylkirauhasten vaurio. Tutkimuksissa 40–50 % potilaista on raportoinut suun kuivuutta myöhäishaittana (42,43).
Nielemisongelma (dysfagia) on merkittävä elämänlaatua heikentävä tekijä pään ja kaulan alueen syövän sädehoidon jälkeen. Ongelmana on ruoan meneminen väärään kurkkuun ja aspiraatiotaipumus. Haittamekanismin uskotaan liittyvän nielun lihasten heikentyneeseen supistumiseen arpeutumisen ja lymfaturvotuksen seurauksena (42). Hankalimmillaan dysfagia edellyttää pysyvää letkuravitsemusta gastrostooman kautta.
Suurin osa todetuista osteoradionekrooseista eli sädehoidon aiheuttamista luun kuolioista todetaan alaleukaluun alueella. Osteoradionekroosi on sädehoidon vakavin haittavaikutus suuontelossa. Se syntyy luukudoksen sädevauriosta, ja oireet ilmaantuvat tavallisesti vasta 1–4 vuoden kuluttua sädehoidosta. Kliinisesti alaikenessä todetaan haavauma, joka etenee limakalvolta luuhun asti paljastaen luualueen.
Osteoradionekroosin riskiä lisäävät leukaluun suuri sädeannos, hammasperäiset tulehdukset ja leuan alueen leikkaukset. Ilmaantuvuus on ollut tutkimuksissa enintään luokkaa 6–7 % (44,45).
Suun kostutukset, suuhygienia ja puheterapeutin ohjaamat nielemisharjoitukset ovat tärkeä osa omahoitoa suuontelon ja nielun sädehoidon jälkeen. Jo ennen sädehoitoa toteutettu hammastarkastus ja -saneeraus sekä hoidon jälkeinen suuhygieniasta huolehtiminen ovat keskeisessä roolissa osteoradionekroosin ehkäisyssä.
Kaulan alueelle ulottuva sädehoito lisää kilpirauhasen vajaatoiminnan riskiä. Hypotyreoosi saattaa kehittyä seurauksena sädehoidon laukaisemasta autoimmuniteetista tai aiheutua suorasta kilpirauhaskudoksen fibroosista tai atrofiasta. Hypotyreoosia esiintyy myöhäishaittana matalillakin annostasoilla 5–30 prosentilla potilaista (46).
Aivokudos
Koko aivoston sädehoitoa on käytetty aivoetäpesäkkeiden hoidossa vuosikymmeniä. Hoitoon tiedetään liittyvä muistin ja kognitiivisten toimintojen heikkenemistä (47). Viime vuosina stereotaktinen sädehoito on korvannut koko aivojen sädehoitoa, mikäli etäpesäkkeiden lukumäärä (1–5 kpl) ja kokonaistilavuus ovat rajalliset. Yleisesti aivojen alueen sädehoidossa erityistä huomiota kiinnitetään aivorungon, kiasman, näköhermojen sekä sisäkorvan sädeannoksiin.
Oireita aiheuttava aivokudoksen sädenekroosi on harvinainen ja sitä tavataan lähinnä stereotaktisten hoitojen tai uusintasädehoitojen myöhäisenä komplikaationa. Oireisto voi olla samankaltainen, kuin kasvaimeen liittynyt oireisto, ja erotusdiagnostiikka kasvaimen uusiutuman ja nekroosin välillä saattaa olla vaikeaa.
Kuolioituneen alueen poisto tai koepala varmistaa tarvittaessa diagnoosin. Hoidoksi on käytetty muun muassa kortisonia ja bevasitsumabia (48).
Hermovauriot
Hermovaurio ilmenee tavallisesti vasta useiden vuosien kuluttua sädehoidosta. Oirekuva riippuu vaurioituneen hermon sijainnista. Selkäytimen vaurio on näistä pelätyin, sillä se voi johtaa pareesiin vaurioalueen alapuolella.
Hermoihin kohdistuva sädevaurio on yhdistetty muutoksiin hermotupessa, Schwannin soluissa ja neurofilamenteissa (49). Hermovaurion riskiä lisäävät sädeannoksen lisäksi hoidettavan alueen kirurgia tai neurotoksinen solunsalpaajahoito. Syntynyt vaurio on korjaantumaton.
Sisäelinten myöhäishaitat
Sädehoidon aiheuttama maksakudoksen fibroosi voi johtaa maksan vajaatoimintaan (50). Pienen osa-alueen sädehoito voidaan kuitenkin toteuttaa suurellakin annoksella ilman merkittävää vaikutusta maksan toimintaan.
Riittävän munuaisfunktion säilymiseksi vähintään toinen munuainen pyritään suojaamaan sädehoidolta (51).
Haiman alueen sädehoito voi aiheuttaa haiman vajaatoimintaa (52). Suoliston saama sädeannos saattaa aiheuttaa suolen supistelutoiminnan häiriöitä, ravinnon imeytymishäiriöitä sekä striktuuroita (53).
Sekundaarinen syöpäriski
Ionisoiva sädehoito aiheuttaa sekundaarisyövän riskin kaikilla kudosalueilla, joille sädehoitokeilat osuvat. Sekundaarinen syöpäriski kasvaa lineaarisesti sädeannoksen kasvaessa ja riippuu paljon myös potilaan iästä (nuoremmilla on suurempi riski), elintavoista (tupakointi) ja riskielimestä (54,55). Esimerkiksi eturauhassyövän sädehoidon jälkeen sekundaarinen syöpäriski on luokkaa 1:220–1:290 (56).
Lopuksi
Sädehoidon haittavaikutukset kohdistuvat, väsymystä lukuun ottamatta, vain sädehoitokeilan alueella sijaitseviin kudoksiin. Osa haitoista tulee esiin jo sädehoitojakson aikana, mutta osa kehittyy hitaasti edeten vuosien aikajänteellä.
Tervekudosannosten määrittäminen on olennainen osa sädehoidon suunnittelua. Toistaiseksi ei ole käytettävissä tehokasta lääkehoitoa sädehoidon aiheuttamien akuuttien tai myöhäishaittojen estoon. Hoitoa suunnitellessa tuleekin huolellisesti punnita hoidon tavoite suhteessa tervekudosten haittavaikutuksiin.
Ei sidonnaisuuksia.
- 1
- Pfahler GE. Irradiation therapy in cancer of the breast. Can Med Assoc J 1933;28(6):602–4.
- 2
- Quastler H. The use of the betatron in cancer therapy. Cancer Res 1946;6:483.
- 3
- Burnet NG, Thomas SJ, Burton KE, Jefferies SJ. Defining the tumour and target volumes for radiotherapy. Cancer Imaging 2004;4:153–61.
- 4
- Balter JM, Haffty BG, Dunnick NR, Siegel EL, Imaging Opportunities Workshop Participants. Imaging opportunities in radiation oncology. Int J Radiat Oncol Biol Phys 2011;79:342–7.
- 5
- Nabavizadeh N, Elliott DA, Chen Y ym. Image guided radiation therapy (IGRT) practice patterns and IGRT’s impact on workflow and treatment planning: Results from a National Survey of American Society for Radiation Oncology Members. Int J Radiat Oncol Biol Phys 2016;94:850–7.
- 6
- Guckenberger M, Andratschke N, Dieckmann K ym. ESTRO ACROP consensus guideline on implementation and practice of stereotactic body radiotherapy for peripherally located early stage non-small cell lung cancer. Radiother Oncol 2017;124:11–7.
- 7
- Mehta MP, Tsao MN, Whelan TJ ym. The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for brain metastases. Int J Radiat Oncol Biol Phys 2005;63:37–46.
- 8
- Habl G, Straube C, Schiller K ym. Oligometastases from prostate cancer: local treatment with stereotactic body radiotherapy (SBRT). BMC Cancer 2017;17:2.
- 9
- International commission on radiation units & measurements, Report 50. icru.org/home/reports/prescribing-recording-and-reporting-photon-beam-therapy-report-50
- 10
- Kouri M, Ojala A, Tenhunen M. Sädehoito. Kirjassa: Joensuu H, Roberts P, Teppo L, Tenhunen M, toim. Syöpätaudit, 3. painos. Kustannus Oy Duodecim 2007.
- 11
- Yarnold J, Brotons MC. Pathogenetic mechanisms in radiation fibrosis. Radiother Oncol 2010;97:149–61.
- 12
- Russell NS, Floot B, van Werkhoven E ym. Blood and lymphatic microvessel damage in irradiated human skin: The role of TGF-beta, endoglin and macrophages. Radiother Oncol 2015;116:455–61.
- 13
- Bentzen SM, Constine LS, Deasy JO ym. Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC): an introduction to the scientific issues. Int J Radiat Oncol Biol Phys 2010;76(3 suppl):3.
- 14
- Mallick S, Benson R, Rath GK. Radiation induced oral mucositis: a review of current literature on prevention and management. Eur Arch Otorhinolaryngol 2016;273:2285–93.
- 15
- Sroussi HY, Epstein JB, Bensadoun RJ ym. Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis. Cancer Med 2017;6:2918–31.
- 16
- Baker S, Fairchild A. Radiation-induced esophagitis in lung cancer. Lung Cancer (Auckl) 2016;7:119–27.
- 17
- Stacey R, Green JT. Radiation-induced small bowel disease: latest developments and clinical guidance. Ther Adv Chronic Dis 2014;5:15–29.
- 18
- Tabaja L, Sidani SM. Management of radiation proctitis. Dig Dis Sci 2018;63:2180–8.
- 19
- Liem X, Saad F, Delouya G. A practical approach to the management of radiation-induced hemorrhagic cystitis. Drugs 2015;75:1471–82.
- 20
- Rosenthal A, Israilevich R, Moy R. Management of acute radiation dermatitis: a review of the literature and proposal for treatment algorithm. J Am Acad Dermatol 2019;81:558–67.
- 21
- Lawenda BD, Gagne HM, Gierga DP ym. Permanent alopecia after cranial irradiation: dose-response relationship. Int J Radiat Oncol Biol Phys 2004;60:879–87.
- 22
- Hsiao CP, Daly B, Saligan LN. The etiology and management of radiotherapy-induced fatigue. Expert Rev Qual Life Cancer Care 2016;1:323–8.
- 23
- Courtier N, Gambling T, Enright S, Barrett-Lee P, Abraham J, Mason MD. Psychological and immunological characteristics of fatigued women undergoing radiotherapy for early-stage breast cancer. Support Care Cancer 2013;21:173–81.
- 24
- Stubbe CE, Valero M. Complementary strategies for the management of radiation therapy side effects. J Adv Pract Oncol 2013;4:219–31.
- 25
- Ruhlmann CH, Jahn F, Jordan K ym. 2016 updated MASCC/ESMO consensus recommendations: prevention of radiotherapy-induced nausea and vomiting. Support Care Cancer 2017;25:309–16.
- 26
- Jain V, Berman AT. Radiation pneumonitis: old problem, new tricks. Cancers (Basel) 2018;10:10.3390/cancers10070222.
- 27
- Marks LB, Bentzen SM, Deasy JO ym. Radiation dose-volume effects in the lung. Int J Radiat Oncol Biol Phys 2010;76(3 suppl):70.
- 28
- Lehto US, Tenhola H, Taari K, Aromaa A. Patients’ perceptions of the negative effects following different prostate cancer treatments and the impact on psychological well-being: a nationwide survey. Br J Cancer 2017;116:864–73.
- 29
- Krol R, Hopman WP, Smeenk RJ, Van Lin EN. Increased rectal wall stiffness after prostate radiotherapy: relation with fecal urgency. Neurogastroenterol Motil 2012;24:e166.
- 30
- Le Borgne G, Mercier M, Woronoff AS ym. Quality of life in long-term cervical cancer survivors: a population-based study. Gynecol Oncol 2013;129:222–8.
- 31
- Pfaendler KS, Wenzel L, Mechanic MB, Penner KR. Cervical cancer survivorship: long-term quality of life and social support. Clin Ther 2015;37:39–48.
- 32
- Gondi V, Bentzen SM, Sklenar KL ym. Severe late toxicities following concomitant chemoradiotherapy compared to radiotherapy alone in cervical cancer: an inter-era analysis. Int J Radiat Oncol Biol Phys 2012;84:973–82.
- 33
- Mirabeau-Beale KL, Viswanathan AN. Quality of life (QOL) in women treated for gynecologic malignancies with radiation therapy: a literature review of patient-reported outcomes. Gynecol Oncol 2014;134:403–9.
- 34
- Farhood B, Mortezaee K, Haghi-Aminjan H ym. A systematic review of radiation-induced testicular toxicities following radiotherapy for prostate cancer. J Cell Physiol 2019; doi: 10.1002/jcp.28283.
- 35
- Okada K, Fujisawa M. Recovery of spermatogenesis following cancer treatment with cytotoxic chemotherapy and radiotherapy. World J Mens Health 2019;37:166–74.
- 36
- Letourneau J, Fair D. Oncofertility in urologic oncology: Fertility preservation for women undergoing cancer treatment. Urol Oncol 2019;doi: 10.1016/j.urolonc.2019.02.008.
- 37
- Darzy KH. Radiation-induced hypopituitarism. Curr Opin Endocrinol Diabetes Obes 2013;20:342–53.
- 38
- Giridhar P, Mallick S, Rath GK, Julka PK. Radiation induced lung injury: prediction, assessment and management. Asian Pac J Cancer Prev 2015;16:2613–7.
- 39
- Filopei J, Frishman W. Radiation-induced heart disease. Cardiol Rev 2012;20:184–8.
- 40
- Darby SC, Ewertz M, McGale P ym. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 2013;368:987–98.
- 41
- Donker M, van Tienhoven G, Straver ME ym. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014;15:1303–10.
- 42
- Strojan P, Hutcheson KA, Eisbruch A ym. Treatment of late sequelae after radiotherapy for head and neck cancer. Cancer Treat Rev 2017;59:79–92.
- 43
- Nutting CM, Scully C. Oral cancer: comprehending the condition, causes, controversies, control and consequences. 12. Radiotherapy and chemotherapy. Dent Update 2011;38:717–9.
- 44
- Studer G, Bredell M, Studer S, Huber G, Glanzmann C. Risk profile for osteoradionecrosis of the mandible in the IMRT era. Strahlenther Onkol 2016;192:32–9.
- 45
- De Felice F, Musio D, Tombolini V. Osteoradionecrosis and intensity modulated radiation therapy: An overview. Crit Rev Oncol Hematol 2016;107:39–43.
- 46
- Nagayama Y. Radiation-related thyroid autoimmunity and dysfunction. J Radiat Res 2018;59(suppl 2):ii107.
- 47
- Tallet AV, Azria D, Barlesi F ym. Neurocognitive function impairment after whole brain radiotherapy for brain metastases: actual assessment. Radiat Oncol 2012;7:77.
- 48
- Mehta S, Shah A, Jung H. Diagnosis and treatment options for sequelae following radiation treatment of brain tumors. Clin Neurol Neurosurg 2017;163:1–8.
- 49
- Delanian S, Lefaix JL, Pradat PF. Radiation-induced neuropathy in cancer survivors. Radiother Oncol 2012;105:273–82.
- 50
- Munoz-Schuffenegger P, Ng S, Dawson LA. Radiation-induced liver toxicity. Semin Radiat Oncol 2017;27:350–7.
- 51
- Dawson LA, Kavanagh BD, Paulino AC ym. Radiation-associated kidney injury. Int J Radiat Oncol Biol Phys 2010;76(3 suppl):108.
- 52
- Gemici C, Yaprak G, Ozdemir S, Baysal T, Seseogullari OO, Ozyurt H. Volumetric decrease of pancreas after abdominal irradiation, it is time to consider pancreas as an organ at risk for radiotherapy planning. Radiat Oncol 2018;13:5.
- 53
- Hauer-Jensen M. Late radiation injury of the small intestine. Clinical, pathophysiologic and radiobiologic aspects. A review. Acta Oncol 1990;29:401–15.
- 54
- Dasu A, Toma-Dasu I. Models for the risk of secondary cancers from radiation therapy. Phys Med 2017;42:232–8.
- 55
- Schneider U, Walsh L. Risk of secondary cancers: bridging epidemiology and modeling. Phys Med 2017;42:228–31.
- 56
- Murray L, Henry A, Hoskin P, Siebert FA, Venselaar J, PROBATE group of GEC ESTRO. Second primary cancers after radiation for prostate cancer: a systematic review of the clinical data and impact of treatment technique. Radiother Oncol 2014;110:213–28.
Adverse effects of radiotherapy
Radiotherapy induces both acute and long-term changes not only to the target area but also to adjacent tissues. During radiotherapy, the tissue response is characterized by an inflammatory phase. This might progress to tissue fibrosis and atrophy during the following months and years. The knowledge of potential risks to surrounding organs is essential in radiotherapy planning.