Sarveiskalvonsiirrot ovat yleistyneet ja monipuolistuneet
• Sarveiskalvon tauteihin voidaan vaikuttaa määräkerroksiin kohdistetuilla sarveiskalvonsiirtoleikkauksilla. Siirtojen määrä on kasvanut Suomessa.
• Siirtotyyppejä ovat lävistävä siirto, pinnallinen ja syvä etukerrossiirto, endoteelikerroksen siirto takastrooman tai Descemetin kalvon tukemana sekä kantasolusiirto.
• Siirtotekniikoissa on tapahtunut merkittävä muutos viime vuosikymmenen aikana. Lävistävät siirrot ovat vähentyneet ja endoteelinsiirrot lisääntyneet.

Sarveiskalvonsiirrot ovat kehittyneet nopeasti ja siirtojen määrä Suomessa on kasvanut. Siirtoja on useita erilaisia. Kehittyneissä maissa sarveiskalvon takakerroksen siirrot ovat selvästi lisääntyneet viime vuosikymmenien aikana.
Edellinen kotimainen katsaus sarveiskalvonsiirroista julkaistiin Aikakauskirja Duodecimissa vuonna 2007 (1). Tämän jälkeen on kehitetty uusia leikkaustekniikoita ja aiemmista leikkaustekniikoista on kertynyt pitkäaikaistuloksia.
Tässä katsauksessa käsittelemme erityyppisiä sarveiskalvon siirtoja, niiden aiheita, eri siirtotyyppien hyötyjä, haittoja ja määrää Suomessa.
Sarveiskalvon anatomia ja fysiologia
Sarveiskalvon tehtävänä on taittaa valoa silmän tarkan näön alueelle, tukea silmän etuosan muita rakenteita ja suojata silmän sisäosia ulkoisilta infektioilta. Silmän kokonaistaittovoima on noin +60 dioptriaa, josta noin +40 dioptriaa on sarveiskalvon osuus ja +20 dioptriaa mykiön osuus. Normaalin sarveiskalvon keskimääräinen paksuus on noin 550 µm. Kyynelkalvo liittyy kiinteästi sarveiskalvon toimintaan. Se suojaa osaltaan silmää infektioilta, kostuttaa silmän pintaa ja muodostaa valoa vahvasti taittavan ilma-vesirajapinnan.
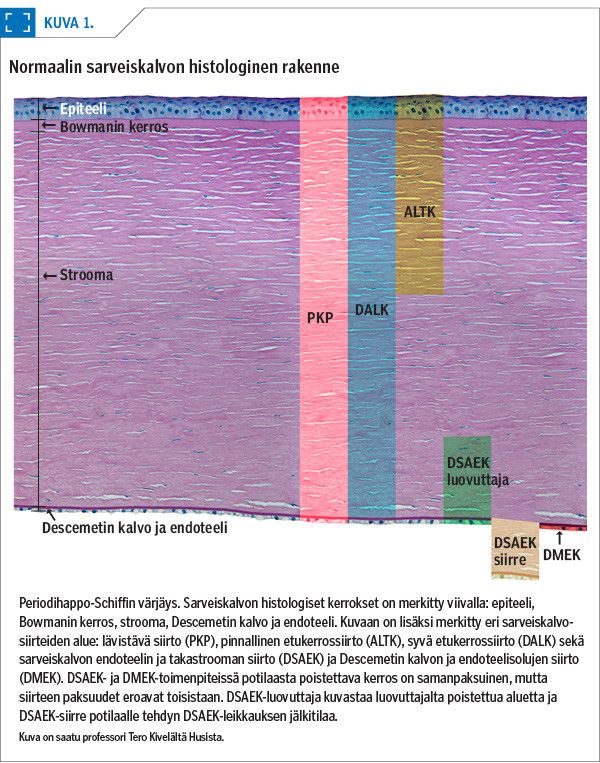
Sarveiskalvo koostuu epiteelistä, Bowmanin kerroksesta, stroomasta, Descemetin kalvosta ja endoteelistä (kuva 1).
Epiteelisolut muodostavat 4–6-solukerroksisen, keskimäärin 50 µm paksun kerroksen. Epiteelin solut uusiutuvat sarveiskalvon ja kovakalvon raja-alueella eli limbuksessa sijaitsevista kantasoluista noin 1–2 viikon välein. Epiteelisolut kiinnittyvät tyvikalvoon, joka koostuu pääasiassa tyypin IV kollageenista sekä laminiinista (2,3). Sarveiskalvon tyvikalvodystrofia aiheuttaa toistuvia sarveiskalvon haavaumia, koska epiteeli kiinnittyy poikkeavaan tyvikalvoon löyhästi ja on siksi altis irtoamaan.
Bowmanin kerros sijaitsee epiteelisolujen tyvikalvon alla. Se on soluton rakenne, joka koostuu pääosin kollageenista. Sen tehtävää ei tarkasti tunneta. Silmän taittovirhekirurgisissa toimenpiteissä, kuten fotorefraktiivisessa keratektomiassa (PRK), Bowmanin kerros voidaan poistaa ilman merkittävää haittaa silmän toiminnalle (4).
Sarveiskalvon strooma koostuu noin 200 kollageenilamellista, muusta soluväliaineesta ja fibroblastin tapaisista keratosyyteistä. Strooma muodostaa valtaosan sarveiskalvon paksuudesta. Keratosyytit erittävät ekstrasellulaarimatriksin, joka koostuu pääasiassa tyypin I ja IV kollageenista sekä proteoglykaaneista (5). Kollageenilamellien säännöllinen järjestäytyminen sekä endoteelisolujen aktiivinen sarveiskalvoa dehydroiva pumppaustoiminta ylläpitävät sarveiskalvon läpinäkyvyyttä (2,3).
Descemetin kalvo sijaitsee strooman takapinnalla. Se on sarveiskalvon endoteelin tavallista paksumpi tyvikalvo. Kalvo on syntyessä noin 3 µm paksu, ja se paksuntuu jatkuvasti iän myötä.
Endoteelisolut muodostavat yksikerroksisen solukerroksen Descemetin kalvon takapinnalle. Sen tehtävä on pumpata sarveiskalvosta nestettä etukammioon, jotta sarveiskalvo pysyy läpinäkyvänä. Endoteelisoluja on aikuisella 2 000–3 000 solua/mm2. Endoteelisolut eivät uusiudu vaan vähenevät iän karttuessa, silmänsisäisten leikkausten seurauksena ja tietyissä sarveiskalvotaudeissa. Vaurioituessaan endoteelisolut venyttyvät peittämään vaurioituneiden solujen jättämät aukot. Endoteelin pumppaustoiminta käy riittämättömäksi, kun endoteelisolujen määrä pienenee alle 500 soluun/mm2 (2,6). Uudet tutkimukset ovat osoittaneet, että Rho-kinaasin estäjät (ROCK-inhibiittorit) nopeuttavat endoteelisoluvaurion korjaantumista (7).
Yksi yleisimmistä sarveiskalvotaudeista on endoteelisoluja ja niiden erittämää Descemetin kalvoa vaurioittava Fuchsin dystrofia, joka johtaa sarveiskalvon strooman ja epiteelin turpoamiseen. Silmäleikkauksista ja muista syistä aiheutuvasta endoteelisoluvajauksesta johtuvaa sarveiskalvon turvotusta kutsutaan rakkulaiseksi sarveiskalvosairaudeksi.
Sarveiskalvonsiirrot eri tilanteissa
Yleisin syy sarveiskalvonsiirtoon on näöntarkkuuden parantaminen; tällöin samentunut tai epämuotoinen sarveiskalvo tai sen osa pyritään korvaamaan kirkkaalla siirteellä. Siirtoja voidaan tehdä myös rakenteellisista syistä. Ohentunut tai puhjennut sarveiskalvo pyritään tekemään siirteellä rakenteellisesti vahvemmaksi ja estämään silmän puhkeaminen ja infektoituminen. Kosmeettisten syiden takia tehdyt sarveiskalvonsiirrot ovat hyvin harvinaisia.
Siirtomenetelmä valitaan nykyään hoidettavan vaurion sijainnin mukaan. Tavoitteena on säilyttää mahdollisimman paljon potilaan omaa kudosta, jolloin siirrettävän kudoksen määrä on mahdollisimman pieni. Siirteen hylkimisriski kasvaa ja on sitä suurempi, mitä enemmän siirrettyä kudosta on kontaktissa potilaan immuunijärjestelmän kanssa (8,9). Sarveiskalvo on normaalitilassa veri- ja imusuoneton kudos, minkä vuoksi se on immunologisesti inaktiivinen (10). Sarveiskalvonsiirron paranemisvaiheen jälkeen hyljinnänestolääkitys on siksi yleensä tarpeeton. Silmän sisäosat on vastaavasti eristetty immuunijärjestelmältä veri-silmäesteellä (blood-retinal barrier ja blood-aqueous barrier) (11).
Sarveiskalvon immunologinen suojaus voi vaurioitua silmäleikkausten, vammojen sekä tulehduksien seurauksena. Tulehdusreaktio voi aiheuttaa verisuonikasvutekijöiden (mm. vascular endothelial growth factor, VEGF) erittymistä, jonka seurauksena potilaan oman sarveiskalvon tai sarveiskalvosiirteen pinnalle voi kasvaa uusia veri- ja imusuonia. Tällöin sarveiskalvosiirteen kudos on kontaktissa potilaan immuunijärjestelmän kanssa. Sarveiskalvolle muodostuneiden uudissuonten seurauksena siirteen hyljinnän riski lisääntyy (12,13). Myös sarveiskalvolle kasvavien imusuonten on havaittu liittyvän hyljintäreaktioon (14,15).
Menetelmät
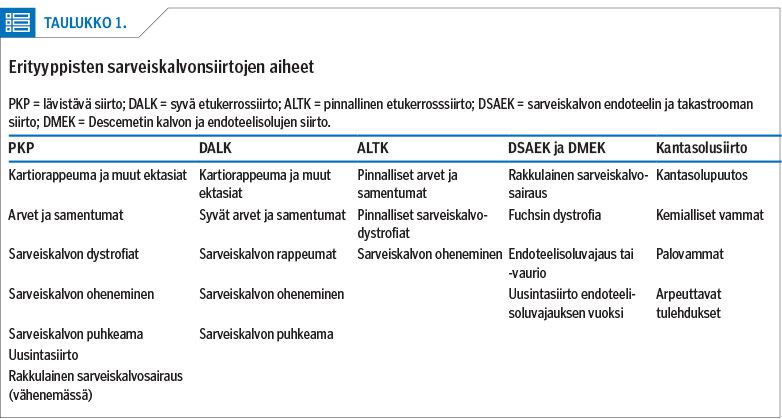
Ensimmäisen onnistuneen lävistävän sarveiskalvonsiirron teki vuonna 1905 Eduard Zirm potilaalle, joka oli sokeutunut emäsvamman vuoksi (16). Viime vuosisadalla pääosa suoritetuista sarveiskalvonsiirroista oli lävistäviä siirtoja. Siirrot ovat nopeasti kehittyneet viime vuosikymmeninä. Kerroksittaisilla sarveiskalvonsiirroilla kyetään nykyään hoitamaan täsmällisesti sarveiskalvon eri kerroksia ja niiden tauteja (taulukko 1).
Lävistävä sarveiskalvonsiirto
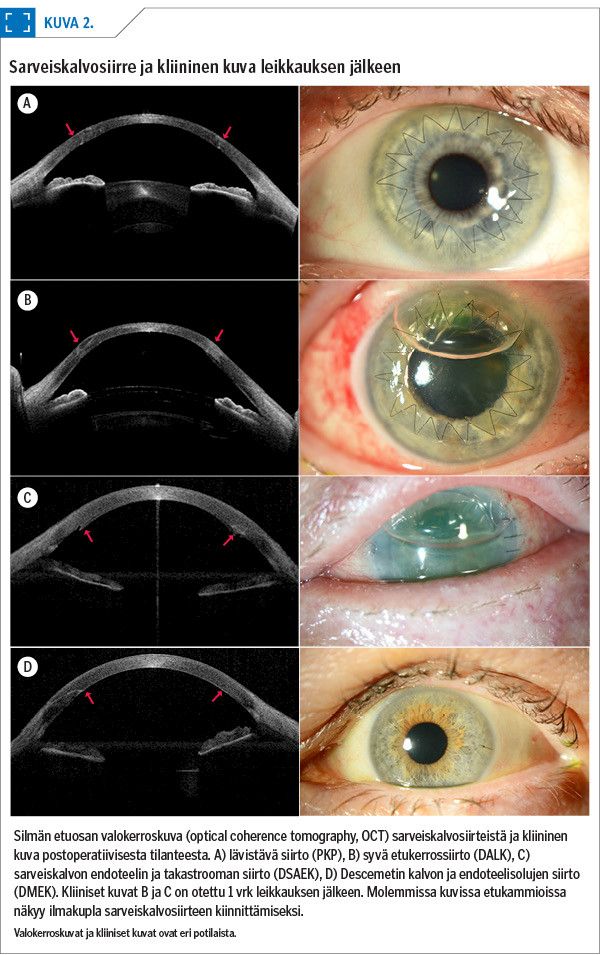
Lävistävässä sarveiskalvonsiirrossa (penetrating keratoplasty, PKP) siirretään luovuttajan sarveiskalvo koko paksuudeltaan (kuva 1). Potilaan sarveiskalvon keskiosa irrotetaan pyöröterällä, minkä jälkeen luovuttajalta poistetusta sarveiskalvosta vastaavasti muotoiltu siirre ommellaan potilaan sarveiskalvoon kiinni yksittäisillä tai jatkuvalla ompeleella (kuva 2A). Ompeleet poistetaan yleensä vuoden kuluttua siirrosta.
Lävistävä sarveiskalvonsiirto sopii tilanteisiin, joissa sarveiskalvo on poikkeava koko paksuudeltaan. Yleisin syy lävistävään sarveiskalvonsiirtoon on pitkälle edennyt sarveiskalvon kartiorappeuma (keratokonus). Kartiorappeumaan on kehitetty sarveiskalvon valokovetushoito (cross-linking), jolla kyetään pysäyttämään taudin eteneminen (17,18,19), ja se näyttää vähentävän sarveiskalvonsiirron tarvetta näillä potilailla (20,21).
Vakavat infektiot ja vammat voivat aiheuttaa sarveiskalvon puhkeamisen. Usein tällaisissa tilanteissa päädytään sarveiskalvon lävistävään siirteeseen. Aiemmin myös endoteelisolujen vajaatoimintaa hoidettiin lävistävällä sarveiskalvonsiirrolla, mutta nykyään nämä leikkaukset ovat käyneet harvinaisiksi uusien leikkaustekniikoiden tultua käyttöön.
Sarveiskalvon etukerrossiirrot
Sarveiskalvon etukerrossiirto voidaan tehdä pinnallisena (automated lamellar therapeutic keratoplasty, ALTK) tai syvänä (deep anterior lamellar keratoplasty, DALK) (kuva 1). ALTK-toimenpiteessä potilaan sarveiskalvon pinnallisesta etukerroksesta poistetaan 150–300 µm paksuinen kerros mikrokeratomilaitteistolla (22) tai femtosekuntilaserilla (23). Siirre valmistellaan vastaavan paksuiseksi samalla menetelmällä, ja se ommellaan potilaan sarveiskalvoon yksittäisompeleilla.
ALTK-siirtoja tehdään nykyään harvoin, koska niiden optinen laatu on yleensä heikompi kuin DALK-toimenpiteen jälkeen (24). ALTK-leikkaus soveltuu tilanteisiin, jossa vika on sarveiskalvon pinnallisissa kerroksissa, kuten tietyissä sarveiskalvodystrofioissa, sarveiskalvon ohentumissa ja pinnallisissa arvissa. Sarveiskalvon pinnallisia samentumia ja tyvikalvodystrofiaa voidaan vaihtoehtoisesti hoitaa eksimeerilaserhionnalla (fototerapeuttinen keratektomia, PTK), jos samentumat ovat riittävän pinnallisia (alle 100 µm).
DALK-toimenpiteessä potilaan sarveiskalvon pintaosa poistetaan käsin Descemetin kalvoon saakka. Leikkaustekniikoita on useita (25,26,27,28,29). Luovuttajan sarveiskalvosta poistetaan Descemetin kalvo endoteelisolukerroksineen, ja siirre ommellaan potilaan sarveiskalvoon (kuva 2B). DALK-toimenpide on kirurgille haastava (30). Jos Descemetin kalvo repeää, leikkaus voidaan muuttaa lävistäväksi sarveiskalvonsiirroksi. Ompeleet poistetaan yleensä vuoden kuluttua leikkauksesta. Endoteelivajausta lukuun ottamatta DALK-leikkaus sopii samoihin tilanteisiin kuin lävistävä sarveiskalvonsiirto. Puhjenneen sarveiskalvon hoidossa suositaan kuitenkin lävistävää siirtoa.
Sarveiskalvon takakerrossiirrot
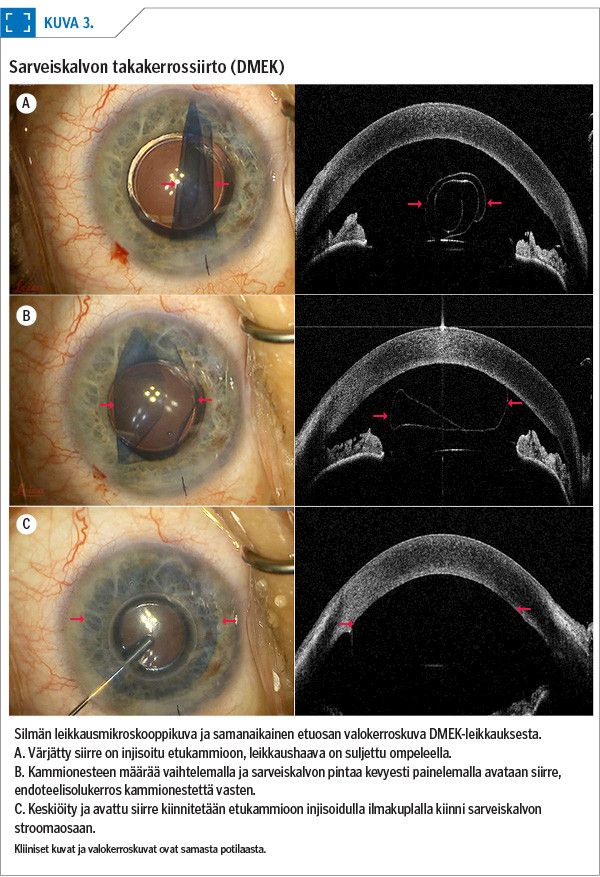
Sarveiskalvon takakerrossiirrossa eli DSAEK-leikkauksessa (Descemet stripping automated endothelial keratoplasty) potilaalle siirretään luovuttajan endoteelisolut, Descemetin kalvo sekä 100–200 µm strooman takaosaa (31) (kuva 1, kuva 2C). Uudemmassa DMEK-leikkauksessa (Descemet membrane endothelial keratoplasty) puolestaan siirretään luovuttajan endoteelisolukerros pelkästään Descemetin kalvon tukemana (32) (kuva 1, kuva 2D, kuva 3).
Molemmissa leikkauksissa pieni leikkaushaava tehdään sarveiskalvon ja kovakalvon rajalle, ja potilaan silmästä poistetaan keskeinen Descemetin kalvo (descemetorhexis) siihen kiinnittyneine endoteelisoluineen. Siirre viedään silmän etukammioon leikkaushaavan kautta, minkä jälkeen se suoristetaan ja kiinnitetään potilaan sarveiskalvon sisäpintaan kaasu- tai ilmakuplan avulla. Ompeleita tarvitaan vain leikkaushaavan sulkemiseen.
DMEK-leikkaus on kirurgille vaativampi kuin DSAEK, sillä siirre on vain 10–15 µm paksu ja sen käsittely ja kiinnittäminen sarveiskalvon takapintaan on haastavampaa (33,34). Kun näkyvyys silmän etukammioon on heikentynyt sarveiskalvon sameuden vuoksi, käytetään usein DSAEK-leikkausta, koska se on helpompi suorittaa. DMEK-siirteessä hyljintäreaktion riski on pienempi kuin DSAEK-siirteessä, jossa on enemmän luovuttajakudosta (9).
Yleisimmät syyt endoteelinsiirtoon ovat Fuchsin dystrofia ja rakkulainen sarveiskalvosairaus.
Sarveiskalvon kantasolusiirrot
Sarveiskalvon kantasolusiirto ("limbussiirto") tehdään joko omasiirteenä (autografti) potilaan toisesta silmästä tai vierassiirteenä (allografti). Menetelmää käytetään, kun kantasolut ovat vaurioituneet. Kantasolut voivat vaurioitua kemikaali- ja palovammojen vuoksi tai silmän pintakudoksia arpeuttavien tautien vuoksi. Kantasoluvaurion seurauksena sidekalvo verisuonineen kasvaa sarveiskalvolle, jonka pinta korvautuu sidekalvon tapaisella kudoksella (konjunktivalisaatio) (35).
Sarveiskalvonsiirrot Suomessa
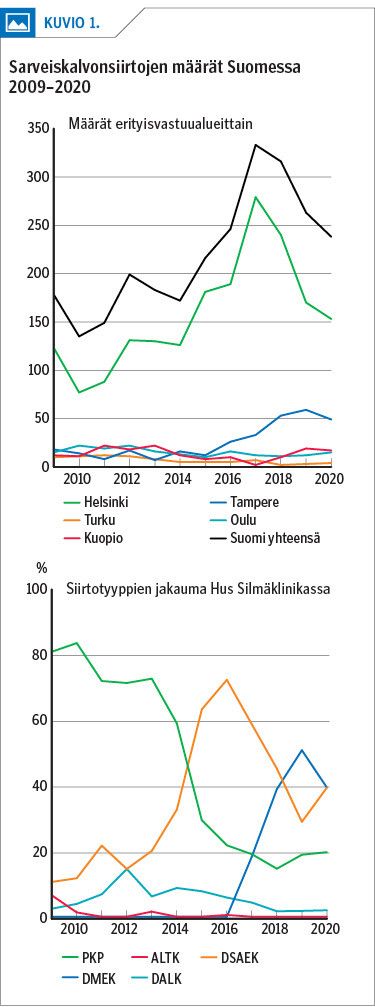
Sarveiskalvonsiirtojen määrä on lisääntynyt Suomessa 2010-luvulla aiemmasta 100–150 siirrosta 250–300 siirtoon vuosittain. Lisäys johtuu pääasiassa sarveiskalvon takakerrossiirtojen lisääntymisestä. Niitä tehdään Helsingin ja Tampereen yliopistollisissa sairaaloissa. Helsingin yliopistollisen sairaalan osuus Suomessa tehdyistä sarveiskalvonsiirroista on noussut aiemmasta 50–60 %:sta nykyiseen 75–85 %:iin.
Helsingin yliopistollisessa sairaalassa tehtyjen lävistävien siirtojen määrä on huomattavasti vähentynyt viime vuosikymmenen aikana. Tätä selittää uudempien endoteelinsiirtojen lisääntyminen mutta myös mahdollisesti sarveiskalvon kartiorappeumaan kehitetyn valokovetushoidon yleistyminen. Endoteelisolujen toimintahäiriötä hoidettiin ennen endoteelinsiirtojen yleistymistä lävistävillä siirroilla.
Endoteelinsiirrot nousivat yleisimmiksi siirtomenetelmiksi Helsingissä vuonna 2015 (kuvio 1) (36). Samanlainen muutos on tapahtunut myös muissa länsimaissa. Endoteelinsiirrot ovat yleistyneet, sillä niiden jälkeen saavutetaan parempi näöntarkkuus, hylkimisreaktioita ja taittovirheitä on vähemmän ja silmä toipuu nopeammin kuin lävistävien siirtojen jälkeen (37,38,39).
Siirrännäisten hankinta
Sarveiskalvosiirteitä kerätään aivokuolleilta monielinluovuttajilta sekä menehtyneiltä henkilöiltä 48 tunnin kuluessa kuolemasta. Luovutuksen edellytyksenä on korkeintaan kaksi vuorokautta ennen kuolemaa otettu verinäyte, josta voidaan tutkia siirteen käytön estävät infektiot, kuten hepatiittivirusten ja HIV-viruksen aiheuttamat infektiot.
Koronaviruspandemia on vähentänyt sarveiskalvosiirteiden saatavuutta, sillä luovuttajalla tulee olla PCR-tekniikalla negatiiviseksi todettu koronavirusnäyte, joka on otettu korkeintaan kolme vuorokautta ennen kuolemaa. Vaihtoehtoisesti näyte voidaan ottaa kuoleman jälkeen sarveiskalvojen irrotuksen yhteydessä.
Sarveiskalvon luovutuksen vasta-aiheita ovat veriteitse tarttuvien virusten lisäksi muut infektiot kuten sepsis, tuberkuloosi, virusenkefaliitti ja meningiitti. Hematologiset maligniteetit ja degeneratiiviset neurologiset sairaudet, kuten amyotrofinen lateraalinen skleroosi, multippeliskleroosi ja Parkinsonin tauti kuuluvat myös vasta-aiheisiin.
Silmäsairauksista vasta-aiheita luovutukselle ovat sarveiskalvon taudit ja aiemmin tehty kaihileikkaus, joka on voinut vaurioittaa sarveiskalvon sisäkerroksen endoteelisoluja. Aiemmin tehty sarveiskalvon taittovoimaa muuttava lasertoimenpide ei ole este sarveiskalvon luovutukselle, sillä luovuttajan sarveiskalvosta voidaan silloin ottaa takakerrossiirre.
Kudospankin henkilökunta auttaa hoitavia yksiköitä selvittämään vainajien sopivuutta luovuttajiksi ja myönteisessä tapauksessa irrottaa sarveiskalvot. Suomessa sarveiskalvosiirteitä toimittavat Helsingin yliopistollisen sairaalan silmäpankki sekä Tampereen kudospankki ja solukeskus Regea. Kudospankissa irrotetuista sarveiskalvoista otetaan bakteeri- ja sieniviljelynäytteet, tarkistetaan endoteelisolujen määrä ja säilötään sarveiskalvot kudosviljelynesteessä. Siirteiden käsittely kestää kaksi viikkoa, minkä jälkeen siirteet on käytettävä kahden viikon kuluessa.
Tulevaisuudennäkymät
Rho-kinaasin estäjien (ROCK-estäjät) on osoitettu parantavan sarveiskalvon endoteelisolujen adheesiota, estävän apoptoosia sekä parantavan endoteelisolujen jakautumiskykyä ja endoteelisoluvaurion parantumista koe-eläinmalleissa (40). Alustavat tulokset potilastutkimuksista ovat lupaavia. Viljeltyjä ihmisen sarveiskalvon endoteelisoluja, jotka oli valmistettu Rho-kinaasin estäjien avulla, on ruiskutettu endoteelisoluvauriopotilaiden silmien etukammioon. Viiden vuoden seurannassa kymmenellä potilaalla yhdestätoista sarveiskalvon endoteelisolukerros oli toimiva ja näöntarkkuus parantui käytännössä normaaliksi (41,42). Rho-kinaasin estäjät voivat mahdollisesti vähentää sarveiskalvosiirteiden tarvetta tulevaisuudessa.
Markkinoilla on muutamia keinotekoisia sarveiskalvoja, Boston KPro tyyppi 1 ja 2 (43), AlphaCor (44) ja osteo-odontokeratoproteesi (OOKP), jossa käytetään hyväksi hammaskudosta (45). Keratoproteeseja käytetään yleensä erittäin vaikeissa tilanteissa, joissa sarveiskalvosiirteiden ennuste on erittäin heikko, kuten Stevens–Johnsonin oireyhtymässä tai limakalvopemfigoidissa. Leikkauksiin liittyy suuri merkittävien komplikaatioiden riski (46,47,48).
Tekosarveiskalvojen tutkimuksessa ollaan Suomessa eturintamassa. Tampereella on ensimmäisenä maailmassa kehitetty ihmisen kantasoluista koostuvien tekosarveiskalvojen 3D-tulostustekniikkaa (49). Rekombinantista ihmiskollageenista valmistetuilla tekosarveiskalvoilla on pienessä tutkimuksessa saavutettu lupaavia tuloksia (50).
Sarveiskalvon viljeltyjen kantasolujen käyttö silmän pintasairauksien hoidossa voisi vähentää hyljintäreaktioita ja parantaa siirteiden saatavuutta, ja siksi niitä on tutkittu aktiivisesti viime vuosina (51).
Sarveiskalvonsiirtojen lukumäärät on saatu suoraan asianomaisista sairaaloista. Kiitämme professori Tero Kivelää sarveiskalvon histologisesta kuvasta.
Olli Ala-Fossi: Luentopalkkio, kongressimatka (Thea Nordic).
Matts Linder: Luentopalkkio (Santen Oy).
Kari Krootila: Hyks silmäpankin vastaava johtaja. Asiantuntijalausunto, palkkio laitokselle (Vakuutus- ja rahoitusneuvonta Fine), luentopalkkiot (Alcon Nordic, Santen Oy), osakeomistus (Orion, Revenio), matka-, majoitus- ja kokouskulut laitokselle (Tekes, Business Finland).
- 1
- Vesaluoma M ym. Uusia hoitomenetelmiä sarveiskalvokirurgiassa. Duodecim 2007;123:2603–12.
- 2
- American Academy of Ophthalmology WR. 2020-2021 Basic and Clinical Science Course, Section 08: External Disease and Cornea. 2020-2021.
- 3
- Yanoff M, Duker J. Ophthalmology, 5. painos. Elsevier 2019.
- 4
- Wilson SE. Bowman’s layer in the cornea- structure and function and regeneration. Exp Eye Res 2020;195:108033.
- 5
- Schlötzer-Schrehardt U ym. Ultrastructure of the posterior corneal stroma. Ophthalmology 2015;122:693–9.
- 6
- DelMonte DW, Kim T. Anatomy and physiology of the cornea. J Cataract Refract Surg 2011;37:588–98.
- 7
- Miyagi H ym. Topical Rho-associated kinase inhibitor, Y27632, accelerates corneal endothelial regeneration in a canine cryoinjury model. Cornea 2019;38:352–9.
- 8
- Panda A ym. Corneal graft rejection. Surv Ophthalmol 2007;52:375–96.
- 9
- Price DA ym. Five-year graft survival of descemet membrane endothelial keratoplasty (EK) versus Descemet stripping EK and the effect of donor sex matching. Ophthalmology 2018;125:1508–14.
- 10
- Chauhan SK ym. Corneal lymphatics: Role in ocular inflammation as inducer and responder of adaptive immunity. J Clin Cell Immunol 2014;5:1000256.
- 11
- Taylor AW. Ocular immune privilege and transplantation. Front Immunol 2016;7:37.
- 12
- Hori J ym. Immune privilege in corneal transplantation. Prog Retin Eye Res 2019;72:100758.
- 13
- Zhong W ym. Angiogenesis and lymphangiogenesis in corneal transplantation - A review. Surv Ophthalmol 2018;63:453–79.
- 14
- Dietrich T, Bock F ym. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. J Immunol 2010;184:535–9.
- 15
- Diamond MA ym. Lymphatic vessels identified in failed corneal transplants with neovascularisation. Br J Ophthalmol 2019;103:421–7.
- 16
- Zirm EK. Eine Erfolgreiche Totale Keratoplastik. Von Graefes Archive Ophtalmology 1906;64:580–93.
- 17
- Wittig-Silva C ym. A randomized, controlled trial of corneal collagen cross-linking in progressive keratoconus: three-year results. Ophthalmology 2014;121:812–21.
- 18
- Hashemi H ym. Standard and accelerated corneal cross-linking long-term results: A randomized clinical trial. Eur J Ophthalmol 2020;30:650–7.
- 19
- Holopainen J, Krootila K. Sarveiskalvon kartiorappeuman uudet hoitomahdollisuudet Duodecim 2010;126:152–8.
- 20
- Sandvik GF ym. Does corneal collagen cross-linking reduce the need for keratoplasties in patients with keratoconus? Cornea 2015;34:991–5.
- 21
- Godefrooij DA ym. Nationwide reduction in the number of corneal transplantations for keratoconus following the implementation of cross-linking. Acta Ophthalmol 2016;94:675–8.
- 22
- Wiley LA ym. Tectonic lamellar keratoplasty utilizing a microkeratome and an artificial anterior chamber system. Cornea 2002;21:661–3.
- 23
- Yoo SH ym. Femtosecond laser-assisted sutureless anterior lamellar keratoplasty. Ophthalmology 2008;115:1303–7.e1.
- 24
- Salvetat ML ym. Higher order aberrations after keratoplasty for keratoconus. Optom Vis Sci 2013;90:293–301.
- 25
- Tsubota K ym. A new surgical technique for deep lamellar keratoplasty with single running suture adjustment. Am J Ophthalmol 1998;126:1–8.
- 26
- Sugita J, Kondo J. Deep lamellar keratoplasty with complete removal of pathological stroma for vision improvement. Br J Ophthalmol 1997;81:184–8.
- 27
- Anwar M, Teichmann KD. Big-bubble technique to bare Descemet’s membrane in anterior lamellar keratoplasty. J Cataract Refract Surg 2002;28:398–403.
- 28
- Melles GR ym. A new surgical technique for deep stromal, anterior lamellar keratoplasty. Br J Ophthalmol 1999;83:327–33.
- 29
- Manche EE ym. Deep lamellar keratoplasty using viscoelastic dissection. Arch Ophthalmol 1999;117:1561–5.
- 30
- Smadja D ym. Outcomes of deep anterior lamellar keratoplasty for keratoconus: learning curve and advantages of the big bubble technique. Cornea 2012;31:859–63.
- 31
- Gorovoy MS. Descemet-stripping automated endothelial keratoplasty. Cornea 2006;25:886–9.
- 32
- Melles GR ym. Descemet membrane endothelial keratoplasty (DMEK). Cornea 2006;25:987–90.
- 33
- Singh A ym. Systematic review and meta-analysis of clinical outcomes of Descemet membrane endothelial keratoplasty versus Descemet stripping endothelial keratoplasty/Descemet stripping automated endothelial keratoplasty. Cornea 2017;36:1437–43.
- 34
- Hamzaoglu EC ym. The first 100 eyes of standardized Descemet stripping automated endothelial keratoplasty versus standardized Descemet membrane endothelial keratoplasty. Ophthalmology 2015;122:2193–9.
- 35
- Yin J, Jurkunas U. Limbal stem cell transplantation and complications. Semin Ophthalmol 2018;33:134–41.
- 36
- Park CY ym. Keratoplasty in the United States: a 10-year review from 2005 through 2014. Ophthalmology 2015;122:2432–42.
- 37
- van Rooij J ym. Corneal transplantation for Fuchs´ endothelial dystrophy: A comparison of three surgical techniques concerning 10 year graft survival and visual function. PloS One 2018;13(10):e0203993.
- 38
- Maier AK ym. Fellow eye comparison of Descemet membrane endothelial keratoplasty and penetrating keratoplasty. Cornea 2013;32:1344–8.
- 39
- Anshu A ym. Risk of corneal transplant rejection significantly reduced with Descemet’s membrane endothelial keratoplasty. Ophthalmology 2012;119:536–40.
- 40
- Okumura N ym. The new therapeutic concept of using a rho kinase inhibitor for the treatment of corneal endothelial dysfunction. Cornea 2011;30 suppl 1:S54–9.
- 41
- Kinoshita S ym. Injection of cultured cells with a ROCK inhibitor for bullous keratopathy. N Engl J Med 2018;378:995–1003.
- 42
- Numa K ym. Five-year follow-up of first eleven cases undergoing injection of cultured corneal endothelial cells for corneal endothelial failure. Ophthalmology 2021;128:504–14.
- 43
- Greiner MA ym. Longer-term vision outcomes and complications with the Boston type 1 keratoprosthesis at the University of California, Davis. Ophthalmology 2011;118:1543–50.
- 44
- Hicks CR ym. AlphaCor: Clinical outcomes. Cornea 2006;25:1034–42.
- 45
- Liu C ym. The osteo-odonto-keratoprosthesis (OOKP). Semin Ophthalmol 2005;20:113–28.
- 46
- Tan A ym. Osteo-odonto keratoprosthesis: systematic review of surgical outcomes and complication rates. Ocul Surf 2012;10:15–25.
- 47
- Saeed HN, Shanbhag S, Chodosh J. The Boston keratoprosthesis. Curr Opin Ophthalmol 2017;28:390–6.
- 48
- Jirásková N ym. AlphaCor artificial cornea: clinical outcome. Eye (Lond) 2011;25:1138–46.
- 49
- Sorkio A ym. Human stem cell based corneal tissue mimicking structures using laser-assisted 3D bioprinting and functional bioinks. Biomaterials 2018;171:57–71.
- 50
- Fagerholm P ym. Stable corneal regeneration four years after implantation of a cell-free recombinant human collagen scaffold. Biomaterials 2014;35:2420–7.
- 51
- Vattulainen M ym. Modulation of Wnt/BMP pathways during corneal differentiation of hPSC maintains ABCG2-positive LSC population that demonstrates increased regenerative potential. Stem Cell Res Ther 2019;10:236.
Corneal transplantations
Corneal diseases can involve different layers of the corneal tissue. Corneal transplantation can be performed to target specifically only layers affected by a given disease. The different types of keratoplasty are penetrating keratoplasty (PKP), superficial (ALTK) and deep anterior lamellar keratoplasty (DALK), transplantation of endothelial cells supported by a thin layer of posterior stroma (DSAEK) or supported by Descemet’s membrane (DMEK) and limbal stem cell transplantation. The number of keratoplasties performed has increased in Finland. There has been a profound change in the types of keratoplasty performed in the last decade; the number of keratoplasties performed has decreased for penetrating keratoplasties and increased for endothelial keratoplasties.