Spiroergometria – käyttöaiheet, suoritus ja tulkinta
• Spiroergometriassa seurataan kliinisen kuormituskokeen aikana sydämen ja hengityksen toimintaa.
• Kliinisissä spiroergometrioissa selvitetään yleisimmin, johtuuko oireisto sydämen vai keuhkojen toiminnan häiriöistä vai lihasperäisistä syistä.
• Tutkimus mittaa erityisesti hapenkulutusta ja rasitukseen liittyvän lihasmetabolian aiheuttamia muutoksia hengitykseen.
• Toivomme tämän kirjoituksen selkeyttävän metaboliakynnysten nimityksiä.

Spiroergometriasta käytetään kansainvälisessä kirjallisuudessa etupäässä nimeä cardiopulmonary exercise test (CPT tai CPET): Kliinisen rasituskokeen EKG- ja hemodynaamisen seurannan lisäksi mitataan hengityskaasuja ja -tilavuuksia eli tutkitaan samanaikaisesti sekä sydämen että keuhkojen toimintaa rasituksessa.
Spiroergometrialaitteet kehitettiin 1920-luvun Saksassa. Hengityskaasut kerättiin näytepusseihin (Douglas-säkki), joista hengitysilma analysoitiin jälkikäteen (1). Tutkimuksen kehittyessä hengityskaasuja kerättiin rasituskokeen aikana sekoituskammioon, josta ne analysoitiin kokeen aikana 10–20 sekuntin välein. Nykyisin analyysit tehdään kuormituskokeen aikana henkäys henkäykseltä.
Tuloksista tärkeimpiä ovat hapenkulutus ja uloshengitysilman hiilidioksidituotto, joiden lisäksi mitataan hengitystoiminnan dynaamisia muutoksia suhteessa rasitusasteeseen. Hengitys-kaasuista voidaan arvioida myös veren maitohappopitoisuuden nousuun liittyvät hengityskaasuvasteet, joita kutsutaan ventilatorisiksi kynnyksiksi.
Spiroergometriatutkimuksia tehdään kliinisen fysiologian ja liikuntalääketieteen aloilla pääosin aikuisille, mutta myös kouluikäiset lapset kykenevät tutkimukseen. Käsittelemme tässä vain aikuisille tehtäviä tutkimuksia.
Spiroergometria on hyödyllinen monilla kliinisillä lääketieteen aloilla, koska tutkimuksen avulla voidaan paitsi arvioida potilaan fyysistä suorituskykyä ja sen mahdollista rajoittumista ja luonnetta, myös selvittää rasituksessa ilmenevien oireiden syitä. Se on tärkeä erilaisten toimenpide- ja työkykyselvityksien yhteydessä. Sen avulla kliinikko voi saada nopeammin selityksen potilaansa fyysiseen rasitukseen liittyvään oireeseen kuin pelkän kliinisen rasituskokeen (ergometria) avulla.
Kysymyksenasetteluna on usein se, onko suorituskyvyn rajoittuminen sydän- vai keuhkoperäistä. Spiroergometria voi auttaa näissä kysymyksissä myös perusterveydenhuoltoa ja säästää turhilta lisätutkimuksilta.
Menetelmä
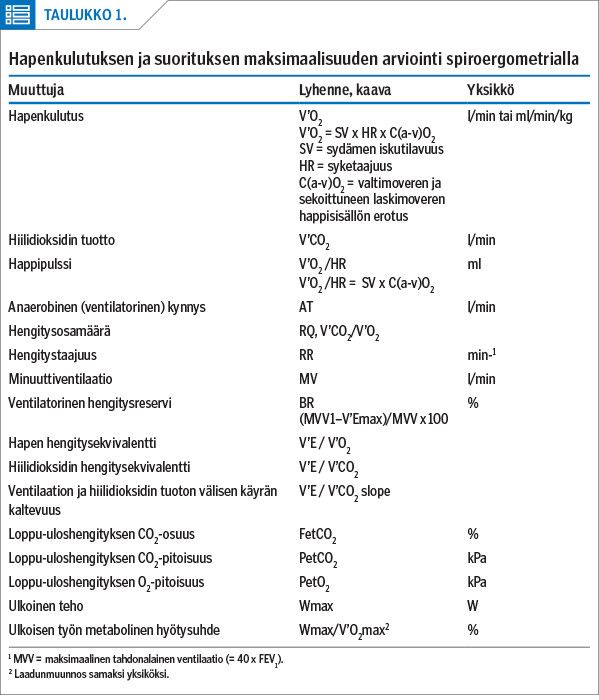
Spiroergometrian tilavuus- ja kaasuanalysaattorit kalibroidaan ennen kokeen alkua, ja otetaan lepospirometria, -verenpaine ja -EKG. Tämän jälkeen tutkittavalle asetetaan maski tai suukappale, jonka kautta laite mittaa hengitysvirtauksen ja josta hengityskaasut johdetaan analysaattoriin. Hengityskaasuista saadaan tulostettua runsaasti ventilaatiota (keuhkotuuletus) ja kaasujen vaihduntaa kuvaavia tuloksia (taulukko 1).
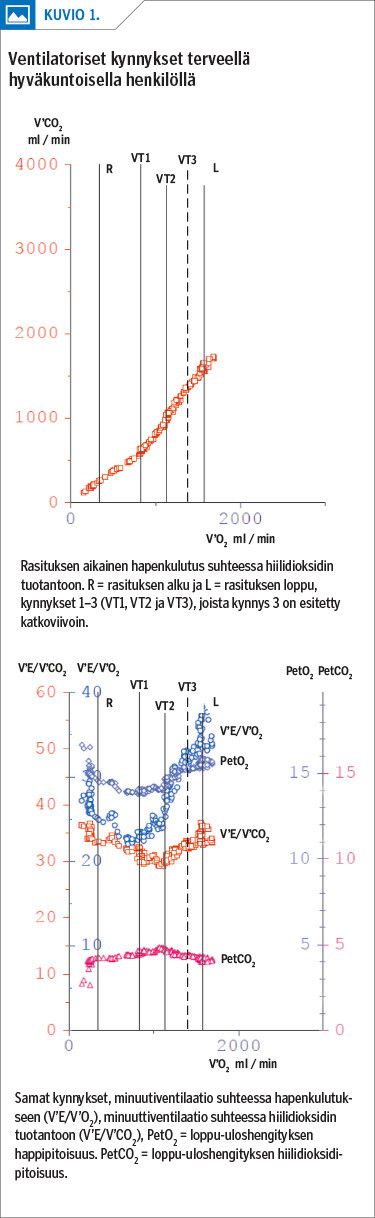
Kuormituskoe tehdään muuten tavanomaisesti EKG-, verenpaine- ja pulssioksimetriseurannassa. Rasituksen aikana pyritään mittaamaan virtaustilavuussilmukat 2–3 minuutin välein. Tämä tarkoittaa, että rekisteröidään rasituksen aikaista kertahengityksen syvyyttä, joka suhteutetaan alkumittauksissa tehtyyn spirometriaan. Näin syntynyttä hengityssilmukkaa voidaan verrata lepotilan spirometriaan ja tehdä johtopäätöksiä hengitysmekaniikasta.
Hengityskaasujen ja -virtauksen seuranta lopetetaan yleensä rasitusvaiheen loputtua. Palautumisvaiheen aikana seurataan FEV1-arvoja (uloshengityksen sekuntikapasiteetti), joista voidaan tehdä arvioita mahdollisesta keuhkoputkien ahtautumisesta tai niiden palautuvuudesta. Tutkimukselle on tavanomaiset rasituskokeen vasta-aiheet (2).
Hapenkulutus
Tärkein spiroergometrian muuttuja on hapenkulutus (V’O2), joka rasituksessa moninkertaistuu lepotasoon verrattuna ja kuvaa tutkittavan sydämeen ja hengitykseen liittyvää suorituskykyä. Maksimaalinen hapenkulutus (V’O2max) terveellä henkilöllä riippuu sukupuolesta, koosta ja kunnosta. Se pienenee iän myötä maksimisykkeen ja sydämen iskutilavuuden pienentyessä, mutta myös monen sairauden yhteydessä (liitetaulukko 1).
Hapenkulutus (V’O2) koostuu toisaalta sydämen pumppaustoiminnasta, toisaalta ääreisverenkiertoa kuvastaa valtimoveren ja laskimoveren happisisältöjen erotus (C(a–v)O2), johon vaikuttavat hemoglobiinipitoisuus, keuhkorakkuloiden tuuletus ja keuhkojen diffuusiokapasiteetti (3,4,5) (kaava 1). Sentraalista pumppaustoimintaa kuvaavat sydämen vasemman kammion iskutilavuus (SV) ja syke (HR), joista lasketaan sydämen aikayksikössä pumppaama verimäärä eli minuuttitilavuus (liitekuvio 1).
Kaava 1. Hapenkulutus
V’O2 = SV x HR x (C(a–v)O2),
jossa SV = sydämen iskutilavuus, HR = syke, (C(a–v)O2) = valtimoveren ja laskimoveren happisisältöjen erotus
Rasituksessa lihaksen sisäisen verenkierron määrä riippuu sydämen minuuttitilavuuden lisäksi lihaskudoksessa tapahtuvasta valtimoiden laajentumisesta, verenkierron jakautumisesta ja hiussuonien tiheydestä. Hapenottokyky voi heikentyä myös ääreisvaltimoiden ahtautumisesta, ääreisverenkierron säätelyn häiriöstä tai lihassolujen aineenvaihduntakapasiteetin heikentymisestä lihassairauden – tai terveellä liikunnan puutteen – vuoksi.
Hapenkulutus ilmoitetaan usein metabolisina yksikköinä (MET). Se arvioidaan ergometrias-sa mitatun tehon (wattia) avulla, jolloin tämä epäsuora arvio perustuu keskimääräisen lepohapenkulutuksen kerrannaisiin (1MET = 3,5 ml/min/kg). MET-arvoista on olemassa eri liikunta- ja työsuorituksiin laskettuja taulukoita (6).
Ventilaatiokynnykset
Rasituskokeen alkuvaiheessa hapenkulutus (V’O2) ja hiilidioksidin tuotanto (V’CO2) nousevat samassa suhteessa. Energialähteenä ovat sekä rasvahapot että glukoosi, joita molempia on saatavilla sekä verenkierrosta että varastoituneena. Aerobiseen glykolyysiin liittyvässä oksidatiivisessa fosforylaatiossa ATP-molekyylejä muodostuu nopeasti suuri määrä. Kuormituksen kasvaessa glukoosi on tärkein energialähde, jota saadaan sekä verenkierrosta että sen lihakseen varastoituneesta muodosta, glykogeenistä.
Kun kasvavaan energian tarpeeseen ei enää saada riittävästi hapekasta valtimoverta, elimistö alkaa tuottaa energiaa yhä enemmän anaerobisesti, jolloin glykolyysin tuotteena syntyy maitohappoa. Maitohapon puskurointi bikarbonaatin avulla (kaava 2) maitohappoasidoosin vähentämiseksi johtaa hiilidioksidin määrän kasvuun (liitekuvio 2), mikä stimuloi hengityskeskusta ja kiihdyttää ventilaatiota, jolloin V’CO2 ja minuuttiventilaatio (V’E) kasvavat alkuun hapenkulutuksen kanssa linjassa (kaava 2).
Kaava 2. Veren maitohapon puskurointi natriumbikarbonaatilla (NaHCO3) aiheuttaa hiilidioksidin (CO2) määrän kasvun
Maitohappo + NaHCO3 ➞ natriumlaktaatti + H2CO3 ↔ H2O + CO2
Tietyssä kohtaa puskurointikapasiteetti ylittyy ja veren maitohappopitoisuus pääsee kasvamaan (I maitohappokynnys), mikä näkyy hengityksessä minuuttiventilaation (V’E) kasvuna ja uloshengityksen hiilidioksidin (V’CO2) nopeana lisääntymisenä verrattuna hapenkulutukseen (I ventilaatiokynnys).
Rasituksen jatkuessa maitohappoa syntyy edelleen lisää, ja tietyssä vaiheessa maitohappopitoisuus jälleen kasvaa, kun aineenvaihdunta ei riitä sen eliminointiin (II maitohappokynnys). Tämä näkyy myös hengityksessä: Ventilaatio lisääntyy suhteessa hiilidioksidin tuottoon ja loppu-uloshengityksen hiilidioksidi alkaa vähetä selvästi (II ventilaatiokynnys) (liitetaulukko 2).
Rasitusaineenvaihdunnan seuranta määrittämällä laskimoveren maitohappopitoisuus rasituksen aikana on tärkeää erityisesti kestävyysurheilussa (7,8), jonka yhteydessä usein käytetään nimityksiä aerobinen ja anaerobinen kynnys. Kliinisessä spiroergometriassa kynnykset arvioidaan hengitysilmasta. Lääketieteellisessä kirjallisuudessa käytetään ensimmäisestä kynnyksestä useimmin nimitystä anaerobinen ja toisesta respiratorinen kompensaatiokynnys. Eri nimityksiä lähteittäin on kuvattu liitetaulukossa 2.
Nimityksien sekavuus voi liittyä rasitusmuotoon (polkupyörä vs. juoksumatto) tai kuormaportaisiin ja niiden kestoon, jolloin anaerobinen kynnys voisi vastata pitkillä (3–4 minuutin) portailla kynnystä 2 ja lyhyillä (yleensä 1 minuutin) loivemmin nousevilla portailla saataisiin paremmin esiin molemmat kynnykset 1 ja 2 (17). Maksimaalisessa rasituksessa hyväkuntoisella henkilöllä voidaan nähdä kolmaskin kynnys, jossa ventilaatio kiihtyy edelleen ja kompensaatiomekanismit ovat täysin riittämättömät.
Koska nimitykset edellä kuvatun kaltaisesti vaihtelevat puhujan ja kirjoittajan mukaisesti, on ehdotettu, että puhuttaisiin kynnyksistä 1–2 (18) (+ tarvittaessa kynnys 3), jotka ilmoitetaan sillä hapenkulutus- tai syketasolla, jolla ne ilmenevät. Parhaiten ne ovat todettavissa graafisesti (kuvio 1). Koska viime aikoina liikuntalääketieteen puolella on alettu suosia tätä nimeämistapaa (9,10), olisi mielestämme suositeltavaa, että myös muuten siirryttäisiin tähän käytäntöön.
Suorituksen maksimaalisuuden arvioiminen
Spiroergometrian tulosprofiilista voidaan päätellä, onko rasitus ollut riittävä. Hengitysosamäärän, joka on hiilidioksidin tuoton ja hapenkulutuksen suhde (RQ tai RER, V’CO2/V’O2), tulee nousta yli arvon 1, jotta suoritusta voidaan objektiivisesti pitää riittävän edustavana ja maksimaalisena. Hapenkulutuksen nousun pysähtyminen rasituksen loppuvaiheessa on myös merkki maksimaalisen aerobisen kapasiteetin saavuttamisesta.
Muita rasituksen maksimaalisuuden arviointiin käytettäviä parametreja ovat hengitystaajuuden kasvu (vähintään 35/min) sekä syketaajuuden arvioidun tai tiedetyn maksimin saavuttaminen. Spiroergometriatutkimuksessa, kuten kliinisessä rasituskokeessakin, pyritään oirerajoitteiseen maksimiin siten, että subjektiivinen rasitusaste on henkilön maksimista noin 90 % (rasittavuustuntemus Borgin asteikolla 17–19/20)(19).
Suorituskykyä rajoittavat tekijät
Hengitykseen liittyvä rajoitttuminen
Keuhkojen tuuletusta kuvaa minuuttiventilaatio (V’E). Ventilatorinen hengitysreservi (BR) (taulukko 1, liitetaulukko 1) (4,5) pienenee erityisesti ventilaatiotoimintaa pienentävien keuhkosairauksien ja hyperventilaation yhteydessä. Normaalisti hengitysreserviä jää rasituskokeessa vähintään 30 % maksimaalisesta tahdonalaisesta ventilaatiokapasiteetista (MVV) (taulukko 1), mutta erittäin hyväkuntoisella se voi jäädä pienemmäksikin.
Spiroergometrian yhteydessä voidaan mitata myös keuhkotuuletuksen tarkoituksenmukaisuutta rasituksen aikana. Hyperventilaatiossa keuhkotuuletus kasvaa voimakkaammin kuin hiilidioksidin tuotanto ja hapenkulutus (hengitysekvivalentit V’E/V’CO2 ja V’E/V’O2) suurenevat ja uloshengitysilman hiilidioksiditaso loppu-uloshengityksessä (FetCO2) pienenee; hypoventilaatiossa löydös on päinvastainen. Hyperventilaatio rasituksessa voi johtua hengityksen säätelyn häiriöstä ilman osoitettavaa fyysistä sairautta tai liittyä sekundaarisena tai kompensatorisena tekijänä keuhkosairauteen (astma, keuhkokudoksen sairaudet) tai sydänsairauteen.
Keuhkosairauksien yhteydessä suorituskyvyn rajoittuminen voi johtua keuhkoputkien ahtautumisesta (keuhkoahtaumatauti, astma), keuhkotilavuuden pienenemisestä (keuhkoresektion jälkitila, rintaontelon epämuodostuma, keuhkokudoksen sairaudet) tai keuhkojen kaasujenvaihduntakyvyn alenemisesta (keuhkokudoksen sairaudet, keuhkoembolian jälkitila).
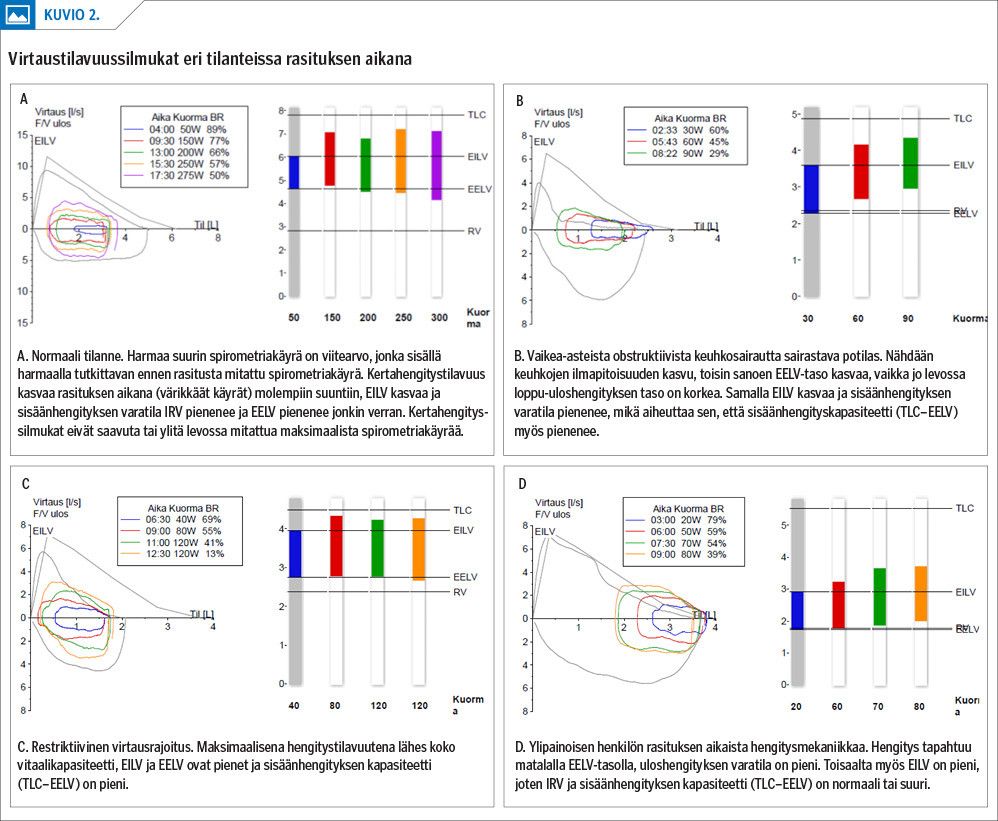
Hengitysvirtauksen rajoittumista rasituksessa voidaan arvioida aikaisemmin kuvatuilla virtaustilavuussilmukoilla (kuvio 2). Virtausrajoituksella tarkoitetaan sitä määrää kertahengitystilavuutta, jossa uloshengitysvirtaus saavuttaa tai ylittää levossa mitatun maksimaalisen spirometrian virtauksen (20). Mitä suurempi on virtausrajoitustilavuus, sitä vaikeampi on keuhkojen tuuletusmekaniikan häiriö, ja sitä enemmän potilas joutuu käyttämään lihasvoimaa uloshengityksessä rasituksen aikana, jolloin hengitystyön määrä kasvaa ja ilmaantuu hengenahdistusta.
Liitetaulukossa 1 on esitetty eri tilojen vaikutusta spiroergometrian tuloksiin. Keuhkoahtaumataudissa (COPD) tyypillinen löydös on palautumaton keuhkoputkien ahtautuminen, joka ei merkitsevästi muutu rasituksen aikana (21). Virtaustilavuussilmukoissa näkyy keuhkojen ilmatäyteisyyden kasvu, jossa tyypillisinä piirteinä on rasituksessa kasvava loppu-uloshengitystilavuus, sisäänhengityksen varatilan pieneneminen (kuvio 2) ja kuolleen tilan osuuden kasvu (22). Sisäänhengityskapasiteetin pieneneminen voi aiheuttaa hyperkapniaa (hiilidioksidin kertymä), rasitushypoksemiaa (vähähappisuus) ja pahentaa hengenahdistusoiretta (22,23,24).
Mikäli COPD-potilaalla on keuhkolaajentuman aiheuttama diffuusiovajaus, kehittyy rasituksessa usein hypoksemia (25). Astma tai COPD ilman keuhkolaajentumaa aiheuttavat rasitushypoksemiaa vasta hyvin pitkälle edenneenä. Myös astmassa voidaan nähdä rasituksessa keuhkoputkien ahtautumiseen liittyvää virtauksen rajoittumista ja sekundaarista hyperventilaatiota. Rasitusastmareaktio (jossa tapahtuu merkitsevä FEV1:n pieneneminen, ≥ 15 %) kehittyy yleensä vasta 4–10 minuuttia rasituksen jälkeen ja palautuu seurannassa itsestään tai keuhkoputkia avaavalla lääkkeellä.
Keuhkokudoksen sairauksissa tyypillisiä löydöksiä rasituksessa ovat suuri hengitystaajuus, pienentynyt hengitysreservi, pieni kertahengitystilavuus ja ventilaation kasvu suhteessa hapenkulutukseen (VE/VO2) ja hiilidioksidin tuotantoon (VE/VCO2) (sekundaarinen hyperventilointi) sekä diffuusiokapasiteetin pienenemisesta johtuva rasituksessa syvenevä hypoksemia (15,26,27). Rasituksen aikana kertahengitystilavuus on restriktiossa lähes vitaalikapasiteetin suuruinen (kuvio 2).
Lihavuuteen liittyvä rajoittuminen
Lihavan henkilöllä rintakehän ja vatsaontelon rasvakudos aiheuttaa rintaontelon tilavuuden ja seinämien venyvyyden (komplianssin) pienenemistä, jolloin uloshengityksen varatila pienenee ja pieniin hengitysteihin voi tulla dynaamista ahtautumista (28). Tällöin hapenkulutus ja hengitystyö kasvavat usein jo alkurasituksessa, koska keuhkojen laajeneminen sisäänhengityksessä tapahtuu suurentunutta vatsaontelon painetta vastaan (29,30,31), jolloin vaaditaan suurempaa hapenkulutusta tehoyksikköä kohden verrattuna normaalipainoiseen henkilöön (ulkoisen työn metabolinen hyötysuhde, Wmax/VO2max pienenee).
Virtaustilavuussilmukoissa lihavuuden yhteydessä on nähtävissä pienentynyt loppu-uloshengitystilavuus ja virtausrajoittuminen (kuvio 2). Erityisesti keskivartalolihavilla keuhkojen alueellinen ventilaatio-perfuusiosuhteen häiriö aiheuttaa makuulla hypoksemian, joka korjautuu istuma-asennossa ja rasituksessa (31). Suurentunut hengitystyö ja keuhkomekaniikan häiriöt lihavilla aikaansaavat oireilua, joka aistitaan rasituksessa hengästymisenä. Ylipainossa hapenkulutus suhteutettuna painoon on usein pieni, mikä voi vaikuttaa suorituskykyyn. Sairaalloisen lihavien kohdalla laihduttaminen parantaa paitsi suorituskykyä merkittävästi, myös kaasujenvaihduntaa ja hengitysmekaniikkaa rasituksessa (32,33,34).
Sydänperäinen rajoittuminen
Sydänperäisessä suorituskyvyn rajoittumisessa syynä on useimmiten sydänsairauteen liittyvä pieneksi jäävä sydämen iskutilavuus (SV) (35,36), jolloin syketaajuus pyrkii kompensatorisesti kasvamaan, kuten sydämen rytmihäiriöissä, eteisvärinässä, sydänlihaksen iskemiassa tai runsaiden lisälyöntien yhteydessä. Kun sydämen minuuttitilavuus jää pieneksi, verenpainevaste rasituksessa voi jäädä poikkeuksellisen matalaksi. Tällöin hapenkulutus (V’O2) ja happipulssi (V’O2/HR) jäävät pieniksi ja samalla ääreisverenkierron tehokkuus pienenee (5).
Sydämen vajaatoiminnassa minuuttiventilaatio kasvaa yleensä nopeasti rasituksen aikana myös suhteessa hiilidioksidin tuotantoon (V’E/V’CO2-käyrän kaltevuus kasvaa). Tämä liittyy varhain ilmaantuvaan maitohappoasidoosiin (35). Lisäksi nähdään keuhkojen hukkatilavuuden kasvua, joka liittyy lisääntyneeseen ventilaation ja perfuusion epäsuhtaan ja pinnalliseen hengitykseen (37,38,39). Mekanismiin liittyy myös keuhkojen verentungos ja sen seurauksena keuhkokudoksen jäykistyminen (36). Kroonisessa vajaatoiminnassa kehittyy usein restriktiivinen ventilaatiotoiminnan häiriö, jossa taustalla voi olla myös hengityslihaksien ja luurankolihaksien toiminnan heikentymistä (35,37).
Sydämen vajaatoimintapotilaalla voidaan rasituksen aikana nähdä hengityksessä virtausrajoittuminen, jolle on tyypillistä pieni uloshengityksen lopputilavuus (kuvio 2), koska keuhkojen komplianssi pienenee. Löydös muistuttaa lihavan henkilön rajoitusta, mutta spirometrian tulos on usein huomattavan restriktiivinen. Fyysinen harjoittelu näkyy sydämen vajaatoimintapotilailla paitsi maksimaalisen V’O2:n ja kynnysten kasvuna, myös V’E/V’CO2:n pienentymisenä (40).
Vähentynyt hapenkulutus sydänsairauden yhteydessä kertoo potilaan huonosta ennusteesta. Toinen tärkeä ennusteellinen suure on V’E/V’CO2-käyrän kaltevuus, joka noustessaan rasituksessa yli 30:n ennustaa ennenaikaista kuoleman riskiä sydänpotilailla (41,42,32). V’E/V’CO2-kaltevuus on kuitenkin epäspesifinen suure, joka kasvaa myös hyperventilaation yhteydessä, ja jota voi esiintyä myös esimerkiksi COPD:ssä tai astmassa (12,34). Vaikeassa vajaatoiminnassa voidaan nähdä oskillatorinen ventilaatio, joka ilmenee ventilaation voimakkaana vaihteluna levossa ja rasituksessa. Sen mekanismit ovat monimutkaiset ja osin vielä epäselvät, mutta siihen liittyvät vajaatoiminnan aiheuttama ventilaatio-perfuusioepäsuhta ja hukkaventilaatio (44).
Lopuksi
Tavallinen kliininen rasituskoe on hyvä tutkimus silloin, kun kysymyksenasetteluna on sepelvaltimotaudin tai rasitukseen liittyvien rytmihäiriöiden toteaminen tai ennusteen arviointi. Rasituksessa ilmenevän hengenahdistuksen yhteydessä spiroergometria voi selvittää oireen taustan. Jos hengenahdistuksesta kärsivällä potilaalla on ennestään keuhkosairaus, on spiroergometria usein paras valinta.
Työkyvyn arvioinnissa spiroergometria auttaa arvioimaan suorituskykyä rajoittavia tekijöitä monipuolisemmin ja suorituksen maksimaalisuutta paremmin kuin kliininen rasituskoe. Myös liikuntaharjoittelun ohjeistuksessa ja potilaalle turvallisen rasitustason löytämisessä spiroergometria on hyödyllinen työväline.
Spiroergometria voi antaa merkittävää lisätietoa myös perusterveydenhuollon kysymyksenasetteluissa. Liikuntalääketieteessä se on tärkeä urheilijoiden seurannassa. Spiroergometriassa mitatut ventilatoriset kynnykset (aerobinen, anaerobinen ja respiratorinen kompensaatiokynnys) ovat kuitenkin nimityksiltään vaihdelleet ja niitä on käytetty sekaisin, mikä on tuonut sekaannusta spiroergometrian tulkintaan. Toivomme, että asia selkeytyisi esimerkiksi esittämällämme tavalla ja nimitykset ventilaatiokynnys 1 ja 2 vakiintuisivat käyttöön.
Ei sidonnaisuuksia.
- 1
- Hollmann W, Prinz JP. Ergospirometry and its history. Sports Med 1997;23:93.
- 2
- Laukkanen J, Nieminen T, Savonen K, Kervinen K, Poutanen T, Raatikainen P. Kliinisen rasituskokeen käyttö sydänsairauksissa – Suomen Kardiologisen Seuran työryhmän suositus. Suom Lääkäril 2016;71:630–41.
- 3
- Myers J, Froelicher VF. Haemodynamic determinants of exercise capacity in chronic heart failure. Ann Intern Med 1991;115:377–86.
- 4
- Wasserman K. Diagnosing cardiovascular and lung pathophysiology from exercise gas exchange. Chest 1997;112:1091–101.
- 5
- Wasserman K, Hansen JE, Sue DY ym. Exercise testing and interpretation. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins 2012.
- 6
- Ainsworth BE, Haskell WL, Herrmann SD ym. Compendium of physical activities: a second update of codes and MET values. Med Sci Sports Exerc 2011;43:1575–81.
- 7
- Aunola S, Rusko H. Reproducibility of aerobic and anaerobic thresholds in 20–50 year old men. Eur J Appl Physiol Occup Physiol 1984;53:260–6.
- 8
- Uusitalo ALT, Laitinen T, Väisänen SB, Länsimies E, Rauramo R. Effects of endurance training on heart rate and blood pressure variability. Clin Physiol & Func Im 2002;22:173–9.
- 9
- Cerezuela-Espejo V, Courel-Ibáñez J, Morán-Navarro R ym. The relationship between lactate and ventilatory thresholds in runners: validity and reliability of exercise test performance parameters. Front Physiol 2018;9:1–7.
- 10
- Pallarés JG, Morán-Navarro R, Ortega JF ym. Validity and reliability of ventilatory and blood lactate thresholds in well-trained cyclists. Plos One 2016;11:e0163389.
- 11
- Faude O, Kindermann W, Meyer T. Lactate threshold concepts. How valid are they. Sports Med 2009;39:469–90.
- 12
- Meyer T, Lucia A, Earnest CP, Kinderman W. A conceptual framework for performance diagnosis and training prescription from submaximal gas exchange parameters – theory and application. Int J Sports Med 2005;26(suppl 1):S38–48.
- 13
- Seiler S. What is best practice for training internsity and duration distribution in endurance athletes? Intern J Sports Physiol and Performance 2010;5:276–91.
- 14
- ATS/ACCP Statement on Cardiopulmonary Exercise Testing. Am J Respir Crit Care Med 2003;167:211–77.
- 15
- Balady GJ, Arena R, Sietsema K ym. Clinician’s guide to cardiopulmonary exercise testing in adults: scientific statement from the American Heart Association. Circulation 2010;122:191–225.
- 16
- Ward SA. Determinants of the physiological systems responses to muscular exercise in healthy subjects. Kirjassa: Palange P, Laveneziana P, Neder Jam Ward SA, toim. Clinical exercise testing. ERS monograph 80/2018;1–33.
- 17
- Roca J, Whipp BJ (co-chairmen), A.G.N. Agustí ym. ERS Task Force on Standardization of Clinical Exercise Testing. Clinical exercise testing with reference to lung diseases: indications, standardization and interpretation strategies. Eur Respir J 1997;10:2662–89.
- 18
- Westhoff M, Rühle KH, Greiwing A ym. Dtsch Med Wochenschr 2013;138:275–80.
- 19
- Sovijärvi A, Piirilä P, Laitinen T. Spiroergometria. Kirjassa: Kliinisen fysiologian ja isotooppilääketieteen perusteet. Duodecim 2018;73–85.
- 20
- Johnson BD, Weisman IM, Zeballos J, Beck KC. Emerging concepts in the evaluation of ventilatory limitation during exercise. The exercise tidal flow-volume loop. Chest 1999;116:488–503.
- 21
- Celli BR, MacNee W, Committee members. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004;23:932–46.
- 22
- O’Donnell DE, Parker CM. COPD exacerpations. Thorax 2006;61:354–61.
- 23
- O’Donnell DE, Revill SM, Webb KA. Dynamic hyperinflation and exercise intolerance in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:770–1.
- 24
- Díaz O, Villafranca C, Ghezzo H ym. Breathing pattern and gas exchange at peak exercise in COPD patients with and without tidal flow limitation at rest. Eur Respir J 2001;17:1120–7.
- 25
- Panos RJ, Eschenbacher W. Exertional desaturation in patients with chronic obstructive pulmonary disease. COPD 2009;6:478–87.
- 26
- Guazzi M, Adams V, Conraads V ym. Clinical recommendations for cardiopulmonary exercise testing data assessment in specific patient populations. Circulation 2012;126:2261–74.
- 27
- Raghu G, Collard HR, Egan JJ ym. ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis An Official ATS/ERS/JRS/ALAT Statement: Idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011;183:788–824.
- 28
- Pelosi P, Ravagnan I, Giurati G ym. Positive end-expiratory pressure improves respiratoy function in obese but not in normal subjects during anesthesia and paralysis. Anesthesiology 1999;91:1221–31.
- 29
- Sharp JT, Henry JP, Sweany SK, Meadows WR, Pietras RJ. The total work of breathing in normal and obese men. J Clin Invest 1964;43:728–39.
- 30
- Lin C-K and Lin D-D. Work of breathing and respiratory drive in obesity. Respirology 2012;17:402–11.
- 31
- Sood A. Altered resting and exercise respiratory physiology in obesity. Clin Chest Med 2009;30:445–54.
- 32
- Hakala K, Mustajoki P, Aittomäki J, Sovijärvi A. Improved gas exchange during exercise after weight loss in morbid obesity. Clin Physiol 1996;16:229–38.
- 33
- Babb TG, Wyrick, BL,Chase PJ ym. Weight loss via diet and exercise improves exercise breathing mechanics in obese men. Chest 2011;140:454–60
- 34
- Bernhardt V, Babb TG. Weight loss reduces dyspnea on exertion in obese women. Respir Physiol Neurobiol 2014;204:86–92
- 35
- Mezzani A, Agostoni P, Cohen-Solal A ym. Standards for the use of cardiopulmonary exercise testing for the functional evaluation of cardiac patients: a report from the Exercise Physiology Section of the European Association for Cardiovascular Prevention and Rehabilitation. J Cardiovasc Prev Rehabil 2009;16:249–67.
- 36
- Tsuneoka H, Koike A, Nagayama O ym. Prognostic value of cardiopulmonary exercise testing in cardiac patients with atrial fibrillation. Int Heart J 2012;53:102–7.
- 37
- Phillips DB, Collins SE, Stickland MK. Measurement and interpretation of exercise ventilatory efficiency. Front Physiol 2020;1–7.
- 38
- Guazzi M. Abnormalities in cardiopulmonary exercise testing ventilatory parameters in heart failure: pathophysiology and clinical usefulness. Curr Heart Fail Rep 2014;11:80–7.
- 39
- Smith JR, Van Iterson EH, Johnson BD, Borlaug B A, Olson TH. Exercise ventilator inefficiency in heart failure and in chronic obstructive pulmonary disease. Intern J Cardiol 2019;274:232–6.
- 40
- Kiilavuori K, Sovijärvi A, Näveri H, Ikonen T, Leinonen H. Effect of physical training on exercise capacity and gas exchange in patients with chronic heart failure. Chest 1996;110:985–91.
- 41
- Francis DP, Shamim W, Davies LC ym. Cardiopulmonary exercise testing for prognosis in chronic heart failure: continuous and independent prognostic value from VE/VCO2 slope and peak VO2. Eur Heart J 2000;21:154–61.
- 42
- Nanas SN, Nanas JN, Sakellariou D Ch ym. VE/VCO2 slope is associated with abnormal resting haemodynamics and is a predictor of long-term survival in chronic heart failure. Eur J Heart Failure 2006;8:420–7.
- 43
- Gitt AK, Wasserman K, Kilkowski C ym. Exercise anaerobic threshold and ventilatory efficiency identify heart failure patients for high risk of early death. Circulation 2002;106:3079–84.
- 44
- Kremser CB, O’Toole, MF, Leff AR. Oscillatory hyperventilation in in severe congestive heart failure secondary to idiopathic dilated cardiomyopathy or to ischemic cardiomyopathy. Am J Cardiol 1967;59:900–5.
Cardiopulmonary exercise testing – indications, performance and interpretation
In cardiopulmonary exercise testing (CPET or spiroergometry), in addition to ECG and blood pressure, respiratory gases and volumes are recorded and analysed during bicycle ergometry or treadmill exercise testing. In the clinical setting, the usual indication is to determine if lowered exercise capacity or symptoms are related to a cardiac, respiratory or muscular aetiology. CPET is also used to support physical training in patients. CPET provides information on respiratory mechanics and disturbances as well as on cardiac limitations. In sports medicine, the interest is to measure maximal oxygen uptake and to assess the ventilatory thresholds of muscular lactate metabolism. However, there has been confusion related to naming of the ventilatory thresholds, usually using aerobic, anaerobic or respiratory compensation threshold with varying meanings. We hope that this article will clarify this, speaking simply of ventilatory thresholds 1–2. CPET is usually performed in clinical physiology or sports laboratories, but CPET also offers useful information for both specialists and non-specialists in local health care units.