Sydäninfarkti mutta ei sepelvaltimotautia – mistä on kyse?
• Osalta sydäninfarktipotilaista ei löydy tyyppioireista ja löydöksistä huolimatta veritulppaa sepelvaltimoista. Tilaa kutsutaan MINOCAksi.
• Potilas on usein keski-ikäinen nainen, jolta puuttuvat klassiset sepelvaltimotaudin riskitekijät.
• MINOCA johtuu monenlaisista sairauksista ja vaatii lisätutkimuksia. Syy voi olla sydänperäinen tai ei-sydänperäinen.
• Hoitona käytetään asetyylisalisyylihappoa, statiinia ja angiotensiinikonvertaasin estäjää tai angiotensiinireseptorin salpaajaa.
• Ennuste on hieman parempi kuin varsinaisen sydäninfarktin sairastaneilla.
Verenkiertoelinten sairaudet ovat tärkein kuolinsyy Suomessa ja maailmalla (1,2). Noin kolmasosa ihmisistä kuolee niihin. Pelkästään sepelvaltimotauti aiheuttaa vuosittain Suomessa 60 000 sairaalakäyntiä, joista sepelvaltimokohtauksia on 22 000 (3).
Sepelvaltimokohtaus johtuu pääasiassa veritulpan aiheuttamasta äkillisestä sepelvaltimon tukkeumasta tai ahtaumasta. Sydäninfarkteja (ST-nousuinfarkti ja sydäninfarkti ilman ST-nousuja) niistä on noin 90 %. Noin 10 % johtuu epästabiilista angina pectoriksesta.
Tässä artikkelissa käsitellään vain sydäninfarkteja. Diagnoosi perustuu tyypillisesti käsivarsiin tai kaulaan säteilevään rintakipuun, EKG:n ST-välin nousuun tai laskuun ja verenkiertoon vapautuneeseen troponiiniin. Diagnoosi varmistetaan sepelvaltimoiden varjoainekuvauksella rannevaltimon kautta. Akuutti vaihe hoidetaan pallolaajennuksella.
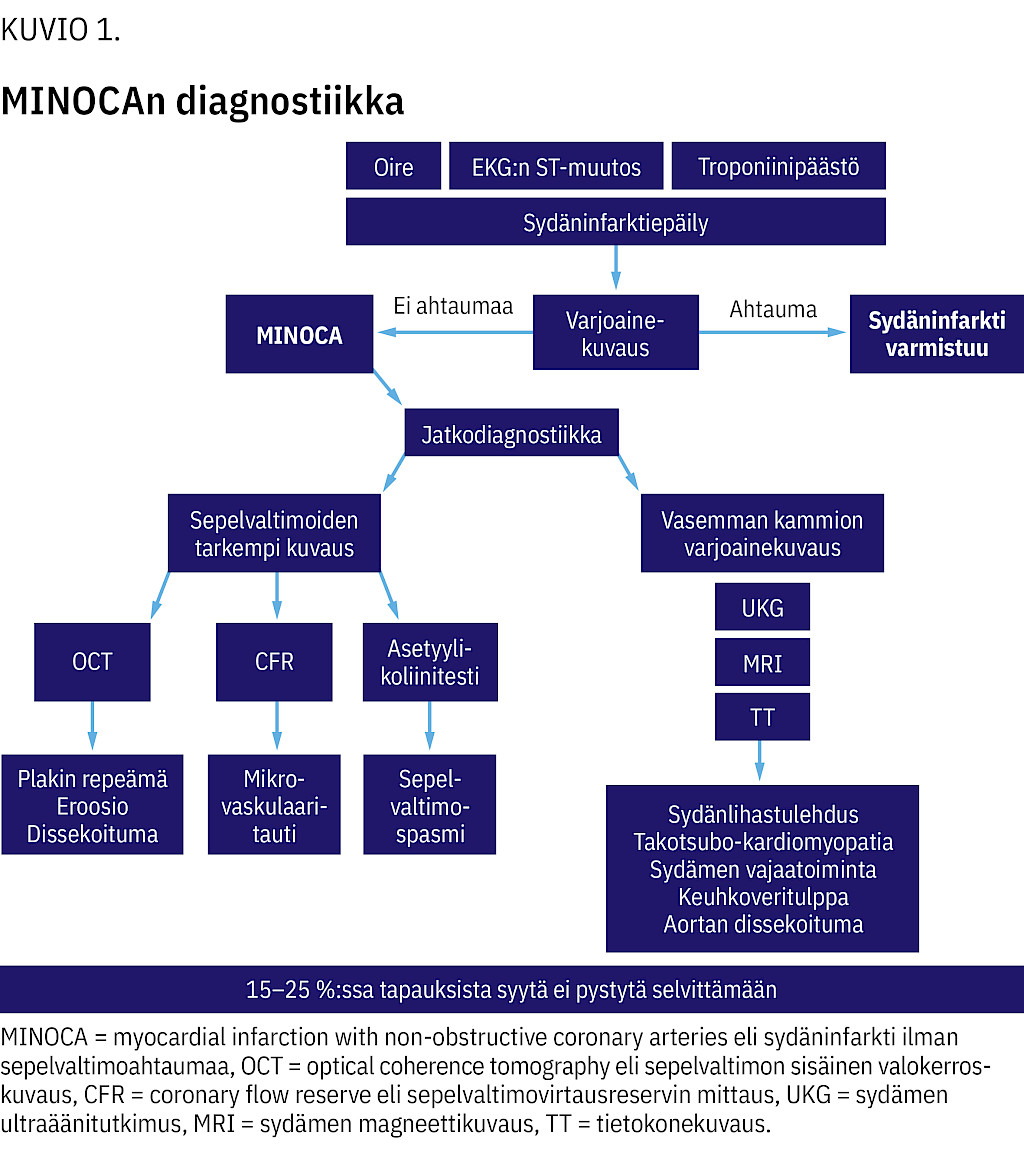
Tyyppioireista ja löydöksistä huolimatta infarktin aiheuttajaksi sopivaa ahtaumaa ei aina löydy. Tilannetta kutsutaan MINOCAksi (myocardial infarction with non-obstructive coronary arteries, sydäninfarkti ilman sepelvaltimoahtaumaa).
MINOCA on työdiagnoosi, joka koostuu erilaisista sairauksista ja vaatii lisätutkimuksia (4).
Epidemiologia
Kaikista sydäninfarktin taudinkuvalla sairaalaan otetuista potilaista 6–15 %:lla on MINOCA. He ovat tyypillisesti infarktipotilaita nuorempia. Jopa yli puolet heistä on naisia, joita infarktipotilaista on vain noin kolmannes (4,5).
MINOCA-potilailla on infarktipotilaita vähemmän klassisia sepelvaltimotaudin riskitekijöitä, kuten korkea kolesteroli, diabetes ja sukurasitus. Poikkeuksena verenpainetautia on suurin piirtein saman verran (5).
Troponiinin vapautuminen verenkiertoon on merkki sydänlihaksen vauriosta, mutta syynä voi olla muukin kuin infarkti. Kun kyseessä on MINOCA, pitää poissulkea muut troponiinipäästön aiheuttajat. Troponiineja I ja T on vain sydänlihaksessa (6).
Troponiinipäästön tyypillisiä syitä on esitetty taulukossa 1.
Taustasairaudet
Sepelvaltimoperäiset syyt
Infarktipotilaan diagnoosi varmistetaan ja sepelvaltimoahtauman aste määritellään varjoainekuvauksen perusteella. Suuret sepelvaltimot (halkaisija 1–5 mm) näkyvät siinä hyvin ja niiden ahtaumat pystytään arvioimaan luotettavasti.
Joskus verenkierron este on pienemmissä suonissa. Tällöin taudinkuva saattaa muistuttaa sydäninfarktia, mutta varjoainekuvauksessa ei nähdä selviä ahtaumia.
Sepelvaltimoiden mikrovaskulaaritauti on jopa puolella oireisista, kroonista ei-ahtauttavaa sepelvaltimotautia sairastavista, mutta heistä vain 8 %:lla on ollut sydäninfarkti (7).
Huomaamatta voi jäädä myös pieni plakkirepeämä, josta veritulppa on jo huuhtoutunut pois. Se selittää noin kolmanneksen MINOCA-tapauksista.
Tarkempaan diagnoosiin päästään tekemällä varjoainekuvauksen aikana sepelvaltimon suonensisäinen valokerroskuvaus (optical coherence tomography, OCT) tai myöhemmin sydämen magneettikuvaus. Niissä sydäninfarkti paljastuu syyksi 20–60 %:ssa tapauksista (5,7). Molemmat tutkimukset lisäävät kustannuksia ja niihin liittyy rajoituksia, minkä vuoksi niitä ei tehdä kaikille.
Jatkotutkimuksia ovat sepelvaltimoiden virtausdynamiikan kuvaus ja radiovesi-positroniemissiotomografia (PET). Virtausdynamiikkaa voidaan arvioida varjoainekuvauksen yhteydessä luotettavasti, kun sepelvaltimoon asennetaan virtausmäärää mittaava vaijeri (coronary flow reserve, CFR). Radiovesi-PET-tutkimusta pidetään kajoamattomana referenssitutkimuksena sydänlihaksen perfuusion arviossa (8).
Taustalla voi olla myös sepelvaltimospasmi. Se ei yleensä näy varjoainekuvauksessa ilman provokaatiota, joka tehdään ruiskuttamalla asetyylikoliinia sepelvaltimoihin.
Sepelvaltimospasmi on alidiagnosoitu, koska se on melko hankala diagnosoida. Tuoreen meta-analyysin mukaan se voi olla syy 30–50 %:ssa tapauksista, joissa rintakivun aiheuttaja jää epäselväksi (9).
Sepelvaltimon dissekoituma aiheuttaa samanlaisen taudinkuvan kuin sydäninfarkti. Se usein kaventaa sepelvaltimoa ja voi olla vaikea erottaa tavanomaisesta sydäninfarktista pelkästään varjoainekuvauksen perusteella.
Sepelvaltimon dissekoituma tulee tyypillisesti fertiili-ikäisille naisille, joilla ei yleensä ole valtimonkovettumistautia ja sydäninfarktit ovat hyvin harvinaisia. Sitä esiintyy raskauden aikana ja sen jälkeen. Alle 50-vuotiaiden naisten sydäninfarktien taustalla se on 22–43 %:ssa tapauksista.
Altistavia tekijöitä ovat fibromuskulaarinen dysplasia ja perinnölliset sidekudossairaudet, kuten Marfanin oireyhtymä (10).
Muut sydänperäiset syyt
Takotsubo-kardiomyopatia selittää 10–18 % MINOCA-tapauksista. Se on tyyppilöydös postmenopausaalisilla naisilla ja tulee tavallisesti äkillisen psyykkisen tai fyysisen rasituksen yhteydessä. Noin neljäsosalla potilaista ei ole mitään edeltävää tapahtumaa, johon kohtaus voitaisiin yhdistää. Taudinkuva muistuttaa usein sydäninfarktia.
Syynä pidetään katekoliamiinimyrskyä, joka aiheuttaa sydänlihastoksisuuden kautta lihaslaman. Tyypillinen on vasemman kammion supistumishäiriö, jonka vajaatoimintalääkitys korjaa 4–6 viikossa (5,7).
Sydänlihastulehdus on MINOCAn taustalla 10–33 %:ssa tapauksista. Potilaalla saattaa olla edeltävästi sydäninfarktia simuloivia rintakipuja, EKG:n ST-välin nousuja ja troponiinipäästö. Diagnoosiepäilys kasvaa, jos potilas on vastikään sairastanut infektion.
Sydänlihastulehdusta tavataan tyypillisesti alle 40-vuotiailla miehillä, joilla sepelvaltimotauti on varsin harvinainen. MINOCA-potilaan sydänlihastulehdus varmistuu usein sydämen magneettikuvauksessa (5,7).
Tyypin 1 sydäninfarktilla tarkoitetaan verisuonen seinämän plakkirepeämän aiheuttamaa veritulppaa ja siitä seurannutta sydäninfarktia. Tyypin 2 sydäninfarktissa sepelvaltimoissa ei ole ahtaumaa mutta potilaalla on esimerkiksi rytmihäiriö, jonka aikana sydänlihaksen hapenkulutus lisääntyy nopean sykkeen takia. Tässä infarktityypissä kyse on siis hapen tarjonnan ja kulutuksen epätasapainosta (5).
Edellä mainitut sairaudet tulisi huomioida MINOCAn jatkotutkimuksissa (kuvio 1). Jos lisätutkimusten jälkeen diagnoosi on yhä epäselvä, pitää poissulkea troponiiniarvon suurenemisen ei-sydänperäiset syyt.
Ei-sydänperäiset syyt
Myös keuhkoveritulppa voi aiheuttaa troponiinipäästön ja rintakivut. Silloin troponiiniarvon kasvu voi johtua äkillisestä sydämen oikean kammion paineennoususta ja venytyksestä tai iskeemisestä kuormituksesta. Kyse ei ole sydäninfarktista, vaan päästö on seurausta keuhkovaltimopaineen noususta.
Keuhkoveritulppa vaatii varmistukseksi keuhkovaltimoiden tietokonekuvauksen (5).
Potilaan oireet, EKG ja troponiinipäästö voivat joskus muistuttaa sydäninfarktia myös sepsiksessä, vaikeassa hypertensiossa tai aortan dissekoitumassa (6).
Sydämen ultraäänitutkimus kuuluu infarktipotilaan perustutkimuksiin ja saattaa paljastaa muita MINOCAn syitä. Esimerkiksi paksuuntunut sydänlihas voi viitata hoitamattomaan verenpainetautiin tai paksuntavaan sydänlihassairauteen.
Sydämen magneettikuvausta voidaan käyttää sydäninfarktin, sydänlihastulehduksen ja takotsubo-kardiomyopatian erotusdiagnostiikassa. Tutkimus tulee tehdä kahden viikon kuluessa sydäntapahtumasta (5).
Epäselvissä tapauksissa diagnoosi varmistuu parhaiten, kun potilaalle tehdään sekä sepelvaltimon valokerroskuvaus (OCT) että sydämen magneettitutkimus. Ne täydentävät toisiaan MINOCAn diagnosoinnissa (5).
Tarkoista tutkimuksista huolimatta 15–25 % tapauksista jää epäselväksi, jolloin lopullinen diagnoosi on MINOCA.
Hoito ja ennuste
MINOCA-potilaiden yhtenäisen hoitomallin määrittämistä hankaloittaa se, että sairauden aiheuttajia on monia. Hoidosta ei myöskään ole vielä sokkoutettuja tutkimuksia.
Lähinnä rekisteritutkimuksiin perustuen pysyväksi hoidoksi suositellaan asetyylisalisyylihappoa, statiinia ja angiotensiinikonvertaasin estäjää tai angiotensiinireseptorin salpaajaa.
Sepelvaltimotaudin hoidossa käytettävästä kaksoistrombosyytinestosta (esim. tikagrelori ja asetyylisalisyylihappo), beetasalpaajasta tai kalsiuminestäjästä ei ole havaittu olevan hyötyä (4,11). Poikkeuksen tekee sepelvaltimospasmi, jota hoidetaan kalsiuminestäjällä (7).
Ennuste riippuu taustalla olevasta tilasta.
Viiden vuoden kuolleisuus on noin 10 %, ja 25 % saa uuden kardiovaskulaaritapahtuman (6). Sydäninfarktissa ikävakioidut luvut ovat hieman huonommat.
Lisäksi neljäsosa kärsii rintakivuista vuoden kuluessa sairaalasta päästyään. Osuus on sama varsinaisissa sydäninfarkteissa (7).
Lopuksi
Sepelvaltimoiden varjoainekuvaus yleistyi vuosituhannen vaihteessa. Diagnostiikan parannuttua huomattiin, että tavallinen sydäninfarkti ei aina selitäkään sille tyypillisiä oireita. Noin 10 %:lla ja varsinkin naisilla sydänlihasvaurion syynä on jokin muu.
Naisten sydäninfarktidiagnooseihin kannattaakin suhtautua varauksellisesti, jos diagnoosia ei ole tehty huolellisesti.
Sydämen magneettikuvauksen käyttö on viime vuosina lisääntynyt ja edelleen tarkentanut diagnostiikkaa. Silti noin viidennes MINOCA-potilaista jää vaille lopullista diagnoosia. Kuvausmenetelmien kehittyminen pienentää osuutta tulevaisuudessa.
Käynnissä olevat sokkoutetut tutkimukset tulevat kertomaan, mikä on MINOCA-potilaan optimaalinen sekundaaripreventio (12).
Juha Sinisalo: Apurahat (Sydäntutkimussäätiö, Suomen Kulttuurirahasto, Valtion tutkimusrahoitus), luentopalkkiot (Amarin, Amgen, AstraZeneca, Novo Nordisk).
- 1
- Tilastokeskus. Kuolemansyyt. https://stat.fi/julkaisu/cl8slomfgpjyk0bw7wivrbxpa
- 2
- Vaduganathan M, Mensah GA, Turco JV, Fuster V, Roth GA. The global burden of cardiovascular diseases and risk: a compass for future health. J Am Coll Cardiol. 2022;80(25):2361–71.
- 3
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Kardiologisen Seuran asettama työryhmä. Sepelvaltimotautikohtaus. Käypä hoito -suositus 18.6.2023. www.kaypahoito.fi
- 4
- Lindahl B, Baron T, Albertucci M, Prati F. Myocardial infarction with non-obstructive coronary artery disease. EuroIntervention 2021;17:e875–e887.
- 5
- Occhipinti G, Bucciarelli-Ducci C, Capodanno D. Diagnostic pathways in myocardial infarction with non-obstructive coronary artery disease (MINOCA). Eur Heart J Acute Cardiovasc Care 2021;10:813–22.
- 6
- Thygesen K, Alpert JS, Jaffe AS ym.; Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth universal definition of myocardial infarction. J Am Coll Cardiol 2018;72:2231–64.
- 7
- Tamis-Holland JE, Jneid H, Reynolds HR ym.; American Heart Association Interventional Cardiovascular Care Committee of the Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Epidemiology and Prevention; Council on Quality of Care and Outcomes Research. Contemporary diagnosis and management of patients with myocardial infarction in the absence of obstructive coronary artery disease: a scientific statement from the American Heart Association. Circulation 2019;139:e891–908.
- 8
- Dilsizian V, Bacharach SL, Beanlands RS ym. ASNC imaging guidelines/SNMMI procedure standard for positron emission tomography (PET) nuclear cardiology procedures. J Nucl Cardiol 2016;23:1187–226.
- 9
- Mileva N, Nagumo S, Mizukami T ym. Prevalence of coronary microvascular disease and coronary vasospasm in patients with nonobstructive coronary artery disease: systematic review and meta-analysis. J Am Heart Assoc 2022;11:e023207.
- 10
- Saw J, Mancini GBJ, Humphries KH. Contemporary review on spontaneous coronary artery dissection. J Am Coll Cardiol 2016;68(3):297–312.
- 11
- Lindahl B, Baron D, Erlinge T ym. Medical therapy for secondary prevention and long-term outcome in patients with myocardial infarction with nonobstructive coronary artery disease. Circulation 2017;135:1481–9.
- 12
- Nordenskjöld AM, Agewall S, Atar D ym. Randomized evaluation of beta blocker and ACE-inhibitor/angiotensin receptor blocker treatment in patients with myocardial infarction with non-obstructive coronary arteries (MINOCA-BAT): rationale and design. Am Heart J 2021;231:96–104.
- 13
- Byrne RA, Rossello X, Coughlan JJ ym.; ESC Scientific Document Group. 2023 ESC guidelines for the management of acute coronary syndromes. Eur Heart J 2023;44:3720–826.