Tulevaisuuden insuliinihoito
Haiman beetasolut ovat elintärkeitä glukoositasapainon säätelyssä.
Niiden toimintahäiriö tai tuhoutuminen insuliininpuutosdiabeteksessa voidaan korvata vain insuliinikorvaushoidolla. Se on kuitenkin omahoidossa raskas, ja siihen liittyy pitkäaikaiskomplikaatioita.
Insuliinikorvaushoidon optimointi edellyttää kehon ulkopuolista biomekaanista keinohaimaa. Sen kehitys on pitkällä mutta haasteellista.
Ratkaisuna voivat olla kantasoluhoidot tai kantasolututkimuksessa kehitetty lääkehoito, joka kohdistuu taudin ydinmekanismiin.

Haiman beetasolujen tuho tai toiminnallinen häiriö johtaa insuliininpuutosdiabetekseen, jonka keskeinen hoitomuoto on insuliinikorvaushoito. Sen haasteet ovat raskaassa omahoidossa. Insuliinin korvaushoito on monimutkainen tehtävä. Siihen vaikuttavat monet fysiologiset tekijät, kuten insuliinin ja ravinnon imeytyminen, hormonaaliset seikat, infektiot ja stressi sekä psyykkiset ja sosiaaliset tekijät.
Insuliinihoitoinen diabetespotilas joutuu jatkuvasti ennakoimaan insuliinin annostelua vaihtuvissa tilanteissa. Tämä aiheuttaa arjessa merkittävää kuormitusta. Insuliinivalmisteet eivät myöskään ole vaikutusnopeudeltaan ja -ajaltaan verrattavissa elimistön insuliinineritykseen. Esimerkiksi ateriainsuliinien vaikutus alkaa yhä liian hitaasti ja kestää liian kauan. Pitkävaikutteiset insuliinit eivät myöskään pysty reagoimaan päivittäin muuttuvaan perusinsuliinin tarpeeseen. Lisäksi insuliinin annostelu pistämällä on työlästä.
Insuliinikorvaushoitoon liittyy akuutteja ja kroonisia komplikaatioita. Diabeteksen pitkäaikaiskomplikaatioiden ja sairaanhoidon kustannusten vähentämiseksi hoitotavoitteisiin tulisi pyrkiä lisäämättä hypoglykemioiden määrää (1,2). Nykyisillä hoitomalleilla ei ole päästy kansainvälisiin tavoitteisiin, eli HbA1c-tasoon alle 53 mmol/mol, yli 70 %:n aikaan tavoitetasolla (TIR; time in range, 3,9–10 mmol/l) ja hypoglykemioiden osuuteen alle 5 % ajasta (3).
Tutkimus insuliinin annostelun helpottamiseksi on kiivasta. Sitä tehdään kehittämällä parempia ja fysiologisempia insuliineja, päätöksentekoa avustavia sovelluksia potilaille sekä älykkäitä insuliinipumppuja, jotka annostelevat insuliinin itse. Tulevaisuudessa odotettavissa ovat kantasoluista tehdyt beetasolut, jotka poistaisivat koko ongelman. Tässä katsauksessa tarkastellaan tulevaisuuden insuliinihoidon toteuttamista.
Insuliinihoito lähivuosina
Uudet insuliinianalogit
Annostelun helpottamiseksi kehitteillä on yhä pitkävaikutteisempia insuliinianalogeja. Tulossa on faasi 3:ssa kerran viikossa annosteltava insuliini Icodec. Sen maksimikonsentraatio saavutetaan 16 tunnin kuluttua pistoksesta, ja puoliintumisaika on noin viikko (4). Pitkävaikutteista insuliinimolekyylia on muokattu niin, että on saavutettu albumiiniin sitoutuva, hitaasti vapautuva icodec-depot (4). Faasi 2:ssa on kerran viikossa annosteltava basaali-insuliini-Fc (BIF), IgG Fc-fuusioproteiini, jonka puoliintumisaika on 17 päivää (5).
Pikainsuliineista nopeampi aspartinsuliini on ollut markkinoilla vuodesta 2017, ja nopeampaa lisproinsuliinia odotetaan Suomeen. Lisproon on lisätty prostasykliinianalogi trepostiniili, joka toimii vasodilataattorina nopeuttaen insuliinin imeytymistä paikallisesti (5). Monipistoshoidossa olevilla tyypin 1 diabetespotilailla aterianjälkeinen glukoosiarvo oli tutkimuksessa selvästi matalampi kuin tavanomaista lisproinsuliinia käyttävillä (6). Myös aterioiden väliset hypoglykemiat vähenivät.
Inhaloitavat insuliinit
Inhaloitava insuliini tuli myyntiin 2006, mutta se vedettiin pois seuraavana vuonna. Syynä olivat lähinnä hengitysteihin liittyvät haittavaikutukset, kuten hengitystieinfektiot ja yskä, mutta myös muutamat raportoidut keuhkosyöpätapaukset (7).
Nykyinen technosphere-tekniikkaan perustuva mikropartikkeli-insuliini on ollut Yhdysvalloissa markkinoilla vuodesta 2015. Eurooppaan sitä ei ole vielä saatu. Aspart- tai lisproinsuliiniin verrattuna inhaloitavan insuliinin vaikutus alkaa tyypin 1 diabetespotilailla nopeammin, aterian jälkeiset verensokeritasot ovat matalammat ja hypoglykemioita on vähemmän (8,9). Yskä on yhä tavallinen sivuvaikutus ja bronkospasmit mahdollisia. Inhaloitavaa insuliinia ei siksi suositella tupakoitsijoille eikä potilaille, joilla on krooninen keuhkosairaus.
Suun kautta annosteltavat insuliinit
Suurimmat esteet suun kautta annosteltavan insuliinin käytölle ovat olleet mahalaukun happamuus ja mahalaukun entsyymit, kuten pepsiini, sekä suolen limakalvo. Entsyymit hajottavat insuliinin rakenteen, ja pääsy läpi suolen limakalvon on haasteellista myös insuliinille (10).
Viime vuosina on kuitenkin edistytty. Sekä pitkävaikutteisia että aterioilla otettavia insuliinitabletteja on tutkittu faasin 1 ja 2 tutkimuksissa tyypin 2 diabetespotilailla (11,12). Perusinsuliinina suun kautta otettava I338-insuliinitabletti toimi 8 viikkoa kestävässä tutkimuksessa yhtä hyvin kuin kerran vuorokaudessa pistettävä glargiini-insuliini (11). Ateriainsuliinina käytettävää insuliinitablettia, Tregopilia, verrattiin lumelääkkeeseen tyypin 2 diabetespotilailla, joilla ei ollut insuliinihoitoa. Annosteltuna 10–20 minuuttia ennen ateriaa ateriainsuliinitabletti pienensi aterianjälkeistä glukoosipitoisuutta 13–18 % verrattuna lumeeseen (12).
Glukoosipitoisuuteen reagoivat insuliinit
Glukoositason vaihteluun reagoiva insuliini olisi optimaalinen, jotta hypoglykemioilta ja glukoosipitoisuuden vaihtelulta vältyttäisiin. Glukoosisensitiivinen insuliinihoito luokitellaan periaatteellisesti kolmeen kategoriaan: 1) algoritmiin pohjautuva (closed-loop) insuliiniannostelu insuliinipumpun ja glukoosisensorin yhdistelmänä (ns. keinohaima), 2) polymeeripohjainen systeemi, jossa insuliini kapseloidaan glukoosisensitiiviseen polymeeriseen matriisipohjaiseen rakkulaan tai hydrogeeliin, ja 3) molekylaarinen glukoosisensitiivinen analogisysteemi. Siinä insuliinimolekyylissä on glukoosisensitiviinen osa, jolla saadaan aikaan glukoosisensitiviisiä muutoksia insuliinin hyötyosuuteen tai hormonaaliseen aktiivisuuteen (13).
Glukoosisensitiivisiä insuliineja on tutkittu 1970-luvulta lähtien, mutta vain muutamat valmisteet ovat edenneet kliinisiin tutkimuksiin (14). Terveen elimistön insuliinineritys on nopeata, ja ruokaillessa insuliinin määrä voi nousta nopeasti jopa 5–10 kertaiseksi. Tämä aiheuttaa haasteita glukoosisensitiivisten insuliinien kehitykselle: ihonalaiskudokseen annosteltu insuliini imeytyy verenkiertoon verrattain hitaasti (14).
Lupaavia lähestymistapoja glukoosisensitiivisen insuliinin kehittämiseen on useita, muun muassa insuliinin kapselointi polymeereihin esimerkiksi glukoosioksidaasin avulla. Glukoosioksidaasi on entsyymi, joka hapettaa glukoosin glukonihapoksi ja vetyperoksidiksi. Reaktion seurauksena polymeerin läpäisevyys muuttuu ja insuliinia vapautuu.
Ongelmana on kuitenkin polymeerien säilyminen ja pysyminen stabiilina elimistössä sekä immunogeenisyys: glukoosioksidaasin pääasiallinen lähde on sieni (Aspergillus niger). Myös insuliinin kaksiketjuisuutta on käytetty hyödyksi glukoosisensitiivisten insuliinien kehittämisessä: Insuliini koostuu kahdesta ketjusta, A ja B, ja haimassa insuliini on yksiketjuisessa muodossa proinsuliini + C-peptidi. Kun C-peptidi irrotetaan, muodostuu aktiivista insuliinia.
Kehitteillä on myös glukoosisensitiivinen katkaisija, joka muuttaa yksiketjuisen insuliinin aktiiviseksi kaksiketjuiseksi muodoksi, kun glukoosipitoisuus suurenee (14). Glukoosisensitiivisten insuliinien tutkimukset ovat nyt pääasiassa faasissa 1.
Älypumput
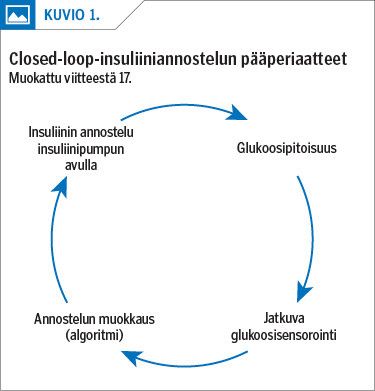
Lähivuosina todennäköisesti yleistyvät huomattavasti ns. älypumput (hybrid closed loop, HCL). Niissä insuliinin annostelua ohjaa algoritmi jatkuvan ihonalaisen glukoosisensoroinnin avulla. Diabeteksen hoidon tavoitteet (TIR, HbA1c, hypoglykemioiden osuus) saavutetaan älypumppujen avulla lapsilla ja aikuisilla huomattavasti useammin kuin millään muulla hoitovälineellä. Tavoitteiden saavuttaminen ei riipu edeltävästä hoitotasapainosta (15,16,17,18). Älykkäiden insuliinipumppujen luokittelu on esitelty taulukossa (taulukko 1) ja periaatteet kuviossa (kuvio 1).
Viime vuosina kehitys on ollut nopeata. Internetin avoimen lähdekoodin yhteisöt toivat ensimmäiset tee-se-itse-algoritmit insuliinin annosteluun jo viitisen vuotta sitten (18). Kaupallinen tason 4 insuliinipumppu (ns. hybridikeinohaima) tuli Yhdysvalloissa markkinoille 2017 ja Euroopassa 2018. Se säätää basaali-insuliinin annostelua ihonalaisen kudosglukoosiarvon ja sen muutosten mukaan (18). Tästä kehittyneempi versio tuli markkinoille 2020 (Minimed 780G, Medtronic). Sitä käytettäessä hiilihydraattien laskeminen ei ole enää yhtä tarkkaa ja algoritmi osaa annostella korjausinsuliinia (17).
Vuonna 2021 Suomessa tuli markkinoille toinen, jo useassa Euroopan maassa markkinoilla oleva letkullinen älykäs insuliinipumppu (Tandem T:slim Control IQ). Letkutonta älypumppua odotetaan Suomeen vuonna 2022 (Omnipod Horizon).
Ensimmäisestä tason 5 älykkäästä insuliinipumpusta (Beta Bionics, Inc) on julkaistu pieni, 13 tutkimushenkilön 21 vuorokautta kestänyt pilottitutkimus, jossa aika tavoitealueella oli varsin samaa tasoa kuin tason 4 älykkäillä insuliinipumpuilla: TIR 71,9 %, hypoglykemioita oli 2,7 % eikä vakavia hypoglykemioita esiintynyt ollenkaan (19,20). Tulos on varsin hyvä, kun otetaan huomioon, että algoritmille annetaan vain potilaan paino eikä hiilihydraatteja tarvitse laskea lainkaan. Halutessaan potilas voi antaa algoritmille ateriamerkin: onko kyseessä tavanomainen, suuri tai pieni ateria. Tämä ei kuitenkaan ole pakollista.
Sekä insuliinia että glukagonia annosteleva tason 6 älykäs bihormonaalinen insuliinipumppu on edennyt potilaiden arkielämässä tehtäviin tutkimuksiin asti. Seuranta-aika on tosin vielä lyhyt (11 vrk) (21). Pumppu paransi tutkittavien aikaa tavoitealueella huomattavasti: 61,9–78,4 %. Hypoglykemiat vähenivät 4,5–1,8 % (22). Hoidon haittapuolena oli pahoinvointi pienellä osalla potilaista.
On osoittautunut haasteelliseksi saada glukagonivalmiste säilyttämään tehonsa muuttumattomana pumpun säiliössä. Tutkimuksissa glukagonisäiliötä piti vaihtaa vuorokauden välein. Siksi valvontaviranomaisten hyväksyntää ei ole vielä saatu, ja yritykseltä (Beta Bionics, Inc) on tulossa ensin tason 5 älykäs insuliinipumppu (20).
Viime aikoina on tutkittu myös kahden hormonin pumppua, jossa insuliinin lisänä on amyliinianalogi pramlintidia. Haiman beetasolut tuottavat terveillä henkilöillä amyliinia, joka hidastaa vatsalaukun tyhjenemistä ja estää glukagonin eritystä vähentäen siten verensokeritason nousua aterian jälkeen. Tyypin 1 diabetespotilaalla amyliinin eritys on heikentynyt. Pienessä 24 tunnin tutkimuksessa pramlintidia annosteltiin vakioitu annos / insuliiniyksikkö kahden hormonin älykkäässä insuliinipumpussa. Hoitoa verrattiin älykkääseen insuliinipumppuun, jossa käytettiin vain insuliinia (22). Aika tavoitealueella nousi 74 %:sta 84 %:iin, mutta vatsaoireita esiintyi insuliini-pramlintidihoidossa enemmän kuin pelkällä insuliinilla (22).
Älypumppujen käytön yleistymistä estää paradoksaalisesti usein raha. Vuosikustannukset ovat suuremmat kuin tavanomaisessa insuliinipumppuhoidossa. Ruotsalaisessa tutkimuksessa tason 4 älypumppuhoidon katsottiin olevan kustannustehokasta, mutta silti etenkin aikuispotilaiden on vaikeata saada näitä laitteita (23).
Toisaalta useimpien maiden valvontaviranomaiset – myös Suomen – suhtautuvat kielteisesti tee-se-itse-järjestelmiin. Tätä ongelmaa yrittää ratkaista yhdysvaltalainen voittoa tavoittelematon organisaatio Tidepool. Se on jo aiemmin tehnyt menestyksekkäästi yhteistyötä insuliinipumppuja, glukoosisensoreita ja verensokerimittareita valmistavien yhtiöiden kanssa. Organisaatio on tuottanut alustan, johon nyt saadaan puretuksi lähes kaikkien diabeteksen hoitoon liittyvien laitteiden tiedot (www.tidepool.org).
Ajatuksena on, että potilas saa itse valita haluamansa pumpun (ns. ACE, alternate controlled-enabled pump, insuliinipumppu, joka pystyy toimimaan turvallisesti usean säätöalgoritmin kanssa). Lisäksi hän saa valita haluamansa glukoosisensorin (iCGM, integrated continuous glucose monitor) sekä säätöalgoritmin (iAGC, interoperable automated glycemic controller, algoritmi, joka pystyy käyttämään mitä tahansa hyväksyttyä glukoosisensoria ja insuliinipumppua insuliinin annosteluun älypuhelimen kautta) (kuvio 1).
Tidepool Loop on tehnyt ensimmäiset alustavat hakemukset Yhdysvaltain valvovalle viranomaiselle FDA:lle. Cambridgen yliopisto on kehitellyt vastaavan edullisemman säätöalgoritmin, joka on saanut CE-merkinnän Ison-Britannian ja EU:n markkinoille. Se toimii vain Android-puhelimella, tietyllä insuliinipumpulla ja yhdellä glukoosisensorilla. Algoritmi on toistaiseksi saatavilla vain Isossa-Britanniassa (https://camdiab.com/).
Älykynät ja hoitoa ohjaavat
älypuhelinsovellukset insuliinihoidossa
Teknologiasta on hyötyä myös niille potilaille, jotka eivät halua tai pysty käyttämään insuliinipumppua. Älypuhelimiin saatavat annoslaskurit ovat jo arkipäivää. Viime vuosina myös insuliinidataa on alettu siirtää näihin sovelluksiin suoraan insuliinikynistä. Puhutaan ns. älykynistä.
Suomessa lanseerataan NovoPen 6 -älykynä, jonka pistostiedot menevät Diasend-älypuhelinsovellukseen.
Ruotsalaisessa monikeskustutkimuksessa seurattiin älykynän vaikutusta diabeteksen hoitotasapainoon 94 potilaalla, joilla oli myös jatkuva glukoosisensorointi. Tässä prospektiivisessa, kontrolloimattomassa tutkimuksessa aika tavoitealueella lisääntyi 8,5 % ja ateriainsuliinin unohtamisia oli 43 % vähemmän kuin ennen älykynän käyttöönottoa (24).
Yhdysvalloissa on markkinoilla vastaava insuliinikynä InPen, joka on Bluetoothilla yhdistettävissä älypuhelinsovellukseen. Sovelluksessa on annosopas, joka ottaa huomioon myös aktiivisen insuliinin ajan, eli vastikään pistetyn insuliinin, kun seuraavaa annosta lasketaan (25). Medtronic osti vastikään InPenin, ja samaan sovellukseen saa glukoosisensorointikäyrän ja trendit Guardian Connect -glukoosisensorista (https://www.medtronicdiabetes.com/products/cgm-and-smart-pen). Advanced Technologies & Treatments for Diabetes -kongressissa 2020 esiteltiin älypuhelinsovelluksen kehittämistä. Vastedes potilas voisi saada esimerkiksi ohjeita insuliinin annosteluun tai lisähiilihydraattien nauttimiseen ennen liikuntaa.
Kantasoluterapia
Biologisessa hoidossa on otettu viime aikoina merkittäviä edistysaskelia. Beetasolukorvausterapia tyypin 1 diabeteksessa on jo käytössä: on tehty haimansiirtoja, ja elinluovuttajien haimasta eristettyjä saarekesoluja on siirretty tyypin 1 diabetesta sairastaville potilaille lupaavin tuloksin (26).
Ongelmana siirroissa on kuitenkin solujen saatavuus ja hoidon tehon hiipuminen vuosien mittaan. Diabetespotilaan elimistö tuhoaa sekä omia että siirrettyjä haiman beetasoluja (27). Koska hoito vaatii hyljinnänestolääkityksen, haimansiirrot ja saarekesolusiirrot on yleensä tehty potilaille, joille tehdään samalla tai on jo aiemmin tehty munuaisensiirto (27).
Kantasolut ovat periaatteessa ehtymätön beetasolujen lähde, joten ne antavat ratkaisun allogeenisiin siirtoihin liittyvään solujen saatavuusongelmaan (27). Kantasoluperäisissä hoidoissa insuliinia tuottavat solut saadaan alkion kantasolulinjoista (embryonic stem cells, ES cells) tai indusoiduista pluripotenteista eli erittäin monikykyisisistä kantasoluista (iPS cells).
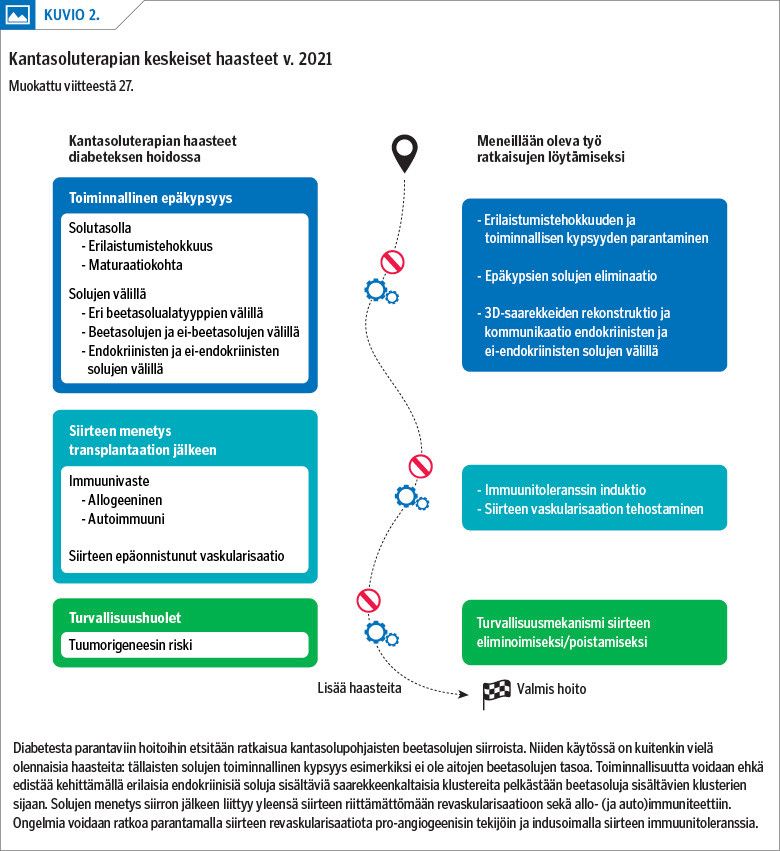
Indusoidut monikykyiset kantasolut tarjoavat erittäin mielenkiintoisen aihion sekä beetasolusiirtojen kehittämiseen että tautimekanismin selvittämiseen ja kohdennettujen yksilöllisten lääkehoitojen kehittämiseen (28). Kokeellisissa tutkimuksissa monikykyisistä kantasoluista kehitetyt pitkälle erilaistuneet, insuliinia erittävät solut siirretään kapselin sisällä ihon alle. Keskeisiä vielä ratkaistavia haasteita ovat riittävän pitkälle erilaistumisen ja solujen toiminnallisen kypsyyden saavuttaminen, hyljinnän esto ja kantasolujen käyttöön liittyvät turvallisuusseikat, kuten tuumorigeneesin välttäminen (kuvio 2) (27).
Ensimmäiset potilaskokeet kantasoluperäisillä insuliinia tuottavilla soluilla aloitettiin Yhdysvalloissa v. 2014. Tähän mennessä on rekisteröity neljä kliinistä tutkimusta kantasolusiirroista tyypin 1 diabeteksen hoidossa. Ensimmäisiä tuloksia odotetaan vuonna 2021 (27). Geeniterapian avulla voidaan myös kehittää uusia täsmähoitoja monogeeniseen diabetekseen ja tulevaisuudessa ehkä myös polygeeniseen diabetekseen (29).
Lopuksi
Insuliininpuutosdiabeteksen hoidossa on otettu viime vuosikymmeninä merkittäviä kehitysaskelia. Glukoosisensoroinnin kehitys ja saatavuus on vienyt omahoitoa merkittävästi eteenpäin. Insuliinihoito on silti yhä raskasta omahoidossa, ja sen optimointia tarvitaan hoitotavoitteisiin pääsemiseksi.
Teknologian kehitys on edistänyt diabeteksen hoitoa omaseurannassa, glukoosisensoroinnissa, insuliinin annostelussa ja closed loop -algoritmien kehityksessä merkittävästi lähelle kehonulkoisen keinohaiman kehitystä ja käyttöönottoa. Haasteita on kuitenkin vielä edessä.
Tulevaisuudessa insuliininannostelusovellusten algoritmit ohjannevat omahoitoa yhä enemmän myös monipistoshoidossa. Nähtäväksi jää, yleistyvätkö inhaloitava insuliini ja suun kautta annosteltava insuliini. Glukoosipitoisuuteen reagoivat insuliinit ovat yhä erittäin mielenkiintoinen tutkimushaaste. Kun kantasolututkimus, geenitutkimus ja geeniteknologia kehittyvät, ratkaisu insuliininpuutosdiabeteksen hoitoon voi löytyä kantasoluista erilaistuneiden insuliinia erittävien beetasolujen siirroista tai taudin ydinmekanismiin kohdentuvasta lääkehoidosta, joka on kehitetty kantasolututkimuksen tuloksena.
Anna-Kaisa Tuomaala: Konsultointi (Medtronic), apurahat (Medtronic), luentopalkkiot (Medtronic, Nordic Infucare, Abbott, Sanofi, Novo Nordisk), korvaus koulutusaineiston tuottamisesta (Medtronic), Advisory board -jäsenyys (Abbott, Medtronic, Sanofi).
Henna Cederberg-Tamminen: Luentopalkkiot (Novo Nordisk, Sanofi, Ipsen, Pfizer), matka-, majoitus- tai kokouskulut (MSD, Novo Nordisk).
- 1
- Nathan DM, Genuth S, Lachin J ym. Diabetes control and complications trial research group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977–86.
- 2
- Orchard TJ, Nathan DM, Zinman B. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA 2015; 13:45–53.
- 3
- Battelino T, Danne T, Bergenstal RM ym. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care 2019;42:1593–603.
- 4
- Rosenstock J, Bajaj H, Janež ym. Once-weekly insulin for type 2 diabetes without previous insulin treatment. N Engl J Med 2020;383:2107–16.
- 5
- Heise T, Chien J, Beals J ym. Basal Insulin Fc (BIF), a novel insulin suited for once weekly dosing for the treatment of patients with diabetes mellitus. J Endocr Soc 2021;5:S1:A329
- 6
- Klaff L, Cao D, Dellva MA ym. Ultra rapid lispro improves postprandial glucose control compared with lispro in patients with type 1 diabetes: Results from the 26–week Pronto–T1D study. Diabetes Obes Metab 2020;22:1799–807.
- 7
- Oleck J, Kassam S, Goldman JD. Commentary: why was inhaled insulin a failure in the market? Diabetes Spectr 2016;29:180–4.
- 8
- Seaquist E, Blonde L, McGill J ym. Hypoglycaemia is reduced with use of inhaled Technosphere® Insulin relative to insulin aspart in type 1 diabetes mellitus. Diabet Med 2020;37:752–9.
- 9
- McGill JB, Weiss D, Grant M ym. Understanding inhaled Technosphere Insulin: Results of an early randomized trial in type 1 diabetes mellitus. J Diabetes 2021;13:164–72.
- 10
- Xiao Y, Tang Z, Wang J ym. Oral insulin delivery platforms: strategies to address the biological barriers angew. Chem Int Ed 2020;59:20248.
- 11
- Halberg I, Lyby K, Wassermann K ym. Efficacy and safety of oral basal insulin versus subcutaneous insulin glargine in type 2 diabetes: a randomised, double-blind, phase 2 trial. The Lancet Diabetes Endocrinol 2019;7:179–88.
- 12
- Khedkar A, Lebovitz H, Fleming A ym. Pharmacokinetics and pharmacodynamics of insulin tregopil in relation to premeal dosing time, between meal interval, and meal composition in patients with type 2 diabetes mellitus. Clin Pharmacol Drug Dev 2020;9:74–86.
- 13
- Jarosinski MA, Dhayalan B, Rege N ym. ’Smart’ insulin-delivery technologies and intrinsic glucose-responsive insulin analogues. Diabetologia.2021;64:1016–29.
- 14
- Hoeg-Jensen T. Review: glucose-sensitive insulin. Mol Metab 2020;Epub Oct 31:101107.
- 15
- Boughton CK, Hovorka R. Is an artificial pancreas (closed-loop system) for Type 1 diabetes effective? Diabet Med 2019;36:279–86.
- 16
- Tauschmann M, Thabit H, Bally L ym. Closed-loop insulin delivery in suboptimally controlled type 1 diabetes: a multicentre, 12-week randomised trial. Lancet 2018;392:1321–9.
- 17
- Boughton CK, Hovorka R. New closed-loop insulin systems. Diabetologia 2021;64:1007–15.
- 18
- Tuomaala A-K, Sandini L, Haro S. Kohti keinohaimaa. Suom Lääkäril 2018;73:773–8.
- 19
- Weisman A, Bai JW, Cardinez M ym. Effect of artificial pancreas systems on glycaemic control in patients with type 1 diabetes: a systematic review and meta-analysis of outpatient randomised controlled trials. Lancet Diabetes Endocrinol 2017;5:501–12.
- 20
- Ekhlaspour L, Nally LM, El-Khatib FH ym. Feasibility studies of an insulin-only bionic pancreas in a home-use setting. J Diabetes Sci Technol 2019;13:1001–7.
- 21
- El-Khatib FH, Balliro C, Hillard MA ym. Home use of a bihormonal bionic pancreas versus insulin pump therapy in adults with type 1 diabetes: a multicentre randomised crossover trial. Lancet 2017;389:369–80.
- 22
- Haidar A, Tsoukas MA, Bernier-Twardy S ym. A novel dual-hormone insulin-and-pramlintide artificial pancreas for type 1 diabetes: A randomized controlled crossover trial. Diabetes Care 2020;43:597–606.
- 23
- Jendle J, Pöhlmann J, de Portu S ym. Cost-effectiveness analysis of the MiniMed 670G hybrid closed-loop system versus continuous subcutaneous insulin infusion for treatment of type 1 diabetes. Diabetes Technol Ther 2019;21:110–18.
- 24
- Adolfsson P, Hartvig N, Kaas A ym. Increased time in range and fewer missed bolus injections after introduction of a smart connected insulin pen. Diabetes Technol Ther 2020;22:709–18.
- 25
- Gildon B. InPen smart insulin pen system: product review and user experience. Care Innovations 2018;31:354–8.
- 26
- Markmann JF, Bartlett ST, Johnson P ym. Executive summary of Ipita-TTS opinion leaders report on the future of β-cell replacement. Transplantation 2016;100:e25-31.
- 27
- Bourgeois S, Sawatani T, Van Mulders A ym. Towards a functional cure for diabetes using stem cell-derived beta cells: Are we There Yet? Cells 2021;10:191.
- 28
- Balboa D, Saarimäki-Vire JM, Otonkoski T. Concise Review: Human Pluripotent Stem Cells for the Modeling of Pancreatic β-Cell Pathology. Stem Cells 2019; 37: 33–41.
- 29
- Balboa D, Prasad RB, Groop L, Otonkoski T. Genome editing of human pancreatic beta cell models: problems, possibilities and outlook. Diabetologia 2019;62:1329–36.
- 30
- Kowalski A. Pathway to artificial pancreas systems revisited: moving downstream. Diabetes Care 2015;38:1036–43.
Future perspectives on insulin therapy for type 1 diabetes
Pancreatic beta cells are lifesaving and critical for insulin secretion and glucose homeostasis. Currently, the only available treatment for destruction or dysfunction of pancreatic beta cells in insulin deficiency diabetes is the administration of insulin by multiple daily injections or insulin pump therapy. Insulin therapy is laborious and costly, and associated with both acute and chronic complications. “Smart” glucose-response insulin treatment regimens including algorithm-based approaches and insulin analogues seek to optimize glycaemic control. In the future, biomechanical artificial pancreas systems will provide optimal treatment for type 1 diabetes. The development of artificial pancreas systems is already advanced, but some challenges remain to be solved. Significant advances have been made in biological therapy in the form of human embryonic or induced pluripotent stem cells and these provide a key platform for beta cell transplantation, study of disease mechanisms and development of tailored treatments in the future.