Uusi strategia vaikean kroonisen munuaistaudin hoidonohjaukseen
• Vaikean munuaistaudin hoitotavat poikkeavat maamme eri osissa eikä potilasohjauksesta ole ollut kansallista ohjetta.
• Uuden strategian mukaan kaikista vaikeutuvaa kroonista munuaistautia sairastavista potilaista tulee konsultoida erikoissairaanhoitoa, kun eGFR laskee pysyvästi alle tason 20 ml/min/1,73 m2.
• Hoitotapa vaikuttaa elämänlaatuun, ennusteeseen ja kustannuksiin, ja se tulee valita yksilöllisesti yhdessä potilaan kanssa.
• Tavoitteena on lisätä kotihoitoja ja elinsiirtoja sekä kehittää oireenmukaista nefrologista hoitoa.

Krooninen munuaistauti tarkoittaa tilaa, jossa munuaisten suodatustoiminta (glomerular filtration rate, GFR) on häiriintynyt (GFR < 60 ml/min/1,73 m2) vähintään kolmen kuukauden ajan, havaitaan proteinuriaa tai munuaisperäistä hematuriaa, munuaisissa on tautiin viittaavia radiologisia löydöksiä tai näiden häiriöiden erilaisia yhdistelmiä (1). Vasta viime vuosia on oivallettu, että kyseessä on varsin tavallinen kansanterveysongelma. Yleistymiseen vaikuttavat erityisesti tyypin 2 diabetes ja väestön ikääntyminen. Vaikka tarkkoja lukuja esiintyvyydestä ei ole, kansainvälisten tietojen mukaan voidaan arvioida, että kroonista munuaistautia sairastaa jopa noin 10 % suomalaisista.
Varhaisen munuaistaudin diagnostiikasta ja hoitolinjoista on äskettäin julkaistu katsaus (2). Samoin vaikeutuvan taudin kliinisiä ongelmia on hiljattain käsitelty tässä lehdessä (3). Krooninen munuaistauti altistaa sydän- ja verisuonisairauksille, ja toisaalta on mahdollista, että tauti etenee ja munuaisten toiminta hiipuu, mikä puolestaan aiheuttaa monia biokemiallisia ja kliinisiä pulmia. Hoidon keskiössä ovat verenpaineen tiukka hallinta (4), antiproteinuurinen hoito ACE:n estäjillä tai AT2-reseptorien salpaajilla, dyslipidemian hoito (5) ja uusimpina lääkkeinä SGLT2:n salpaajat, jotka vaikuttavat merkittävästi proteinuurisen taudin etenemiseen (6).
Miten Suomessa hoidetaan vaikeaa munuaistautia?
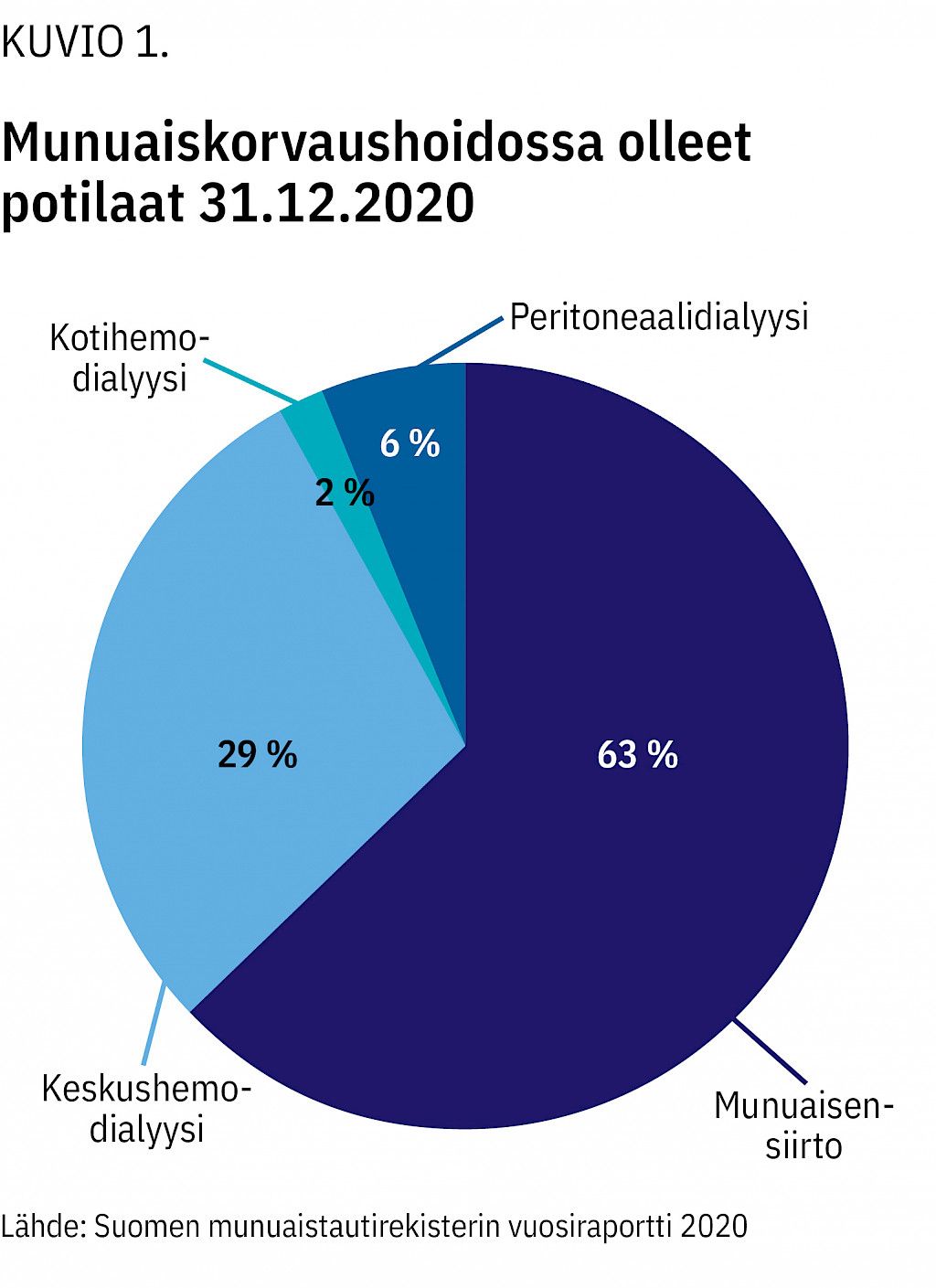
Osalla potilaista munuaisten toiminta ehtyy, ja heistä runsaat 500 aloittaa vuosittain munuaiskorvaushoidon (dialyysi, munuaisensiirto). Vuoden 2020 lopussa Suomessa oli korvaushoidossa noin 5 300 potilasta (7), joista 63 % eli toimivan munuaissiirteen kanssa ja muut olivat dialyysissä (kuvio 1). Dialyysipotilaista miltei 4/5 kävi hemodialyysissä sairaalakeskuksissa tai ns. satelliittiyksiköissä tyypillisesti kolmesti viikossa.
Hoitoon tulee entistä iäkkäämpiä potilaita, ja ennusteiden mukaan munuaiskorvaushoidossa olevien potilaiden määrä lisääntyy merkittävästi seuraavien 10–15 vuoden kuluessa.
Omatoimisuuteen ja kotihoitoon tähtääviä dialyysihoitomenetelmiä on Suomessa kehitetty määrätietoisesti. Vatsakalvodialyysi aloitettiin 1970-luvun lopussa ja siitä tulikin tärkein kotidialyysihoitomuoto. 1980-luvulta lähtien on potilaita opetettu itse huolehtimaan hemodialyysistä sairaaloissa, satelliittiyksiköissä tai ns. dialyysikioskeissa.
Kotihemodialyysi alkoi yleistyä 1990-luvun lopussa. Nämä hoidot tehdään yleensä viidesti viikossa, jolloin vältetään monet perinteisen hemodialyysin pulmat. Kotihoidossa olevan dialyysipotilaan ennuste on vähintään yhtä hyvä tai parempi kuin keskusdialyysissä hoidetun, ja tuoreen suomalaisen tutkimuksen mukaan kotihemodialyysi ja laiteavusteinen ns. automaattinen vatsakalvodialyysi ovat ennusteeltaan yhtä hyviä (8). Vuoden 2020 lopussa 22 % kaikista Suomen noin 2 000 dialyysipotilaista oli kotidialyysissä.
Munuaisensiirtotoiminta on niin ikään muuttunut viime vuosina monin tavoin. STM:n työryhmän vuonna 2014 julkaistun mietinnön (9) pohjalta elinirrotustoimintaa on kehitetty ja lisätty siirtoja aivokuolleelta.
Vuonna 2021 käynnistettiin elinluovutustoiminta verenkierron pysähtymisen ja kuoleman toteamisen jälkeen. Tuona vuonna tehtiin yhteensä 268 munuaisensiirtoa. Varsin suuri muutos on tapahtunut eläviltä luovuttajilta tehdyissä siirroissa, joiden määrää on pystytty lisäämään erittäin merkittävästi; vuonna 2021 niitä tehtiin 46. Munuaisensiirtoja voidaan nykyään tehdä myös pre-emptiivisesti eli ilman edeltävää dialyysihoitoa.
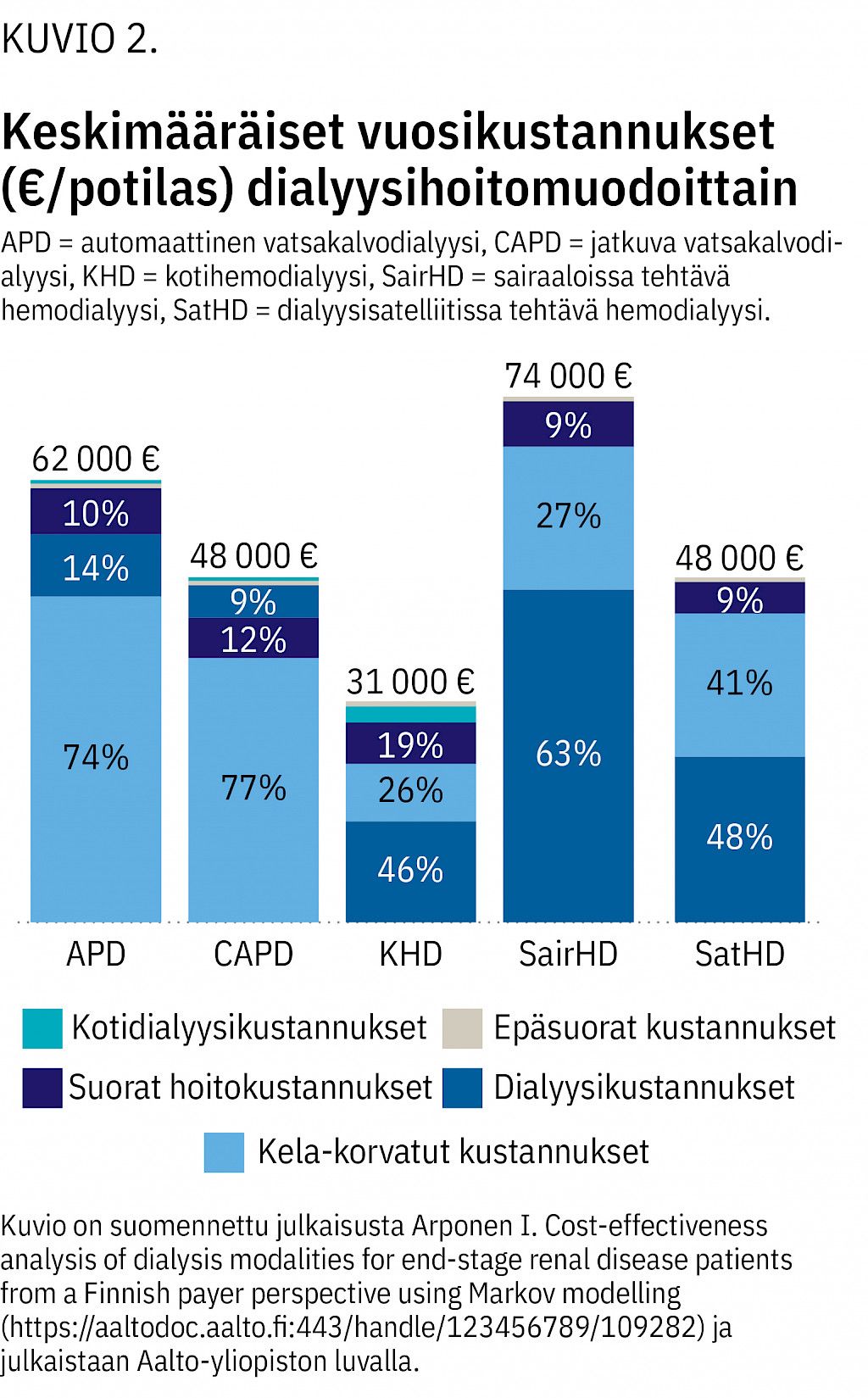
Munuaiskorvaushoidon tapa vaikuttaa hyvin merkittävästi kustannuksiin. Yhteiskunnan kannalta munuaisensiirto on ylivoimaisesti edullisisin (10). Aalto-yliopistossa äskettäin tehdyn, Husin dialyysimenetelmiä vertailleen tutkimuksen (11) perusteella edullisimpia ovat kotihemo- ja vatsakalvodialyysi, ja omatoimiseen hoitoon perustuvissa satelliiteissa tapahtuva dialyysi säästää myös kustannuksia sairaalakeskuksessa tehtyyn hoitoon verrattuna (kuvio 2).
Munuaiskorvaushoito vaikuttaa suuresti myös potilaan kokemaan elämänlaatuun, mutta siihenkin voidaan vaikuttaa onnistuneella hoitotavan valinnalla. Elämänlaatu on paras onnistuneen munuaisensiirron jälkeen ja kotidialyysissä parempi kuin keskusdialyysissä (12).
Miksi strategiasuositus tehtiin?
Tuoreiden eurooppalaisten (13) ja yhdysvaltalaisten (14) suositusten tavoitteena on vähentää vaikean munuaistaudin ilmaantuvuutta mutta myös lisätä merkittävästi kotidialyysiä sekä elinsiirtoja. Ruotsalaisessa suosituksessa (15) korostetaan potilaan omatoimisuutta ja kotihoitoja. Eurooppalainen suositus taas korostaa myös elämänlaatua ja tarvetta kehittää oireenmukaista hoitoa (13).
Ratkaisevan tärkeää on pohtia ja suunnitella hoito yhdessä potilaan kanssa hyvissä ajoin, niin että mahdollisimman moni munuaisten korvaushoitoon suunniteltu voidaan ohjata kotidialyysiin tai elinsiirtoon.
Dialyysi- ja elinsiirtohoito on Suomessa kokonaisuudessaan laadukasta (7). Pulmana on se, että hoitomenetelmiä käytetään hyvin vaihtelevasti sairaanhoitopiireissä ja myös munuaisensiirtojonoon pääsyn nopeudessa on eroja (7). Yhdenmukaisia ohjeita siitä, milloin potilaat tulisi lähettää erikoissairaanhoitoon, ei ole ollut. Emme myöskään tiedä tarkoin, kuinka moni potilas ohjataan oireenmukaiseen hoitoon munuaisten toiminnan ehtyessä.
Dialyysiä edeltävän vaiheen potilasohjaus vaatii nykyään paljon sairaanhoidon voimavaroja. Niiden niukkuus johtaa helposti siihen, että potilas ohjautuu keskusdialyysiin eikä kotiin tai varhain munuaisensiirtojonoon.
Pulmana ovat niin ikään olleet dialyysihoitomuotojen eriarvoistava vaikutus potilaalle kertyviin kustannuksiin. Kelan tuet ja joidenkin sairaaloiden maksukäytännöt eivät suosi kotidialyysiä. Lisäksi eri kotidialyysihoitomuodot ovat tukien ja maksujen suhteen keskenään eriarvoisia. Avusteiselle kotidialyysille ei ole toimivaa tukijärjestelmää.
Suomen Nefrologiyhdistys ry perusti moniammatillisen työryhmän pohtimaan ongelmia ja määrittelemään valtakunnalliset tavoitteet. Siihen pyydettiin edustajat Suomen munuaistautialan sairaanhoitohenkilöstö ry:stä (MuSa), Suomen munuaistautirekisteristä ja potilaita edustavasta Munuais- ja maksaliitto ry:stä. Työryhmän mietintö (16) julkaistiin marraskuussa 2021, ja seuraavassa esitetään tiivistelmä uudesta strategiasta.
Potilaan ohjaus erikoissairaanhoitoon ja hoitopäätös
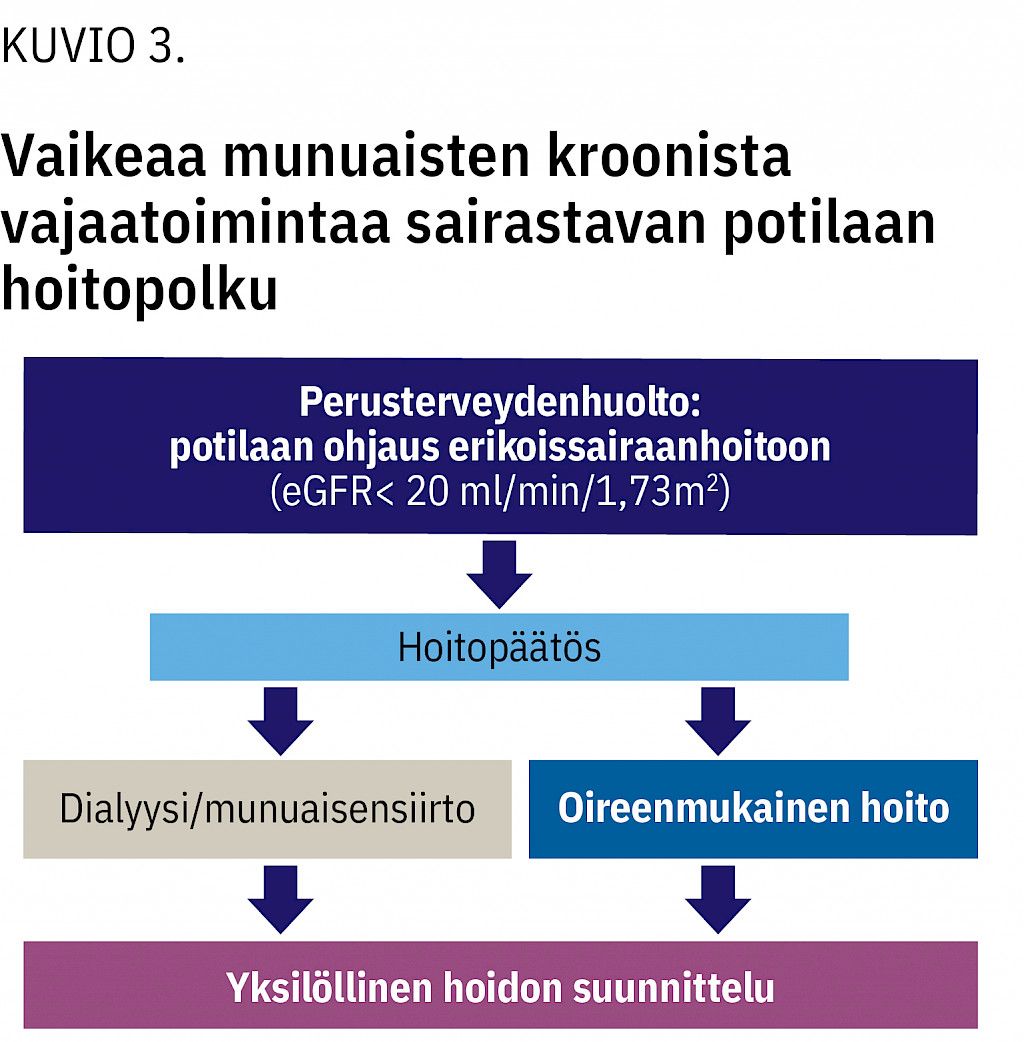
Työryhmä katsoi, että kaikista potilaista tulee konsultoida nefrologia viimeistään silloin, kun laskennallinen GFR (eGFR) on alle 20 ml/min/1,73 m2 vähintään kolmessa mittauksessa kolmen kuukauden kuluessa (kuvio 3). Mikäli munuaistoiminta heikkenee nopeasti (eGFR laskee vuodessa yli 5 ml/min/1,73 m2), tulee konsultaatio tehdä jo aiemmin.
Erityisen tärkeää on kuvata lähetteessä potilaan toimintakyky sekä lääkärin ja potilaan mielipide hoitolinjoista. Joissain tapauksissa jo tässä vaiheessa voidaan päätyä oireenmukaiseen hoitoon ja antaa konsultaatiovastauksessa siihen liittyviä toimintaohjeita.
Mikäli on todennäköistä, että taudin edetessä ryhdytään munuaiskorvaushoitoon, potilas otetaan erikoissairaanhoidon arvioon. Näin menetellään myös aina, mikäli hoitolinjaus ei ole täysin selvä.
Munuaiskorvaushoidon periaatteista ja myös mahdollisesta oireenmukaisesta hoidosta keskustellaan potilaan kanssa. Hoitopäätös tulee aina tehdä yhteisymmärryksessä potilaan kanssa, ja mikäli päädytään oireenmukaiseen hoitoon, päätöksen perustelut tulee kirjata potilaskertomukseen.
Munuaiskorvaushoito tulee suunnitella yhdessä potilaan kanssa
Työryhmä suosittelee, että jokaisen munuaiskorvaushoitoon tulevan potilaan kohdalla arvioidaan, onko hänelle mahdollista tehdä munuaisensiirto. Mikäli se vaikuttaa mahdolliselta, tulee ensisijaisesti selvittää, voisiko potilas saada siirteen elävältä luovuttajalta. Tavoitteena on suorittaa siirto elävältä luovuttajalta tai ilmoittaa potilas siirtolistalle, kun eGFR on alle 15 ml/min/1,73 m2 ja eGFR:n lasku jatkuu.
Samanaikaisesti tulee aloittaa dialyysihoidon suunnittelu. Potilasta informoidaan hoitomuodoista, ja ensisijaisesti tulee pohtia kotidialyysin mahdollisuudet. Ellei se jostain (perustellusta) syystä tule kysymykseen, tulee selvittää, voidaanko potilasta kouluttaa ainakin osittain huolehtimaan hemodialyysistä. Ellei sekään osoittaudu mahdolliseksi, päädytään avustettuun keskushemodialyysiin.
Tämä työ tehdään siis ennen kaikkea nefrologisilla poliklinikoilla, ja se vaatii erityiskoulutettua henkilökuntaa, nykyisin myös usein sähköisiä apuneuvoja (esim. Terveyskylän Munuaistalon palvelut, https://www.terveyskyla.fi/munuaistalo). Selvittely vaatii myös useiden alojen konsultaatioita (esim. radiologia, verisuonikirurgia, kardiologia, hammaslääketiede, ravitsemusterapia, sosiaalitoimi ym.). Tärkeänä apuna ovat potilasjärjestön tarjoama vertaistuki ja informaatio (https://www.muma.fi/files/458/munuaispotilaan_opas.pdf).
Dialyysihoidon aloittamisen ajankohta määräytyy laboratoriotulosten kehityksen ja oireiden perustella. Vuoden 2019 munuaistautirekisterin tietojen (17) mukaan eGFR oli dialyysihoidon alkaessa keskimäärin 8,2 ml/min/1,73 m2.
Oireenmukaista hoitoa kehitetään
Nefrologiassa oireenmukainen hoito tarkoittaa yleensä pidättäytymistä dialyysistä. Tämän tarve todennäköisesti lisääntyy väestön vanhetessa, koska vuosien ja tautitaakan karttuessa dialyysihoito ei välttämättä paranna elämänlaatua eikä juuri pidennä elinaikaakaan.
Vaikka dialyysihoito on aloitettu, potilaan kunto saattaa ajan kuluessa heikentyä jopa niin, että hoito huonontaa elämänlaatua. Silloin hoitoja voidaan harventaa tai niistä voidaan luopua kokonaan ja siirtyä elämän loppuvaiheen oireenmukaiseen hoitoon. Ratkaisujen tulee tapahtua yhteisymmärryksessä potilaan ja läheisten kanssa.
Työryhmä pitää tärkeänä, että hyvinvointialueilla kehitetään nefrologista oireenmukaista hoitoa yhteistyössä palliatiivisen hoitoon perehtyneiden yksiköiden kanssa.
Tavoitteet ja miten niihin päästään
Kansalliseksi tavoitteeksi asetettiin kaikkien hoitopäätösten kirjaaminen ja hoitopolun kehittäminen hyvinvointialueilla perusterveydenhuollon ja erikoissairaanhoidon välille. Tavoitteena on lisätä vuoteen 2025 mennessä kotidialyysihoidossa olevien määrää 40 %:iin kaikista dialyysipotilaista. Samalla halutaan nopeuttaa potilaan pääsyä munuaisensiirtojonoon ja elinsiirtoon. Tavoitteeksi asetettiin, että ennen dialyysihoidon aloittamista ainakin 15 % potilaista olisi saanut siirteen tai odottaisi sitä.
Tavoitteiden saavuttamiseksi on tärkeää, että sairaaloiden ja hyvinvointialueiden johto tunnistaa munuaistautien poliklinikoiden kehitystarpeet. Myös Kelan vammais- ja hoitotukiin liittyvää lainsäädäntöä tulee uudistaa siten, että tuet kannustavat kotidialyysiin ja molempia kotidialyysihoitomuotoja tuetaan samanarvoisesti. Tukien tulee myös mahdollistaa kotona tapahtuva avustettu dialyysi, joka nykyään on potilaalle kohtuuttoman kallista. Lainsäädäntöpulmien ratkaisu kuuluu sosiaali- ja terveysministeriölle ja eduskunnalle.
Perusterveydenhuollolla on keskeinen asema vaikeutuvan munuaistaudin tunnistamisessa ja oikea-aikaisessa erikoissairaanhoidon konsultoinnissa. Koska myös oireenmukaisen hoidon tärkeä käytännön toteuttaja on perusterveydenhuolto, on kehitettävä koulutusta ja yhteystyöverkostoja.
Tuloksia seuraa Suomen munuaistautirekisteri. Toiminnan käytännön seurantaan on Suomen Nefrologiyhdistys ry perustanut moniammatillisen työryhmän, jossa ovat mukana myös MuSa ry sekä potilasjärjestö.
Lopuksi
Krooninen munuaistauti on vaikeutuessaan raskas potilaalle, läheisille ja yhteiskunnalle. On tärkeää, että potilaat lähetetään oikea-aikaisesti erikoissairaanhoidon arvioon. Hoitomuodon valinnan keskiössä on potilas, jonka elämänlaatuun, ennusteeseen ja hoidosta aiheutuviin kustannuksiin uudella strategialla voidaan merkittävästi vaikuttaa.
Eero Honkanen: Konsultointipalkkiot (Astra Zeneca), luentopalkkiot (Fresenius MC Suomi).
Satu Mäkelä: Asiantuntijalausunto (Astra Zeneca), luentopalkkiot (Astellas Pharma, Astra Zeneca, Bayer, Boehringer-Ingelheim, Vifor Pharma, Sandoz), korvaus koulutusaineiston tuottamisesta (Astra Zeneca).
Virpi Rauta: Apurahat laitokselle (Business Finland). Luentopalkkiot (Astra Zeneca, Baxter, Fresenius MC Suomi), korvaus koulutusaineiston tuottamisesta (Astra Zeneca).
Niina Koivuviita: Ei sidonnaisuuksia.
- 1
- KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:1–148.
- 2
- Mäkelä S, Saha H. Krooninen munuaistauti – yleisimmät sudenkuopat perusterveydenhuollossa. Duodecim 2020;136:260–6.
- 3
- Wuorela M, Tertti R. Krooninen munuaisten vajaatoiminta. Suom Lääkäril 2019;74:2365–9.
- 4
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Verenpaineyhdistys ry:n asettama työryhmä. Kohonnut verenpaine. Käypä hoito -suositus 10.9.2020. www.kaypahoito.fi
- 5
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Sisätautilääkärien Yhdistys ry:n asettama työryhmä. Dyslipidemiat. Käypä hoito -suositus 31.3.2022. www.kaypahoito.fi
- 6
- Larmour K, Levin A. Slowing progression in CKD. DAPA CKD and beyond. CJASN 2021;16:1117–9. doi: 10.2215/CJN.20211220
- 7
- Suomen munuaistautirekisteri. Vuosiraportti 2020. https://www.muma.fi/files/5604/Suomen_munuaistautirekisteri_vuosiraportti_2020.pdf
- 8
- Bitar W, Helve J, Honkanen E, Rauta V, Haapio M, Finne P. Survival on home hemodialysis and automated peritoneal dialysis-an inception cohort study. Nephrol Dial Transplant 2022;37:1545–51. doi: 10.1093/ndt/gfab233
- 9
- Elinluovutusta ja elinsiirtoja koskeva kansallinen toimintasuunnitelma vuosille 2015–2018. Sosiaali-terveysministerion julkaisuja 2014:149.
- 10
- Helanterä I, Isola T, Lehtonen T ym. Association of clinical factors with the costs of kidney transplantation in the current era. Ann Transplant 2019;24:393–400.
- 11
- Arponen I. Cost-effectiveness analysis of dialysis modalities for end-stage renal disease patients from a Finnish payer perspective using Markov modelling. https://aaltodoc.aalto.fi:443/handle/123456789/109282
- 12
- Chuasuwan A, Pooripussarakul S, Thakkinstian A ym. Comparison of quality of life between patients underwent peritoneal dialysis and hemodialysis: a systematic review and meta-analysis. Health Qual Life Outcomes 2020;18(1):191. doi: 10.1186/s12955-020-01449-2
- 13
- European Kidney health Alliance 2015. https://ekha.eu
- 14
- Executive Office of the President. Advancing American kidney health. Department of health & human services, USA. https://www.federalregister.gov/documents/2019/07/15/2019-15159/advancing-american-kidney-health
- 15
- Njurförbundet. Nationellt vårdprogram för egenvård vid dialys https://njurforbundet.se/wp-content/uploads/2019/09/Nationellt-vårdprogam-för-egenvård-vid-dialys.pdf
- 16
- Suomen nefrologiyhdistys ry. Vaikean kroonisen munuaistaudin hoidon ohjaus. Suomen strategia. 2021. https://www.e-julkaisu.fi/sny/ckd-strategia/mobile.html#pid=1
- 17
- Suomen Munuaistautirekisteri. Vuosiraportti 2019. https://www.muma.fi/files/5297/Suomen_munuaistautirekisteri_vuosiraportti_2019.pdf
Finnish strategy for treatment modality planning in severe chronic kidney disease
Chronic kidney disease (CKD) is a common disorder that affects ca. 10% of the adult population, and it may progress to loss of kidney function. Patients with kidney failure have two treatment options: to start renal replacement therapy (RRT: dialysis, transplantation), or palliative therapy. In Finland there were 5300 RRT patients on December 31, 2020, of whom 520 had started the therapy during that year. The modality of treatment has a great impact on survival, quality of life and costs. Kidney transplantation is the optimal RRT, and home dialysis has many advantages as compared to in-centre dialysis. Thus far there have been no national guidelines as to when to refer patients for nephrological evaluation and how to guide them to their optimal RRT modality. A working group founded by the Finnish Society of Nephrology has agreed on the treatment pathways for patients with severe CKD. Every patient should be referred to a nephrologist when estimated GFR is repeatedly < 20 ml/min/1.73m2. The formal decision between RRT and palliative care should be made together with the patient, i.e. there should be shared decision making. If RRT is planned, every patient should be evaluated for kidney transplantation, and possibilities for living-related transplantation should be investigated. The preferred dialysis option should be home therapy, i.e. peritoneal dialysis or home haemodialysis. The numeric goals to be achieved by 2025 set by the working group were: > 40% of all dialysis patients should be on home dialysis (in 2019: 22%) and > 15% of the patients should be on the waiting list or have had a functioning kidney transplant before the start of dialysis (in 2019: 7%). Palliative nephrology should be developed together with primary health care and specialized centres.
Eero Honkanen, Satu Mäkelä, Virpi Rauta, Niina Koivuviita
Eero Honkanen
Professor, Specialist in Internal Medicine and Nephrology