Vastasyntyneen hypoglykemia: kuinka seuraan, ehkäisen ja hoidan?
Hypoglykemia on yleinen aineenvaihdunnan häiriö ensimmäisinä elinpäivinä.
Altistavista tekijöistä yleisimpiä ovat äidin glukoosiaineenvaihdunnan häiriöt.
Jos vastasyntynyt on hypoglykemian riskissä, on tärkeää käynnistää ehkäisevät toimet eli turvata ihokontakti ja tiheä maitoruokinta. Glukoositasoa ja mahdollisia hypoglykemian oireita tulee seurata.
Vastasyntyneen hypoglykemian ensisijainen hoito on suun limakalvolle hierottava glukoosigeeli yhdistettynä maitoruokintaan. Tarvittaessa aloitetaan glukoosi-infuusio laskimoon.
Pitkittynyt tai vaikea hypoglykemia edellyttää taustasyyn selvittämistä.

Glukoosi on solujen tärkein energianlähde. Etenkin aivojen tasaisen energiansaannin turvaamiseksi veren glukoosipitoisuus pyritään pitämään riittävänä. Glukoosiaineenvaihdunnan säätely on usean elimen yhteistyötä, jossa haiman tuottamalla insuliinilla ja sen vastavaikuttajahormoneilla on keskeisimmät roolit.
Sikiö on riippuvainen glukoosin saannista istukan kautta, ja äidin veren glukoosipitoisuus määrää sikiön veren glukoosipitoisuuden. Sikiön haiman insuliinieritys reagoi tähän, mutta insuliini säätelee sikiökaudella ensisijaisesti kudosten kasvua (1).
Syntymän jälkeen vastasyntyneen on sopeuduttava jaksottaiseen energiansaantiin. Napanuoran katkaisu aiheuttaa veren glukoosipitoisuuden pienenemisen, joka herättää vastasyntyneen imemistarpeen ja käynnistää oman glukoosituotannon eli glykogenolyysin ja glukoneogeneesin entsyymien aktivoitumisen. Terveen täysiaikaisen vastasyntyneen glukoosi on alhaisimmillaan noin 1–2 tunnin iässä ja pysyy keskimäärin matalammalla tasolla (plasman glukoosipitoisuuden keskiarvo 3,0–3,3 mmol/l) ensimmäisten 2–3 elinvuorokauden ajan, kunnes saavuttaa aikuiselle fysiologisen tason (keskiarvo 4,4–4,6 mmol/l, vaihteluväli 3,9–5,6 mmol/l) (1,2,3). Tällä hetkellä on näyttöä, että adaptaatiovaiheessa haiman beetasoluissa on vielä alentunut glukoosin kynnysarvo insuliinin eritykselle kuten sikiöaikana, jolloin sen on todennäköisimmin tarkoitus turvata sikiöaikaista kasvua. Tämän vuoksi adaptaatiovaihe on altis häiriöille ja hypoglykemian ilmaantumiselle (4).
Hypoglykemiaa on raportoitu 5–15 %:lla kaikista vastasyntyneistä ja joka toisella riskiryhmissä, kuten raskausdiabeetikkojen vastasyntyneillä (5,6,7). Ilmaantuvuus on lisääntynyt etenkin raskausdiabeteksen yleistyessä ja vastasyntyneiden voinnin seurannan tarkentuessa. Vaikka vasta syvä tai pitkittynyt hypoglykemia johtaa vaikeaan aivovaurioon, vastasyntyneisyyskauden hypoglykemia voi aiheuttaa lieviä kognitiivisen kehityksen pitkäaikaisongelmia (8,9). Vastasyntyneen hypoglykemiaan liittyy vielä runsaasti ratkaisemattomia kysymyksiä, ja aihetta on viime vuosina tutkittu aktiivisesti (8).
Mikä on vastasyntyneen hypoglykemia?
Yleisesti hypoglykemia on tila, jossa matala veren glukoositaso aiheuttaa aivotoiminnan häiriön merkkejä. Vastasyntynyt voi käyttää laktaattia ja ketoaineita aivojen vaihtoehtoisina energianlähteinä, mutta niiden suojaava merkitys hypoglykemian aikana on ilmeisesti vähäinen (10). Näyttöön perustuvia hypoglykemian hoitorajoja ei voi antaa. Yleisimmin hoitorajana ensimmäisinä elinpäivinä on pidetty plasman glukoosipitoisuutta < 2,6 mmol/l (11,12,13), mutta neurologisen ennusteen turvaamiseksi on suositeltu myös korkeampaa raja-arvoa 2,8 mmol/l (14). Yli 2–3 vuorokauden iässä alarajana pidetään plasman glukoosipitoisuutta 3,3 mmol/l (14,15,16) (liitetaulukko 1 artikkelin verkkoversiossa). Eriäviä näkemyksiä on myös siitä, tulisiko käyttää eri hoitorajoja riippuen vastasyntyneen iästä, oireista tai hypoglykemian riskitekijöistä (2,3,11,14). Lähivuosina valmistuvista pitkäaikaisseurantatutkimuksista odotetaankin lisätarkennusta hypoglykemian hoidon raja-arvoihin.
Altistavat tekijät
Vastasyntyneet ovat adaptaatiovaiheessa alttiita hypoglykemialle aivojen suhteellisen isosta koosta johtuvan suuren glukoosintarpeen, niukkojen glykogeenivarastojen ja aineenvaihduntareittien kypsymättömyyden takia. Lisäksi useat verrattain yleiset sikiöaikaiset ja syntymän jälkeiset tekijät lisäävät hypoglykemian riskiä (17) (taulukko 1). Näistä merkittävin on äidin ennen raskautta tai raskauden aikana alkanut diabetes, joka johtaa sikiön lisääntyneeseen insuliinin eritykseen ja vastasyntyneen merkittävästi suurentuneeseen hypoglykemian riskiin. Useamman riskitekijän esiintyminen on yhdistetty suurempaan hypoglykemian tai vaikean hypoglykemian riskiin (6,10).
Oireet ja riskiryhmiin kuuluvien vastasyntyneiden seuranta
Vastasyntyneen hypoglykemia voi olla oireeton tai lieväoireinen tilanteessa, jossa metabolinen adaptaatio etenee ja varaenergianlähteitä glykogeeni- ja rasvavarastoista on tarjolla. Näiden ehtyessä hypoglykemia voi aiheuttaa hyvin moninaisia oireita, kuten syömisongelmia, hengitysvaikeutta, käsittelyarkuutta, täristelyä, poikkeavaa itkuääntä tai heikentynyttä lihasjäntevyyttä. Hypoglykemian syventyessä ilmaantuu neurologisia oireita, kuten tajunnantason heikkenemistä, hengityskatkoksia ja kohtausoireita (16).
Oireiselta vastasyntyneeltä tulee viipymättä mitata plasman glukoosipitoisuus. Myös oireettomien riskiryhmiin kuuluvien vastasyntyneiden plasman glukoosipitoisuutta tulee seurata ensimmäisten elinpäivien aikana. Seurannan tulee olla tiheintä ensimmäisten 24 tunnin aikana, jolloin valtaosa hypoglykemioista ilmaantuu (5). On kuitenkin huomioitavaa, että noin viidennes diabetesta sairastavien äitien vastasyntyneiden hypoglykemioista ilmaantuu tämän jälkeen (18). Seurantaa kannattaa jatkaa, kunnes 2–3 perättäistä arvoa ovat normaalitasolla huomioiden kansalliset suositukset ja hoitokäytännöt (17).
Yleinen käytäntö on seuloa vastasyntyneen hypoglykemiaa pikamittarilla, johon liittyy lukuisia käytännön hyötyjä laboratoriomenetelmiin verrattuna. Tässä tulee käyttää vastasyntyneille soveltuvia plasman glukoosipitoisuutta (10–18 % kokoveren glukoositasoa korkeampi) mittaavia pikamittareita. Pikamittarit ovat epätarkkoja etenkin vähäisten veren glukoosipitoisuuksien määrittämisessä, ja laboratoriomääritykset ovat merkittävästi herkempiä ja tarkempia kuin pikamittarimääritykset. Diagnoosia ja kliinistä päätöksentekoa varten glukoosipitoisuus onkin syytä varmistaa glukoosioksidaatioon perustuvalla laboratoriomenetelmällä. Tämä ei saa kuitenkaan viivästyttää oireisen hypoglykemian hoitoa (19).
Ehkäisy
Riskiryhmiin kuuluvien vastasyntyneiden adaptaatiovaiheen hypoglykemia on usein ehkäistävissä. Synnytyssairaaloissa tulisi olla selkeät toimintaohjeet näistä käytännöistä, sillä hypoglykemiaa ehkäisevien suositusten on esitetty vähentävän hypoglykemian esiintymistä riskiryhmissä (6). Suomalainen käytäntö on kuvattu raskausdiabeteksen Käypä hoito -suosituksessa (20), jonka päivitys on valmistunut keväällä 2022.
Vastasyntyneen hypoglykemiaa voidaan ehkäistä estämällä vastasyntyneen jäähtymistä syntymän jälkeen sekä mahdollistamalla ihokontakti ja imetys ensimmäisen elintunnin aikana synnytyssalissa (13,15). Riskiryhmään kuuluvia vastasyntyneitä tulee ensimmäisinä elinpäivinä imettää tiheästi, 2–3 tunnin välein. Äidinmaidon heruttelu ja talteenotto ennen synnytystä 35. raskausviikon jälkeen ja sen antaminen vastasyntyneelle pian syntymän jälkeen on ilmeisesti turvallista sekä saattaa edistää imetyksen onnistumista (22,23). Tarvittaessa hypoglykemian riskissä olevalle vastasyntyneelle annetaan myös lisämaitoa, jos äidin oma rintamaito arvioidaan riittämättömäksi tai sitä ei ole saatavissa.
Hiljattain julkaistussa riskiryhmään kuuluvien vastasyntyneiden satunnaistetussa ja sokkoutetussa monikeskustutkimuksessa todettiin, että varhaisen rintamaitoruokinnan lisäksi tunnin iässä suun limakalvolle annosteltu 40-prosenttinen glukoosigeeli (200 mg/kg) vähensi merkittävästi hypoglykemian ilmaantumista lumevalmisteen käyttöön verrattuna (23). Profylaktisen glukoosigeelin pitkäaikaisturvallisuudesta ei kuitenkaan vielä ole riittävää tutkimusnäyttöä, joten sen rutiininomaista käyttöönottoa ei toistaiseksi voi suositella (24).
Hoito
Hypoglykemian hoidon tavoitteena on aivosolujen toiminnan turvaaminen palauttamalla veren glukoosipitoisuus normaalille iänmukaiselle tasolle välttäen hyvin nopeita glukoositason vaihteluja (14). Tutkimusnäyttöön perustuvia tarkkoja raja-arvoja hoidon aloittamiseksi ei ole määritelty. Lievän hypoglykemian ensisijainen hoito on suun limakalvolle hierottava 40-prosenttinen glukoosigeeli (200 mg/kg) yhdistettynä maitoruokintaan. (25). Vaikea-asteisessa, toistuvassa tai oireisessa hypoglykemiassa aloitetaan glukoosi-infuusio laskimoon. Glukoosiboluksen antoa ei rutiininomaisesti suositella, sillä se johtaa nopeisiin veren glukoosipitoisuuden muutoksiin, joilla voi hypoglykemian ohella olla yhteyttä neurologisiin pitkäaikaisongelmiin (8).
Lisätutkimukset
Useimmissa tapauksissa hypoglykemia on ohimenevä ja korjaantuu ensimmäisten elinpäivien jälkeen. Etiologiset jatkotutkimukset ovat harvoin aiheellisia, mutta ne tulee muistaa poikkeavan vaikeassa, toistuvassa tai adaptaatiovaiheen jälkeen ilmenevässä hypoglykemiassa. Niitä on syytä harkita myös, jos vastasyntyneellä todetaan oireyhtymäpiirteitä tai rakennepoikkeavuuksia tai jos suvun sairaushistoria herättää epäilyn perinnöllisestä hypoglykemiataipumuksesta.
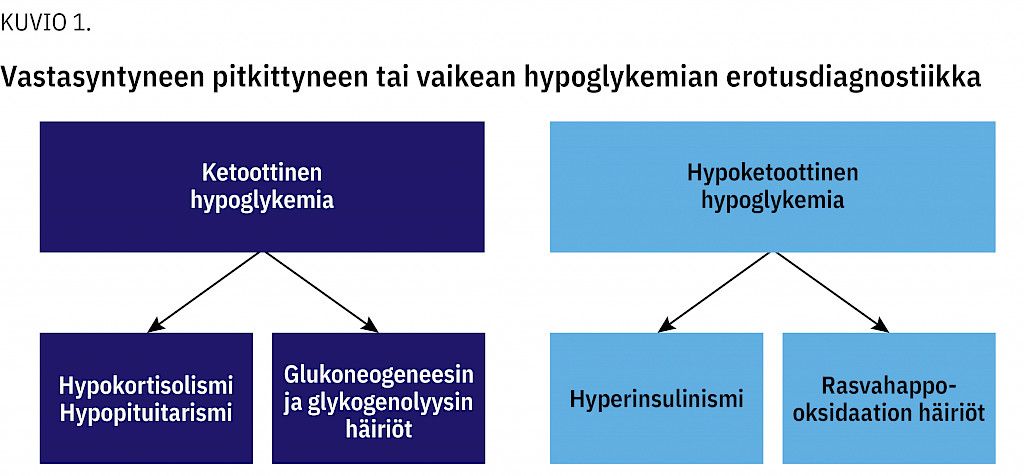
Taustasyyn selvittely perustuu hypoglykemian aikana otettaviin näytteisiin ja kliiniseen kokonaisarvioon sekä näiden pohjalta suunniteltuihin geneettisiin ja kuvantamistutkimuksiin (14). Vastasyntyneen pitkittyvän tai vaikean hypoglykemian taustasyyn selvittämiseksi suositellut laboratoriotutkimukset on esitetty taulukossa 2, ja tulosten perusteella erotusdiagnostiikassa voidaan edetä kuvion 1 mukaisesti.
Pitkittyneen hypoglykemian hoidossa edetään etiologian mukaisesti. Selvästi yleisin pitkittynyttä hypoglykemiaa aiheuttava sairaus on synnynnäinen hyperinsulinismi. Hyperinsulinismi voi olla muutamissa viikoissa tai kuukausissa ohimenevä (ilmaantuvuus 1:7 500 vastasyntynyttä) tai pysyvä sairaus (ilmaantuvuus 1:11 000–45 000 vastasyntynyttä), joka vaatii pitkäkestoista sairauden syyn mukaista hoitoa. Hyperinsulinismin tunnistaminen ja tehokas hoito ovat ensisijaisen tärkeitä, koska hyperinsulinismi estää aivoille vaihtoehtoisten energialähteiden muodostumisen hypoglykemian aikana (26,27).
Myös moniin oireyhtymiin, kuten Beckwith–Wiedemannin oireyhtymään, ja vastasyntyneenä ilmeneviin sairauksiin, kuten panhypopituitarismiin tai aineenvaihduntasairauksiin, esimerkiksi glukoneogeneesin tai glykogenolyysin, rasvahappo-oksidaation tai hengitysketjun häiriöihin, voi liittyä ensioireena hypoglykemiataipumusta (28).
Ennuste
Ilmeisesti myös oireettomaan tai lieväoireiseen vastasyntyneen hypoglykemiaan liittyy lisääntynyt lievien neurologisen kehityksen häiriöiden riski varhaislapsuudessa (2–5-vuotiaana) (8,29,30). Näyttö vastasyntyneisyyskauden ohimenevän hypoglykemian vaikutuksesta neurologiseen ennusteeseen kouluiässä on vielä ristiriitaista. Yhdysvaltalaisessa 1 395 lapsen kohortissa vastasyntyneisyyskauden ohimenevä hypoglykemia oli yhteydessä huonompaan koulumenestykseen 10-vuotiaana (31). Tuoreessa uusiseelantilaisessa seurantatutkimuksessa (480 lasta, joilla oli vähintään yksi hypoglykemian riskitekijä ja 176:lla vastasyntyneenä hypoglykemia) vastasyntyneenä koettu hypoglykemia ei liittynyt heikompaan koulumenestykseen 9–10-vuotiaana (32). Huomionarvoista oli, että oppimistulokset olivat keskimääräistä huonommat koko kohortissa riippumatta hypoglykemian ilmaantumisesta, mikä viittaa siihen, että vastasyntyneen hypoglykemialle altistavat tekijät voivat itsessään lisätä kehityksen häiriöiden riskiä.
Syvään tai pitkäkestoiseen hypoglykemiaan, jonka taustalta usein löytyy synnynnäinen glukoosiaineenvaihdunnan häiriö, liittyy kuitenkin merkittävästi kohonnut aivovaurion riski. Esimerkiksi hyperinsulinismissa vaihtoehtoisia energianlähteitä ei hypoglykemian aikana ole tarjolla. Pitkäaikaiskehityksen häiriöitä on raportoitu keskimäärin kolmasosalla pysyvää tai ohimenevää synnynnäistä hyperinsulinismia sairastavista potilaista (27).
Lopuksi
Vastasyntyneen hypoglykemiaan liittyy vielä paljon avoimia kysymyksiä. Ehkäisy ja varhainen tunnistaminen, riittävä hoito sekä synnynnäiseen sairauteen liittyvän hypoglykemian erottaminen ohimenevästä adaptaatiovaiheen hypoglykemiasta ovat keskeisiä. Sekä hypoglykemian yli- että alihoitamiseen liittyy mahdollisia haittoja.
Vastasyntyneen hypoglykemia aiheuttaa myös merkittäviä välittömiä ja välillisiä terveydenhuollon kustannuksia sekä elämänlaadun heikkenemistä (33). Tutkimusnäyttöön perustuvat vastasyntyneen hypoglykemian ehkäisy- ja hoitokeinot tulisikin ottaa viipymättä käyttöön kaikissa synnytyssairaaloissa. Vaikea tai pitkittyvä hypoglykemia on tärkeää tunnistaa, koska taustalla voi olla synnynnäinen glukoosiaineenvaihdunnan sairaus.
Ulla Sankilampi: Matka-, majoitus- tai kokouskulut (Chiesi, neonatologian alan etäkoulutus).
Muut kirjoittajat: Ei sidonnaisuuksia.
- 1
- Stanley CA, Rozance PJ, Thornton PS ym. Re-evaluating "transitional neonatal hypoglycemia": mechanism and implications for management. J Pediatr 2015;166:1520–5.
- 2
- Güemes M, Rahman SA, Hussain K. What is a normal blood glucose? Arch Dis Child 2016;101:569–74.
- 3
- Harris DL, Weston PJ, Gamble GD, Harding JE. Glucose profiles in healthy term infants in the first 5 days: The Glucose in Well Babies (GLOW) study. J Pediatr 2020;223:34–41.
- 4
- Stanescu DL, Stanley CA. Advances in understanding the mechanism of transitional neonatal hypoglycemia and implications for management. Clin Perinatol 2022;49:55–72. doi:10.1016/j.clp.2021.11.007
- 5
- Harris DL, Weston PJ, Harding JE. Incidence of neonatal hypoglycemia in babies identified as at risk. J Pediatr 2012;161:787–91.
- 6
- Rasmussen AH, Wehberg S, Fenger-Groen J, Christesen HT. Retrospective evaluation of a national guideline to prevent neonatal hypoglycemia. Pediatr Neonatol 2017;58:398–405.
- 7
- Voormolen D, de Wit L, van Rijn B ym. Neonatal hypoglycemia following diet-controlled and insulin-treated gestational diabetes mellitus. Diabetes Care 2018;41:1385–90.
- 8
- Shah R, Harding J, Brown J, McKinlay C. Neonatal glycaemia and neurodevelopmental outcomes: a systematic review and meta-analysis. Neonatology 2019;115:116–26.
- 9
- Alsweiler JM, Harris DL, Harding JE, McKinlay CJD. Strategies to improve neurodevelopmental outcomes in babies at risk of neonatal hypoglycaemia. Lancet Child Adolesc Health 2021;5:513–23.
- 10
- Harris DL, Weston PJ, Harding JE. Alternative cerebral fuels in the first five days in healthy term infants: The Glucose in Well Babies (GLOW) study. J Pediatr 2021;231:81–6.
- 11
- Harding JE, Harris DL, Hegarty JE, Alsweiler JM, McKinlay CJ. An emerging evidence base for the management of neonatal hypoglycaemia. Early Hum Dev 2017;104:51–6.
- 12
- Narvey MR, Marks SD. The screening and management of newborns at risk for low blood glucose. Paediatr Child Health 2019;24:536–54.
- 13
- Wackernagel D, Gustafsson A, Edstedt Bonamy AK ym. Swedish national guideline for prevention and treatment of neonatal hypoglycaemia in newborn infants with gestational age ≥35 weeks. Acta Paediatr 2020;109:31–44.
- 14
- Thornton PS, Stanley CA, De Leon DD ym. Recommendations from the pediatric endocrine society for evaluation and management of persistent hypoglycemia in neonates, infants, and children. J Pediatr 2015;167:238–45.
- 15
- Hawdon JM. Identification and management of neonatal hypoglycemia in the full-term infant. British Association of Perinatal Medicine Framework for Practice, 2017. J Hum Lact 2019;35:521–3.
- 16
- Committee on Fetus and Newborn, Adamkin DH. Postnatal glucose homeostasis in late-preterm and term infants. Pediatr 2011;127:575–9.
- 17
- Luukkainen P, Metsäranta M, Sankilampi M, toim. Vastasyntyneiden akuuttihoito. Hypoglykemia. Kustannus Oy Duodecim 2019.
- 18
- Karbalivand H, Iyare A, Aponte A, Xianhong X, Kim M, Havranek T. Hypoglycemia screening of asymptomatic newborns on the 2nd day of life. J Neonatal Perinatal Med. 2022;15:311–6.
- 19
- Edwards T, Harding JE. Clinical aspects of neonatal hypoglycemia: a mini review. Front Pediatr 2021;8:562251.
- 20
- Suomalaisen Lääkäriseuran Duodecimin, Suomen Diabetesliiton lääkärineuvoston ja Suomen Gynekologiyhdistys ry:n asettama työryhmä. Raskausdiabetes. Käypä hoito -suositus 31.5.2022. www.kaypahoito.fi
- 21
- Forster DA, Moorhead AM, Jacobs SE ym. Advising women with diabetes in pregnancy to express breastmilk in late pregnancy (Diabetes and Antenatal Milk Expressing [DAME]): a multicentre, unblinded, randomised controlled trial. Lancet 2017;389:2204–13.
- 22
- Juntereal NA, Spatz DL. Integrative review of antenatal milk expression and mother–infant outcomes during the first 2 weeks after birth. J Obstet Gynecol Neonatal Nurs 2021;50:659–68.
- 23
- Harding JE, Hegarty JE, Crowther CA, Edlin RP, Gamble GD, Alsweiler JM; hPOD Study Group. Evaluation of oral dextrose gel for prevention of neonatal hypoglycemia (hPOD): A multicenter, double-blind randomized controlled trial. PLoS Med 2021;18:e1003411.
- 24
- Edwards T, Alsweiler JM, Crowther CA ym. Prophylactic oral dextrose gel and neurosensory impairment at 2-year follow-up of participants in the hPOD randomized trial. JAMA 2022;327:1149–57.
- 25
- Harris DL, Weston PJ, Signal M, Chase JG, Harding JE. Dextrose gel for neonatal hypoglycaemia (the Sugar Babies Study): a randomised, double-blind, placebo-controlled trial. Lancet 2013;382:2077–83.
- 26
- Banerjee I, Salomon-Estebanez M, Shah P, Nicholson J, Cosgrove KE, Dunne MJ. Therapies and outcomes of congenital hyperinsulinism-induced hypoglycaemia. Diabet Med 2019;36:9–21.
- 27
- Männistö JME, Jääskeläinen J, Otonkoski T, Huopio H. Long-term outcome and treatment in persistent and transient congenital hyperinsulinism: A Finnish population-based study. J Clin Endocrinol Metab 2021;106:e1542–51.
- 28
- Ghosh A, Banerjee I, Morris AAM. Recognition, assessment and management of hypoglycaemia in childhood. Arch Dis Child 2016;101:575–80.
- 29
- Wickström R, Skiöld B, Petersson G, Stephansson O, Altman M. Moderate neonatal hypoglycemia and adverse neurological development at 2-6 years of age. Eur J Epidemiol 2018;33:1011–20.
- 30
- McKinlay CJ, Alsweiler JM, Anstice NS, ym. Children With Hypoglycemia and Their Later Development (CHYLD) study team. Association of neonatal glycemia with neurodevelopmental outcomes at 4.5 years. JAMA Pediatr 2017;171:972–83.
- 31
- Kaiser JR, Bai S, Gibson N ym. Association between transient newborn hypoglycemia and fourth-grade achievement test proficiency: A population-based study. JAMA Pediatr 2015;169:913–21.
- 32
- Shah R, Dai DWT, Alsweiler JM ym; Children With Hypoglycaemia and Their Later Development (CHYLD) study team. Association of neonatal hypoglycemia with academic performance in mid-childhood. JAMA 2022;327:1158–70.
- 33
- Glasgow MJ, Edlin R, Harding JE. Cost burden and net monetary benefit loss of neonatal hypoglycaemia. BMC Health Serv Res 2021;21:121.
Hypoglycaemia of the newborn
Neonatal hypoglycaemia is a common metabolic disorder. Newborns are physiologically more susceptible to hypoglycaemia especially during the period of metabolic adaptation within the first 2–3 days of life. Additionally, several pre- and perinatal factors increase the risk of hypoglycaemia, most importantly maternal diabetes. For at-risk neonates, early skin contact, early sufficient breast feeding, oral dextrose gel, and keeping the baby warm are recommended for prevention of hypoglycaemia. Since the symptoms are unspecific and often absent, plasma glucose levels should be routinely monitored in babies at risk during the first days of life.
The studies have not been able to unambiguously define a single cut-off plasma glucose (PG) value for hypoglycaemia during the first days of life, and recommendations of operational thresholds are contradictory. Treatment aims to maintain normoglycaemia without rapid PG changes. In addition to frequent feeding, oral dextrose gel is the first-line treatment in mild hypoglycaemia. Intravenous glucose infusion is used for severe, recurrent, or symptomatic hypoglycaemia.
Neonatal hypoglycaemia is usually transient. Further aetiological studies should be considered if hypoglycaemia is severe, recurrent or manifests after the period of metabolic adaptation, and then the most common underlying cause is congenital hyperinsulinism. Only severe, prolonged hypoglycaemia causes permanent brain injury, but neonatal hypoglycaemia is associated with mild cognitive difficulties.
Identification of at-risk babies, prevention and detection of hypoglycaemia, adequate treatment, and distinguishing persistent hypoglycaemia disorders from transient neonatal hypoglycaemia are crucial in ensuring the child´s natural growth and development. Evidence-based preventive methods and treatment should be promptly introduced in all maternity hospitals, and the results of ongoing follow-up studies are expected to clarify many still unresolved issues with neonatal hypoglycaemia.
Jonna Männistö, Ulla Sankilampi, Hanna Huopio
Jonna Männistö
M.D., Paediatrician undergoing specialist education in clinical genetics
Kuopio University Hospital, Department of Pediatrics, Department of Clinical Genetics, and University of Eastern Finland, Institute of Clinical Medicine