Huumeiden käyttäjien vakavat MRSA-infektiot ovat lisääntyneet
Lähtökohdat Viime vuosina Husin alueella, Varsinais-Suomessa ja Pirkanmaalla on todettu aiempaa enemmän metisilliinille resistentin Staphylococcus aureuksen (MRSA) aiheuttamia veriviljelypositiivisia infektioita huumeita pistämällä käyttävillä. Tavoitteena oli selvittää epidemian laajuus, MRSA-kantatyypit ja infektioiden vakavuus.
Menetelmät Huumeiden käyttäjien veriviljelypositiiviset MRSA-infektiot taustatietoineen kerättiin Husin sekä Varsinais-Suomen ja Pirkanmaan sairaanhoitopiirien alueellisista rekistereistä vuosilta 2015–22. Muista sairaanhoitopiireistä selvitettiin, oliko veriviljelypositiivisia MRSA-infektioita todettu huumeiden käyttäjillä vuosina 2019–22. MRSA-kannoille tehtiin spa-tyypitys sekä kokogenomin sekvensointi (WGS) THL:n asiantuntijalaboratoriossa.
Tulokset Husissa huumeiden käyttäjien veriviljelypositiiviset MRSA-infektiot kaksinkertaistuivat vuosina 2020–21. Veriviljelypositiiviset MRSA-infektiot olivat pääosin (70 %) kahden eri pvl-geenipositiivisen MRSA-kannan (spa-tyypit t008 ja t024) aiheuttamia. Varsinais-Suomessa yleisin spa-tyyppi oli t386 ja Pirkanmaalla t304.
Päätelmät Osa pistoshuumeiden käyttäjien vakavien MRSA-infektioiden lisääntymisestä liittyi tiettyjen virulenttien kantojen leviämiseen.

Staphylococcus aureus on yksi yleisimmistä veriviljelypositiivisen infektion aiheuttajista (1). Se on yleinen nenän limakalvoilla ja ihorikoissa, ja ihovauriot ovat invasiivisten infektioiden riskitekijöitä. Tämän vuoksi nämä infektiot ovat yleisiä huumeita pistämällä käyttävillä.
Veriviljelypositiivisiin S. aureus -infektioihin liittyy usein syviä infektiopesäkkeitä (2,3,4,5) ja ne vaativat pitkän suoneen annettavan mikrobilääkehoidon (6). MRSA aiheuttaa samanlaisia infektioita kuin herkkä S. aureus, mutta infektioiden hoito on hankalampaa, koska tehoavia mikrobilääkkeitä on vähemmän (7).
Sairaanhoitopiirien (nykyisin hyvinvointialueiden) infektioyksiköt seuraavat tartuntatautilain velvoittamana MRSA-löydöksiä alueellaan (8). Vuodesta 2015 alkaen Helsingin ja Uudenmaan sairaanhoitopiirin (Hus) alueella on todettu aiempaa enemmän MRSA:n aiheuttamia veriviljelypositiivisian infektioita huumeiden käyttäjillä. Tutkimuksen tavoitteena oli selvittää epidemian laajuus, aiheuttajakannat ja tapausten kliinistä taudinkuvaa. Selvitystä laajennettiin Varsinais-Suomeen ja Pirkanmaalle sekä muihin sairaanhoitopiireihin.
Aineisto ja menetelmät
Kliinisen mikrobiologian laboratoriot ilmoittavat MRSA-löydökset tartuntatautirekisteriin ja lähettävät kannat THL:n asiantuntijalaboratorioon spa-tyypitykseen tartuntatautilain ja asetuksen perusteella. Tyypityksen tarkoituksena on tuottaa tietoa MRSA-kantojen klonaalisuudesta. Kaikille verestä eristetyille kannoille tehdään myös kokogenomin sekvensointiin (whole genome sequencing, WGS) perustuva ydingenomianalyysi (core genome MLST, cgMLST), jolla voidaan tutkia bakteerien geneettistä samankaltaisuutta. Mitä läheisempää sukua MRSA-kannat ovat toisilleen, sitä todennäköisempää on, että kyseinen kanta on tarttunut henkilöstä toiseen. Sairaanhoitopiirin kuntayhtymä ylläpitää alueellista MRSA-rekisteriä ja seuraa MRSA-tapausten esiintyvyyttä ja ohjaa torjuntatoimia.
Tutkimuksessa tarkasteltiin vuosien 2015–22 MRSA:n aiheuttamia veriviljelypositiivisia infektioita ja muita MRSA-tapauksia Husin, Varsinais-Suomen ja Pirkanmaan alueella. Näillä alueilla MRSA-tapauksia seurataan sairaalan mikrobilääke- ja infektioseurantajärjestelmästä (SAI). Tieto huumeiden käytöstä, syvistä infektiopesäkkeistä, sairaalahoidon keskeytymisestä ja kuolinpäivästä kerättiin potilaskertomuksista.
Tutkimus tehtiin tartuntatautilain velvoittamana normaalin epidemiaselvityskäytännön mukaisesti.
Muista sairaanhoitopiireistä selvitettiin, oliko niissä todettu MRSA:n aiheuttamia veriviljelypositiivisia infektioita pistoshuumeiden käyttäjillä.
Tulokset
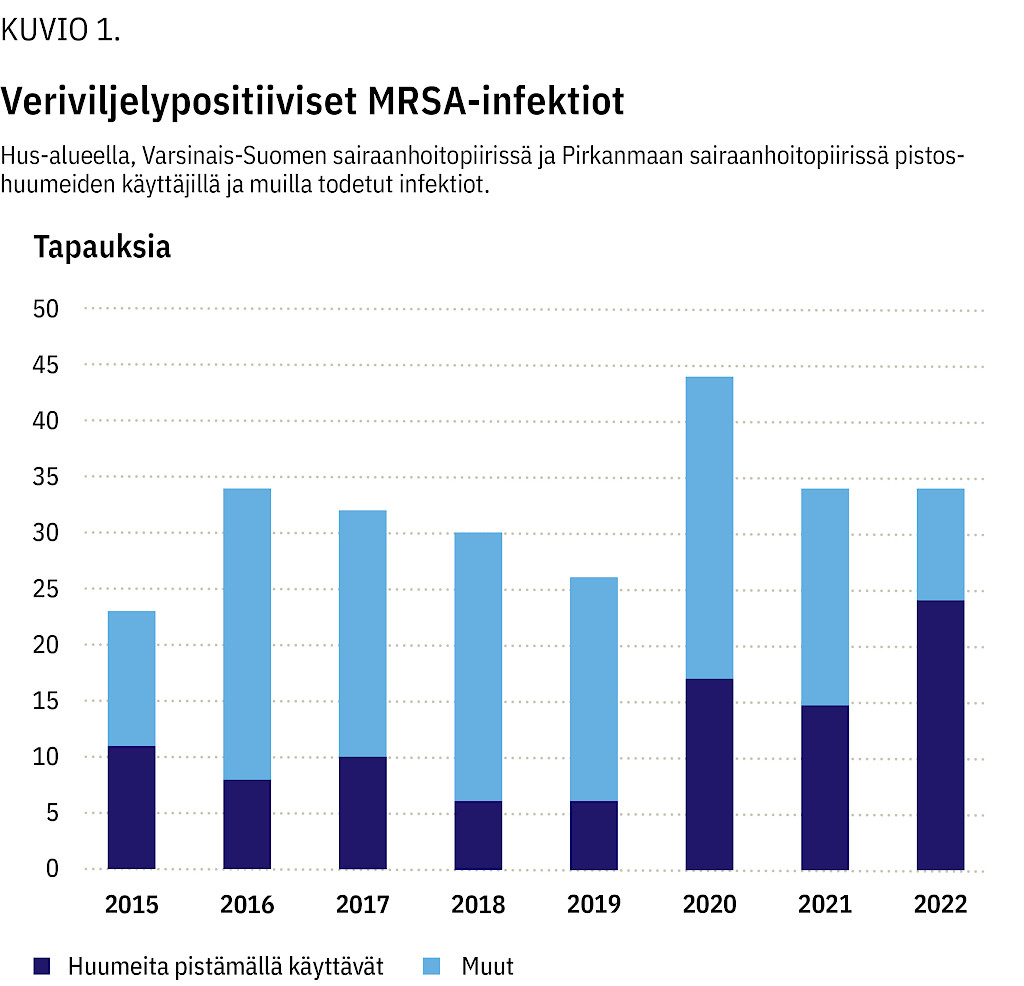
Tutkimusajankohtana veriviljelypositiiviset MRSA-infektiot lisääntyivät merkittävästi huumeiden käyttäjillä (kuvio 1). Hus-alueella näitä infektioita todettiin yhteensä 181 potilaalla, joista 81 käytti huumeita pistämällä.
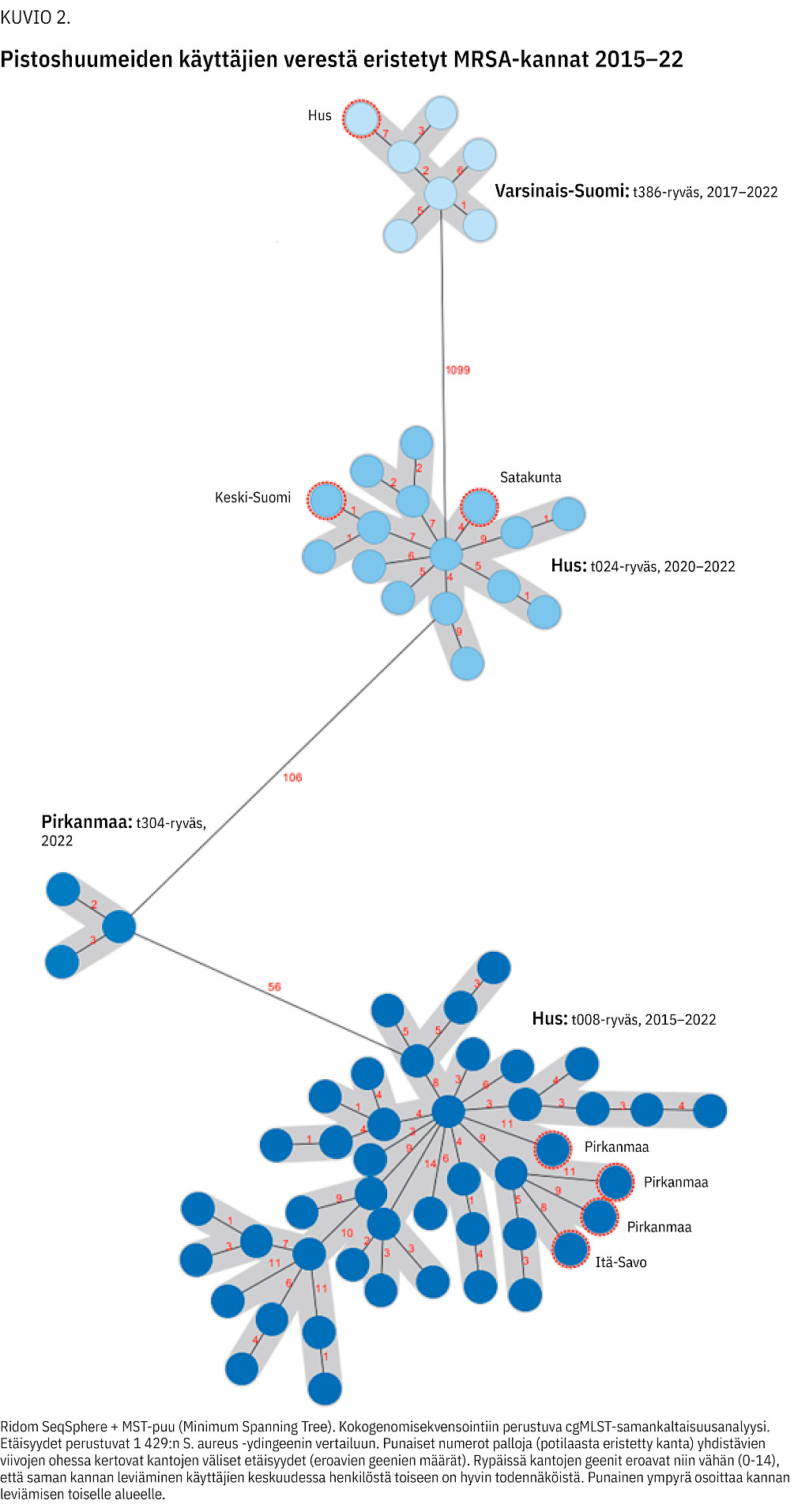
Huumeiden käyttäjien veriviljelypositiivisista infektioista 52 % (42/81) aiheutti pvl -geenipositiivinen MRSA-kanta spa-tyyppi t008 ja 19 % (15/81) pvl -geenipositiivinen MRSA-kanta spa-tyyppi t024. WGS-analyysien perusteella kumpikin kanta muodosti oman rypäänsä eli ne olivat levinneet huumeiden käyttäjien keskuudessa Hus-alueella (kuvio 2). Samaan rypääseen kuuluva t008-kanta löytyi myös kolmesta huumeiden käyttäjän veriviljelypositiivisesta infektiosta Pirkanmaalta ja yhdestä Itä-Savosta sekä t024-kanta vastaavasti Keski-Suomen ja Satakunnan sairaanhoitopiireistä.
Varsinais-Suomessa veriviljelypositiivisia MRSA-infektioita oli 32 eli noin viidesosa Husin vastaavasta. Niistäkin merkittävä osa (40 % vuosina 2017 ja 2020) oli huumeiden käyttäjillä. Varsinais-Suomessa kaikki huumeiden käyttäjien veriviljelypositiiviset MRSA-infektiot liittyivät spa-tyyppiin t386 ja WGS-analyysin perusteella ne kuuluivat samaan rypääseen. Tätä spa-tyyppiä ei ole veriviljelyissä todettu muilla kuin huumeiden käyttäjillä. Vuonna 2022 sama t386-kanta todettiin yhdellä pistoshuumeiden käyttäjällä myös Hus-alueella (kuvio 2).
Pirkanmaan sairaanhoitopiirissä vastaavana aikana todettiin yhteensä 42 MRSA:n aiheuttamia veriviljelypositiivisia infektioita, joista 9 oli huumeiden käyttäjillä. Pirkanmaalla todetuista huumeiden käyttäjien veriviljelypositiivisista infektioista 4 oli spa-tyypin t304 aiheuttamia ja 3 tyypin t008 aiheuttamia. t304-kannoista 3 oli samaa pvl -positiivista kantaa (kuvio 2).
Viidessä muussa sairaanhoitopiirissä todettiin vuosina 2019–22 huumeiden käyttäjillä yhteensä 7 veriviljelypositiivista MRSA-infektioita. Näistä yksi liittyi WGS-analyysin perusteella Husin t008-rypääseen (kuvio 2). Myös Pirkanmaan kolme huumeidenkäyttäjien veriviljelyistä eristettyä t008-kantaa kuuluvat samaan rypääseen.
Näiden kolmen sairaanhoitopiirien alueilla todetuissa huumeiden käyttäjien veriviljelypositiivissa MRSA-infektioissa 89 %:lla (86/97) tapauksista todettiin ainakin yksi syvä infektiopesäke ja näistä lähes puolella (39/86) useita. Yleisimpiä olivat keuhkojen bakteeriemboliat (n = 27), spondylodiskiitti (n = 24), endokardiitti (n = 24), septinen artriitti (n = 21) ja raajan iho- ja pehmytkudosinfektio (n = 19). Endokardiiteista valtaosa sijaitsi kolmiliuskaläpässä (21/24). Aorttaläpän ja mitraaliläpän endokardiitteja todettiin yksi kumpaakin. 27 potilasta jätti sairaalahoidon kesken ja 5 potilasta menehtyi sairaalahoitojakson aikana.
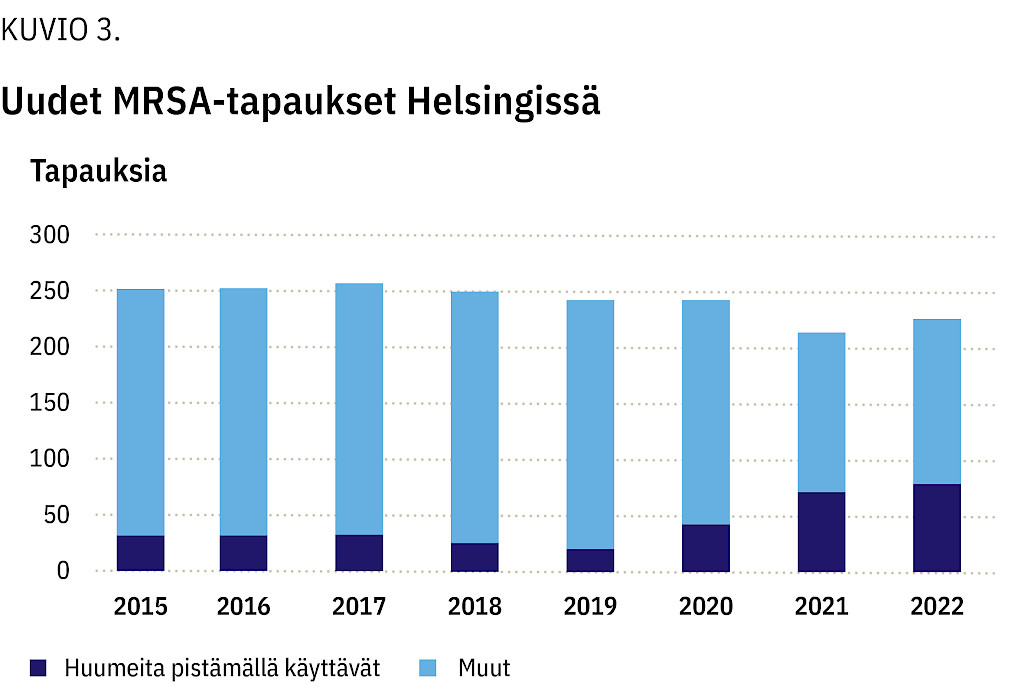
Helsingissä huumeiden käyttäjien osuus kaikista uusista MRSA-tapauksista lisääntyi: vuonna 2018 osuus oli 12 % ja vuonna 2022 puolestaan 36 % (kuvio 3). Sama ilmiö todettiin myös Varsinais-Suomen sairaanhoitopiirissä (9 % vuonna 2019, 12 % vuonna 2022) sekä Pirkanmaan alueella (4 % vuonna 2018, 17 % vuonna 2022). Huumeiden käyttäjiltä löytyi seulonta- ja märkäviljelynäytteissä useita MRSA-kantoja. Yleisimmät spa-tyypit olivat kuitenkin samoja kuin veriviljelyistä löytyneet: Hus-piirissä t008 ja t024, Varsinais-Suomessa t386 ja Pirkanmaalla t304 ja t008.
Pohdinta
Tutkimuksessamme todettiin invasiivisten MRSA-infektioiden lisääntyneen huumeita pistämällä käyttävien keskuudessa Suomessa. Huumeiden käyttäjien iho kolonisoituu herkästi MRSA:lla ja bakteeri voi levitä huumeiden käyttäjien keskuudessa. Kolonisaatiolle altistavat pistämisestä johtuvat ihorikot, kaatuiluun ja pahoinpitelyihin liittyvät ihotraumat, huono henkilökohtainen hygienia, ahtaat ja likaiset asumisolosuhteet, sairaalahoitojaksot sekä mikrobilääkekuurit, joita huumeiden käyttäjät saavat mm. pistospaikkainfektioihin (9,10,11,12,13).
MRSA:lla kolonisoituneet henkilöt ovat alttiita saamaan bakteerin aiheuttaman pistospaikkainfektion sekä siitä edelleen invasiivisen infektion (14). Jos hoitoon hakeutuminen viivästyy, infektiokomplikaatioiden riski kasvaa (15,16,17,18). Yhdysvalloissa tehdyssä tutkimuksessa osoitettiin, että huumeita pistämällä käyttäjillä oli 16-kertainen riski saada invasiivinen MRSA-infektio verrattuna henkilöihin, jotka eivät käyttäneet huumeita (7).
MRSA-infektioiden hoitoa vaikeuttaa se, että bakteeri on vastustuskykyinen mm. tavallisesti käytetyille beetalaktaamiantibiooteille, minkä vuoksi tehokkaan mikrobilääkkeen aloitus viivästyy, hoitoon tarvittaviin lääkkeisiin liittyy enemmän haittavaikutuksia ja hoito on kalliimpaa (19,20).
Vakavien MRSA-infektioiden lisääntyminen liittyi tiettyjen MRSA-kantojen leviämiseen, joista osaa havaittiin useammassa sairaanhoitopiirissä. Kaksi suurinta ryvästä todettiin Hus-alueella. Rypäitä aiheuttaneiden MRSA-kantojen (pvl -geenipositiiviset t008 ja t024) havaittiin levinneen myös muihin sairaanhoitopiireihin.
Pirkanmaalla todettiin omanlaisensa pvl-geenipositiivinen, moniresistentti MRSA-kanta (spa t304). Se on toistaiseksi aiheuttanut kolme veriviljelypositiivista infektiota alueella. Kanta on ominaisuuksiensa vuoksi hyvin leviämiskykyinen.
Varsinais-Suomen pvl -geeninegatiivinen MRSA-kanta (t386) eroaa geneettisesti selvästi muista huumeiden käyttäjien infektiorypäitä aiheuttaneista kannoista, eikä sen aiheuttama kuuden tapauksen ryväs ole merkittävästi laajentunut.
Spa t008 -epidemiakanta on maailmanlaajuisesti erittäin menestyneen MRSA USA300 -kloonin kaltainen. Kannalla on USA300-NA (North American variant) ominaisuudet (ST8, SCCmec IVa, pvl +, ACME+) ja t024-kannalla puolestaan USA300-LV (Latin-American Variant) -kannalle ominaiset piirteet (ST8, SCCmec IVc, pvl +, ACME-). ACME (arginine catabolic mobile element) geenilokuksen koodittaman arginiinihydrolyysireitin tuotoksena syntyy ammoniakkia, joka auttaa stafylokokkia selviytymään ihmisen ihon happamassa ympäristössä. PVL (Panton-Valentinen leukosidiini) on sytotoksiini, joka aiheuttaa valkosolujen tuhoutumista ja kudosvaurioita. Sitä tuottavat kannat liittyvät usein märkäisiin ihoinfektioihin sekä paiseiden muodostukseen. Nämä hankinnaiset ominaisuudet antavat kannalle hyvän kolonisointikyvyn, joka entisestään lisää kannan leviämistä etenkin riskiryhmien keskuudessa (21).
Tässä tutkimuksessa 89 %:lla huumeiden käyttäjistä, joilla todettiin invasiivinen MRSA-infektio, oli myös MRSA:n aiheuttama syvä infektiopesäke. Syviä infektiopesäkkeitä kartoitetaan vartalon tietokonetomografialla ja sydämen kaikututkimuksilla, ja jos sellaisia todetaan, mikrobilääkehoitoa annetaan suoneen vähintään neljän viikon ajan.
Yleisimmin käytettyjä mikrobilääkkeitä ovat vankomysiini, keftaroliini ja daptomysiini (22,23). Hoito suunnitellaan aina yhdessä infektiolääkärin kanssa. Klindamysiini ja sulfa-trimetopriimi tehoavat osaan MRSA-kannoista, mutta ne ovat bakteeriostaattisia lääkkeitä, eikä niitä pidä käyttää ainoina lääkkeinä veriviljelypositiivisen MRSA-infektion hoitoon.
Huumeiden käyttäjät sitoutuvat huonosti pitkiin sairaalahoitoihin. Tutkimuksessamme 28 % potilaista jätti sairaalahoidon kesken. On oleellista, että myös päihdehoitotyön osaajat osallistuvat hoidon suunnitteluun.
Avohoidon vastaanotolle hakeutuvan huumeiden käyttäjän märkäisten ihoinfektioiden ja paiseiden kohdalla on syytä huomioida MRSA:n mahdollisuus. Hyvän käsihygienian lisäksi ihorikkojen ja paiseiden käsittelyssä käytetään suojakäsineitä sekä kertakäyttöistä pitkähihaista suojatakkia ja kirurgista suu-nenäsuojusta sekä tarvittaessa silmäsuojusta tai visiiriä. Kädet desinfioidaan aina ennen suojainten pukemista ja heti niiden riisumisen jälkeen, jotta hoitoympäristöön ei levitetä bakteereita. Paiseesta ja märkäeritteestä otetaan bakteeriviljely, jotta voidaan varmistaa mikrobilääkkeen osuvuus ja infektion paraneminen.
Toisinaan paiseen avaus riittää hoidoksi. Mikrobilääkehoitoa vaativa MRSA:n aiheuttama ihoinfektio hoidetaan herkkyysmäärityksen mukaisella lääkkeellä. Klindamysiini ja sulfa-trimetopriimia sopivat ihoinfektion hoitoon, jos bakteeri on niille herkkä. Penisilliinit ja kefalosporiinit eivät tehoa MRSA-bakteeriin.
Sairaalahoitoon jääviltä pistoshuumeiden käyttäjiltä tulee ottaa tulovaiheessa MRSA-seulontanäytteet ja noudattaa kosketusvarotoimia, kunnes MRSA on suljettu pois (24). Päivystyksessä kuumeilevalta huumeiden käyttäjältä otetaan veriviljelyt ja vakavissa ihoperäisen sepsiksen epäilyissä konsultoidaan infektiolääkäriä MRSA:han tehoavan mikrobilääkkeen liittämisestä hoitoon.
Huumeiden käyttäjien vaikeat yleisinfektiot ja MRSA-epidemia heijastavat Suomen pahenevaa huumeongelmaa. Huumeiden käyttö ja niihin liittyvät ongelmat ovat lisääntyneet viimeisen vuosikymmenen aikana. Vuonna 2017 Suomessa arvioitiin olevan 31 100–44 300 amfetamiinin ja opioidien ongelmakäyttäjää. Ongelmakäyttö oli yleisintä 25–34-vuotiailla, mutta myös 15–24-vuotiaiden keskuudessa käyttö on lisääntynyt (25,26).
Suomessa on hyviä kokemuksia terveysneuvontapisteistä ja puhtaiden pistosvälineiden vaihtamisesta HIV-infektioiden ja hepatiitti C:n ehkäisyssä (25). Huumeiden käyttöön liittyviä MRSA-infektioita ja muita bakteeri-infektioita voidaan ehkäistä edistämällä puhtaiden pistosvälineiden käyttöä ja antamalla huumeiden käyttäjille tietoa infektioista sekä tarjoamalla puitteet huolehtia henkilökohtaisesta hygieniasta. Valvottuja pistotiloja on ollut eri Euroopan maissa 1980-luvulta lähtien, mutta ei vielä Suomessa, vaikka myös meillä asiantuntijat niitä suosittelevat. Pistotilat tuovat huumeita käyttäville useita hyötyjä, kuten turvalliset pistovälineet, turvallinen pistäminen, yliannostuskuolemien väheneminen sekä mahdollisuus saada ohjausta päihdehoitoon (27).
Huumeita pistämällä käyttävien pitää päästä matalalla kynnyksellä haavanhoitoon terveydenhuollon toimipiteisiin. Ehkäisevällä päihdetyöllä vähennetään kaikkia huumeiden käytöstä aiheutuvia terveyshaittoja, myös bakteerien aiheuttamia vakavia yleisinfektiota (28).
Laura Pakarinen: Luentopalkkio (Orion).
Mari Kanerva: Advisory Board (Pfizer), luentopalkkiot (Chiesi, GSK, Orion, Pfizer), kongressimatkakulut (Pfizer)
Laura Lindholm, Reetta Huttunen, Minna Nieminen, Anu Harttio-Nohteri, Tiina Kurvinen, Jaana-Marija Lehtinen, Outi Lyytikäinen: Ei sidonnaisuuksia.
Tämä tiedettiin
• Huumeita pistämällä käyttävät ovat alttiimpia kolonisoitumaan MRSA:lla.
• Aiemmin on todettu, että huumeita pistämällä käyttävillä on 16-kertainen riski sairastua veriviljelypositiiviseen MRSA-infektioon muun väestön riskiin verrattuna.
Tutkimus opetti
• Vakavat veriviljelypositiiviset infektiot ovat lisääntyneet merkittävästi Suomessa viime vuosina.
• Lisääntyminen liittyy erityisesti tiettyjen virulenttien MRSA-kantojen leviämiseen pistoshuumeita käyttävien keskuudessa.
- 1
- Laupland KB, Lyytikäinen O, Søgaard M ym. The changing epidemiology of Staphylococcus aureus bloodstream infection: a multinational population-based surveillance study. Clin Microbiol Infect 2013;19:465–71.
- 2
- Kourtis AP, Hatfield K, Baggs J ym. Emerging Infections Program MRSA Author Group. Vital signs: epidemiology and recent trends in methicillin-resistant and in methicillin-susceptible Staphylococcus aureus bloodstream infections – United States. MMWR Morb Mortal Wkly Rep 2019;68:214–9.
- 3
- van Hal SJ, Jensen SO, Vaska VL, Espedido BA, Paterson DL, Gosbell IB. Predictors of mortality in Staphylococcus aureus bacteremia. Clin Microbiol Rev 2012;25:362–86.
- 4
- Ruotsalainen E, Kardén-Lilja M, Kuusela P ym. Methicillin-sensitive Staphylococcus aureus bacteraemia and endocarditis among injection drug users and nonaddicts: host factors, microbiological and serological characteristics. J Infect 2008;56:249–56.
- 5
- Hämäläinen P, Oksi J. Suonensisäisten huumeiden käyttäjien Staphylococcus aureus -bakteremiat Varsinais-Suomen sairaanhoitopiirin alueella 2007‒2017. Duodecim 2019;135(2):191‒9.
- 6
- Holland TL, Arnold C, Fowler Jr VG. Clinical management of Staphylococcus aureus bacteremia: a review. JAMA 2014;312:1330–41.
- 7
- Jackson KA, Bohm MK, Brooks JT ym. Invasive methicillin-resistant Staphylococcus aureus infections among persons who inject drugs – six sites, 2005–2016. MMWR Morb Mortal Wkly Rep 2018;67:625–8.
- 8
- Kolho E, Lyytikäinen O, Jalava J. Ohje moniresistenttien mikrobien tartunnantorjunnasta. THL, Ohjaus 2/2020. http://urn.fi/ URN:ISBN:978-952-343-463-9
- 9
- Bassetti S, Battegay M. Staphylococcus aureus infections in injection drug users: risk factors and prevention strategies. Infection 2004;32:163–9.
- 10
- Campbell KM, Vaughn AF, Russell KL ym. Risk factors for community-associated methicillin-resistant Staphylococcus aureus infections in an outbreak of disease among military trainees in San Diego, California, in 2002. J Clin Microbiol 2004;42:4050–3
- 11
- Wagner R, Agusto FB. Transmission dynamics for Methicillin-resistant Staphylococcus areus with injection drug user. BMC Infect Dis 2018;18(1):69. doi: 10.1186/s12879-018-2973-4
- 12
- Centers for Disease Control and Prevention (CDC). Methicillin-resistant Staphylococcus aureus skin infections among tattoo recipients – Ohio, Kentucky, and Vermont, 2004-2005. MMWR Morb Mortal Wkly Rep 2006;55:677–9.
- 13
- Ebright JR, Pieper B. Skin and soft tissue infections in injection drug users. Infect Dis Clin North Am 2002;16:697–712.
- 14
- Parikh MP, Octaria R, Kainer MA. Methicillin-Resistant Staphylococcus aureus Bloodstream Infections and Injection Drug Use, Tennessee, USA, 2015-2017. Emerg Infect Dis 2020;26(3):446–53. doi: 10.3201/eid2603.191408
- 15
- Cooper HLF, Brady JE, Ciccarone D, Tempalski B, Gostnell K, Friedman SR. Nationwide increase in the number of hospitalizations for illicit injection drug use-related infective endocarditis. Clin Infect Dis 2007;45:1200–3.
- 16
- Wurcel AG, Anderson JE, Chui KKH ym. Increasing infectious endocarditis admissions among young people who inject drugs. Open Forum Infect Dis 2016;3:ofw157. 10.1093/ofid/ofw157
- 17
- Mawn JG, Rao SS, Chaudhry YP ym. Septic arthritis among users of injection drugs: clinical course and microbial characteristics. Orthopedics 2021;44(6):e747–52.
- 18
- Chandrasekar PH, Narula AP. Bone and joint infections in intravenous drug abusers. Rev Infect Dis 1986;8:904–11.
- 19
- Hassoun A, Linden P, Friedman B. Incidence, prevalence, and management of MRSA bacteremia across patient populations-a review of recent developments in MRSA management and treatment. Crit Care 2017;21(1):211. doi: 10.1186/s13054-017-1801-3
- 20
- Gould IM, David MZ, Esposito S ym. New insights into meticillin-resistant Staphylococcus aureus (MRSA) pathogenesis, treatment and resistance. Int J Antimicrob Agents 2012;39:96–104.
- 21
- Planet PJ, LaRussa SJ, Dana A ym. Emergence of the epidemic methicillin-resistant Staphylococcus aureus strain USA300 coincides with horizontal transfer of the arginine catabolic mobile element and speG-mediated adaptations for survival on skin. MBio 2013;4:e00889-13. doi: 10.1128/mBio.00889-13
- 22
- Ludwig F, Edwards B, Lawes T, Gould IM. Effects of storage on vancomycin and daptomycin MIC in susceptible blood isolates of methicillin-resistant Staphylococcus aureus. J Clin Microbiol 2012;50:3383–7.
- 23
- Zasowski EJ, Trinh TD, Claeys KC ym. Multicenter observational study of ceftaroline fosamil for methicillin-resistant Staphylococcus aureus bloodstream infections. Antimicrob Agents Chemother 2017;61(2). doi: 10.1128/AAC.02015-16
- 24
- Oksanen P, Rintala E, Mastokangas T. MRSA:n seulonta kustannustehokasta hoidon lisäkuluihin verrattuna. Suom Lääkäril 2011;66(40):2949–53.
- 25
- Rönkä S, Markkula J, toim. Huumetilanne Suomessa 2020. THL Raportti 2020.
- 26
- Rönkä S, Ollgren J, Alho H ym. Amfetamiinien ja opioidien ongelmakäytön yleisyys Suomessa vuonna 2017. Duodecim 2020;136(8):927–35.
- 27
- Tran V, Reid S, Roxburgh A, Day C. Assessing drug consumption rooms and longer term (5 year) impacts on community and clients. Risk Manag Healthc Policy 2021;14:4639–47.
- 28
- Rhodes T. Risk environments and drug harms: a social science for harm reduction approach. Int J Drug Policy 2009;20(3):193–201.
MRSA bloodstream infections among injecting drug users
Background Bloodstream infections (BSIs) caused by methicillin-resistant Staphylococcus aureus (MRSA) has increased among injecting drug users (IDU) in Helsinki-Uusimaa Healthcare District (HUS), Southwest Finland (VSSHP) and Pirkanmaa. Our aim was to investigate the extent of the outbreak, MRSA strains involved and the severity of these infections.
Methods Background information of BSI cases caused by MRSA among IDUs during 2015-2022 were collected from the regional MRSA registers of HUS, VSSHP and Pirkanmaa. Other healthcare districts were asked whether MRSA BSIs were detected among IDUs during 2019-2022.Spa-typing and whole-genome sequencing was conducted to MRSA strains in THL's expert microbiology laboratory.
Results In HUS, MRSA BSI cases among IDUs doubled during 2020-2021. Of the cases, 70% were caused by two different pvl-gene positive MRSA-strains (spa-type t008 and t024). In VSSHP, the most common spa-type was t386 and in Pirkanmaa t304.
Conclusions The increase in severe MRSA infections among IDUs was partly explained by the spread of certain MRSA strains that can cause invasive infections more frequently.
Laura Pakarinen, Laura Lindholm, Mari Kanerva, Reetta Huttunen, Minna Nieminen, Anu Harttio-Nohteri, Tiina Kurvinen, Jaana-Marija Lehtinen, Outi Lyytikäinen