Otsalohkodementia – salakavala muistisairaus
Otsalohkodementian ensioireita ovat suunnitelmallisen toiminnan vaikeudet, persoonan ja käyttäytymisen muutokset sekä psyykkiset oireet. Muistin ongelmat ovat alkuvaiheessa yleensä vähäisiä.
Erotusdiagnostiikka voi olla vaikeaa, sillä otsalohkodementiaan saattaa liittyä vaikeita psykoosi- ja mielialaoireita ilman tyypillistä etenevän muistisairauden oirekuvaa.
C9ORF72-toistojaksomutaatio on yleisin otsalohkodementian geneettinen syy, ja mutaation määritystä voidaan harkita diagnostiikassa.
Hoitosuunnitelman tekemiseksi otsalohkodementia on tärkeää tunnistaa varhain. Taudinkulkuun vaikuttavia hoitoja ei toistaiseksi ole.

Otsa-ohimolohkorappeumia (frontotemporal lobar degeneration, FTLD) on pidetty harvinaisina muistisairauksina. Viime vuosina diagnostiikan kehittymisen ja genetiikan tutkimuksen ansiosta niiden on kuitenkin havaittu olevan yleisempiä kuin aiemmin luultiin: niiden arvellaan kattavan 5–10 % etenevistä muistisairauksista (1). Oireet alkavat tyypillisesti myöhäisessä työiässä, ja työikäisten etenevistä muistisairauksista noin 20 % on otsa-ohimolohkorappeumia.
Tuoreen kotimaisen tutkimuksen mukaan otsa-ohimolohkorappeumien ilmaantuvuus pohjoissuomalaisessa 45–70-vuotiaassa väestössä oli 26,8/100 000. Näiden tautien esiintyvyys näyttää olevan Suomessa suurempi kuin muualla maailmassa (2). Oirekuvaa ja taudinmääritystä on selkiyttänyt vuonna 2011 löydetty kromosomiin 9 liittyvä avoimen lukukehyksen 72 toistojaksomutaatio (C9-monistuma), joka periytyy autosomissa vallitsevasti. Mutaation esiintyvyys suomalaisilla potilailla on kansainvälisessä vertailussa erittäin suuri, ja se selittää noin puolet suomalaisista perinnöllisistä tautitapauksista (3,4).
Otsa-ohimolohkorappeumaa sairastavan diagnoosi näyttää viivästyvän 4–5 vuotta oireiden alusta. Diagnostiikan viivästyminen on yhteiskunnalle kallista, sillä potilas kuormittaa sekä työ- ja perheyhteisöä että terveydenhuollon palveluja. Otsa-ohimolohkorappeumien kliiniset ilmentymät tulee tunnistaa ja diagnosoida, jotta oirekuvaan osataan suhtautua asianmukaisesti ja hoitopolku rakentaa potilaan tarpeet huomioivaksi.
Oirekuva
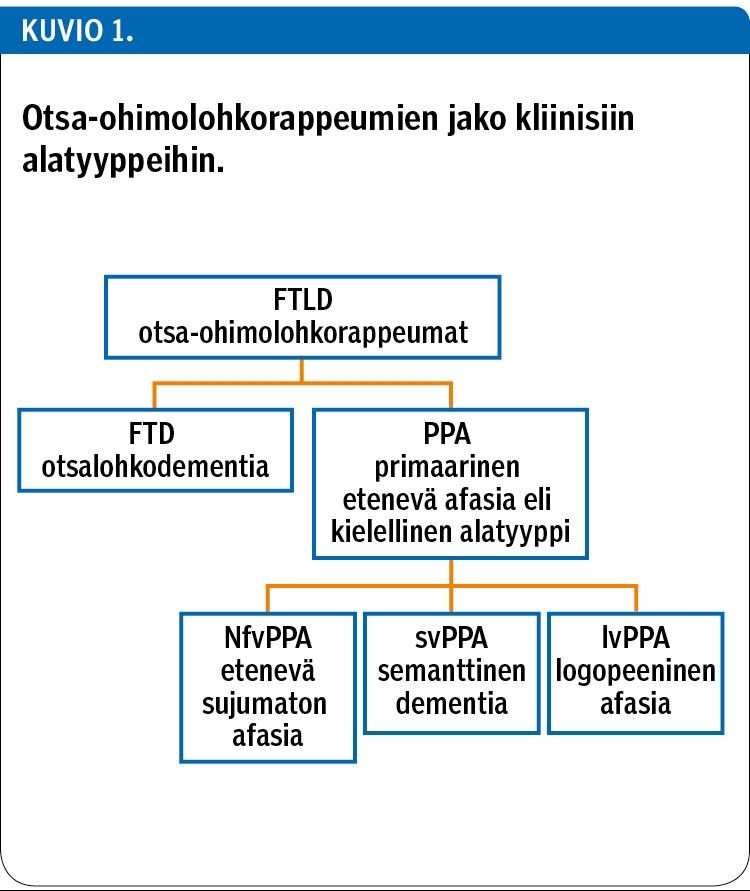
Otsa-ohimolohkorappeumat jaotellaan kliinisen oirekuvan perusteella alatyyppeihin: käytösoirein ilmenevään otsalohkodementiaan (frontotemporal dementia, FTD) ja pääasiassa kielellisin oirein ilmeneviin etenevään sujumattomaan afasiaan (non-fluent variant primary progressive aphasia, nfvPPA), semanttiseen dementiaan (semantic variant primary progressive aphasia, svPPA) ja logopeeniseen afasiaan (logopenic variant primary progressive aphasia, lvPPA) (kuvio 1). Näistä ehdottomasti yleisin on otsalohkodementia, lähes 80 % kaikista otsa-ohimolohkorappeumista (5,6).
Otsalohkodementian ensioireita ovat muutokset käyttäytymisessä ja persoonallisuudessa (taulukko 1). Lisäksi arviointikyky ja toiminnanohjaus heikkenevät. Henkilö voi olla joko apaattinen tai toisaalta levoton ja vauhdikas, aivoatrofian sijainnin mukaan. Merkittävällä osalla potilaista tauti ilmenee alkuun mieliala- ja psykoosioirein (7), kun taas muistisairauteen viittaavat varsinaiset muistivaikeudet ovat vähäisiä. Tämän vuoksi taudin tunnistaminen on haasteellista, samoin kuin erotusdiagnostiikka psykiatrisiin sairauksiin nähden. Mielenkiintoisen havainnon mukaan jopa puolet otsalohkodementiapotilaista on tehnyt taudin alkuvaiheessa rikoksen (esim. liikennerikkeet, seksuaaliset hyökkäykset, omaisuuden tuhoaminen, väkivalta) (8).
Otsalohkodementian oireet alkavat yleensä 55–60 vuoden iässä, mutta vaihtelu on suurta: tiedetään noin 30 ikävuoden kohdalla alkaneita tautitapauksia sekä toisaalta vasta 80 vuoden iässä ilmenneitä ensioireita (9,10). Taudin alkaminen alle 45-vuotiaalla tai yli 75-vuotiaalla on kuitenkin harvinaista. Taudinkuva syvenee verrattain nopeasti ja keskimääräinen elinajan ennuste on 8 vuotta diagnoosista. Kuitenkin osa otsalohkodementioista etenee hyvin hitaasti, jopa 20 vuotta. Merkittävällä osalla potilaista on parkinsonismin tai ALS-taudin piirteitä.
Diagnostiikka
Otsalohkodementian diagnostiikka perustuu oirekuvaan, neuropsykologiseen tutkimukseen ja aivojen kuvantamistutkimuksiin. Koska oireet etenevät alkuun verkkaisesti ja taudinkuva poikkeaa muistisairauden tyypillisestä kuvasta, diagnoosi usein viivästyy. Hitaasti esiin tulevia käyttäytymisen ja persoonan muutoksia ei välttämättä huomata, ennen kuin muutos on jo hyvin merkittävä, tai niitä selitetään elämäntilanteella. Masennusta tai psykoosioireita ei liioin mielletä osaksi neurologista sairautta. Terveenkin henkilön persoona voi iän myötä muuttua, eikä ole helppoa arvioida, mikä kuuluu normaaliin elämään ja missä menee kynnys, jolloin diagnostiset tutkimukset tulisi aloittaa.
Otsalohkodementialle julkaistiin diagnostiset kriteerit viimeksi vuonna 2011 (5), ja niiden suomenkieliset käännökset löytyvät tuoreesta muistisairauksien Käypä hoito -suosituksesta (11). Niissä esitetään diagnoosille kolme eri varmuusastetta: 1) mahdollinen otsalohkodementia kliinisen oirekuvan ja neuropsykologisen tutkimuksen perusteella, 2) todennäköinen otsalohkodementia aivojen kuvantamistutkimuksen (magneettikuvaus ja PET) ja toimintakyvyn heikkenemisen perusteella ja 3) varma otsalohkodementia potilaan perimässä havaitun mutaation tai neuropatologisessa näytteessä todetun histopatologisen löydöksen perusteella.
Tärkeimpiä erotusdiagnostisia sairauksia ovat Alzheimerin tauti, muut muistisairaudet ja psykiatriset sairaudet, kuten depressio, myöhään alkava skitsofrenia ja kaksisuuntainen mielialahäiriö. Muita erotusdiagnostisesti huomioon otettavia sairauksia ovat delirium, aivoverenkiertohäiriöt, aivovammat, keskushermoston infektiot, systeemisairaudet (kuten hypotyreoosi) tai päihteiden väärinkäyttö. Erotusdiagnostisesti haastavissa tilanteissa suosittelemme seurantaa ja tutkimusten toistamista esimerkiksi kuuden kuukauden kuluttua, jotta vältytään vääriltä diagnooseilta.
Neuropsykologiset menetelmät diagnostiikan tukena
Otsalohkodementialle tyypillisiä kognitiivisia oireita ovat toiminnanohjauksen ja tarkkaavuuden säätelyn ongelmat, kielellisen sujuvuuden heikentyminen sekä sosiaalisen kognition vaikeudet. Sen sijaan muistisuoriutuminen säilyy paremmin kuin esimerkiksi Alzheimerin taudissa (12,13,14). Toiminnanohjauksen vaikeuksia esiintyy myös muissa sairauksissa, kuten verenkiertoperäisessä muistisairaudessa ja Alzheimerin taudissa.
Toiminnanohjauksen muutokset eivät välttämättä näy perusterveydenhuollossa käytetyissä testeissä (MMSE, CERAD), ja usein MMSE-testin tulos taudin alkuvaiheessa ja keskivaikeassakin vaiheessa on normaali. Suomessa muistisairauksien seulontaan yleisesti käytetyssä CERAD-tehtäväsarjassa otsalohkodementiaa sairastavien potilaiden on todettu suoriutuvan kielellisen sujuvuuden tehtävässä heikommin ja muistiosioissa paremmin kuin Alzheimer-potilaat (15). CERAD-tehtäväsarja ei kuitenkaan sisällä varsinaista toiminnanohjausta arvioivaa osiota, joten normaali suoriutuminen siinä ei sulje pois varhaista otsalohkodementiaa.
Neuropsykologisessa tutkimuksessa keskeisiä välineitä ovat mm. toiminnanohjausta arvioivat foneeminen sujuvuus, Trail Making ja Stroop, joissa suoritusnopeuden ohella on tärkeää huomioida potilaiden korostunut virhealttius (13,14,16). Aivan sairauden alkuvaiheessa erilaisten sosiaalista kognitiota arvioivien menetelmien on todettu olevan herkempiä tunnistamaan otsalohkodementiaa sairastavat kuin perinteisten neuropsykologisten testien (16), mutta tämäntyyppiset testit eivät vielä ole yleisessä kliinisessä käytössä.
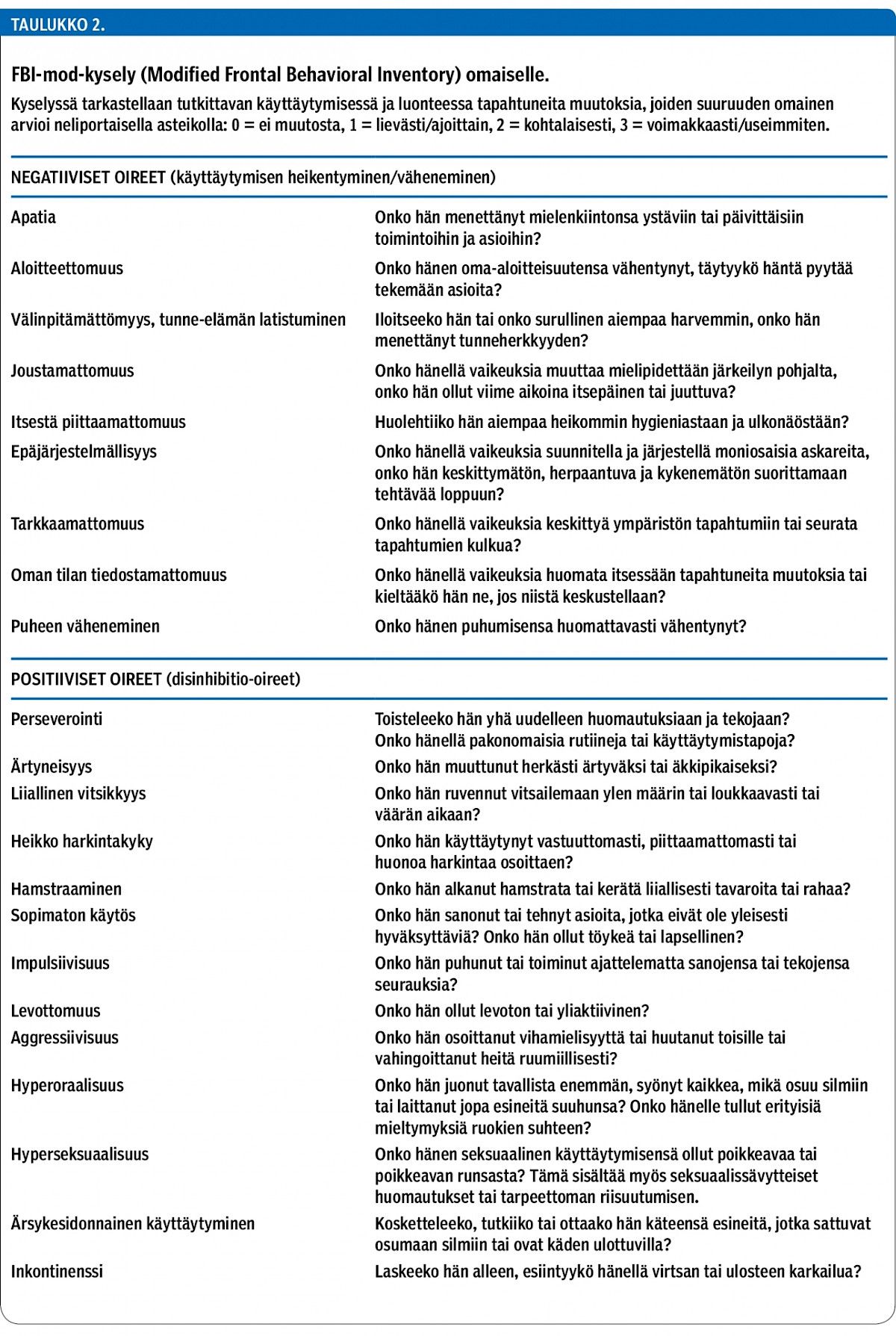
Kognitiota arvioivien testimenetelmien lisäksi otsalohkodementialle tyypillisten käytösoireiden arvioiminen haastattelemalla potilaan läheisiä tai omaiskyselyin on välttämätön osa sairauden diagnostiikkaa (17). Tieteellisissä tutkimuksissa yleisesti käytetty NPI-käytösoirehaastattelu (Neuropsychiatric Inventory) on kliinisessä työssä aikaa vievä. Omaisen täyttämä FBI-mod-kyselylomake (Modified Frontal Behavioral Inventory) (taulukko 2) on helppokäyttöinen ja soveltuu paremmin tämän potilasryhmän arviointiin. Kysely perustuu otsalohkodementian tyyppioireisiin, ja sen on todettu erottelevan hyvin otsalohkodementiaa sairastavat Alzheimer-potilaista ja lievää kognitiivista heikentymää sairastavista (18).
Kuvantamistutkimukset
Rakenteelliseen kuvantamiseen tulisi käyttää magneettikuvausta. Otsalohkodementiassa atrofiaa nähdään molemmin puolin otsa- ja ohimolohkoissa, erityisesti gingulumin etuosissa, uncuksessa ja parahippokampaaligyruksessa, mutta myös päälaki- ja takaraivolohkojen rajoilla (19).
Otsa-ohimolohkorappeumien eri alatyypeille ominaisia aivojen rakenteellisia muutoksia pystytään osoittamaan hyvin ryhmätasolla. Yksilötasolla diagnostisten kriteerien mukainen atrofian arviointi on kuitenkin vaikeaa. Kuvantamislöydös voi jäädä vähäiseksi ja epäspesifiseksi, jolloin löydöksenä voi olla lievä yleinen atrofia. Etenkin sairauden alkuvaiheessa rakenteellisia muutoksia ei välttämättä kyetä havaitsemaan (20). Toisaalta erotusdiagnostiikkaa voi vaikeuttaa mm. se, että vaikka hippokampuksen atrofia on perinteisesti liitetty Alzheimerin tautiin, sitä esiintyy myös otsalohkodementiassa, jopa voimakkaampana (21). Aivojen rakenteelliset kuvantamislöydökset onkin liitettävä osaksi kliinistä kuvaa ja muita diagnostisia tutkimuksia.
Toiminnallinen kuvantaminen (SPECT ja PET) parantaa diagnostiikan luotettavuutta. SPECT- ja PET-tutkimuksissa voidaan nähdä hypoperfuusiota tai hypometaboliaa otsa- ja/tai ohimolohkojen alueella (5). Diffuusiotensorikuvaus ei ole vielä tavanomaisessa kliinisessä käytössä, mutta useissa tutkimuksissa sen on havaittu olevan huomattavasti perinteistä rakenteellista magneettikuvausta herkempi tunnistamaan otsalohkodementiaan liittyviä aivomuutoksia (22,23,24). Myös tau-ligandiin perustuvalla PET-kuvauksella pystytään havaitsemaan jo taudin varhaisessa vaiheessa tau-patologiaa edustavat otsalohkodementiaan liittyvät muutokset (25). Tulevaisuudessa nämä menetelmät voivat selvästi parantaa otsalohkodementian varhaisvaiheen diagnostiikan herkkyyttä ja tarkkuutta.
Selkäydinnesteen biologiset merkkiaineet
Biologinen merkkiaine on esimerkiksi plasmasta tai aivo-selkäydinnesteestä mitattavissa oleva suure, joka kuvastaa tautia tai tautiprosessia. Alzheimerin taudin diagnostiikassa on käytössä kolme biologista merkkiainetta, aivo-selkäydinnesteen tau-proteiini ja fosforyloitunut tau-proteiini sekä amyloidi-β-42, ja selkäydinnesteen merkkiaineita voidaan käyttää otsalohkodementian erotusdiagnostiikassa. Näiden sairauksien neuropatologinen tausta on erilainen ja niin on myös biologisten merkkiaineiden profiili lähtökohtaisesti. Otsalohkodementian diagnostiikassa ei toistaiseksi ole käytössä merkkiaineita. Kuitenkin lähes puolella otsalohkodementiaa sairastavista potilaista neuropatologiaan liittyy poikkeava tau-proteiinin kertyminen, ja tämä voi näkyä suurentuneina fosforyloituneen taun ja taun pitoisuuksina.
Oman tutkimuksemme mielenkiintoinen havainto oli, että otsalohkodementiaa aiheuttavan C9-monistuman kantajista noin 30 %:lla havaittiin poikkeavan pieni aivo-selkäydinnesteen amyloidi-β-42 pitoisuus, vaikka tämän mutaation ei pitäisi altistaa amyloidipatologialle vaan se aiheuttaa TDP-43:een liittyvät neuropatologiset muutokset (FTLD-TDP-patologia) (26). TDP-43 on yleinen immunohistokemiallinen löydös sekä otsalohkodementiassa että ALS-taudissa, mutta sen biologinen merkitys ei ole täysin selvillä.
Toisaalta useampien muistisairauksien sekapatologia on mahdollista myös otsalohkodementiassa, ja sen mahdollisuus lisääntyy iän myötä (27,28). TDP-43:een liittyvästä neuropatologiasta huolimatta aivo-selkäydinnesteen TDP-43-pitoisuuksissa ei ole todettu eroa C9-monistuman kantajien ja muiden potilaiden välillä (29). Voidaankin todeta, että aivo-selkäydinnesteen biologisilla merkkiaineilla ei voida luotettavasti erotella otsalohkodementiaa Alzheimerin taudista.
Genetiikka
Noin puolella potilaista otsalohkodementiaa esiintyy suvussa. Taudin taustalta tunnetaan viisi merkittävää geneettistä tekijää. Suomessa valtaosa suvuittain ilmenevistä tautitapauksista johtuu C9-monistumasta (3,30), ja tämän mutaation esiintyvyys on suomalaisilla maailman suurin (4). C9-monistuman tiedetään aiheuttavan myös noin puolet perinnöllisestä ALS-taudista. Mutaatiota on löydetty myös ilman sukutaustaa ilmenevissä otsalohkodementia- ja ALS-tapauksista (3,30). Tähän mutaatioon liittyvän perinnöllisyyden arvioimista vaikeuttaa se, että taudinkuvissa ilmenee vaihtelua niin, että osalla sukulaisista muistisairauden syyksi on diagnosoitu iäkkäänä ilmaantunut ja ilman spesifistä diagnoosia jäänyt dementia tai Alzheimerin tauti, joillakin psykiatrinen sairaus ja osalla ALS.
C9-monistuma kuuluu mekanismiltaan toistojaksomutaatioihin. C9ORF72-geenin kuuden nukleotidin (GGGGCC) jaksosta terveellä henkilöllä on tyypillisesti kolme kopiota. Otsalohkodementiassa toistojaksoja on satoja tai tuhansia. Sairautta aiheuttavan muutoksen alarajana pidetään 20–40 toiston määrää. Väliin jää alue, jossa toistoja voi olla joitakin kymmeniä eikä niiden biologista merkitystä ei tarkasti tunneta. Välimuotoisten toistomäärien on ajateltu liittyvän esimerkiksi Parkinsonin tautiin (31). Lisäksi toistojaksojen on havaittu pitenevän sukupolvelta toiselle ja samalla myös taudin alkamisikä varhaistuu (32).
Muita tärkeimpiä tautia aiheuttavia perinnöllisiä tekijöitä ovat mutaatiot PGRN-, MAPT-, CHMP2B- ja VCP-geeneissä. Näiden on kuitenkin arvioitu olevan hyvin harvinaisia Suomessa (33,34). Suuri osa tautia aiheuttavista mutaatioista on vielä löytämättä ja taudin geneettinen tutkimus on vilkasta.
C9ORF72-toistojaksomutaatioon liittyvät erityispiirteet
C9-monistuman on havaittu aiheuttavan kaikkia otsa-ohimolohkorappeumien kliinisiä alatyyppejä. Suurimmalla osalla mutaation kantajista on otsalohkodementia, mutta oirekuvassa on vaihtelua. C9-monistuma on käytännössä ainoa tunnettu perinnöllinen tekijä, joka aiheuttaa samanaikaisen ALS-taudin ja otsalohkodementian (36).
Erityisesti C9-monistumaan liittyy poikkeuksellisen runsaasti psykiatrisia oireita. Suomalaisista potilaista yhteensä 60 % oli kärsinyt psykiatrisiksi luokitelluista tiloista ennen otsalohkodementian diagnoosia (7). Suurimmalla osalla ensidiagnoosi oli psykoosi, mutta osalla potilaista oli diagnosoitu myös mielialahäiriö. Psykiatriset oireet ilmenivät keskimäärin viisi vuotta ennen otsalohkodementian diagnoosia. Muiden mutaatioiden aiheuttamassa otsalohkodementiassa ei esiinny psykoottista käytöstä.
C9-monistumaa kantavien potilaiden ryhmä on myös kuvantamislöydöksiltä varsin heterogeeninen. Mutaation kantajilla atrofia on usein laaja-alaista käsittäen otsa-ja ohimolohkot (mukaan lukien prefrontaalikorteksi, insula ja cingulate) sekä alueita päälaki- ja takaraivolohkoissa. Tarkemmissa tietokonepohjaisissa rakenneanalyyseissä on havaittu usein atrofiaa myös talamuksessa ja pikkuaivoissa (37), ja tätä havaitaan verrattaessa C9-monistumaa kantavia muihin otsalohkodementiapotilaisiin. Toisaalta kirjallisuudessa on kuvattu myös C9-monistuman kantajia, joilla on kliinisesti selvä otsalohkodementia muttei lainkaan havaittavia rakennemuutoksia aivojen magneettikuvassa (37).
C9ORF72-toistojaksomutaation määritys osana kliinistä diagnostiikkaa
C9-monistuman määritys osana kliinistä diagnostiikkaa on myös mahdollista, ja suomalaisilla otsalohkodementia- ja ALS-potilailla mahdollisuus mutaation löytymiseen on kohtalainen. Geenitesti on nopea ja vahvistaa neurologisen sairauden usein varhaisemmin kuin mitä diagnoosiin päästäisiin muuten.
Etenevän muistisairauden geneettinen diagnoosi tuo kuitenkin mukanaan tarpeen perinnöllisyysneuvontaan ja etenkin lähisuvun tilanteen pohdintaan. Kyseessä on autosomissa vallitsevasti periytyvä sairaus, joten lasten riski kantaa mutaatiota on 50 %. Prediktiivistä geenitutkimusta ei kuitenkaan pidä nykytietämyksen valossa tehdä. C9-monistuman aiheuttamassa fenotyypissä on laaja vaihtelu, keski-iässä alkavasta etenevästä muistisairaudesta hyvinkin iäkkäänä alkaviin neurologisiin oireisiin ja ALS-tautiin. Nykytiedon perusteella mutaation kantajan oirekuvaa tai sairastumisikää ei pystytä ennustamaan.
Geenitutkimus tuo hyvän työkalun neurologiseen diagnostiikkaan, mutta se tulee tehdä harkiten ja yhteisymmärryksessä potilaan ja omaisten kanssa niin, että tuloksen tuomiin seuraamuksiin osataan varautua.
Hoito
Otsalohkodementian taudinkulkuun vaikuttavia hoitomuotoja ei toistaiseksi ole. Alzheimerin taudin kolinergisiä lääkehoitoja ja memantiinia on tutkittu myös otsalohkodementiassa, joskin hyvin pienissä potilasryhmissä. Niistä ei ole saatu merkittävää hyötyä ja ne saattavat jopa pahentaa oireita (38). SSRI-lääkkeillä on kuvattu olevan jonkin verran hyödyllisiä vaikutuksia käytösoireisiin, mutta satunnaistettuja tutkimuksia ei ole tehty. Aripipratsolilla, olantsapiinilla ja risperidonilla on yksittäisissä tutkimuksissa saavutettu kohtalainen vaste potilaiden käytösoireisiin, mutta niitä tulee käyttää erityistä varovaisuutta noudattaen, sillä otsalohkodementiapotilaat ovat erittäin herkkiä saamaan psykoosilääkkeistä ekstrapyramidaalisille haittavaikutuksille (38).
Lääkkeettömät keinot, kuten muiden sairauksien hyvä hoito, hyvästä yleishoidosta (esim. ravitsemuksesta) huolehtiminen, säännöllinen seuranta, liikunta, säännöllinen unirytmi, puheterapia ja psykoedukaatio, ovat tärkeä osa otsalohkodementiapotilaan hoitoa. Käyttäytymisterapeuttiset hoidot (oireanalyysi, käyttäytymisen muutoksen johtavan mallin pohtiminen ja muutoksen arviointi) voivat olla hyödyllisiä. Sosiaalipalvelujen ja taloudellisen tuen tarve tulee arvioida varhaisessa vaiheessa, ja tällöin on hyvä ottaa kantaa myös oikeustoimikelpoisuutta edellyttäviin seikkoihin, kuten testamenttikelpoisuuteen ja edunvalvontaan. Hoitavan lääkärin tulee arvioida potilaan ajokyky. Hoitoketjujen kehittäminen on tarpeen, ja toisaalta tietoa otsalohkodementiasta on syytä lisätä niin perusterveydenhuollossa kuin neurologian ja psykiatrian alallakin (38).
Tutkimus taudin molekulaarisen patogeneesin ympärillä on vilkasta. Eläinmalleissa on kuvattu lupaavia tuloksia C9-monistumaan kohdistuvasta geeniterapiasta (39).
Lopuksi
Otsalohkodementian tunnistaminen sekä oikea ja varhainen diagnostiikka on tärkeää, jotta henkilön oireisiin osataan suhtautua asianmukaisesti ja hoito voidaan kohdistaa ja ajoittaa oikein. Asianmukainen diagnoosi myös vähentää omaisten hämmennystä potilaan muuttuneesta käytöksestä ja tukee jaksamista.
Otsalohkodementia on sairaus neurologian ja psykiatrian rajapinnalta, ja taudin diagnostiikassa ja hoidossa tarvitaan näiden kahden erikoisalan yhteistyötä. Muistisairauksien kirjossa näitä potilaita ei ole määrällisesti kovin paljon, he ovat usein työikäisiä ja oirekuva on käytösoirepainotteinen, ja siksi hoito voidaan ja kannattaa suunnitella yksilöllisesti. Vahva psykiatrinen osaaminen hoidossa on tarpeen ja potilaan vuorohoidot lienee siten järkevää järjestää yksikössä, jossa se on tarjolla.
C9-monistuman määritystä voidaan käyttää diagnostiikan apuvälineenä tilanteissa, joissa erotusdiagnostiikkaan tarvitaan lisätyökaluja, kuten keski-iässä alkaneissa psykiatrisissa sairauksissa. Geenitutkimuksen harkinta on syytä jättää muistisairauksiin perehtyneelle neurologille tai geriatrille, koska geneettinen diagnoosi tuo tullessaan tiedon vallitsevasti perinnöllisestä neurologisesta sairaudesta. Sillä voi olla suuri vaikutus perheen ja laajemmin suvun henkiseen hyvinvointiin. Toisaalta tieteellisen tutkimuksen ja taudinkulkuun vaikuttavien hoitojen kehittymisen myötä C9-monistuman aiheuttamaa neurologista sairautta voidaan ehkä vuosien kuluttua hoitaa kohdennetulla geeniterapialla, jonka vuoksi on tärkeää, että opimme diagnosoimaan otsa-ohimolohkorappeumat mahdollisimman varhaisessa vaiheessa.
Anne M. Remes, Ramona M. Haanpää, Noora-Maria Suhonen, Anna Junttila, Eino Solje: Ei sidonnaisuuksia.
- 1
- Cooper-Knock J, Shaw PJ, Kirby J. The widening spectrum of C9ORF72-related disease; genotype/phenotype correlations and potential modifiers of clinical phenotype. Acta Neuropathol 2014;127:333–45.
- 2
- Luukkainen L, Bloigu R, Moilanen V, Remes AM. Epidemiology of frontotemporal lobar degeneration in Northern Finland. Dement Geriatr Cogn Dis Extra 2015;5:435–41.
- 3
- Renton AE, Majounie E, Waite A ym. A hexanucleotide repeat expansion in C9ORF72 is the cause of chromosome 9p21-linked ALS-FTD. Neuron 2011;72:257–68.
- 4
- Majounie E, Renton AE, Mok K ym. Frequency of the C9orf72 hexanucleotide repeat expansion in patients with amyotrophic lateral sclerosis and frontotemporal dementia: a cross-sectional study. Lancet Neurol 2012;11:323–30.
- 5
- Rascovsky K, Hodges JR, Knopman D ym. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain 2011;134:2456–77.
- 6
- Gorno-Tempini ML, Hillis AE, Weintraub S ym. Classification of primary progressive aphasia and its variants. Neurology 2011;76:1006–14.
- 7
- Solje E, Aaltokallio H, Koivumaa-Honkanen H ym. The phenotype of the C9ORF72 expansion carriers according to revised criteria for bvFTD. PLoS One 2015;10:e0131817.
- 8
- Liljegren M, Naasan G, Temlett J ym. Criminal behavior in frontotemporal dementia and Alzheimer disease. JAMA Neurol 2015;72:295–300.
- 9
- Rosso SM, Donker Kaat L, Baks T ym. Frontotemporal dementia in The Netherlands: patient characteristics and prevalence estimates from a population-based study. Brain 2003;126:2016–22.
- 10
- Mackenzie IR, Foti D, Woulfe J, Hurwitz TA. Atypical frontotemporal lobar degeneration with ubiquitin-positive, TDP-43-negative neuronal inclusions. Brain 2008;131:1282–93.
- 11
- Suomalaisen Lääkäriseuran Duodecimin, Societas Gerontologica Fennican, Suomen Geriatrit -yhdistyksen, Suomen Neurologisen Yhdistyksen, Suomen Psykogeriatrisen Yhdistyksen ja Suomen Yleislääketieteen Yhdistyksen asettama työryhmä. Muistisairaudet. Käypä hoito -suositus 27.1.2017. www.kaypahoito.fi
- 12
- Harciarek M, Cosentino S. Language, executive function and social cognition in the diagnosis of frontotemporal dementia syndromes. Int Rev Psychiatry 2013;25:178–96.
- 13
- Yoshizawa H, Vonsattel JP, Honig LS. Presenting neuropsychological testing profile of autopsy-confirmed frontotemporal lobar degeneration. Dement Geriatr Cogn Disord 2013;36:279–89.
- 14
- Ranasinghe KG, Rankin KP, Lobach IV ym. Cognition and neuropsychiatry in behavioral variant frontotemporal dementia by disease stage. Neurology 2016;86:600–10.
- 15
- Haanpaa RM, Suhonen NM, Hartikainen P ym. The CERAD neuropsychological battery in patients with frontotemporal lobar degeneration. Dement Geriatr Cogn Dis Extra 2015;5:147–54.
- 16
- Torralva T, Roca M, Gleichgerrcht E, Bekinschtein T, Manes F. A neuropsychological battery to detect specific executive and social cognitive impairments in early frontotemporal dementia. Brain 2009;132:1299–309.
- 17
- Bozoki AC, Farooq MU. Frontotemporal lobar degeneration insights from neuropsychology and neuroimaging. Int Rev Neurobiol 2009;84:185–213.
- 18
- Suhonen NM, Hallikainen I, Hanninen T ym. The Modified Frontal Behavioral Inventory (FBI-mod) for patients with frontotemporal lobar degeneration, Alzheimer’s disease, and mild cognitive impairment. J Alzheimers Dis 2017;56:1241–51.
- 19
- Hartikainen P, Rasanen J, Julkunen V ym. Cortical thickness in frontotemporal dementia, mild cognitive impairment, and Alzheimer’s disease. J Alzheimers Dis 2012;30:857–74.
- 20
- Diehl-Schmid J, Onur OA, Kuhn J, Gruppe T, Drzezga A. Imaging frontotemporal lobar degeneration. Curr Neurol Neurosci Rep 2014;14:489,014-0489-x.
- 21
- Hornberger M, Wong S, Tan R ym. In vivo and post-mortem memory circuit integrity in frontotemporal dementia and Alzheimer’s disease. Brain 2012;135:3015–25.
- 22
- Zhang Y, Tartaglia MC, Schuff N ym. MRI signatures of brain macrostructural atrophy and microstructural degradation in frontotemporal lobar degeneration subtypes. J Alzheimers Dis 2013;33:431–44.
- 23
- Mahoney CJ, Simpson IJ, Nicholas JM ym. Longitudinal diffusion tensor imaging in frontotemporal dementia. Ann Neurol 2015;77:33–46.
- 24
- Santillo AF, Martensson J, Lindberg O ym. Diffusion tensor tractography versus volumetric imaging in the diagnosis of behavioral variant frontotemporal dementia. PLoS One 2013;8:e66932.
- 25
- Dani M, Brooks DJ, Edison P. Tau imaging in neurodegenerative diseases. Eur J Nucl Med Mol Imaging 2016;43:1139–50.
- 26
- Kamalainen A, Herukka SK, Hartikainen P ym. Cerebrospinal fluid biomarkers for Alzheimer’s disease in patients with frontotemporal lobar degeneration and amyotrophic lateral sclerosis with the C9ORF72 repeat expansion. Dement Geriatr Cogn Disord 2015;39:287–93.
- 27
- Kovacs G, Alafuzoff, I, Al-Sarraj S ym. Mixed brain pathologise in dementia: the BrainNet Europe consortium experience. Dement Geriatr Cogn Dis 2008;26:343–50.
- 28
- Wharton S, Brayne C, Savva G ym. Medical Research Council Cognitive Function and Aging Study: Epidemiological neuropathology: The MRC cognitive function and aging study experience. J Alzheimers Dis 2011;25:359–72.
- 29
- Junttila A, Kuvaja M, Hartikainen P ym. Cerebrospinal fluid TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis patients with and without the C9ORF72 hexanucleotide expansion. Dement Geriatr Cogn Dis Extra 2016;6:142–9.
- 30
- DeJesus-Hernandez M, Mackenzie IR, Boeve BF ym. Expanded GGGGCC hexanucleotide repeat in noncoding region of C9ORF72 causes chromosome 9p-linked FTD and ALS. Neuron 2011;72:245–56.
- 31
- Nuytemans K, Bademci G, Kohli MM ym. C9ORF72 intermediate repeat copies are a significant risk factor for Parkinson disease. Ann Hum Genet 2013;77:351–63.
- 32
- Benussi L, Rossi G, Glionna M ym. C9ORF72 hexanucleotide repeat number in frontotemporal lobar degeneration: a genotype-phenotype correlation study. J Alzheimers Dis. 2014;38:799–808.
- 33
- Kaivorinne AL, Kruger J, Kuivaniemi K ym. Role of MAPT mutations and haplotype in frontotemporal lobar degeneration in Northern Finland. BMC Neurol 2008;8:48,2377-8-48.
- 34
- Kruger J, Kaivorinne AL, Udd B, Majamaa K, Remes AM. Low prevalence of progranulin mutations in Finnish patients with frontotemporal lobar degeneration. Eur J Neurol 2009;16:27–30.
- 35
- Snowden JS, Rollinson S, Thompson JC ym. Distinct clinical and pathological characteristics of frontotemporal dementia associated with C9ORF72 mutations. Brain 2012;135:693–708.
- 36
- Rohrer JD, Isaacs AM, Mizlienska S ym. C9orf72 expansions in frontotemporal dementia and amyotrophic lateral sclerosis. Lancet Neurol 2015;14:291–301.
- 37
- Riedl L, Mackenzie IR, Forstl H, Kurz A, Diehl-Schmid J. Frontotemporal lobar degeneration: current perspectives. Neuropsychiatr Dis Treat 2014;10:297–310.
- 38
- Ciura S, Lattante S, Le Ber I ym. Loss of function of C9 orf 72 causes motor deficits in a zebrafish model of amyotrophic lateral sclerosis. Ann Neurol 2013;74:180–7.
Frontotemporal dementia
Frontotemporal lobar degeneration (FTLD) is the second most common early onset dementing disease. The most common subtype of FTLD is behavioural variant frontotemporal dementia (bvFTD). The first symptoms of bvFTD include deterioration of executive functions, changes in personality and behaviour, and psychiatric symptoms. Disturbances of episodic memory are not usually encountered in the early phases of bvFTD.
Other subtypes of FTLD include primary progressive aphasias, which are divided into non-fluent variant primary progressive aphasia (nfvPPA) and semantic variant primary progressive aphasia (svPPA).
The early symptoms of bvFTD may include psychotic and mood symptoms without features of progressive dementing disease. Thus, the differential diagnosis between bvFTD and psychiatric disorder may be challenging.
The Modified Frontal Behavioral Inventory (FBI-mod) is a useful tool in the assessment of behavioural symptoms and in diagnostics.
The recognition and diagnosis of FTLD is an important issue for appropriate pharmaceutical interventions and for a proper medical treatment plan.
The C9ORF72 expansion is the most common genetic aetiology for FTLD and screening for the mutation may be used in the diagnostic workup of these diseases.