Eteisvärinäpotilaan liitännäissairaudet rekisteritiedon perusteella
Lähtökohdat Eteisvärinä on merkittävä aivoinfarktin riskitekijä, ja eteisvärinäpotilaan aivoinfarktiriskiin vaikuttavat muun muassa potilaan ikä, sukupuoli ja liitännäissairaudet. Aivoinfarktin riski arvioidaan CHA 2 DS 2 -VASc-pisteytyksen avulla, ja ≥ 2 pistettä saaneella potilaalla riski on suuri. Liitännäissairauksien asianmukainen kirjaaminen potilastietojärjestelmiin sekä terveydenhuollon rekistereihin on tärkeää.
Menetelmät Eteisvärinän aivoinfarktiriskiin vaikuttavien liitännäissairauksien esiintyvyydet kerättiin valtakunnallisista terveydenhuollon rekistereistä vuosina 2012–2018 uuden eteisvärinädiagnoosin saaneista potilaista (n = 168 356).
Tulokset Verenpainetaudin, hyperkolesterolemian ja diabeteksen suurimmat esiintyvyydet löytyivät lääkeostorekisterin perusteella. Sydämen vajaatoiminta-, valtimosairaus- sekä iskeeminen aivohalvaus- ja ohimenevä aivoverenkiertohäiriö (TIA) -diagnooseja tunnistettiin selvästi eniten erikoissairaanhoidon hoitoilmoitusrekisteritiedoista. CHA 2 DS 2 -VASc-arvo ≥ 2 oli miehistä 74,8 %:lla ja naisista 87,1 %:lla.
Päätelmät Kattava analyysi eteisvärinäpotilaiden liitännäissairauksista edellyttää tietojen laajamittaista yhdistämistä useista rekisterilähteistä.

Valtakunnallisia sosiaali- ja terveydenhuollon rekistereitä käytetään terveyden- ja sairaanhoidon toiminnan kehittämiseen, hallinnollisiin tarkoituksiin sekä tutkimustoiminnassa (1,2). Rekistereihin voi liittyä tiedon kattavuuden haasteita; ne esimerkiksi sisältävät harvoin tietoa kaikista väestöryhmistä ja sairauksista. Tutkimuksissa on myös todettu eroavaisuuksia rekisteritietojen ja terveystutkimusten tietojen vastaavuudessa. Hoitoilmoituksiin perustuvien rekisteriaineistojen tiedot on todettu puutteellisiksi muun muassa lihavuuden ja korkean verenpaineen esiintyvyyksien arvioinnissa. FinTerveys 2017 -väestötutkimuksessa kohonneen verenpaineen esiintyvyys oli hoitoilmoitusrekisteritietoihin verrattuna yli kaksinkertainen (3).
Eteisvärinä on yleisin pitkäkestoinen rytmihäiriö, ja sen esiintyvyys lisääntyy huomattavasti iän mukana. Yli 80-vuotiaista sitä sairastaa jopa 17 %, ja elinikäinen riski saada eteisvärinä on yli 30 % (4,5). Eteisvärinään liittyy tromboembolisten komplikaatioiden – erityisesti aivoinfarktin – riski, ja vähintään 20–30 % aivoinfarktipotilaista sairastaa eteisvärinää (6,7). Iäkkäillä potilailla eteisvärinän osuus aivoinfarktin aiheuttajana kasvaa merkittävästi (6). Aivoinfarktin riski arvioidaan CHA 2 DS 2 -VASc-riskipisteytyksen avulla: ≥ 2 pistettä saaneella potilaalla riski on suuri (8). Aivoinfarktiin vaikuttavien riskitekijöiden tulisi olla asianmukaisesti kirjattuna rekistereissä potilaan hyvän hoidon kannalta sekä tilastollisista syistä.
Tutkimuksemme tarkoituksena oli selvittää, miten eteisvärinän aivoinfarktiriskiin vaikuttavat liitännäissairaudet voidaan havaita eri väestörekistereiden avulla, sekä arvioida, miten eri rekistereiden käyttö ja yhdistäminen vaikuttaa potilaiden kokonaisriskiin CHA 2 DS 2 -VASc-pisteillä arvioituna.
Aineisto ja menetelmät
Tutkimus on osa FinACAF-tutkimushanketta (9). Keskeisistä valtakunnallisista rekistereistä kerättiin tiedot suomalaisista eteisvärinäpotilaista vuosilta 2004–2018. Tämän tutkimuksen aineisto koostuu kaikista 18 vuotta täyttäneistä suomalaisista eteisvärinäpotilaista, joilla oli ICD-10 (International Classification of Diseases) -luokituksen mukainen uusi I48-diagnoosikoodi hoitoilmoitusrekisterissä (Hilmo, AvoHilmo) tai Kelan lääkekorvattavuusrekisterissä vuosina 2012–2018 (n = 168 356).
Potilastiedot yhdistettiin henkilötunnuksen avulla Hilmon ja AvoHilmon sekä Kelan lääkeostorekisterin ja lääkekorvattavuusrekisterin tietoihin aikaväliltä 1.1.2004–31.12.2018. Perusterveydenhuollon hoitoilmoitusrekisteri (AvoHilmo) otettiin käyttöön vuonna 2011. Halusimme selvittää myös tämän rekisterin tietosisältöä merkittävien liitännäissairauksien löytämiseksi, joten tutkimuskohortin muodostavat potilaat, joiden eteisvärinädiagnoosi on asetettu 1.1.2012 alkaen.
Eteisvärinäpotilaan aivoinfarktiriski arvioidaan CHA 2 DS 2 -VASc-pisteytyksellä (taulukko 1), joka koostuu seuraavista riskitekijöistä: sydämen systolinen vajaatoiminta (1 piste), verenpainetauti (1 piste), ikä ≥ 75 vuotta (2 pistettä), diabetes (1 piste), aiempi aivohalvaus tai ohimenevä iskeeminen aivoverenkiertohäiriö (TIA) (2 pistettä), valtimosairaus (1 piste), ikä 65–74 vuotta (1 piste) sekä naissukupuoli, jos henkilö on 75 vuotta täyttänyt (1 piste). CHA 2 DS 2 -VASc-pisteytys tunnistaa hyvin sekä pienen riskin (CHA 2 DS 2 -VASc = 0/1) että suuren riskin (CHA 2 DS 2 -VASc ≥ 2) potilaat ja soveltuu hyvin eteisvärinäpotilaan antikoagulaatiohoidon tarpeen arviointiin kliinisessä työssä (8,10).
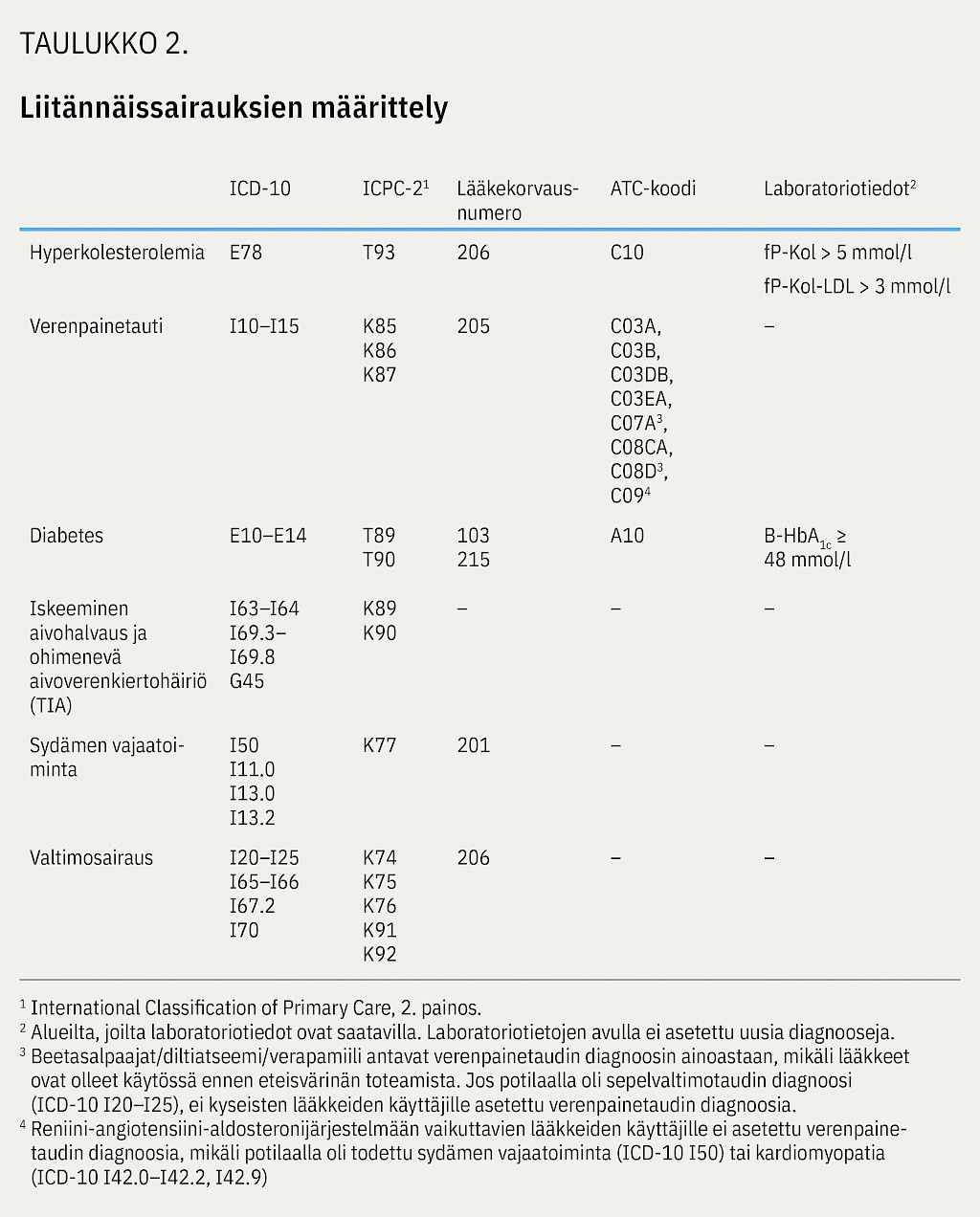
Eteisvärinän liitännäissairauksista tarkasteltiin verenpainetautia, diabetesta, hyperkolesterolemiaa, sydämen vajaatoimintaa, valtimosairautta sekä sairastettua iskeemistä aivohalvausta tai TIA-kohtausta.
Liitännäissairauksia tunnistettiin hoitoilmoitusrekistereistä; Hilmosta ICD-10-diagnoosikoodilla ja AvoHilmosta ICD-10- sekä ICPC-2-koodien avulla (International Classification of Primary Care). ICPC-2-luokitus kuvaa vastaanottokäynteihin johtaneita syitä ja terveysongelmia perusterveydenhuollossa. Jokaisesta hoitoilmoitusrekisterin kontaktista kirjattiin 12 ensimmäistä oire- ja syydiagnoosia tai ICPC-2-luokituksen käyntisyytä. Hyperkolesterolemian, verenpainetaudin, diabeteksen, sydämen vajaatoiminnan tai valtimosairauden diagnoosi asetettiin myös potilaan lääkityksen perusteella, lääkeostojen ja lääkekorvattavuusoikeuksien avulla. Liitännäissairauksien määrittelyt kuvataan taulukossa 2.
Laboratoriotietoja kerättiin kuudesta sairaanhoitopiiristä ja ne kattoivat noin 80 % potilaista. Laboratoriotietoja käytettiin täydentävänä tietona diabeteksen ja hyperlipidemian arvioimisessa, mutta laboratoriotuloksen perusteella potilaille ei asetettu enää uusia diagnooseja.
Liitännäissairauksien esiintyvyydet ja potilaiden CHA 2 DS 2 -VASc-pisteet on laskettu kohorttiin tulon hetkellä rekisterikohtaisesti sekä kaikki rekisteritiedot yhdistäen.
Tulokset
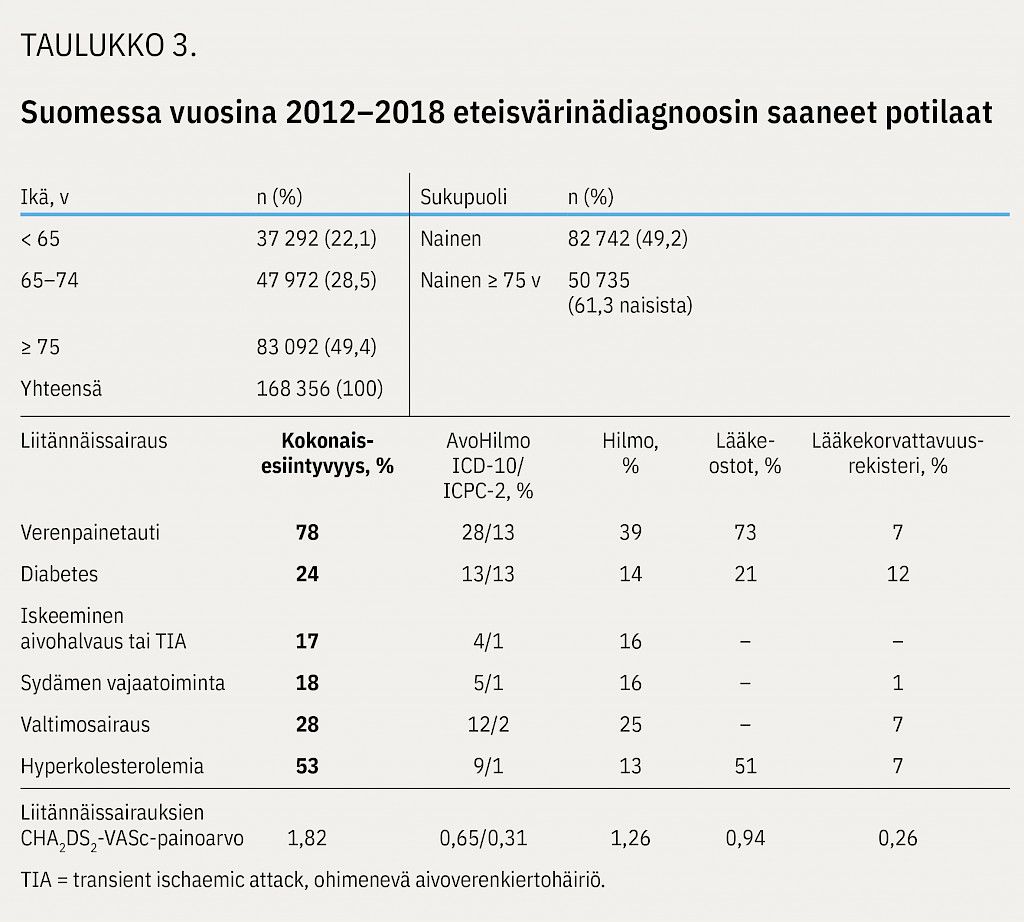
Vuosina 2012–2018 todettiin uusi eteisvärinä 168 356 potilaalla. Kohorttiin tulon hetkellä miesten iän keskiarvo oli 70,0 vuotta ja naisten 76,9 vuotta. CHA 2 DS 2 -VASc-arvo oli ≥ 2 miehistä 74,8 %:lla (keskiarvo 2,83) ja naisista 87,1 %:lla (keskiarvo 3,98). Lähes puolet (49,4 %) potilaista oli diagnoosihetkellä 75-vuotiaita tai vanhempia eli suuren riskin potilaita jo pelkän iän perusteella.
Verenpainetaudin esiintyvyys oli lääkeostorekisterin perusteella 73 %, hoitoilmoitusrekistereissä 13–39 % ja lääkekorvattavuusrekisterin perusteella 7 %. Taudin kokonaisesiintyvyys oli 78 %. Hyperkolesterolemian esiintyvyys oli vastaavasti 51 %, 1–13 % ja 7 % kokonaisesiintyvyyden ollessa 53 %.
Sydämen vajaatoiminta-, valtimosairaus- sekä iskeeminen aivohalvaus- ja TIA-diagnooseja tunnistettiin selvästi eniten erikoissairaanhoidon hoitoilmoitusrekisterin tiedoista (Hilmosta). Hilmon käyntitietojen perusteella 16 % eteisvärinäpotilaista sairasti sydämen vajaatoimintaa ja 25 % valtimosairautta. Näiden kahden sairauden kokonaisesiintyvyydet olivat 18 % ja 28 %. Iskeemisten aivohalvausten ja TIA-kohtausten kokonaisesiintyvyys oli 17 %. Lähes kaikki diagnoosit (96 %) löytyivät Hilmon tiedoista.
Diabeteksen kokonaisesiintyvyys eteisvärinäpotilailla oli 24 %. Lääkeostojen perusteella esiintyvyys oli 21 %. Muista rekistereistä (hoitoilmoitusrekisterit ja lääkekorvattavuusrekisteri) diabetesdiagnoosi tunnistettiin 12–14 %:lta potilaista.
Liitännäissairaudet tuottivat potilaalle keskimäärin 1,82 CHA 2 DS 2 -VASc-riskipistettä. Yksittäisten rekisterien vertailussa eniten riskipisteitä kertyi Hilmon tiedoilla, ja vastaavasti pienin merkitys oli Kelan lääkekorvattavuusrekisterillä. Lääkeostorekisterin perusteella tunnistettiin suurin määrä potilaita, joille antikoagulaatiohoidon aloittaminen on aiheellista Käypä hoito -suosituksen mukaan (CHA 2 DS 2 -VASc ≥ 2). Rekisterikohtaiset CHA 2 DS 2 -VASc-riskipisteet on esitetty taulukossa 3.
Potilasryhmässä, josta oli käytettävissä laboratoriotuloksia (n = 133 867), hyperkolesterolemia todettiin 34 %:lla ja diabetekseen viittaavia laboratorioarvoja 13 %:lla. Kun laboratoriotiedot yhdistettiin koko tutkimuskohortin rekisteriaineistoon, hyperkolesterolemian esiintyvyys kasvoi 53 %:sta 64 %:iin ja diabeteksen 24 %:sta 25 %:iin.
Päätelmät
Valtakunnalliset väestön terveyttä ja hyvinvointia koskevat rekisterit tuottavat tietoa terveydenhuollosta, sairauksista ja niiden hoidosta. Rekistereitä käytetään muun muassa kansainväliseen ja kotimaiseen tilastointiin, tutkimustarkoituksiin, sosiaali- ja terveydenhuollon toiminnan seurantaan ja arvioimiseen sekä palveluiden suunnitteluun (2,11).
Suomessa hoitoilmoitusrekisteri Hilmo on ollut käytössä vuodesta 1994, jolloin se korvasi aiemmin käytössä olleen Poistoilmoitusrekisterin. Hilmon laatu on tutkimuksissa vaihdellut tyydyttävästä hyvään. Päädiagnoosien kirjaamisen laatu on ollut hyvä, mutta sivudiagnoosien kattavuus on ollut huonompi. Yleisten diagnoosien kohdalla on todettu, että oikeiden positiivisten diagnoosien osuus Hilmossa on 75–99 %, mutta harvinaisempien diagnoosien kohdalla väärien positiivisten osuus kasvaa. Tutkimuksessamme oletetaan kirjatun diagnoosin olevan oikea, ja tuloksia tarkastellessa täytyy muistaa mahdollisten väärien positiivisten diagnoosien vaikutus (3,12,13).
Perusterveydenhuollon avohoidon hoitoilmoitusrekisterin (AvoHilmo) laatu on todettu riittämättömäksi (14). Vuonna 2019 perusterveydenhuollon avosairaanhoidon lääkärin vastaanottokäynneistä vain noin 65 %:ssa oli kirjattu ICD-10-luokituksen mukainen diagnoosi, ja ICPC-2-luokituksen mukainen käyntisyy oli noin 8 %:ssa käynneistä. Lisäksi noin 14 %:ssa terveyskeskuksista diagnoosi kirjattiin alle kolmasosassa lääkärissäkäynneistä (15). Laajamittaista suomalaisten rekisterien vertailuja ja etenkään AvoHilmon ja ICPC-2-merkintöjen validaatiota ei ole tehty. Siten näiden rekistereiden sisältämän diagnoosi-informaation todellinen osuvuus ei ole tiedossa.
Tutkimuksemme mukaan yksittäisen hoitoilmoitusrekisterin perusteella ei pystytä kattavasti tunnistamaan eteisvärinään liittyvän tukosriskin riskitekijöinä pidettyjä sairauksia. Selvästi suurin osa verenpainetaudin ja hyperkolesterolemian diagnooseista tunnistettiin lääkeostojen perusteella, ja molempien sairauksien esiintyvyydet olivat merkittävästi pienemmät hoitoilmoitusrekistereissä kuin lääkeostorekisteriaineistossa. Myös laboratoriotietojen perusteella saatu hyperkolesterolemian suurempi esiintyvyys kertoo diagnoosin puutteellisesta kirjaamisesta ja siirtymisestä hoitoilmoitusrekistereihin.
Emme pyytäneet Kelalta tietoja hyperkolesterolemian lääkekorvausoikeuksista koodeilla 213 (poistui käytöstä vuonna 2011) ja 211 (familiaalinen hyperkolesterolemia). Olemme siten menettäneet informaation osasta näillä lääkekorvausoikeuksilla olevia potilaita. Vuonna 2018 voimassa olevista hyperkolesterolemiaan liittyvistä lääkekorvausoikeuksista noin 29 % oli muun kuin tässä tutkimuksessa käytetyn koodin (206) perusteella (16).
Verenpainetaudin lääkeostojen perusteella tehdyissä päätelmissä on voinut tapahtua virheitä, sillä diagnoosin asettamiseen käytetyillä lääkeaineilla voi olla monta eri käyttöaihetta. Lääkeaineita rajattiin (taulukko 2), jotta saataisiin mahdollisimman todenmukainen arvio verenpainetaudin esiintyvyydestä. Verenpainetaudin esiintyvyys eteisvärinäpotilailla on tutkimusten mukaan 60–80 %, eli todettu esiintyvyys sopii hyvin yhteen aiempien tutkimusten kanssa (17,18). Tuloksemme toisaalta vahvistaa sen, että tyytyminen pelkkään erikoissairaanhoidon rekisteritietoon aliarvioi verenpainetaudin yleisyyttä eteisvärinäpotilailla (19,20). Tämä on myös havaittu Sote-rahoituksen tarvevakiointi -selvityksessä (21).
Hoitoilmoitusrekisterien aineistoista saatujen sydämen vajaatoiminnan, diabeteksen sekä iskeemisen aivohalvauksen ja TIA:n esiintyvyydet eteisvärinäpotilailla vastasivat hyvin Ruotsissa sekä Englannissa tehtyjen tutkimusten esiintyvyyslukuja. Valtimosairauden esiintyvyys oli meidän tutkimuksessamme hieman suurempi, mutta ero voisi selittyä valtimosairauden määrittelytavalla (18,22).
Suomalaisten eteisvärinäpotilaiden aivohalvausriski on CHA 2 DS 2 -VASc-pisteytyksen mukaan korkea. Jotta potilaan riskitekijät saataisiin selville mahdollisimman luotettavasti, on asianmukainen diagnoosien kirjaaminen potilastietojärjestelmiin tärkeää. Diagnoosien kirjaaminen erikseen – sairauskertomusteksteissä mainitsemisen lisäksi – helpottaa niiden löydettävyyttä sekä lisää potilasturvallisuutta. Jos riskitekijöitä löytyy ainoastaan sairauskertomusten teksteissä, on niiden havaitseminen vaikeampaa.
On huomattava, ettei yhtäkään tutkimuksen kohteena olleista terveydenhuollon rekistereistä ole varsinaisesti tarkoitettu potilaan diagnoosien tunnistamiseen, vaan niillä on omat hallinnolliset ja lakisääteiset tehtävänsä. Esimerkiksi erityiskorvausoikeustiedoissa päätöksenteon kriteerit eivät vastaa lääketieteellisiä diagnostisia kriteereitä. Etenevissä tutkimuksissa on mahdollisuus vahvistaa suoraan potilaalta hänen diagnoosinsa, mutta rekisteritutkimus joutuu nojaamaan kirjattuihin ja siten rekisteröityihin tietoihin.
Hoitoilmoitusrekisterit voivat tuottaa liian pienen arvion sellaisten pitkäaikaissairauksien esiintyvyydestä, joiden hoito ei edellytä säännöllistä lääkärin kontaktia (23). Tuoreessa suomalaistutkimuksessa todettiin, että hoitoilmoitusrekisteritietojen pohjalta voidaan tehdä melko tarkkoja arvioita säännöllistä lääkitystä vaativien sairauksien, kuten sepelvaltimotaudin ja astman, yleisyydestä. Kyseisessä tutkimuksessa myös huomioitiin, että hoitoilmoitusrekisteritiedot ovat epäluotettavia pitkäaikaissairauksien riskitekijöiden esiintyvyyksien arvioimisessa (esimerkiksi verenpainetauti, hyperkolesterolemia, lihavuus ja tupakointi) (3). Pitkäaikaissairauksien ja potilaan riskitekijöiden huolellisempaa kirjaamista sekä kirjaamisen helppoutta tulisi jatkossa edistää. Potilastietojen siirtyminen rekistereihin paranisi myös rakenteisissa potilastietojärjestelmissä, joissa järjestelmä ei esimerkiksi päästäisi eteenpäin ilman kirjattua diagnoosia.
Tutkimuksemme perusteella kattava rekisteripohjainen analyysi eteisvärinäpotilaiden liitännäissairauksista edellyttää tietojen yhdistämistä useista rekisterilähteistä.
Kirjoittajien ilmoittama käsikirjoitukseen liittyvä rahoitus:
Helsingin ja Uudenmaan sairaanhoitopiiri (dx.doi.org/10.13039/100008376)
Jari Haukka: Konsultointi (Hus).
Pirjo Mustonen: Konsultointi (Roche), luentopalkkiot (Novartis, FCG, Suomen Sisätautilääkäriyhdistys, Boehringer–Ingelheim, BMS, Bayer, Roche, Suomen Kardiologinen Seura).
Jukka Putaala: Konsultointi (Boehringer–Ingelheim, Bayer, BMS-Pfizer, Abbott), apurahat (BMS–Pfizer), luentopalkkiot (Boehringer–Ingelheim, Bayer, BMS–Pfizer, Abbott), muu (Bayer, tutkimuksen vastuullinen henkilö).
Saga Itäinen-Strömberg: Apurahat (Otto A. Malmin lahjoitusrahasto), matka-, majoitus- tai kokouskulut (Boehringer–Ingelheim).
Alex Luojus: Apurahat (Aarne Koskelon säätiö, Sydäntutkimussäätiö,Yrjö Jahnssonin säätiö, Hus, Valtion tutkimusrahoitus).
Tero Penttilä: Apurahat (Boehringer–Ingelheim, Bristol–Myers Sqibb & Pfizer), luentopalkkiot (Bristol–Myers Sqibb & Pfizer).
Juha Hartikainen: Johtokunnan/hallituksen jäsenyys (Islab), konsultointi (Amgen, Bayer, BMS–Pfizer, Boehringer–Ingelheim, Novo Nordisk, Cardiome), luentopalkkot (BMS–Pfizer, Amgen, Cardiome), osakkeet/optiot (Novo Nordisk, Pfizer).
Paula Tiili: Apurahat (Otto A. Malmin lahjoitusrahaston apuraha).
Juhani Airaksinen: Konsultointi (Bayer, BMS–Pfizer-allianssi, Boehringer–Ingelheim), luentopalkkiot (Bayer, BMS–Pfizer-allianssi, Boehringer–Ingelheim).
Mika Lehto: Apurahat (Aarne Koskelon säätiö, Sydäntutkimussäätiö, Yrjö Jahnssonin säätiö, Hus, Valtion tutkimusrahoitus), konsultointi (Bayer, BMS–Pfizer-allianssi, Boehringer–Ingelheim ja MSD), luentopalkkiot (Bayer, BMS–Pfizer-allianssi, Boehringer–Ingelheim ja MSD), osakkeet/optiot (Orion), matka-, majoitus- tai kokouskulut (Bayer, BMS–Pfizer-allianssi, Boehringer–Ingelheim ja MSD).
Elis Kouki, Olli Halminen, Miika Linna, Janne Kinnunen, Aapo Aro, Jussi Niiranen: Ei sidonnaisuuksia.
Tämä tiedettiin
Rekisterien käytössä esiintyy tiedon kattavuuteen liittyviä haasteita.
Eteisvärinäpotilailla on runsaasti liitännäissairauksia.
Tutkimus opetti
Sairauksien kirjaaminen vaihtelee eri rekisterien välillä. Totuudenmukaiset tulokset eri sairauksien esiintyvyyksistä vaativat useiden rekisterien tietojen yhdistämistä.
Tyytyminen pelkkään erikoissairaanhoidon rekisteritietoon aliarvioi verenpainetaudin yleisyyttä eteisvärinäpotilailla.
Suomalaisten eteisvärinäpotilaiden CHA2DS2-VASc-riskipisteet ovat korkeat.
- 1
- Gissler M, Haukka J. Finnish health and social welfare registers in epidemiological research. Norsk Epidemiologi 2004;14:113–20.
- 2
- Komulainen J. Suomalainen tautien kirjaamisen ohjekirja. THL Opas 17/2012.
- 3
- Laatikainen T, Koponen P, Reinikainen J ym. Kansanterveyden seuranta, arviointi ja ennakointi: Mitä tietoa Suomessa saadaan hoitoilmoitusrekistereistä ja mitä väestötutkimuksista? Suom Lääkäril 2020;37:1853–8.
- 4
- Zoni-Berisso M, Lercari F, Carazza T ym. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213–20.
- 5
- Staerk L, Wang B, Preis S ym. Lifetime risk of atrial fibrillation according to optimal, borderline, or elevated levels of risk factors: cohort study based on longitudinal data from the Framingham Heart Study. BMJ 2018;360:k1453.
- 6
- Björck S, Palaszewski B, Friberg L ym. Atrial fibrillation, stroke risk, and warfarin therapy revisited: A population-based study. Stroke 2013;44:3103–8.
- 7
- Hindricks G, Potpara T, Dagres N ym. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;42:373–498.
- 8
- Olesen JB, Lip GYH, Hansen ML ym. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011;342:d124.
- 9
- Lehto M, Halminen O, Mustonen P ym. The nationwide Finnish AntiCoagulation in Atrial Fibrillation (FinACAF): study rationale, design, and patient characteristics. Eur J Epidemiol 2022;37:95–102.
- 10
- Killu AM, Granger CB, Gersh BJ. Risk stratification for stroke in atrial fibrillation: a critique. Eur Heart J 2019;40:1294–302.
- 11
- Häkkinen P, Mölläri K, Saukkonen S-M ym. Hilmo Sosiaali- ja terveydenhuollon hoitoilmoitus 2020. THL Ohjaus 7/2019.
- 12
- Sund R. Quality of the Finnish Hospital Discharge Register: A systematic review. Scand J Public Health 2012;40:505–15.
- 13
- Järvelin J, Ryynänen H, Mahkonen R ym. Kohti luotettavaa syövän hoitoon pääsyn seurantaa: Hilmon ja syöpärekisterin diagnoositietojen vertailu. Suom Lääkäril 2019;74:2581–8.
- 14
- Ketola E, Pitkänen V, Huvinen S ym. Koko Suomen perusterveydenhuollon asiakaskirjo on nyt kuvattu. Suom Lääkäril 2019;74:2027–34.
- 15
- Mölläri K. Perusterveydenhuollon avosairaanhoidon vastaanoton asiakkaiden käyntisyyt vuonna 2019. THL Tilastoraportti 44/2020.
- 16
- Lääkealan turvallisuus- ja kehittämiskeskus Fimea ja Kansaneläkelaitos. Suomen lääketilasto 2018. Helsinki 2019. urn.fi/URN:NBN:fi-fe2019123149481
- 17
- Gumprecht J, Domek M, Lip GYH ym. Invited review: Hypertension and atrial fibrillation: epidemiology, pathophysiology, and implications for management. J Hum Hypertens 2019;33:824–36.
- 18
- Allan V, Banerjee A, Shah A ym. Net clinical benefit of warfarin in individuals with atrial fibrillation across stroke risk and across primary and secondary care. Heart 2017;103:210–8.
- 19
- Lehto M, Niiranen J, Korhonen P ym. Quality of warfarin therapy and risk of stroke, bleeding, and mortality among patients with atrial fibrillation: results from the nationwide FinWAF Registry. Pharmacoepidemiol Drug Saf 2017;26:657–65.
- 20
- Kjerpeseth L, Igland J, Selmer R ym. Prevalence and incidence rates of atrial fibrillation in Norway 2004–2014. Heart. 2021;107:201–7.
- 21
- Häkkinen U, Holster T, Haula T ym. Sote-rahoituksen tarvevakiointi. THL Raportti 6/2020. urn.fi/URN:ISBN:978-952-343-483-7
- 22
- Johansson C, Dahlqvist E, Andersson J ym. Incidence, type of atrial fibrillation and risk factors for stroke: a population-based cohort study. Clin Epidemiol 2017;9:53–62.
- 23
- Boshuizen H, Poos M, van den Akker M ym. Estimating incidence and prevalence rates of chronic diseases using disease modeling. Popul Health Metr 2017;15:13.
Estimating the prevalence of comorbidities affecting the risk of stroke in patients with atrial fibrillation – A registry-based study
Background Atrial fibrillation (AF) is a major cause of ischaemic stroke. The risk of stroke is strongly associated with the patient’s age, sex and comorbidities. It is crucial that the comorbidities are consistently recorded in medical records as well as in health care registries.
Methods The Finnish AntiCoagulation in Atrial Fibrillation (FinACAF) study collected data on all Finnish AF patients from 2004 to 2018. This substudy used the data of patients with a new AF diagnosis between 2012–2018 (n = 168 356). The prevalences of comorbidities related to AF stroke were evaluated in various Finnish national health care registries.
Results The average baseline CHA 2 DS 2 -VASc risk score based on information from all registries was 2.83 for men and 3.98 for women. The highest prevalences of hypertension, hypercholesterolaemia, and diabetes were found based on data from the National Prescription Register. Vascular disease, heart failure, and stroke or TIA were identified almost exclusively based on secondary and tertiary hospital records.
Conclusions A comprehensive registry analysis of AF patients requires the inclusion of both hospital and medication data.
Elis Kouki
B.M.
Helsinki University Hospital, Heart and Lung Center, and University of Helsinki
Olli Halminen, Jari Haukka, Pirjo Mustonen, Jukka Putaala, Miika Linna, Saga Itäinen-Strömberg, Janne Kinnunen, Aapo Aro, Alex Luojus, Jussi Niiranen, Tero Penttilä, Juha Hartikainen, Paula Tiili, K.E. Juhani Airaksinen, Mika Lehto