Remdesiviiri sairaalahoitoisessa COVID-19-taudissa
– Pragmaattinen, adaptiivinen, satunnaistettu Solidarity Finland -monikeskustutkimus
Lähtökohdat Remdesiviiriä tutkittiin Solidarity Finland -tutkimuksessa.
Menetelmät COVID-19-taudin takia sairaalahoitoon joutuneet potilaat satunnaistettiin saamaan standardihoitoa tai sen lisäksi remdesiviiriä. Solidarity-tutkimuksessa ja satunnaistettujen tutkimusten meta-analyysissä ensisijainen päätetapahtuma oli sairaalahoitoajan kuolleisuus.
Tulokset Rekrytoimme 208 potilasta yhdestätoista sairaalasta. Sairaalahoidon aikana remdesiviiriryhmässä (n = 114) kuoli 1 % ja standardihoitoryhmässä (n = 94) 4 %. Invasiiviseen hengityslaitehoitoon joutui 5 % molemmissa ryhmissä. Tehohoitoa sai 11 % remdesiviiri- ja 12 % standardihoitoryhmässä. Maksaentsyymit nousivat merkittävästi 5 %:lla remdesiviiri- ja 2 %:lla standardihoitoryhmässä. Meta-analyysin alaryhmäanalyysissä remdesiviiri vähensi kuoleman riskiä potilailla, jotka eivät sairaalahoidon alkaessa saaneet hengityslaitehoitoa (RR 0,85, 95 % LV 0,75–0,96).
Päätelmät Suomessa on pandemian aikana mahdollista rekrytoida merkittävä määrä potilaita suuriin, satunnaistettuihin tutkimuksiin, joilla voidaan saada luotettavia tuloksia nopeasti. Remdesiviiristä voi olla apua sairaalahoitoisessa COVID-19-taudissa varhain aloitettuna.

COVID-19-tautia aiheuttava SARS-CoV-2-virus levisi nopeasti ympäri maailman. Maailman terveysjärjestö (WHO) julisti pandemian maaliskuussa 2020 (1,2).
Pandemian alussa COVID-19-tautiin ei tunnettu tehokkaita lääkkeitä (3). Maaliskuussa 2020 WHO käynnisti suuren, pragmaattisen, adaptiivisen monikansallisen satunnaistetun Solidarity-tutkimuksen selvittämään eri lääkehoitojen tehoa sairaalahoitoiseen COVID-19-tautiin (4).
Ensi vaiheessa tutkimus sisälsi viisi tutkimushaaraa, joiden tavoitteena oli tutkia lupaavaksi arvioitujen neljän lääkkeen (remdesiviiri, hydroksiklorokiini, lopinaviiri-ritonaviiri ja lopinaviiri-ritonaviiri interferonibeeta-1a:n kanssa) vaikutusta COVID-19-taudin vuoksi sairaalaan joutuneiden potilaiden kuolleisuuteen standardihoitoon verrattuna. Tutkimus on adaptiivinen, eli tutkimuksen edetessä aiempia tutkimushaaroja voidaan keskeyttää ja uusia tutkimushaaroja aloittaa.
Remdesiviiri on viruksen RNA-polymeraasin estäjä, jota alun perin kehitettiin C-hepatiitin hoidoksi ja sittemmin tutkittiin ebola- ja Marburg-virusinfektioissa. Tutkimusta käynnistäessä sen tiedettiin estävän SARS-CoV-2-viruksen monistumista koeputkessa (5,6) sekä vähentävän hengitystieoireita ja keuhkovaurioita reesusapinoilla 12 tuntia SARS-CoV-2-altistuksen jälkeen annosteltuna (7). Ihmisillä remdesiviiri lyhensi vakavan COVID-19-taudin sairaalahoidon kestoa lumekontrolloidussa amerikkalaistutkimuksessa (8), mutta remdesiviirin vaikutuksesta kuolleisuuteen ei ollut luotettavaa näyttöä.
Tässä artikkelissa raportoimme monikansallisen tutkimuksen osana olleiden suomalaisten potilaiden (Solidarity Finland) remdesiviirihaaran tulokset sekä kaikkien satunnaistettujen remdesiviiritutkimusten meta-analyysin (9). Kansainvälisen Solidarity-tutkimuksen tuloksia on julkaistu aiemmin (4,9).
Aineisto ja menetelmät
Tutkimusasetelma
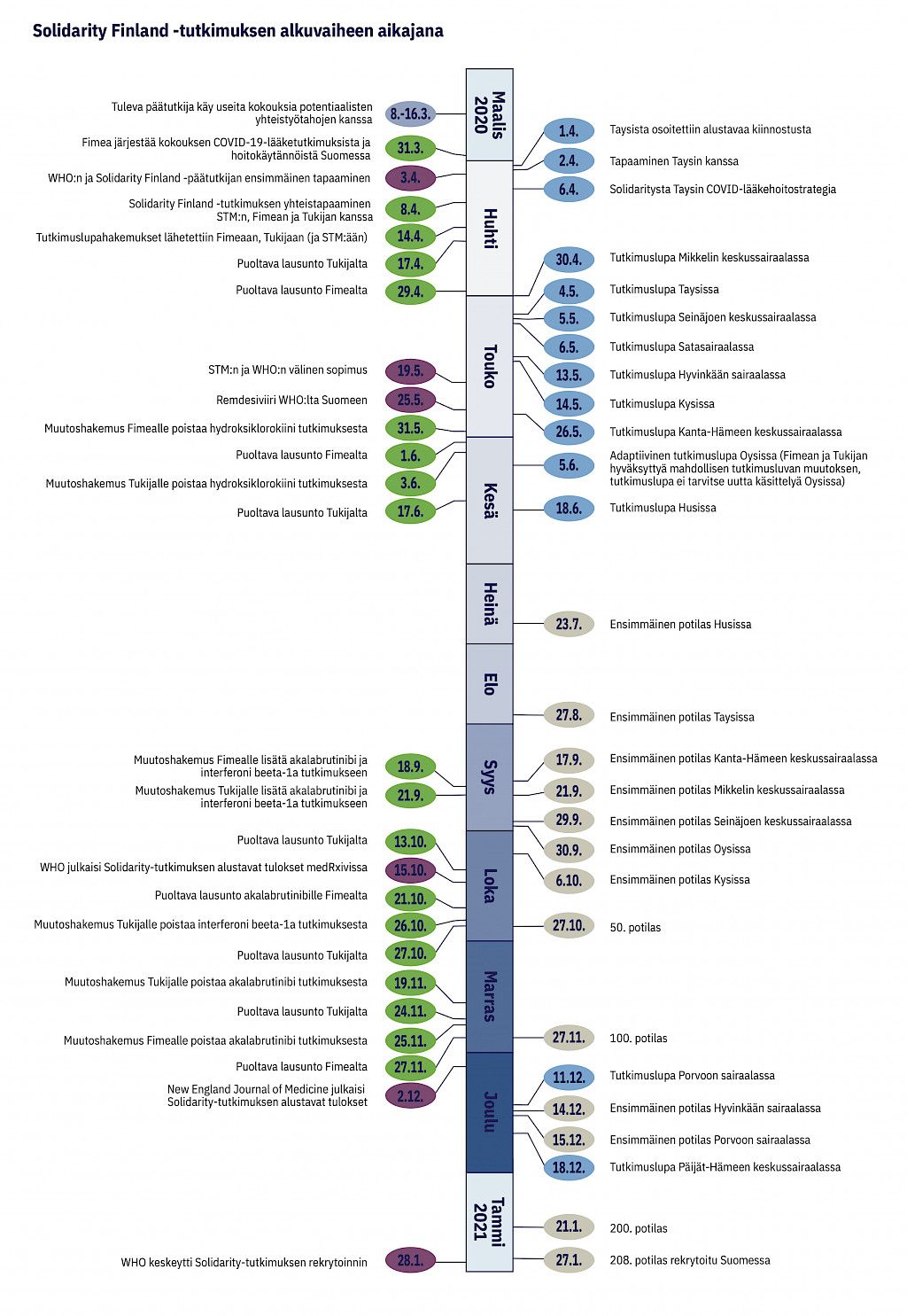
Solidarity Finland on pragmaattinen, adaptiivinen, satunnaistettu ja avoin lääketutkimusalusta, joka on luotu ja kehitetty COVID-19-pandemian aikana (kuvio 1).
Pragmaattisella tutkimusasetelman ja yksinkertaisten sisäänottokriteereiden avulla potilaiden rekrytointi, kokeellinen hoito ja seuranta kyettiin yksinkertaistamaan pandemian aiheuttamaan sairaaloiden ylikuormitukseen soveltuvaksi. Potilaista kerättiin vain kliiniseen päätöksentekoon tarvittavaa ja potilaille merkityksellistä tietoa, jota kertyi normaalin rutiinihoidon ohessa (10,11).
Keväällä 2020 Solidarityn tutkimushaarat olivat hydroksiklorokiini, lopinaviiri–ritonaviiri, lopinaviiri–ritonaviiri inteferonibeeta-1a:n kanssa ja remdesiviiri. Suomi osallistui tutkimuksen alkaessa toukokuussa 2020 remdesiviiri- ja hydroksiklorokiinihaaroihin. Hydroksiklorokiinihaara ehdittiin kuitenkin sulkea ennen kuin Suomessa oli rekrytoitu yhtäkään potilasta (kuvio 1).
Satunnaistaminen ja tutkimushoito
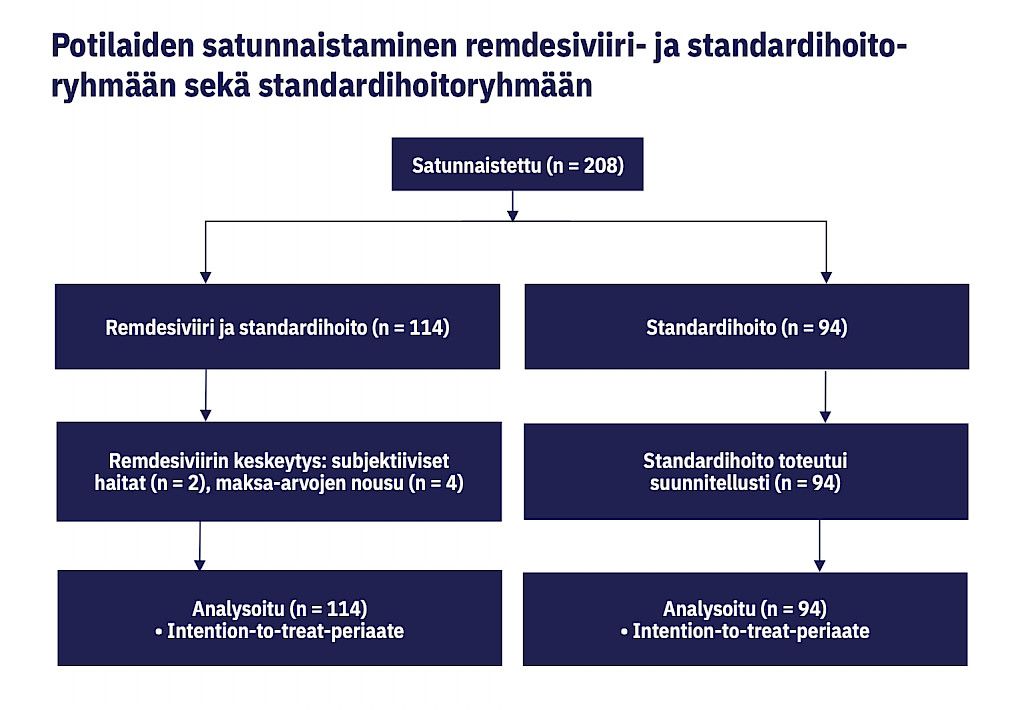
Satunnaistimme potilaat 1:1-suhteessa standardihoito- ja remdesiviiriryhmien välillä internetpohjaisella Castor EDC -tiedonkeruu- ja hallintaohjelmalla (www.castoredc.com; Amsterdam, Alankomaat). Kumpaakin ryhmää hoidettiin vakiintuneen käytännön mukaan, ja remdesiviiriryhmä sai vakiintuneen hoidon lisäksi remdesiviiriä. Lumeinfuusioita ei käytetty, joten sekä potilas että hoitohenkilökunta tiesivät, kumpaan tutkimusryhmään potilas kuului. Mikäli vakiintunut hoito muuttui tutkimuksen aikana, muutos toteutui samanlaisena kummassakin ryhmässä.
Koska tutkimuksen toteuttamisen aikana deksametasonista tuli luotettavaa näyttöä sen kuolleisuutta vähentävästä vaikutuksesta (12), se otettiin käyttöön sairaaloissa satunnaistamisesta riippumatta paikallisten hoito-ohjeiden mukaisesti. Remdesiviiriannos oli ensimmäisenä päivänä 200 mg ja seuraavina päivinä 100 mg suoneen annettuna, joko kotiutumiseen asti tai enintään 10 päivän ajan.
Tutkimuspotilaat
Tutkimuksen sisäänottokriteerit olivat i) vähintään 18 vuoden ikä, ii) PCR-varmistettu COVID-19-tauti, iii) sairaalahoidon tarve (riippumatta oireiden kestosta) ja iv) tietoinen suostumus tutkimukseen osallistumisesta ja v) ei suunniteltua sairaalasiirtoa tutkimukseen osallistumattomaan sairaalaan seuraavan 72 tunnin aikana.
Tutkimuksen poissulkukriteerit olivat i) alle 3 kk:n elinajanodotteeseen johtava vakava pitkäaikaissairaus, ii) yli viisinkertaisesti viitevälin ylärajaa suurempi aminotransferaasipitoisuus (ALAT tai ASAT), iii) muu vakava akuutti sairaus viimeisen 7 päivän aikana (esimerkiksi sydäninfarkti), iv) yliherkkyys käytetyille lääkkeille, v) raskaus tai imetys, vi) mikä tahansa lääkärin arvioima este tutkimukseen osallistumiselle, vii) osallistuminen toiseen lääketutkimukseen (tai tutkimuslääkkeen käyttö jo sairaalaan saapuessa) sekä viii) vaikea-asteinen (eGFR < 30 ml/min/1,73 m²) munuaisten vajaatoiminta.
Päätetapahtumat
Ensisijainen päätetapahtuma oli kuolema sairaalahoidon aikana. Muita päätetapahtumia olivat sairaalahoidon kesto sekä invasiivisen ventilaation (hengityslaitehoidon) tai tehohoidon tarve. Haittatapahtumista raportoimme lisäksi molemmista ryhmistä Common Terminology Criteria for Adverse Events (CTCAE) -luokituksen vähintään 3. asteen haittatapahtumat (13) sekä vakavat haittatapahtumat (14). Remdesiviiriryhmästä raportoimme myös 1.–2. asteen haittatapahtumat, jos ne johtivat remdesiviirilääkityksen keskeytykseen.
Analyysit
Päätetapahtumien pienen määrän vuoksi raportoimme päätetapahtumien lukumäärät, prosenttiosuudet ja niiden luottamusvälit. Tulokset raportoidaan hoitoaikeen mukaan (”intention to treat”).
Tutkimuslupa ja eettinen arviointi
Ennen potilaiden rekrytoinnin aloittamista kansallinen lääkeviranomainen Fimea sekä Valtakunnallinen lääketieteellinen tutkimuseettinen toimikunta Tukija antoivat tutkimussuunnitelmalle puoltavan lausunnon. Lisäksi haimme alueelliset tutkimusluvat kustakin osallistuvasta sairaanhoitopiiristä tai -alueesta erikseen. Koska tutkimus on adaptiivinen, lupaprosessit on tehty useita kertoja tutkimuksen edetessä (kuvio 1). Tutkimus oli WHO:n ja sen jäsenvaltion yhteistyöhanke, joten siitä tehtiin myös WHO:n sekä sosiaali- ja terveysministeriön (STM) välinen sopimus.
Tulokset
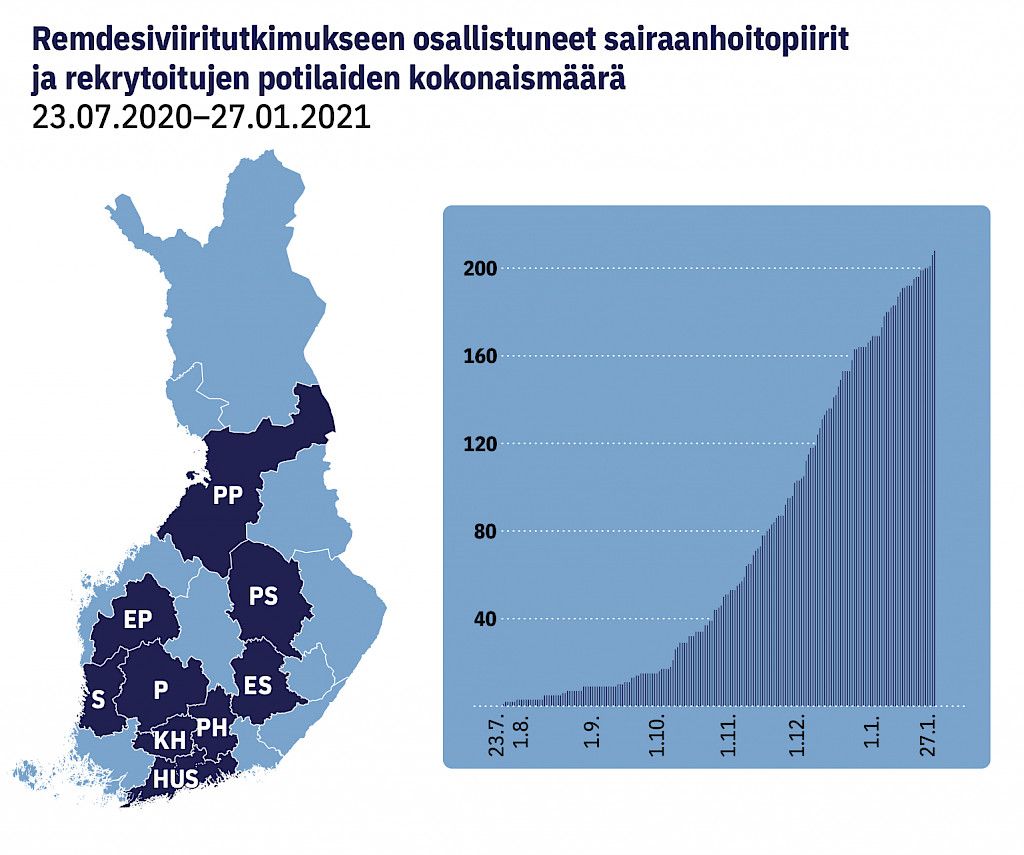
Tutkimus oli valmis aloittamaan rekrytoinnin toukokuussa 2020, mutta silloin epidemian ensimmäinen aalto Suomessa oli jo pääsosin hiipunut. Rekrytointi remdesiviirihaaraan tapahtui Suomen toisen epidemia-aallon aikana 23.7.2020–27.1.2021 (kuviot 1 ja 2). Rekrytoimme yhdestätoista tutkimussairaalasta yhdeksässä sairaanhoitopiirissä yhteensä 208 potilasta (kuvio 3), mikä vastasi 23 %:a tutkimussairaaloissa kyseisenä aikana hoidetuista potilaista (liitetaulukko 1). Rekrytointi päättyi WHO:n sulkiessa remdesiviirihaaran maailmanlaajuisesti.
Potilaat
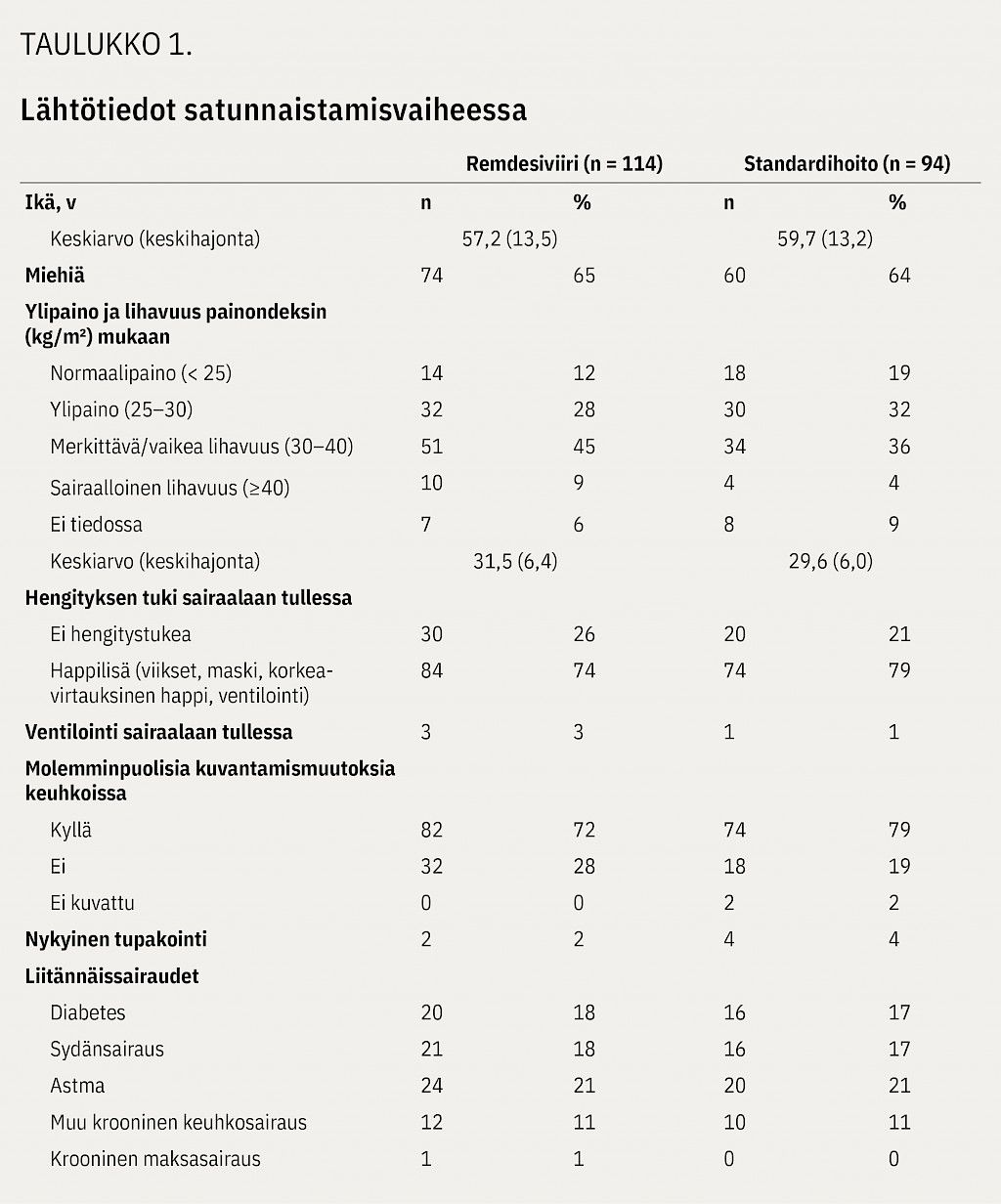
Satunnaistettujen potilaiden (taulukko 1) mediaani-ikä oli 58,5 vuotta (kvartaaliväli 50–68 v; vaihteluväli 25–88 v), miehiä oli 64 % ja painoindeksin keskiarvo 30,6 kg/m 2 (keskihajonta 6,2). Lähtötilanteessa lisähappea (viikset, maski tai korkeavirtauksinen happi nenäkanyylin kautta) sai 76 %. Poikkeava keuhkokuvalöydös todettiin lähtötilanteessa 75 %:lla potilaista.
Toteutunut remdesiviirihoito
Remdesiviiriryhmään satunnaistetuista 114 potilaasta 112 (98 %) sai vähintään yhden remdesiviiri-infuusion, kaksi (2 %) kieltäytyi satunnaistamisen jälkeen. Remdesiviiri aloitettiin 65 potilaalle (58 %) sairaalaantulo- tai sitä seuraavana päivänä, 36 potilaalle (32 %) toisena ja 10 potilaalle (9 %) kolmantena sairaalaan tuloa seuraavana päivänä sekä kahdelle (2 %) myöhemmin. Remdesiviirihoidon keston mediaani oli 5 päivää (kvartaaliväli IQR 4–8).
Muu hoito
Glukokortikoideja sai remdesiviiriryhmässä 79 potilasta (69 %, 95 % luottamusväli LV 60–78 %) ja standardihoitoryhmässä 72 potilasta (77 %, 95 % LV 67–85 %). Happihoitoa sai sairaalajakson aikana 98 potilasta (86 %, 95 % LV 78–92 %) remdesiviiriryhmässä ja 82 potilasta (87 %, 95 % LV 79–93 %) standardihoitoryhmässä.
Sairaalakuolleisuus
Sairaalahoidon aikana remdesiviiriryhmässä kuoli yksi (1 %) potilas ja standardihoitoryhmässä neljä (4 %) (taulukko 2). Kuolinsyy oli kaikissa tapauksissa COVID-19-infektion aiheuttama hengitysvajaus.
Muut päätetapahtumat
Invasiiviseen hengityslaitehoitoon joutui remdesiviiriryhmästä kuusi (5 %) ja standardihoitoryhmästä viisi potilasta (5 %) (taulukko 2). Ei-invasiiviseen ventilaatioon (mutta ei hengityslaitehoitoon) joutui remdesiviiriryhmästä seitsemän (7 %, 95 % LV 3–12 %) ja standardihoitoryhmästä yhdeksän (10 %, 95 % LV 5–17 %) potilasta. Tehohoitoa sai remdesiviiriryhmässä 12 (11 %) ja standardihoitoryhmässä 11 (12 %) potilasta.
Sairaalahoidon mediaanikesto oli remdesiviiriryhmässä 8 ja standardihoitoryhmässä 8,5 päivää (taulukko 2). Post hoc -analyysissä sairaalahoidon kesto oli pitkittynyt eli yli 14 päivää remdesiviiriryhmässä 15 (13 %) ja standardihoitoryhmässä 26 potilaalla (28 %) (riskisuhde 0,48, 95 % LV 0,27–0,84).
Haittatapahtumat
Maksaentsyymien lisääntyminen vähintään 5-kertaisesti yli viitealueen ylärajan todettiin remdesiviiriryhmässä kuudella (5 %) potilaalla ja standardihoitoryhmässä kahdella (2 %) (taulukko 2). Maksaentsyymien lisääntymisen yhteydessä remdesiviirihoito keskeytettiin eikä vakavia hepatiitteja tai maksan vajaatoimintatapauksia kehittynyt. Kaksi potilasta (2%) remdesiviiriryhmästä halusi keskeyttää lääkkeen lievien subjektiivisten haittatapahtumien vuoksi (toisella lihaskipuja ja vapinaa; toisella ummetusta ja tiheävirtsaisuutta).
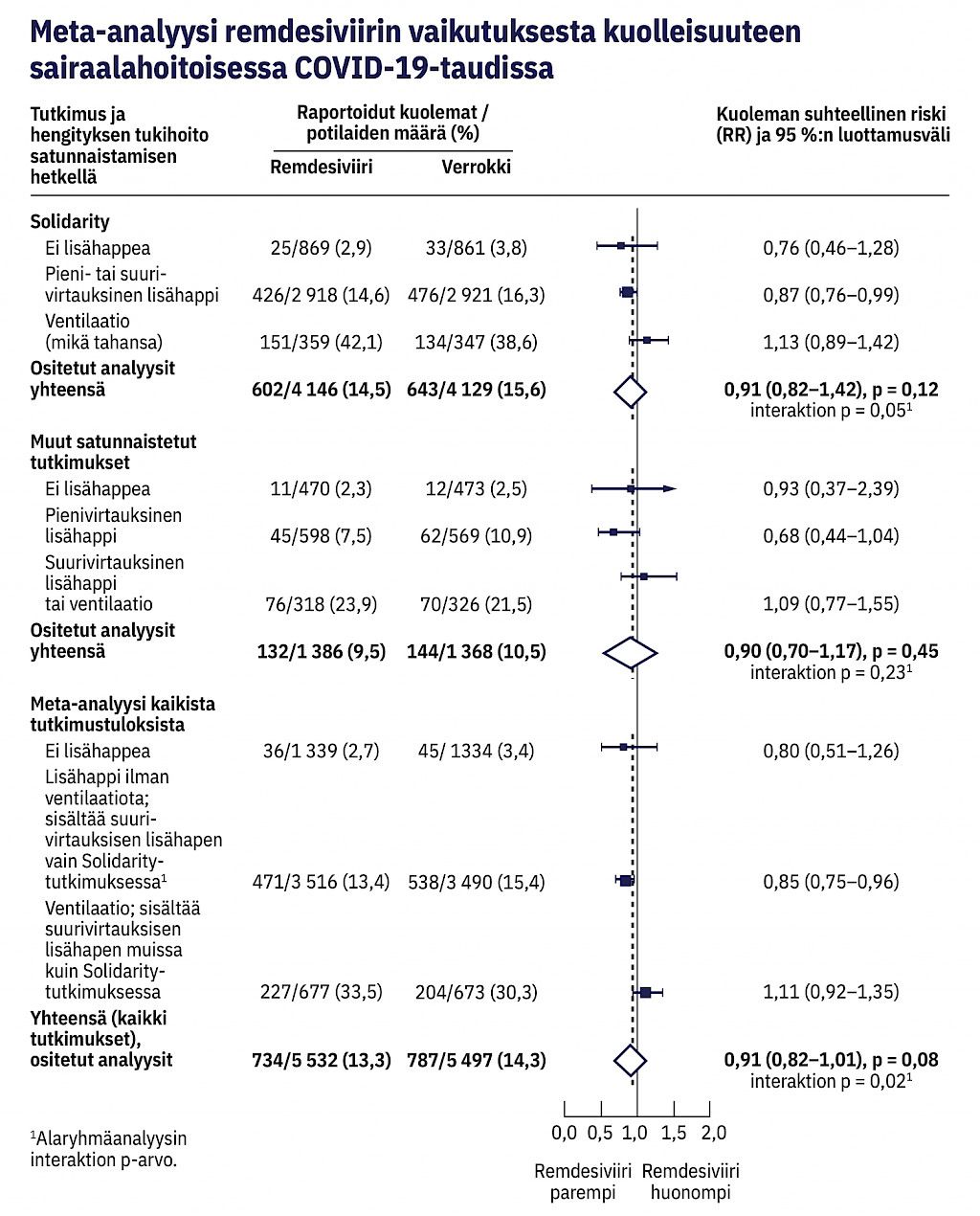
Remdesiviiritutkimusten meta-analyysi
Monikansallisen Solidarity-tutkimuksen yhteydessä julkaistiin remdesiviiriä lumelääkkeeseen tai standardihoitoon verranneiden satunnaistettujen tutkimusten meta-analyysi. Meta-analyysi sisältää yhteensä 11 029 potilasta ja 1 521 kuolemaa. Solidarity-tutkimuksen osuus on 75,0 % potilasmäärästä ja 81,9 % kuolemantapauksista (kuvio 4). Meta-analyysissä remdesiviiri-ryhmän potilaiden kuolleisuus oli 13,3 % ja verrokkiryhmän 14,3 %. Kaikkia potilaita koskevassa meta-analyysissä ryhmien välinen ero ei ollut tilastollisesti merkitsevä (suhteellinen riski 0,91; 95 % LV 0,82–1,01). Satunnaistamisen hetkellä tarvitun hengitystuen mukaan tehdyssä alaryhmäanalyysissä potilaiden, joilla ei ollut ei-invasiivisen tai invasiivisen hengityslaitehoidon tarvetta, kuolleisuus remdesiviiriryhmässä oli 13,4 % ja verrokkiryhmässä 15,4 % (riskisuhde 0,85; 95 % LV 0,75–0,96).
Päätelmät
Monikansallinen WHO Solidarity on potilasmäärältään selvästi suurempi remdesiviirin tehoa COVID-19-taudissa selvittävä satunnaistettu tutkimus kuin kaikki muut tutkimukset maailmassa yhteensä (9). Solidarity Finland on potilasmäärältään monikansallisen tutkimuksen yhdenneksitoista suurin osa ja selvästi suurempi satunnaistettu COVID-19-taudin lääkehoitoa selvittävä tutkimus kuin kaikki muut satunnaistetut COVID-19-lääketutkimukset Suomessa yhteensä.
Remdesiviiri osoittautui tutkimuksessa hyvin siedetyksi. Vaikka WHO Solidarity -tutkimuksessa (9) tai kaikkien tutkimusten meta-analyysissä ei havaittu remdesiviirin vaikuttavan sairaalaan joutuneiden COVID-19-potilaiden kuolleisuuteen, kaikkien remdesiviiritutkimuksista tehdyn meta-analyysin alaryhmäanalyysissä havaittiin remdesiviirin vähentävän kuoleman suhteellista riskiä 15 % ja absoluuttista riskiä 2,0 % sairaalahoitoisilla COVID-19-potilailla, jotka eivät lääkitystä aloitettaessa saaneet ei-invasiivista tai invasiivista hengityslaitehoitoa (9).
COVID-19-taudin alkuvaihetta hallitsee varhainen viremiavaihe ja vakavat oireet kehittyvät taudin edetessä hyperinflammatoriseen vaiheeseen, jolloin immuunijärjestelmän ylireagointi aiheuttaa kudostuhoa (15). Virustaudeissa viruslääkkeiden teho on suurimmillaan mahdollisimman varhain annettuna, jolloin viruksen monistumista voidaan hillitä.
Lumekontrolloidussa yli 550 avohoitopotilaalla tehdyssä satunnaistetussa tutkimuksessa varhain annettu remdesiviiri vähensi sairaalahoitoon johtumisen riskiä 5,3 %:sta 0,7 %:iin (suhteellisen riskin vähenemä 87 %, 95 % LV 41–97 %) (16). Solidarity-tutkimuksen tulokset sopivat tähän viitekehykseen. Remdesiviiristä voi olla hyötyä sairaalaan joutuneilla potilailla, joiden taudinkuva on lähtötilanteessa lievempi. Sairaalaan jouduttaessa viruslääkkeiden aikaikkuna on kuitenkin sulkeutumassa ja hengitysvajauksen edelleen syventyessä sairaus on todennäköisesti edennyt hyperinflammatoriseen vaiheeseen, jolloin remdesiviiristä ei ole enää apua.
Pitkittynyttä sairaalahoitoa (yli 14 päivää) esiintyi enemmän standardihoitoryhmässä. Tämä post hoc -analyysin havainto on linjassa noin tuhannen sairaalapotilaan lumekontrolloidun ACTT-tutkimuksen (8) kanssa, mutta ei globaalin Solidarity-tutkimuksen kanssa (9). Suomen osatutkimuksen potilaat tarvitsivat sairaalaan tullessa harvemmin hengityslaitehoitoa ja olivat täten luultavasti varhaisemmassa vaiheessa tautia, kuin keskimäärin Solidarity-tutkimuksen muissa maissa. Tähän liittyen on mahdollista, että Suomessa remdesiviiri vähensi pitkittyneitä sairaalahoitojaksoja siitäkin huolimatta, että avoimessa tutkimusasetelmassa interventioryhmän potilaita saatetaan jättää sairaalaan saamaan lääkettä suoneen ylimääräisiksi hoitopäiviksi.
Pohdittaessa remdesiviirin asemaa sairaalahoitoisessa COVID-19-sairaudessa, sen mahdollisia hyötyjä tulee punnita suhteessa lääkkeen annostelusta, hinnasta ja toimitusketjusta syntyviin resurssikustannuksiin. Remdesiviirin käyttöä kannattaa harkita COVID-19-potilaiden (sairaalahoidon) varhaisvaiheessa (kuvio 4) (16). Esimerkiksi muusta syystä sairaalassa oleva potilas, jolla todetaan samanaikainen varhainen COVID-19-infektio ja suuri riski kehittää vakava tauti, voi hyötyä remdesiviiristä. Lääke osoittautui tutkimuksessamme hyvin siedetyksi ja sairaalassa helppokäyttöiseksi. Avohoitopotilailla remdesiviirin käytettävyyttä heikentää sen annostelu suoneen.
Tutkimuksen rajoitteena on sen avoimuus: sekä potilas että hoitohenkilökunta tiesivät, saiko potilas remdesiviiriä. Avoimesta asetelmasta aiheutuvaa harhaa vähennettiin käyttämällä objektiivista ja potilaille hyvin merkityksellistä päätetapahtumaa, sairaalahoidon aikaista kuolleisuutta. Päätetapahtumien pienen määrän vuoksi Solidarity Finland -tutkimusta tuleekin arvioida osana monikansallista Solidarity-tutkimusta.
Pandemiatilanteessa vain otoskooltaan suuri monikeskustutkimus mahdollistaa käyttökelpoisten tulosten tuottamisen nopeasti ja luotettavasti kliinistä työtä varten (10,11). Tämä on ymmärretty Britanniassa, jossa tutkimusrahoitus keskitettiin Recovery-tutkimukseen (17,18), jonka avulla löydettiin ensimmäinen vaikeassa COVID-19-taudissa kuolleisuutta vähentävä hoito – deksametasoni (12). Recovery-tutkimus alkoi alle viikossa siitä, kun tutkimusprotokolla lähetettiin viranomaisarvioon (10). Laaja, valtakunnallinen kliinisten tutkimusyksikköjen verkosto liittyi tutkimukseen mukaan. Terveysministeriön johto kannusti satunnaistamaan sairaalapotilaat Recovery-tutkimukseen ja välttämään off-label -hoitoja (3,10).
Aloitimme elokuussa 2021 ensimmäisenä maana maailmassa rekrytoinnin WHO Solidarity -tutkimuksen toiseen vaiheeseen, jossa Suomessa tutkimuslääkkeinä ovat leukemialääke imatinibi ja reumalääke infliksimabi sekä globaalisti lisäksi malarialääke artesunaatti (19). Maaliskuun 2022 alkuun mennessä koko Solidarity Finland -tutkimukseen on rekrytoitu yli 370 potilasta.
Solidarity Finland on ainutlaatuinen satunnaistettu COVID-19-hoitokoe maailmassa ja poikkeaa WHO:n tutkimuksesta siten, että seuraamme potilaiden toipumista kahden vuoden ajan sairaalasta kotiutumisen jälkeen (Solidarity Finland Long-COVID) (20). Olemmekin paraikaa viimeistelemässä tämän remdesiviiritutkimuksen yhden vuoden seurantatutkimusta, johon osallistuivat lähes kaikki (92 %) potilaat. Olemme myös toteuttamassa samanlaista seurantatutkimusta (6 kk, 1 v ja 2 v) uusille imatinibi- ja infliksimabitutkimusten potilaille (21).
Solidarity Finland -tutkimus on osoittanut satunnaistetun lääketutkimuksen olevan Suomessa mahdollista myös pandemian kuormittamassa terveydenhuollossa. Potilaille merkityksellisiä ja kliinisesti käyttökelpoisia tuloksia varten tarvittava potilasmäärä on mahdollista saavuttaa vain osana suurta, pragmaattista kansainvälistä tutkimushanketta. Monikansallisen Solidarity-tutkimuksen ja kaikkien muiden remdesiviiritutkimusten meta-analyysin tulosten perusteella remdesiviiristä voi olla hyötyä sairaalaan joutuneille varhaisvaiheen COVID-19-potilaille, joilla ei vielä ole runsasta lisähapen tarvetta.
Kiitokset
Solidarity Finland -tutkimusryhmä kiittää kaikkia osallistuneita potilaita ja seurantaryhmän (Data ja Safety Management Committee) puheenjohtajaa, professori Anssi Auvista sekä jäseniä professori Katri Kaukista ja professori Miia Turpeista.
Apurahat
Solidarity Finland -tutkimusryhmä sai remdesiviiritutkimukseen tutkimuslääkkeet WHO:lta ja apurahan Suomen Akatemialta (309387).
Liitetaulukko 1. Potilaiden rekrytointi Solidarity Finland -tutkimukseen tutkimuksen aikana
Työryhmä
Ohjaus- ja johtoryhmä: Kari Tikkinen, kansallinen päätutkija ja ohjaus- ja johtoryhmän puheenjohtaja, Saana Horstia, Petrus Järvinen, Ilkka Kalliala, Tuomas Kilpeläinen, Jussi Mustonen, Olli Nevalainen, Carolina Nystén, Markus Perola, Erja-Leena Paukkeri, Jarno Rutanen, Marjatta Sinisalo
Tutkijat: Hus Kirurginen sairaala/Meilahti/Jorvi: Marjukka Myllärniemi (päätutkija), Juuso Paajanen (päätutkija), Ville Holmberg, Hanna-Riikka Kreivi, Pauliina Kuutti, Satu Lamminmäki, Tiina Mattila, Laura Mäkinen, Jarkko Mäntylä, Katariina Pihlajamaa, Andreas Renner, Mari Saalasti, Susanna Tuominen
Hus Hyvinkää: Taina Nykänen (päätutkija), Mia Haukipää, Maarit Helén, Toni Jämsänen, Miro Nyqvist, Hanna Tapanainen
Hus Porvoo: Heikki Ekroos (päätutkija), Jere Reijula
Kanta-Häme: Tuomas Rosberg (päätutkija), Iivo Hetemäki, Maiju Leppänen, Emma Reponen, Hanna Korkeamäki
Kys: Katariina Sivenius (päätutkija), Irma Koivula, Anne Lätti, Riitta-Liisa Patovirta, Päivi Salonen
Mikkeli: Ilari Kuitunen (päätutkija), Jenna Leppä
Oys: Heikki Kauma (päätutkija), Tero Ala-Kokko, Pia Holma, Janne Hukkanen, Hanna Jaula, Jaana Karhu, Juha Koskenkari, Jouko Laurila, Terhi Partanen, Jaana Pikkupeura, Emmi Puusti, Elina Saarela, Sinikka Sälkiö, Helena Vanninen
Päijät-Häme: Alvar Külmäsu (päätutkija), Heikki Annala, Niko Korpi, Katri Lind, Mikko Planting, Marjo Soini, Janne Virtanen, Kalle Voutilainen
Satasairaala: Raija Uusitalo-Seppälä (päätutkija), Tuomas Nieminen
Seinäjoki: Sari Risku (päätutkija), Lauri Aitokari, Oskari Jääskeläinen, Timo Kuoppala, Jouko Kähkönen, Elina Kärnä, Hanna-Liisa Malmi, Elle Myllykoski, Anastassia Povalisina, Matti Rekiaro, Leena Tuomisto, Juha Alanko
Tays: Jarno Rutanen (päätutkija), Jaakko Antonen, Pertti Arvola, Jutta Delany, Riina Hankkio, Päivi Hämäläinen, Ville Jalkanen, Jenni Jouppila, Juuso Järventie, Tina Katto, Janne Laine, Sirpa Leivo-Korpela, Gitte Määttä, Joni Niskanen, Ulla Otava, Erja-Leena Paukkeri, Marjatta Sinisalo, Khalil Sumrein, Jaana Syrjänen, Petrus Säilä, Laura Tervo, Vesa Virtanen, Hanna Viskari
Jarno Rutanen: Apurahat (Tays VTR).
Petrus Järvinen: Osakkeet/optiot (Osgenic Oy).
Heikki Kauma: Luentopalkkiot (Boehringer–Ingelheim Finland).
Tiina Mattila: Konsultointi (THL), apurahat (Hus VTR), luentopalkkiot (GSK, Boehringer–Ingelheim, AstraZeneca), matka-, majoitus- tai kokouskulut (Boehringer–Ingelheim, AstraZeneca).
Tuomas Rosberg: Luentopalkkiot (AstraZeneca, Boehringer–Ingelheim, Chiesi, GSK, Orion).
Katariina Sivenius: Konsultointi (Roche).
Kari A. O. Tikkinen: Apurahat (Suomen Akatemia, Hus VTR, Päivikki ja Sakari Sohlbergin säätiö, Sigrid Juséliuksen Säätiö).
Muut kirjoittajat: Ei sidonnaisuuksia.
Tämä tiedettiin
Aikaisempien pandemioiden aikana ei suuria satunnaistettuja kokeita ole tehty.
COVID-19-pandemian alkaessa ei ollut tiedossa, mitkä lääkehoidot vaikuttavat taudin ennusteeseen suotuisasti.
Tutkimus opetti
Pandemian aikana lääkehoitojen hyödyt ja haitat voidaan selvittää luotettavasti ja nopeasti vain laajojen, satunnaistettujen monikeskustutkimusten avulla.
Pragmaattinen tutkimusasetelma ja useiden tutkimussairaaloiden osallistuminen mahdollistaa merkittävän potilasmäärän rekrytoinnin kansainväliseen satunnaistettuun hoitokokeeseen myös Suomessa.
Remdesiviiri on sairaalaan joutuneille COVID-19-potilaille turvallinen lääke, jolla on meta-analyysin perusteella varhaisessa sairauden vaiheessa aloitettuna kuolleisuutta vähentävä vaikutus.
- 1
- Zhu N, Zhang D, Wang W ym. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020;382:727–33.
- 2
- WHO Director-General’s opening remarks at the media briefing on COVID-19 – 11 March 2020. (siteerattu 2.3.2022). www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020
- 3
- Rutanen J, Tikkinen KAO. Luotettava lääketiede koronaviruksen kourissa. Suom Lääkäril 2020;75:1356–7.
- 4
- WHO Solidarity Trial Consortium. Repurposed antiviral drugs for Covid-19 — interim WHO Solidarity trial results. New Engl J Med 2021;384:497–511.
- 5
- Wang M, Cao R, Zhang L ym. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res 2020;30:269–71.
- 6
- Choy K-T, Wong AY-L, Kaewpreedee P ym. Remdesivir, lopinavir, emetine, and homoharringtonine inhibit SARS-CoV-2 replication in vitro. Antivir Res 2020;178:104786.
- 7
- Williamson BN, Feldmann F, Schwarz B ym. Clinical benefit of remdesivir in rhesus macaques infected with SARS-CoV-2. Nature 2020;585:273–6.
- 8
- Beigel JH, Tomashek KM, Dodd LE ym. Remdesivir for the treatment of Covid-19 — Final Report. New Engl J Med 2020;383:1813–26.
- 9
- WHO Solidarity Trial Consortium. Remdesivir and other drugs for hospitalised Covid-19: final results of the WHO Solidarity randomised trial and updated meta-analyses. Lancet 2022;399:1941–53.
- 10
- Tikkinen KAO, Malekzadeh R, Schlegel M, Rutanen J, Glasziou P. COVID-19 clinical trials: learning from exceptions in the research chaos. Nat Med 2020;26:1671–2.
- 11
- Tikkinen KAO, Nevalainen OPO, Rutanen J. Satunnaistetut, pragmaattiset monikeskustutkimukset ovat parantaneet COVID-19-taudin hoitoa. Duodecim 2022;138:5–8.
- 12
- Recovery Collaborative Group. Dexamethasone in hospitalized patients with Covid-19. New Engl J Med 2021;384:693–704.
- 13
- Common Terminology Criteria for Adverse Events (CTCAE). U.S. Department of Health and Human Services, 2017.
- 14
- Kliiniset lääketutkimukset, Fimea, 26.11.2019, Määräys 005055/00.01.02/2019. www.finlex.fi/fi/viranomaiset/normi/558001/45607
- 15
- Fajgenbaum DC, June CH. Cytokine storm. N Engl J Med 2020;383:2255–73.
- 16
- Gottlieb RL, Vaca CE, Paredes R ym. Early remdesivir to prevent progression to severe Covid-19 in outpatients. New Engl J Med 2022;386:305–15.
- 17
- Glasziou PP, Tikkinen KAO. The RECOVERY trial platform: a milestone in the development and execution of treatment evaluation during an epidemic. J R Soc Med 2021;114:443–6.
- 18
- Rutanen J, Mustonen J, Tikkinen KAO. Koronan lääkehoito kehittyy, mutta kysymyksiä. Suom Lääkäril 2021;48:2841.
- 19
- Suomi hyväksytty ensimmäisenä maana Solidarity-koronalääketutkimuksen toiseen vaiheeseen. Sosiaali- ja terveysministeriö 11.8.2021. valtioneuvosto.fi/-/1271139/suomi-hyvaksytty-ensimmaisena-maana-solidarity-koronalaaketutkimuksen-toiseen-vaiheeseen.
- 20
- Solidarity Finland Long COVID-19 (NCT04978259). ClinicalTrials.gov. 20.7.2021. clinicaltrials.gov/ct2/show/record/NCT04978259
- 21
- Solidarity Finland Plus Long COVID-19 (NCT05220280). ClinicalTrials.gov. 1.2.2022. www.clinicaltrials.gov/ct2/show/record/NCT05220280
Remdesivir in the treatment of hospitalized patients with COVID-19: Solidarity Finland, a pragmatic, adaptive, randomized multicentre study
Background In partnership with the WHO, we launched Solidarity Finland, a study that determines the effect of different drugs in hospitalized COVID-19 patients. This article reports the Solidarity Finland results for remdesivir (RDV).
Methods We randomly allocated patients to receive standard of care (SoC) or SoC plus RDV. The protocol-specified primary intention-to-treat analysis was in-hospital mortality. Secondary analyses included initiation of (invasive) ventilation and duration of hospitalization.
Results Between July 2020 and January 2021, we recruited 208 participants across 11 hospitals (94 assigned to SoC, and 114 to SoC plus RDV). Death occurred in 4 participants in the SoC group and 1 participant in the RDV group, and 5% in both groups required invasive ventilation. Median duration of hospitalization was 8 days in the remdesivir group and 8.5 days in the SoC group.
Conclusions Our study demonstrates that even during a pandemic putting a strain on the health care system it is feasible to recruit a substantial number of patients into a large, randomized trial in Finland. Due to the small sample size, our results should be analysed as part of an international collaborative meta-analysis.
Jarno Rutanen, Olli P. O. Nevalainen, Saana Horstia, Sanna Laakkonen, Jussi Mustonen, Tuomas P. Kilpeläinen, Heikki Ekroos, Juuso Järventie, Petrus Järvinen, Ilkka Kalliala, Heikki Kauma, Hanna-Riikka Kreivi, Ilari Kuitunen, Tiina Mattila, Marjukka Myllärniemi, Jarkko Mäntylä, Taina Nykänen, Carolina Nystén, Juuso Paajanen, Erja-Leena Paukkeri, Markus Perola, Andreas Renner, Sari Risku, Tuomas Rosberg, Marjatta Sinisalo, Katariina Sivenius
Kari A. O. Tikkinen
M.D., Ph.D., Professor of Urology, Department Head
Faculty of Medicine, University of Helsinki, Helsinki, Finland
Department of Urology, University of Helsinki and Helsinki University Hospital, Helsinki, Finland
Department of Surgery, South Karelian Central Hospital, Lappeenranta, Finland