Rintasyövän neoadjuvanttihoidon toteutuminen ja tulokset
Lähtökohdat Rintasyövän hoito edellyttää yksilöllistä hoidon suunnittelua taudin biologisen alatyypin ja levinneisyyden perusteella. Aggressiivista alatyyppiä, kuten HER2-positiivista tai kolmoisnegatiivista (TNBC, triple negative breast cancer; ei ilmennä hormonireseptoreita tai HER2-geenimonistumaa) rintasyöpää, sairastavat potilaat hyötyvät ennen leikkausta aloitettavasta lääkkeellisestä neoadjuvanttihoidosta. FinNa-tutkimuksessa kartoitimme neoadjuvanttihoidon toteutumista ja hoitotuloksia Pirkanmaan sairaanhoitopiirissä (PSHP). Menetelmät Tiedot PSHP:ssa hoidetuista rintasyöpäpotilaista (ICD-10: C50), joille oli aloitettu neoadjuvanttihoito aikavälillä 1.1.2017–30.6.2018, kerättiin potilastietojärjestelmistä. Tulokset Neodjuvanttihoito toteutui pääasiassa kansallisten ja kansainvälisten hoitosuositusten mukaisesti. Lähes puolella kohortin potilaista oli HER2-positiivinen rintasyöpä. Yleisin leikkausta edeltävä levinneisyysaste oli III. Täydellisen patologisen vasteen saavuttaneiden potilaiden osuus HER2+- ja TNBC-alaryhmissä oli linjassa aiemman kliinisen tutkimusnäytön kanssa. Päätelmät Neoadjuvanttihoidolla voidaan saavuttaa erinomainen patologinen vaste varsinkin aggressiivisten alatyyppien kohdalla ja siksi sen vakiinnuttamista osaksi hoitokäytäntöä kansallisella tasolla tulee tavoitella.

Rintasyöpä on naisten yleisin syöpä. Suomessa siihen sairastuu vuosittain noin 5 000 naista ja menehtyy noin 800 (1). Rintasyövän ennuste on Suomessa Euroopan parhaimpia. Suhteellinen 5-vuotiselossaololuku yleisväestöön verrattuna oli vuosina 2012–2014 todetuilla rintasyöpäpotilailla 91 % ja 10-vuotiselossaololuku 85 % (1,2).
Rintasyöpä on moninainen sairaus, joka edellyttää yksilöllistä hoidon suunnittelua. Hoitojen valintaan vaikuttavat muun muassa taudin levinneisyys sekä kasvaimen biologinen alatyyppi, joka määritetään hormoni- ja HER2-reseptorien (human epidermal growth factor type 2 receptor) esiintymisen sekä syöpäsolujen jakaantumisaktiiviuuden perusteella.
Varhaisvaiheen rintasyövässä leikkaus on yleensä ensisijainen hoitomenetelmä, johon yhdistetään leikkauksen jälkeinen adjuvantti- eli liitännäishoito joko biologiselle alatyypille soveltuvana lääkehoitona, sädehoitona tai näiden yhdistelmänä. Tietyissä tapauksissa onkologiset hoidot voidaan aloittaa jo ennen leikkausta.
Ennen leikkausta annettavaa hoitoa eli neoadjuvanttihoitoa käytetään erityisesti potilaille, joiden tauti on edennyt paikallisesti rinnan tai kainalon alueella ja/tai kasvain ei ole leikattavissa tai joilla on tulehduksellinen rintasyöpä (2). Neoadjuvanttihoidolla tähdätään kasvaimen leikattavuuden parantamiseen sekä systeemitaudin hoidon välittömään aloitukseen. Lisäksi etuna on mahdollisuus seurata varhaista hoitovastetta ja käyttää tätä tietoa leikkauksen jälkeisen liitännäishoidon räätälöinnissä.
Rintasyövän valtakunnallisen diagnostiikka- ja hoitosuosituksen (2019) mukaan neoadjuvanttihoito aloitetaan yleensä antrasykliini- ja/tai taksaanipohjaisilla solunsalpaajahoidoilla (2). Potilaille, joilla on hormonireseptoripositiivinen kasvain, neoadjuvanttihoito voidaan toteuttaa osin tai kokonaan endokriinisilla lääkkeillä (2,3). Kolmoisnegatiivisen rintasyövän (ei ilmennä hormonireseptoreita tai HER2-geenimonistumaa) hoitoon suositellaan platinapohjaisia solunsalpaajahoitoja paremman hoitotuloksen saavuttamiseksi (4,5). HER2-positiivisessa rintasyövässä käytetään taksaanin kanssa HER2-vasta-ainehoitoa: trastutsumabia yksin tai pertutsumabin kanssa (6,7). Valtakunnallinen hoitosuositus on päivittynyt tämän tutkimuksen ajanjakson jälkeen (2021) ja sisältää aiempaa laajemman valikoiman hoitovaihtoehtoja (2).
Kansainväliset hoitosuositukset korostavat neoadjuvanttihoidon käytön tärkeyttä leikkaukseen soveltumattoman ja tulehduksellisen rintasyövän lisäksi aggressiivisten alatyyppien, kuten HER2-positiivisen ja kolmoisnegatiivisen syövän, sekä leikattavissa olevan, kainalon alueelle levinneen taudin hoidossa (8,9). Näihin alatyyppeihin liittyy suurentunut uusiutumisriski, mutta ne myös reagoivat lääkehoitoihin hyvin (10).
Suomessa valtakunnallinen hoitosuositus pyrkii ohjaamaan ja yhtenäistämään hoitomenetelmien valintaa. Vuonna 2020 julkaistu selvitys, jossa haastateltiin yliopisto- ja keskussairaaloista yhteensä 12:ta syöpätauteihin tai kirurgiaan erikoistunutta tai erikoistuvaa lääkäriä, kuitenkin osoittaa, että suomalaisten syöpäklinikoiden välillä on eroja neoadjuvanttihoidon käytön laajuudessa ja toteutumisessa. Selvityksen mukaan puolet haastatelluista koki, että neoadjuvanttihoitoa tulisi käyttää merkittävästi enemmän. Vaikka haastatelluilla lääkäreillä oli yhteneväinen näkemys neoadjuvanttihoidon hyödyistä, koettiin käyttöä rajoittaviksi tekijöiksi esimerkiksi yhtenäisten ja selkeiden hoitokäytäntöjen puute, konservatiiviset asenteet sekä kokemuksen ja suomalaisen tosielämän tutkimusnäytön vähäisyys (MedEngine Oy, julkaisematon havainto).
Rintasyöpäpotilaiden neoadjuvanttihoidon käytäntöjä ei ole Suomessa kartoitettu. Pirkanmaan sairaanhoitopiirissä (PSHP) rintasyövän neoadjuvanttihoito on ollut verrattain laajassa käytössä ja potilaan hoitopolkua on kehitetty määrätietoisesti. Tämän FinNa (Finnish Neoadjuvant) -tutkimuksen tavoitteena oli kuvata PSHP:ssa neoadjuvanttihoitoa saaneiden potilaiden perusominaisuuksia, hoidon toteutumista ja tuloksia.
Aineisto ja menetelmät
FinNa-tutkimuskohortti (n = 71) sisälsi kaikki PSHP:n rintasyöpää (ICD-10: C50) sairastavat aikuispotilaat, joille oli aloitettu neoadjuvanttihoito aikavälillä 1.1.2017–30.6.2018. Potilaita seurattiin vähintään 12 kuukautta neoadjuvanttihoidon aloituksesta (30.6.2019 saakka). Tiedot kerättiin sähköisistä potilastietojärjestelmistä tiedonhakualgoritmeja käyttäen ja niitä täydennettiin tarvittaessa manuaalisesti.
Potilaan perustiedot kerättiin rintasyöpädiagnoosin ja neoadjuvanttihoidon aloittamisen välisen ajanjakson viimeisimmästä kirjauksesta. Rintasyövän leikkausta edeltävä levinneisyysaste (TNM) luokiteltiin AJCC:n (American Joint Committee on Cancer) kahdeksannen version mukaisesti (11). Neoadjuvanttihoidon aloitus- ja lopetusajankohta sekä hoidossa käytetyt lääkkeet kerättiin sairaalalääkkeistä sekä lääkemääräyksistä. Kirurgiset rinnan ja kainalon toimenpiteet luokiteltiin kirjattujen toimenpidekoodien (NCSP, Nordic Classification of Surgical Procedures) mukaisesti (resektio/mastektomia/kainaloevakuaatio/vartijaimusolmukebiopsia). Patologisen vasteen luokitus (RCB 0–III, residual cancer burden) perustui kirurgin potilaskertomukseen kirjaamaan tietoon, jossa RCB 0 vastasi täydellistä patologista vastetta ja RCB I–III jäännöstautia (vähäinen/keskisuuri/suuri) (12).
Tulokset
Kohortin perustiedot
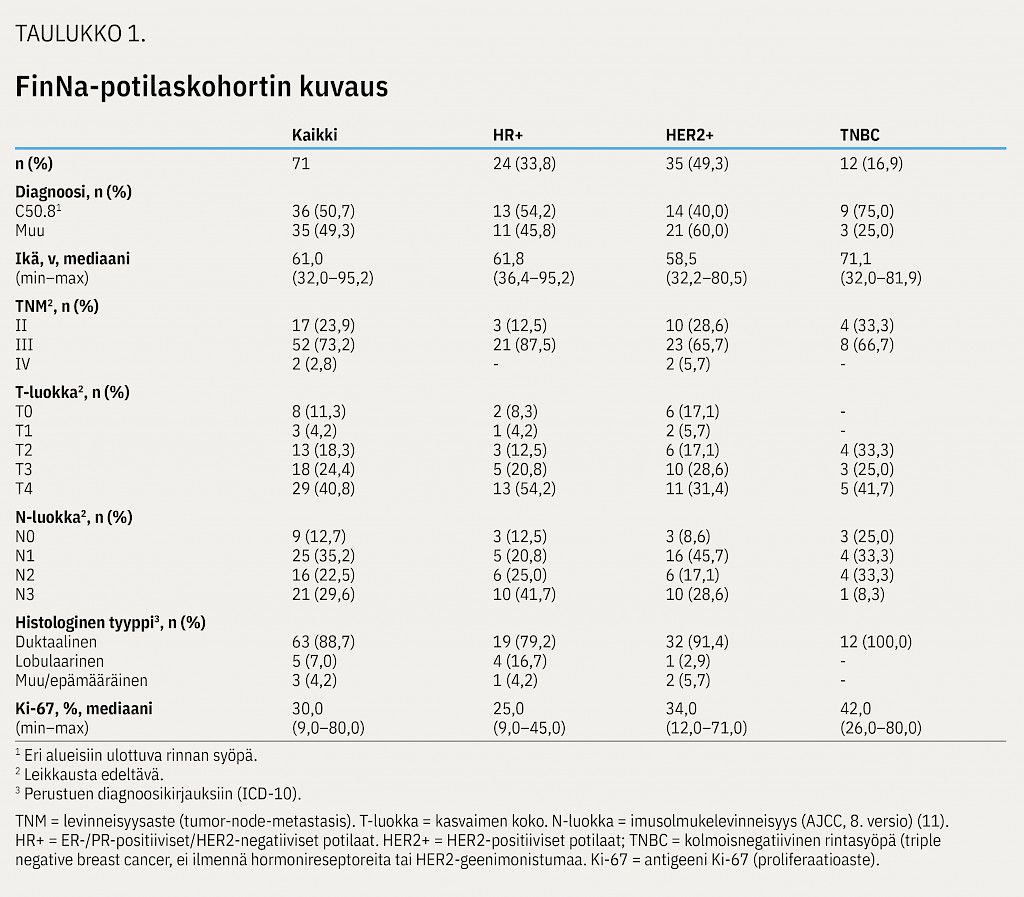
Sisäänottokriteerit täyttäviä potilaita tunnistettiin yhteensä 71. Potilaat jaettiin kolmeen biologiseen alaryhmään reseptorien ilmentymisen perusteella (HR+/HER2+/TNBC). Hormonireseptoripositiivisten (HR+) alaryhmän (n = 24; 33,8 %) muodostivat potilaat, joilla oli havaittu syöpäkudoksessa estrogeeni- tai progesteronireseptorien ilmentymistä (ER tai PR) ja jotka olivat HER2-negatiivisia. Potilaita, joilla oli HER2-geenimonistuma (HER2+) – riippumatta ER-/PR-statuksesta – oli kohortissa 35 (49,3 %). Kolmoisnegatiivista (TNBC) alatyyppiä edusti 12 potilasta (16,9 %).
Potilaiden perustiedot on esitetty taulukossa 1. ICD-10-luokitukseen perustuen noin puolella kaikista potilaista (36/71; 50,7 %) oli koko rinnan tauti (C50.8, eri alueisiin ulottuva rinnan syöpä) ja sitä esiintyi eniten TNBC-alaryhmässä (9/12; 75,0 %). Yleisin leikkausta edeltävä levinneisyysaste oli III, joka raportoitiin 87,5 %:lla HR+-alaryhmässä (21/24), 65,7 %:lla HER2+-alaryhmässä (23/35) ja 66,7 %:lla TNBC-alaryhmässä (8/12).
Neoadjuvanttihoidon toteutuminen
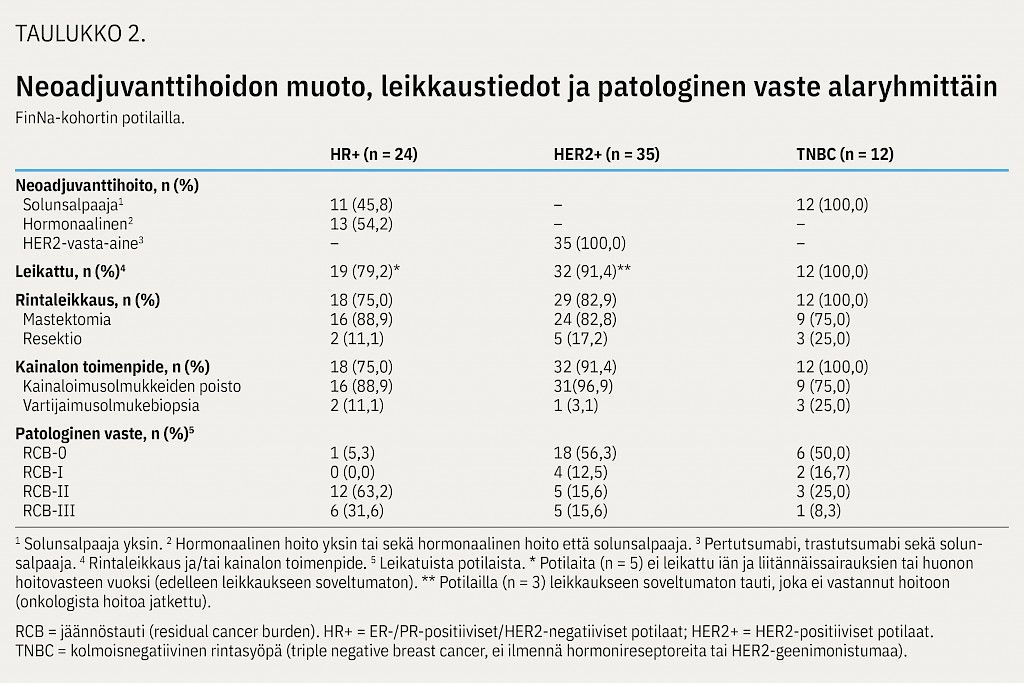
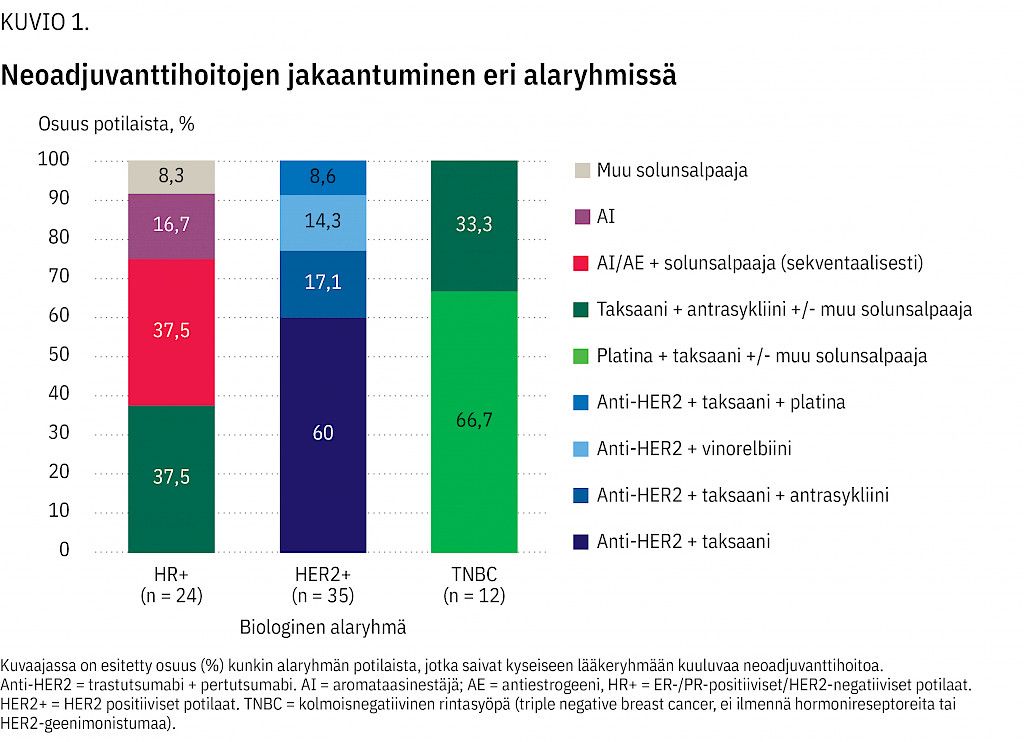
HER2+-alaryhmän potilaista kaikkia hoidettiin neoadjuvanttihoitojakson aikana HER2-reseptorin kaksoissalpauksella eli trastutsumabin ja pertutsumabin yhdistelmällä (taulukko 2). Yli puolella näistä potilaista (21/35; 60,0 %) tähän yhdistettiin taksaanihoito ja 17,1 %:lla (6/35) sekä taksaani- että antrasykliinipohjainen hoito (yleisimmin syklofosfamidin, epirubisiinin ja fluorourasiilin yhdistelmä, CEF). Myös vinorelbiiniä (5/35, 14,3 %) sekä taksaanin ja platinayhdisteen yhdistelmää (3/35, 8,6 %) käytettiin HER2-vasta-ainehoidon kanssa (kuvio 1). Neoadjuvanttihoidon mediaanikesto oli HER2+-alaryhmässä 5,3 kuukautta (vaihteluväli 3,8–42,5 kk).
Hormonireseptoripositiivisista potilaista 54,2 % (13/24) sai hormonaalista hoitoa. Näistä potilaista valtaosa (9/13, 69,2 %) sai aromataasinestäjän tai antiestrogeenin lisäksi solunsalpaajahoitoa (kuten taksaani + CEF). Pelkkää solunsalpaajahoitoa sai 45,8 % (11/24) potilaista, joista valtaosa sai sekä taksaania että CEF-yhdistelmää (9/11, 81,8 %) (kuvio 1). Neoadjuvanttihoidon mediaanikesto HR+-alaryhmässä oli hormonaalista hoitoa saaneilla 5,3 kuukautta (1,2–7,9 kk) ja pelkkää solunsalpaajahoitoa saaneilla 5,8 kuukautta (2,5–10,2 kk).
Kaikki kolmoisnegatiivisista rintasyöpää sairastavat potilaat saivat solunsalpaajahoitoa ja potilaista 66,7 % (8/12) hoidettiin platinapohjaisella hoidolla, johon oli yhdistetty yksin taksaani (yleisimmin karboplatiini-paklitakseli) tai taksaanin lisäksi muu solunsalpaaja (taulukko 2, kuvio 1). Neoadjuvanttihoidon mediaanikesto oli TNBC-alaryhmässä 5,2 kuukautta (1,6–7,0 kk).
Leikkaushoito ja patologinen vaste
Neoadjuvanttihoidon jälkeen valtaosalle (79,2–100,0 %) kunkin alaryhmän potilaista tehtiin joko rintaleikkaus ja/tai kainalon toimenpide (taulukko 2). Valtaosalla leikatuista potilaista rinnan kirurginen toimenpide oli koko rinnan poisto (HR+ 88,9 %; HER2+ 82,8 %; TNBC 75,0 %). Rintaleikkauksen yhteydessä tehtiin aina myös kainalon imusolmuketoimenpide, joka oli valtaosalla imusolmukkeiden poisto (HR+ 88,9 %; HER2+ 96,9 %; TNBC 75,0 %). HR+- ja HER2+-alaryhmissä oli myös yksittäisiä potilaita (HR+, n = 1; HER2+, n = 3), joille tehtiin tutkimuksen seuranta-aikana ainoastaan kainalon toimenpide ilman primaarista rintaleikkausta.
Leikatuista potilaista täydellisen patologisen vasteen (RCB 0) saavutti HR+-alaryhmässä 5,3 %, HER2+-alaryhmässä 56,3 % ja TNBC-alaryhmässä 50,0 % (taulukko 2).
Päätelmät
Rintasyövän neoadjuvanttihoitoa on arvioitu käytettävän lisääntyneestä tutkimusnäytöstä huolimatta verrattain vähän suomalaisessa erikoissairaanhoidossa (MedEngine Oy, julkaisematon havainto; 13). Esimerkiksi Saksassa neoadjuvanttihoitoa annetaan 65 %:lle kaikista rintasyöpäpotilaista ja yli 70 %:lle HER2-positiivista tai kolmoisnegatiivista syöpää sairastavista (14). Tämän tutkimuksen mukaan PSHP:ssa aikavälillä 1.1.2017–30.6.2018 neoadjuvanttihoidon aloittaneiden potilaiden määrä vastaa noin 10 %:ia sairaanhoitopiirissä todetuista rintasyöpätapauksista (1).
Lähes puolet (49,3 %) tutkimuksen potilaista kuului HER2+-alaryhmään ja valtaosalla (73,2 %) oli levinneisyysasteen III tauti. HER2+- ja TNBC-alaryhmissä asteen II osuudet (28,6 % ja 33,3 %) olivat suurempia kuin HR+-alaryhmässä (12,5 %). Tämä tulos vastaa kansainvälisiä hoitosuosituksia, jotka ohjaavat aloittamaan leikkausta edeltävän systeemihoidon etenkin potilailla, joilla on HER2-positiivinen suurikokoinen kasvain tai asteen II kolmoisnegatiivinen rintasyöpä (8,9).
Neoadjuvanttihoito toteutui pääosin vallitsevien hoitosuositusten mukaisesti (2,8,9). HER2+-alaryhmässä yli puolet (60,0 %) potilaista sai trastutsumabi-pertutsumabihoidon lisäksi taksaanipohjaista hoitoa ja vain 17,1 % sekä taksaani- että antrasykliinipohjaista hoitoa. HR+-alaryhmässä oli sekä hormonaalista hoitoa (yksin tai solunsalpaajan jälkeen) että pelkästään solunsalpaajaa saaneita potilaita. Valtaosa (66,7 %) kolmoisnegatiivista rintasyöpää sairastavista hoidettiin platinapohjaisella solunsalpaajahoidolla, mikä on linjassa tällä hoidolla saavutetun paremman tutkimusnäytön kanssa (4,5).
Kaikissa alaryhmissä valtaosalle (75,0–88,9 %) leikatuista potilaista tehtiin koko rinnan poisto. Euroopassa arviolta noin 60–80 % kaikista todetuista rintasyövistä voidaan leikata rintaa säästävästi joko heti diagnoosin tai primaarin systeemisen hoidon jälkeen (8). Tässä tutkimuksessa kaikista potilaista yli puolella (50,7 %) oli koko rinnan tauti, joka lähes poikkeuksetta johtaa mastektomiaan. Lisäksi 73,2 %:lla oli levinneisyysasteen III tauti, joka niin ikään heikentää mahdollisuutta säästävään kirurgiaan. Lisäksi on huomioitava, että osalla potilaista, joilla kasvain ei ole ollut lähtökohtaisesti leikattavissa, neoadjuvanttihoidollakaan ei ole saavutettu leikattavuutta (taulukko 2).
Kohortissa oli myös kaksi levinneisyysasteen IV HER2+-potilasta, joilla neoadjuvanttihoito tähtäsi leikkaukseen paikallisongelmien estämiseksi ilman välitöntä parantavaa tavoitetta. On huomattava, että PSHP:ssa on tutkimuksen ajanjakson aikana ja sen jälkeen päivitetty neoadjuvanttihoidon käytäntöä ja nykyään kainalopositiivisuus on aiempaa selkeämpi neoadjuvanttihoidon harkitsemisen aihe. Tästä johtuen neoadjuvanttipotilaiden levinneisyysluokat ovat nykyään aiempaa pienempiä, mikä mahdollistaa rintaa säästävän kirurgian entistä useammin.
Täydellisen patologisen vasteen saavuttaneiden potilaiden osuus HER2+- (56,3 %) ja TNBC-alaryhmissä (50,0 %) oli linjassa aiemman kliinisen tutkimusnäytön kanssa (6,7,15,16). Aiempien tutkimusten perusteella neoadjuvanttihoidolla saavutetaan täydellinen patologinen vaste sitä todennäköisemmin, mitä aggressiivisempi syöpätyyppi on kyseessä (17). Täydellisen patologisen vasteen saavuttaneilla on suurempi todennäköisyys saavuttaa pidempi uusiutumisvapaa sekä kokonaiselossaoloaika (10). HR+-alaryhmässä täydellisen patologisen vasteen saavuttaneiden osuus (5,3 %) oli pienempi, mutta samankaltainen aiemmin raportoitujen tulosten kanssa (18,19). HR+-alaryhmässä hormonaalinen hoito liitetään potilaan hoito-ohjelmaan usein vasta leikkauksen jälkeen. Maksimaalisen vasteen saavuttaminen voi tapahtua hitaasti, eikä patologinen vaste siten ole yhtä hyvä pidemmän aikavälin ennustetekijä tässä alaryhmässä (20).
Näyttö neodjuvanttihoidolla saavutettavista erinomaisista hoitotuloksista, etenkin aggressiivisten alatyyppien kohdalla, puoltaa tämän hoitomuodon vakiinnuttamista osaksi suomalaista hoitokäytäntöä. Neoadjuvanttihoidon käytön yhtenäistäminen edellyttää kuitenkin rintasyövän hoitopolun ja toimintamallien kehittämistä moniammatillisesti syöpälääkärien, kirurgien, radiologien ja patologien yhteistyönä.
Kiitokset
Kiitämme Roche Oy:tä, jonka tuki mahdollisti tutkimuksen toteuttamisen sekä Taysin kliinisen informatiikan tiimiä tutkimuksen tietopoiminnan toteuttamisesta. Kiitämme myös Ilona Iso-Mustajärveä tutkimuksen suunnitteluun osallistumisesta.
Heidi Loponen: Palkkiot osallistumisesta tutkimuksen toteutukseen (Roche), korvaus käsikirjoituksen kirjoittamisesta tai tarkistamisesta (Roche), konsultointi (Roche).
Harlan Barker: Palkkiot osallistumisesta tutkimuksen toteutukseen (Roche), korvaus käsikirjoituksen kirjoittamisesta tai tarkistamisesta (Roche).
Tero Ylisaukko-oja: Palkkiot osallistumisesta tutkimuksen toteutukseen (Roche), korvaus käsikirjoituksen kirjoittamisesta tai tarkistamisesta (Roche), konsultointi (useita lääkeyrityksiä, ml. Roche), korvaus käsikirjoituksen valmistelusta (useita lääkeyrityksiä, ml. Roche), osakkeet/optiot (MedEngine Oy)
Maarit Bärlund: Kirjoitusapu (Roche, tämän artikkelin käsikirjoitus).
Minna Tanner: Konsultointi (Advisory Board; Roche, Pfizer, Novartis, Lilly, Astra Zeneca, Pierre Fabre), matkakorvaus (Roche, Pfizer, MSD, Astra Zeneca), palkkiot osallistumisesta tutkimukseen (Orion , Abbvie, Novartis, Roche, Boehringer–Ingelheim), kirjoitusapu (Roche, tämän artikkelin käsikirjoitus), konsultointi (Pfizer, Roche, Novartis, Pierre Fabre, Medengine), asiantuntijalausunnot (Hila-lausunnot; Pfizer, Amgen, Novartis, Pierre Fabre), luentopalkkiot (Novartis, Roche, Astra Zeneca, Teva, Novartis, Lilly, MSD).
Tämä tiedettiin
Rintasyövän neoadjuvanttihoidon avulla voidaan parantaa kasvaimen leikattavuutta, aloittaa systeemitaudin hoito viiveettä, sekä seurata varhaista hoitovastetta ja käyttää tätä tietoa leikkauksen jälkeisen liitännäishoidon räätälöinnissä.
Rintasyövän neoadjuvanttihoitoa käytetään lisääntyneestä tutkimusnäytöstä huolimatta verrattain vähän suomalaisessa erikoissairaanhoidossa.
Nykyiset kansainväliset hoitosuositukset korostavat neoadjuvanttihoidon käytön tärkeyttä leikkaukseen soveltumattoman ja tulehduksellisen rintasyövän lisäksi myös etenkin aggressiivisten alatyyppien, kuten HER2-positiivisen ja kolmoisnegatiivisen syövän, sekä leikattavissa olevan, kainalon alueelle levinneen taudin hoidossa.
Tutkimus opetti
Pirkanmaan sairaanhoitopiirissä noin 10 % kaikista rintasyöpäpotilaista sai aikavälillä 1.1.2017–30.6.2018 neoadjuvanttihoitoa ja heistä noin puolet oli HER2-positiivisia.
Valtaosalle (83,1 %) leikatuista potilaista tehtiin koko rinnan poisto.
Täydellisen patologisen vasteen saavuttaneiden potilaiden osuudet olivat linjassa aiemman kliinisen tutkimusnäytön kanssa kaikissa alaryhmissä.
- 1
- Suomen Syöpärekisteri. Syöpätilastot. (siteerattu 27.1.2021). syoparekisteri.fi/tilastot/tautitilastot/
- 2
- Suomen Rintasyöpäryhmä ry. Rintasyövän valtakunnallinen diagnostiikka- ja hoitosuositus. Päivitysversiot 2/2019 (2.12.2019) ja 1/2021 (1.6.2021). rintasyoparyhma.yhdistysavain.fi/hoitosuositus
- 3
- Spring LM, Gupta A, Reynolds KL ym. Neoadjuvant endocrine therapy for estrogen receptor–positive breast cancer. JAMA Oncol 2016;2:1477–86.
- 4
- Petrelli F, Coinu A, Borgonovo K ym. The value of platinum agents as neoadjuvant chemotherapy in triple-negative breast cancers: a systematic review and meta-analysis. Breast Cancer Res Treat 2014;144:223–32.
- 5
- Sikov WM, Berry DA, Perou CM ym. Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage II to III triple-negative breast cancer: CALGB 40603. J Clin Oncol 2015;33:13–21.
- 6
- Gianni L, Eiermann W, Semiglazov V ym. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet Oncol 2014;15:640–7.
- 7
- Swain SM, Baselga J, Kim S-B ym. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015;372:724–34.
- 8
- Cardoso F, Kyriakides S, Ohno S ym. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019;30:1194–220.
- 9
- Burstein HJ, Curigliano G, Loibl S ym. Estimating the benefits of therapy for early-stage breast cancer: the St. Gallen International Consensus Guidelines for the primary therapy of early breast cancer 2019. Ann Oncol 2019;30:1541–57.
- 10
- Cortazar P, Zhang L, Untch M ym. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014;384:164–72.
- 11
- Hortobagyi GN, Connolly JL, D'Orsi CJ ym. Breast. Kirjassa: Amin MB, Edge S, Greene F ym., toim. American Joint Committee on Cancer. AJCC cancer staging manual, 8. painos. Springer 2017:589–636.
- 12
- Symmans WF, Peintinger F, Hatzis C ym. Measurement of Residual Breast Cancer Burden to Predict Survival After Neoadjuvant Chemotherapy. J Clin Oncol 2007;25:4414–22.
- 13
- Hyvärinen A, Härkönen U, Kiviniemi V. Pertutsumabi varhaisvaiheen HER2-positiivisen rintasyövän liitännäishoidossa. Uusien sairaalalääkkeiden arviointi. Lääkealan turvallisuus- ja kehittämiskeskus Fimea. Fimea kehittää, arvioi ja informoi -julkaisusarja, 13/2018.
- 14
- Hennigs A, Riedel F, Marmé F ym. Changes in chemotherapy usage and outcome of early breast cancer patients in the last decade. Breast Cancer Res Treat 2016;160:491–9.
- 15
- Pandy JGP, Balolong-Garcia JC, Cruz-Ordinario MVB ym. Triple negative breast cancer and platinum-based systemic treatment: a meta-analysis and systematic review. BMC Cancer 2019;19:1065.
- 16
- Poggio F, Bruzzone M, Ceppi M ym. Platinum-based neoadjuvant chemotherapy in triple-negative breast cancer: a systematic review and meta-analysis. Ann Oncol 2018;29:1497–508.
- 17
- Yu K-D, Fan L, Qiu L-X ym. Influence of delayed initiation of adjuvant chemotherapy on breast cancer survival is subtype-dependent. Oncotarget 2017;8:46549–56.
- 18
- Alba E, Calvo L, Albanell J ym. Chemotherapy (CT) and hormonotherapy (HT) as neoadjuvant treatment in luminal breast cancer patients: results from the GEICAM/2006-03, a multicenter, randomized, phase-II study. Ann Oncol 2012;23:3069–74.
- 19
- Barnadas A, Gil M, Sánchez-Rovira P ym. Neoadjuvant endocrine therapy for breast cancer: past, present and future. Anticancer Drugs 2008;19:339–47.
- 20
- Carey LA, Dees EC, Sawyer L ym. The triple negative paradox: Primary tumor chemosensitivity of breast cancer subtypes. Clin Cancer Res 2007;13:2329–34.
Implementation and outcomes of neoadjuvant therapy for breast cancer
Background Breast cancer (BC) is a multifaceted disease that requires individual treatment planning based on the biological subtype and stage of the disease. In particular, patients with aggressive subtypes, such as HER2-positive or triple negative BC (TNBC), benefit from preoperative systemic (neoadjuvant) therapy. In this study, we assessed the treatment patterns and outcomes of neoadjuvant therapy in the Pirkanmaa Hospital District.
Methods Data on adult breast cancer patients (ICD-10: C50) who had started neoadjuvant treatment between January 1st, 2017 and June 30th, 2018 in the Pirkanmaa Hospital District were collected from electronic health records.
Results Neoadjuvant treatment was mainly carried out in accordance with national and international treatment recommendations. Nearly half of the patients in the cohort had HER2-positive BC. The most common preoperative stage was III. The proportion of patients who achieved a complete pathological response in the HER2 + and TNBC subgroups was in line with previous clinical trial evidence.
Conclusions Neoadjuvant treatment results in a high rate of complete pathological response, especially in aggressive subtypes. Thus, establishment of neoadjuvant therapy as a part of standard treatment practices at the national level should be pursued.
Heidi Loponen, Harlan Barker, Tero Ylisaukko-oja, Maarit Bärlund, Minna Tanner
Heidi Loponen
Ph.D., Senior Scientific Consultant
MedEngine Oy