Sattumalta löydetyistä lisämunuaiskasvaimista valtaosa ei vaadi seurantaa
Lähtökohdat Kuvantamisen lisääntyessä sattumalta löydettyjen lisämunuaiskasvainten määrä on kasvanut. Jatkotutkimusten ja seurannan käytännöt ovat olleet vaihtelevia ja hyöty kyseenalainen. Selvitimme lisämunuaisinsidentaloomien luonnetta ja tietokonetomografian osuvuutta kasvainten luokittelussa ja seurannan ohjauksessa Pohjois-Pohjanmaan sairaanhoitopiirin potilasaineistossa.
Menetelmät Aineisto muodostui 451 täysi-ikäisestä potilaasta vuosilta 2003–2013. Lisämunuaisinsidentaloomien radiologiset ja hormonaaliset löydökset kartoitettiin.
Tulokset Adenoomia oli 352 (78,0 %), feokromosytoomia 10 (2,2 %), kortikaalisia karsinoomia 5 (1,1 %) ja etäpesäkkeitä 6 (1,3 %). Adenoomat olivat läpimitaltaan keskimäärin 2,1 cm (0,5–5,5 cm). Alle 20 Hounsfieldin yksikön tiheyksisistä kasvaimista ei löytynyt yhtään pahanlaatuista primaarikasvainta. TT-kuvauksessa adenoomiksi lausutut kasvaimet eivät kasvaneet tai osoittautuneet seurannassa pahanlaatuisiksi potilailla, joilla ei ollut syöpähistoriaa.
Päätelmät Tuloksemme on sopusoinnussa European Society of Endocrinologyn suosituksen kanssa, jonka mukaan pienitiheyksisten (≤ 10 HU) ja pienikokoisten (≤ 4 cm), hormonaalisesti toimimattomien kasvainten kuvantamisseurannasta voidaan luopua.

Sattumalta löydetyllä lisämunuaiskasvaimella tarkoitetaan lisämunuaiseen liittymättömästä syystä tehdyssä kuvantamistutkimuksessa löydettyä lisämunuaisen kasvainta. Kuvantamistutkimusten käytön lisääntyessä todettujen insidentaloomien määrä on kasvanut viime vuosikymmenten aikana, ja niistä on muodostunut merkittävä kliininen ongelma (1,2,3).
Ruumiinavausaineistoissa esiintyvyys on keskimäärin 2,3 % ja se kasvaa iän myötä; yli 70-vuotiaista kasvaimia löydetään noin 15 %:lta (1,3). Radiologisissa aineistoissa esiintyvyys on keskimäärin 4 % keski-ikäisillä ja yli 10 % iäkkäillä (4,5).
Vaikka valtaosa lisämunuaisinsidentaloomista on toimimattomia adenoomia, on joukossa myös pahanlaatuisia ja hormonaalisesti aktiivisia kasvaimia, jotka tulee hoitaa kirurgisesti. Tämä johtaa haasteisiin seurannan suhteen, sillä kalliiden turhien tutkimusten tekemistä tulisi välttää ja toisaalta olisi löydettävä hoitoa tarvitsevat potilaat.
Keskeisimmät asiat insidentalooman löydyttyä ovat sen pahanlaatuisuuden ja hormonaalinen aktiivisuuden arviointi. Selvitimme insidentaloomien luonnetta ja TT-tutkimuksen osuvuutta kasvainten luokittelussa ja hoidon ohjauksessa Pohjois-Pohjanmaan sairaanhoitopiirissä ja peilasimme tuloksia European Society of Endocrinologyn (ESE) vuonna 2016 antamaan suositukseen (6).
Aineisto ja menetelmät
Aineisto muodostui täysi-ikäisistä potilaista, joilta löydettiin lisämunuaisinsidentalooma vuosina 2003–2013 ja jotka lähetettiin Oulun yliopistolliseen sairaalaan tai Oulaskankaan aluesairaalaan jatkoselvityksiin. Aineisto kerättiin taulukon 1 mukaisilla ICD-10-diagnoosikoodeilla.
Aineiston täydentämiseksi haettiin Oysin radiologisesta tietokannasta potilaat, joille oli samalla aikavälillä tehty lisämunuaisten TT-kuvaus; magneettikuvauksista ei vastaavaa tietokantaa ollut saatavilla.
Lähtöaineistot yhdistettiin ja varmistettiin, että sama potilas ei esiinny aineistossa kahdesti. Potilaat, joilla oli ennen kuvantamistutkimusta kliininen epäily lisämunuaisen liiallisesta hormonierityksestä tai uudesta syövästä, suljettiin pois tutkimuksesta. Myös muista sairaanhoitopiireistä lisämunuaiskasvaimen vuoksi Oysiin lähetetyt potilaat jätettiin pois.
Tiedot kerättiin Esko-potilastietojärjestelmän potilaskertomuksista. Radiologiset tiedot kerättiin radiologien lausunnoista. Lisämunuaiskasvaimen suurimman läpimitan lisäksi kirjattiin ylös TT-kuvista mitattu kasvaimen tiheysarvo (Hounsfieldin yksikkö, HU). Tiheysarvon mittauksessa on käytetty kansainvälisesti hyväksyttyjä periaatteita (7).
Tiheysmittaukset on tehty ilman varjoainetta otetuista kuvista. Mielenkiintoalue on mitattu kasvaimen keskeltä, ja se käsittää vähintään puolet kasvaimen pinta-alasta välttäen nekroottisia alueita. Magneettikuvauksessa käytettiin hyväksi adenoomien solunsisäisen rasvan aiheuttamaa signaalin madaltumaa ns. in phase -kuvissa verrattuna out of phase -kuviin (8).
Insidentaloomat luokiteltiin tiheytensä perusteella kolmeen ryhmään: < 10 HU, 10–20 HU, > 20 HU. Hormonaalisten määritysten tulkinnat kirjattiin endokrinologien lausuntojen perusteella.
Kortisolineritystä arvioitiin 1,5 mg:n deksametasonikokeen perusteella, mutta epäselvissä tilanteissa käytettiin myös muita hyperkortisolismin tutkimuksia (Sa-korsol klo 23, dU-korsol-v, 3 mg deksametasonikoe ja tarvittaessa tutkimusten toisto). Raja-arvoina pidettiin 1,5 mg:n deksametasonikokeessa seerumin kortisoliarvoa < 50 nmol/l, syljen yökortisolitasoa < 3 nmol/l ja vuorokausivirtsan vapaalle kortisolille viitearvoja 30–144 nmol.
Hyperaldosteronismin selvittelyssä raja-arvoina pidettiin aldosteronipitoisuutta > 400 pmol/l sekä jarruuntunutta reniiniaktiivisuutta (< 1 μg/l/t). Aldosteroni-reniinisuhteen katsottiin olevan poikkeavan korkea, jos se oli > 800.
Hyperandrogenismin ylärajana olivat seerumin dehydroepiandrosteronisulfaattipitoisuuden (S-DHEAS) sukupuolen mukaisen viitealueen (miehet 2–16 µmol/l; naiset 1–14 µmol/l) ylittävät arvot. Naisilla myös seerumin testosteronin viitearvojen (0,4–2,3 nmol/l) ylittyminen viittasi hyperandrogenismiin.
Feokromosytooma suljettiin pois vuorokausivirtsan metanefriinin ja normetanefriinin määrityksin (dU-Metnef < 1,7 µmol ja dU-Normet < 4 µmol).
Tilastolliset käsittelyt tehtiin SPSS-ohjelmalla (IBM Statistics v22). Tulokset ilmoitetaan keskiarvona tai mediaanina ja vaihteluvälinä. Vertailu tehtiin verrannollisten parien t-testillä. Lupa rekisteritutkimukseen anottiin johtajaylilääkäriltä.
Tulokset
Potilasaineisto
Kaikkiaan 741 potilaan potilaskertomukset käytiin läpi. Tutkimukseen otettiin vain ne, joilla lisämunuaiskasvaimen löytyminen katsottiin olevan sattumaa, jolloin tutkimuksen otokseen tuli 451 potilasta. Heistä miehiä oli 209 (46 %) ja naisia 242 (54 %). Keski-ikä oli 61,7 vuotta (27–89 v) (taulukko 2).
Radiologiset löydökset
Lisämunuaisinsidentaloomat löydettiin useimmiten TT-kuvauksella (n = 367, 81 %). Kaikututkimuksella kasvain löydettiin 59 ja magneettikuvauksella 25 potilaalta. Kaikututkimuksessa löydetyt kasvaimet kuvannettiin myöhemmin joko natiivi-TT:lla tai magneettikuvauksella.
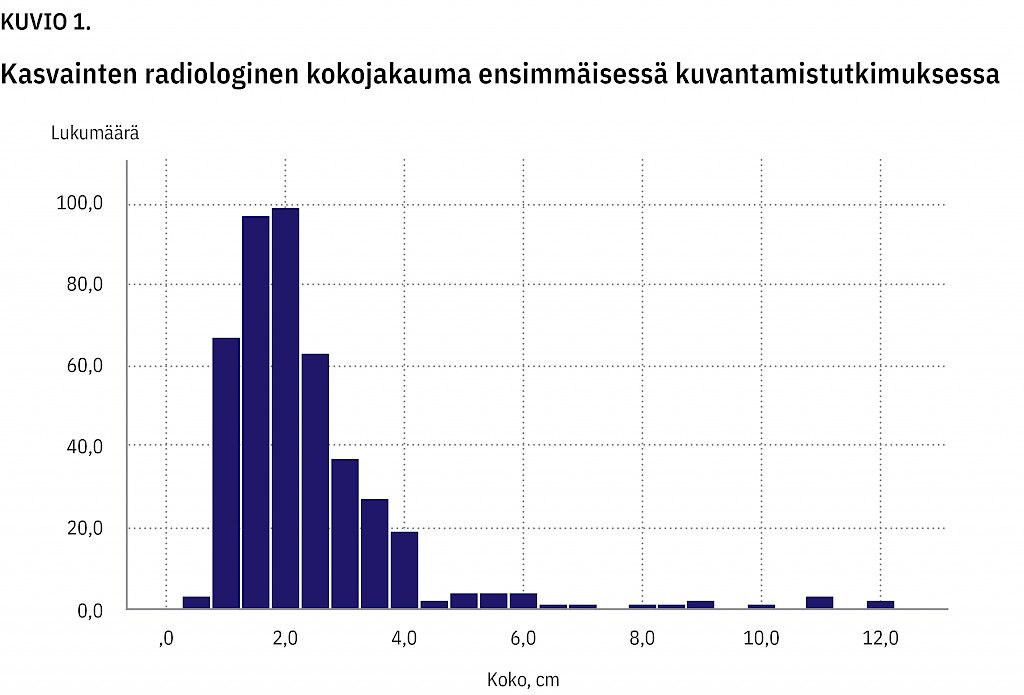
Kasvaimista 219 sijaitsi vasemmalla (49 %), 159 oikealla (35 %) ja 73 bilateraalisesti (16 %) . Ne olivat läpimitaltaan keskimäärin 2,4 cm:n kokoisia (0,5–12 cm). Bilateraalisista valittiin tilastolliseen käsittelyyn suurin kasvain. Radiologisesti määritettyjen kokojen jakauma ensimmäisessä kuvantamistutkimuksessa on esitetty kuviossa (kuvio 1).
Potilaita kuvattiin keskimäärin 2,3 kertaa (1–7 kertaa), ja 380 potilasta kuvattiin kahdesti tai useammin. Seuranta-ajan mediaani ensimmäisen ja viimeisen kuvauksen välillä oli 226 päivää (0–3 200 päivää).
101 potilaan (27 %) insidentaloomassa havaittiin kasvua, jonka mediaani oli 0,2 cm (0,1–4,0 cm). Suurin kasvu liittyi kuorikerroksen karsinoomaan. 128 (33,7 %) potilaan kasvaimessa todettiin pienenemistä, jonka mediaani oli 0,3 cm (0,1–5,4 cm). Suuret koon muutokset johtuivat hematoomien resorboitumisesta.
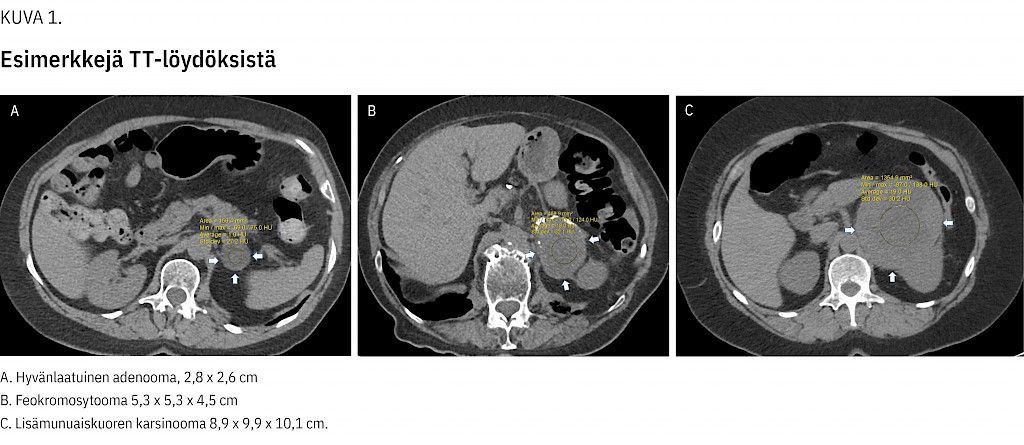
Radiologiseksi diagnoosiksi ensimmäisen kuvauksen tai seurantakuvausten (TT tai MK) perusteella saatiin 347 adenoomaa (77 %), muita hyvänlaatuisia muutoksia 19 (4,2 %, lipoomia, kystia ja hematoomia), pahanlaatuisia kasvaimia 10 (2,2 %, neljä etäpesäkettä), 2 feokromosytoomaa (0,4 %) ja epäselviä 73 (16 %) (kuva 1).
Kasvaimista 263:sta oli käytettävissä tiheysarvo (taulukko 2). Alle 20 HU:n tiheyksisistä kasvaimista ei löytynyt yhtään pahanlaatuista primaarikasvainta.
Jo kasvaimen löytäneen TT-kuvauksen perusteella adenoomiksi lausuttiin 157 insidentaloomaa. Niistä 113:a seurattiin kuvantaen ja 110 (97 %) jäi seurannassa radiologisesti adenoomiksi. Kolmesta muuttuneesta diagnoosista yksi vaihtui epävarmaksi (todennäköisesti vähälipidinen adenooma) ja kaksi paljastui etäpesäkkeiksi potilailla, joilla oli jo ennestään syöpähistoriaa. Alkuvaiheessa adenoomiksi lausuttuja kasvaimia kuvattiin keskimäärin 2,5 kertaa (2–6 kertaa) eivätkä ne seurannan (mediaani 291 pv) aikana kasvaneet.
Hormonaalinen aktiivisuus
Kortisolineritystä oli mitattu 419 potilaalta (93 %), ja 42:lla (10 %) se katsottiin poikkeavaksi. Heistä 10 (24 %) leikattiin.
Feokromosytooman poissulkemiseksi katekoliamiinitutkimukset tehtiin 431 potilaalle (96 %). Näissä tulos oli poikkeava 10 potilaalla (2,3 %). Aldosteronooman poissulkemiseksi määritykset tehtiin 101 (22 %) potilaalle, joista yhdelläkään ei ollut hyperaldosteronismia.
Androgeenipitoisuuksia mitattiin 227 (50 %) potilaalta, joista naisia oli 169 (74 %). Heistä kolmella pitoisuudet olivat yli viitealueen.
Yksikään lähtötilanteessa hormonaalisesti toimimaton kasvain ei muuttunut seurannassa hormonaalisesti aktiiviseksi.
Histologiset löydökset
Insidentaloomista 37 (8 %) leikattiin. Leikatut kasvaimet olivat radiologisesti kookkaampia, keskimäärin 5,5 cm:n läpimittaisia (1,1–12,0 cm).
Adenoomia oli 12 (32 %), feokromosytoomia 10 (27 %, yksi oli selkeästi pahanlaatuinen), kortikaalisia karsinoomia 5 (14 %), etäpesäkkeitä 2 (keuhkoperäinen adenokarsinooma ja karsinosarkooma), lipoomia 2, ganglioneuroomia 2, hemangioomia 2, myelolipoomia ja schwannoomia 1 (taulukko 2). Kahdella naisella, joilla todettiin poikkeavat androgeenipitoisuudet, oli kortikaalinen karsinooma.
Radiologisten ja histologisten tietojen vertailu
Leikatuista kasvaimista puolesta (19/37) oli tiedossa tiheysarvot ja puolesta kasvaimen luonnetta arvioitiin kuvaillen. Yli 20 HU:n tiheyksisissä leikatuista kasvaimista (n = 11) adenoomia oli 2, feokromosytoomia 5 ja kortikaalisia karsinoomia, lipoomia, adenokarsinoomia ja hemangioomia kutakin 1. Radiologisten ja histologisten diagnoosien vastaavuutta on vertailtu taulukossa (taulukko 3).
Pohdinta
Selvitimme Pohjois-Pohjanmaan sairaanhoitopiirin potilailta vuosina 2003–2013 löydettyjen lisämunuaisinsidentaloomien luonnetta ja arvioimme tutkimus- ja seurantakäytäntöjä.
Insidentalooma löytyi 451 potilaalta (taulukko 2). Radiologisesti niistä valtaosa eli 77 % luokiteltiin adenoomiksi. Kortikaalisia karsinoomia (1,1 %), etäpesäkkeitä (1,3 %) ja feokromosytoomia (2,2 %) löytyi vähemmän kuin yleensä on raportoitu (3,4,6). Primaaristen kortikaalisten karsinoomien osuus insidentaloomista on tutkimuksissa ollut 1,9–5 % ja etäpesäkkeiden osuus 0,7–2,5 %. Kliinisesti hiljaisia feokromosytoomia on ollut 3–5 % (4,5,9,10).
Feokromosytoomien pieni määrä voi selittyä niille altistavien geneettisten oireyhtymien (esim. MEN2) harvinaisuudesta alueellamme. Kortikaaliset karsinoomat löytyivät keskimäärin nuoremmilta potilailta (keski-ikä 51 v) kuin insidentaloomat (keski-ikä 62 v). Karsinoomat olivat jo löytöhetkellä kookkaita (6–12 cm), mikä on yhteneväinen tulos aiempien tutkimusten kanssa (5,11).
Huomioitavaa on, että alle 20 HU:n tiheyksisistä kasvaimista ei löytynyt yhtään pahanlaatuista primaarikasvainta. Lisäksi ensimmäisessä natiivi-TT-kuvauksessa adenoomiksi lausutusta kasvaimesta 97 % jäi seurannassa radiologisesti adenoomiksi.
Tuloksemme ovat sopusoinnussa tuoreiden raporttien (12,13,14) ja ESE:n suosituksen (6) kanssa. ESE suosittaa luokittelemaan lisämunuaiskasvaimet jo ensimmäisellä kuvantamiskerralla joko hyvän- tai pahanlaatuisiksi. Alle 4 cm:n läpimittaiset ja pienitiheyksiset (≤ 10 HU) insidentaloomat sopivat adenoomiksi eikä kontrollikuvauksia tarvita.
Jos hormonaalisesti toimimaton kasvain jää luonteeltaan epäselväksi, suositellaan välitöntä kontrollikuvausta toista menetelmää käyttäen tai kuvauskontrollia 6–12 kuukauden kuluttua tai välitöntä leikkaushoitoa. Päätös tulisi tehdä moniammatillisessa työryhmässä (6). Uusimmassa eurooppalaisessa, prospektiivisessa tutkimuksessa ehdotetaan vielä tiheysrajan nostoa tasolle 20 HU (15), mikä on sopusoinnussa tutkimustuloksemme kanssa.
Lähtötilanteen perusteella hyvänlaatuisiksi todettujen adenoomien pitkäaikaisseurannasta on tuoreen kustannus-hyötyanalyysin perusteella järkevää luopua (16).
Feokromosytoomien tiheysarvot olivat suuremmat kuin adenoomien, mikä on linjassa sen käsityksen kanssa, että alle 10 HU:n tiheys natiivikuvassa sulkee pois feokromosytooman (13,17,18,19,20,21). ESE suosittaa, että alle 10 HU:n tiheyksisten ja natiivi-TT-kuvauksessa homogeenisiltä näyttävien insidentaloomien rutiininomaisesta katekoliamiinien mittaamisesta luovutaan (6). Feokromosytoomat olivat myös kooltaan adenoomia suurempia, mikä on yhteneväinen tulos aiempien tutkimusten kanssa (18,19,20,21).
TT:lla mitattujen tiheysarvojen mittauksissa on tunnettuja rajoitteita, jotka on otettava huomioon tuloksia tulkittaessa (7) etenkin niillä potilailla, joilla on suhteellisen tuore syöpähistoria.
Liiallista kortisolineritystä todettiin 10 %:lla potilaista, mikä on suuruusluokaltaan samankaltainen osuus kuin useimmissa tutkimuksissa (5,9). Hormonaalista aktiivisuutta tutkittaessa kortisolituotannon selvittely on keskeistä, koska subkliininen Cushingin oireyhtymä on suhteellisen yleinen (5–30 %) (5,22) ja se voi aiheuttaa merkittäviä haittoja, kuten hypertensiota, hyperglykemiaa, obesiteettia ja osteoporoosia.
Tutkimuksessamme naisilla normaalia suuremmat androgeenipitoisuudet assosioituivat kortikaaliseen karsinoomaan. Vastaavasti laajassa kortikaalisten karsinoomien aineistossa 15 %:lla potilaista todettiin hyperandrogenismi (23). ESE ehdottaakin sukupuolihormoneja tarkistettavaksi vain, jos on herännyt epäily pahanlaatuisuudesta (6). Aineistossamme ei löytynyt yhtään varmuudella aldosteronia erittävää adenoomaa, mikä vahvistaa sattumalta löydettyjen aldosteronoomien harvinaisuutta (5,9).
Lopuksi
Tutkimuksemme vahvuutena on alueellisesti kattava, pitkällä aikavälillä (10 v) kerätty suurehko aineisto. Retrospektiivisen luonteen ja vaihtelevien käytäntöjen vuoksi seurantavaihtoehtojen vertailu ei ollut mahdollista, etenkään hormonaalisen seurannan osalta.
Tuloksemme korostaa tiheysarvojen merkitystä kliinisessä päätöksenteossa ja vahvistaa päätelmää siitä, että alle 10 HU:n tiheyksisten insidentaloomien katekoliamiinimittauksista ja alkuvaiheessa adenoomiksi lausuttujen, enimmillään 4 cm:n läpimittaisten kasvainten rutiininomaisesta kuvantamisseurannasta voidaan luopua, jos potilaalla ei ole tuoretta syöpäanamneesia,. Prospektiiviset tutkimukset tuovat seurantalinjauksiin vielä lisäselvyyttä.
Minna Koivikko, Tuukka Itkonen, Juho Jaakola, Eija Pääkkö, Pasi Salmela, Tapani Ebeling: Ei sidonnaisuuksia.
- 1
- Sherlock M, Scarsbrook A, Abbas A ym. Adrenal incidentaloma. Endocrine Rev 2020;41:1–46.
- 2
- Kebebew E. Adrenal incidentaloma. N Engl J Med 2021;384:1542–51.
- 3
- Sane T, Schalin-Jäntti C, Raade M. Lisämunuaisten insidentalooma – miten laajat tutkimukset ovat tarpeen? Suom Lääkäril 2012;67:2979–80.
- 4
- Arnaldi G, Boscaro M. Adrenal incidentaloma. Best Pract Res Clin Endocrinol Metab 2012;26:405–19.
- 5
- Terzolo M, Stigliano A, Chiodini I ym. AME position statement on adrenal incidentaloma. Eur J Endocrinol 2011;164:851–70.
- 6
- Fassnacht M, Arlt W, Bancos I ym. Management of adrenal incidentalomas: European Society of Endocrinology clinical practice guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol 2016;175:G1–34.
- 7
- Johnson PT, Morton KM, Fishman ET. Adrenal imaging with multidetector CT: evidence-based protocol optimization and interpretative practice. Radiographics 2009;29:1319–31.
- 8
- Blake MA, Cronin CG, Boland GW. Adrenal imaging. AJR Am J Roentgenol 2010;194:1450–80.
- 9
- Nieman LK. Approach to the patient with an adrenal incidentaloma. J Clin Endocrinol Metab 2010;95:4106–13.
- 10
- Cawood TJ, Hunt PJ, O'Shea D ym. Recommended evaluation of adrenal incidentalomas is costly, has high false-positive rates and confers a risk of fatal cancer that is similar to the risk of the adrenal lesion becoming malignant; time for a rethink? Eur J Endocrinol 2009;161:513–27.
- 11
- Mantero F, Terzolo M, Arnaldi G ym. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab 2000;85:637–44.
- 12
- Schalin-Jäntti C, Raade M, Hämäläinen E, Sane T. A 5-year prospective follow-up study of lipid-rich adrenal incidentalomas: no tumor growth or development of hormonal hypersecretion. Endocrinol Metab 2015;30:481–7.
- 13
- Marty M, Gaye D, Perez P ym. Diagnostic accuracy of computed tomography to identify adenomas among adrenal incidentalomas in an endocrinological population. Eur J Endorcrinol 2018;178.439–46.
- 14
- Kahramangil B, Kose E, Remer EM ym. A modern assessment of cancer risk in adrenal incidentalomas: analysis of 2219 patients. Ann Surg 2022;275(1):e238–e244. doi: 10.1097/SLA.0000000000004048
- 15
- Bancos I, Taylor AE, Chortis V ym. Urine steroid metabolomics for the differential diagnosis of adrenal incidentalomas in the EURINE-ACT study: a prospective test validation study. Lancet Diabetes Endocrinol 2020;8:773–81.
- 16
- Chomsky-Higgins,K, Seib C, Rochefort H ym. Less is more: cost-effectiveness analysis of surveillance strategies for small, nonfunctional, radiographically benign adrenal incidentalomas. Surgery 2018;163:197–204.
- 17
- Kannan S, Remer EM, Hamrahian AH. Evaluation of patients with adrenal incidentalomas. Curr Opin Endocrinol Diabetes Obes 2013;20:161–9.
- 18
- Sane T, Schalin-Jantti C, Raade M. Is biochemical screening for pheochromocytoma in adrenal incidentalomas expressing low unenhanced attenuation on computed tomography necessary? J Clin Endocrinol Metab 2012;97:2077–83.
- 19
- Szolar DH, Korobkin M, Reittner P ym. Adrenocortical carcinomas and adrenal pheochromocytomas: mass and enhancement loss evaluation at delayed contrast-enhanced CT. Radiology 2005;234:479–85.
- 20
- Buitenwerf E, Korteweg T, Visser A ym. Unenhanced CT imaging is highly sensitive to exclude pheochromocytoma: a multicenter study. Eur J Endocrinol 2018;178:431–7.
- 21
- Canu L, Van Hemert JAW, Kerstens MN ym. CT characteristics of pheochromocytoma: relevance for the evaluation of adrenal incidentaloma. J Clin Endocrinol Metab 2019;104:312–8.
- 22
- Zavatta G, Di Dalmazi G. Recent advances on suclinical hypercortisolism. Endocrinol Metab Clin North Am 2018;44:375–83.
- 23
- Ayala-Ramirez M, Jasim S, Feng L ym. Adrenocortical carcinoma: clinical outcomes and prognosis of 330 patients at a tertiary care center. Eur J Endocrinol 2013;169:891–9.
Most adrenal incidentalomas do not require routine follow-up
Background Increased used of computerized tomography (CT) imaging has led to an increased number of incidentally found adrenal masses. Guidelines for management of adrenal incidentalomas have been extensive and inconsistent.
Methods We examined the biochemical characteristics and unenhanced density of adrenal incidentalomas in the Northern Ostrobothnia Hospital District in 2003–2013.
Results In this retrospective study, 451 adult patients with incidentally found adrenal tumours were identified. Of these tumours, 352 (78.0%) were adenomas, 10 (2.2%) phaeochromocytomas, 5 (1.1%) cortical carcinomas and 6 (1.3%) metastases. In the group of low attenuation (< 20 Hounsfield units, HU), none of the patients had a primary adrenal malignancy. The attenuation value was > 25 HU in all phaeochromocytomas. If the adrenal tumour was classified as an adenoma in the initial imaging, no growth or malignant transformation was observed if the patient did not have an earlier history of malignancy.
Conclusion Our results are consistent with the European Society of Endocrinology Clinical Practice Guideline. When a small (≤ 4 cm), hormonally inactive adrenal incidentaloma with an unenhanced attenuation ≤ 10 HU is found, further routine follow-up is not needed.
Minna Koivikko, Tuukka Itkonen, Juho Jaakola, Eija Pääkkö, Pasi Salmela, Tapani Ebeling
Minna Koivikko
M.D., Ph.D.
University of Oulu and Oulu University Hospital