Suuren uusiutumisriskin melanoomapotilaiden kuvantamisseuranta kannattaa
Lähtökohdat Melanooman kuvantamisseurantasuositukset eivät ole kansainvälisesti yhdenmukaisia. Tutkimuksessamme kuvataan, miten melanooman uusiutumiset havaittiin TAYS:ssa.
Menetelmät Aineistona olivat TAYS:n syövänhoidon vastuualueelle 2012–2014 lähetetyt levinneisyysasteiden I–III ihomelanoomapotilaat (n = 100). Potilaiden mediaaniseuranta-aika oli 2,9 vuotta.
Tulokset Seuranta-aikana 31 %:lla potilaista melanooma uusiutui ja uusiutumia todettiin yhteensä 46. Kaukometastasoinneista 60 % todettiin seurantakuvauksissa ja vain 28 % oireperusteisissa kuvauksissa. Paikallisuusiutumia havaittiin lähes yhtä paljon molemmissa kuvauksissa (38 % ja 42 %). Suurin osa imusolmukealueen uusiutumista todettiin kaikukuvauksella (52 %) ja valtaosa kaukometastaaseista TT-kuvauksella (72 %).
Päätelmät Kolmannes suuren uusiutumisriskin melanoomista uusiutui kolmen vuoden aikana, joten näiden potilaiden seuranta erikoissairaanhoidossa on perusteltua. TT-kuvaus on suositeltava leviämisen havaitsemiseksi varhaisemmin, jolloin taudinkulkuun voidaan vaikuttaa tehokkailla lääkehoidoilla.

Uusia ihomelanoomia todettiin Suomessa vuonna 2016 yhteensä 1 947. Kaikki levinneisyysasteet huomioiden suhteellinen viiden vuoden elossaolo-osuus on lähes 90 % (1).
Tärkeimmät ennustetekijät diagnoosivaiheessa ovat melanooman paksuus (millimetreinä, Breslow’n mitta), haavautuminen sekä levinneisyys lähi-imusolmukkeisiin tai muualle. Myös intralymfaattiset lähipesäkkeet (in-transit-metastaasit ja satelliitit) heikentävät ennustetta. Nämä tekijät määräävät levinneisyysasteen American Joint Committee on Cancer (AJCC) levinneisyysasteluokittelussa. (2) Lisäksi miessukupuoli, korkea ikä ja syövän sijainti vartalolla, pään alueella tai kaulalla heikentävät ennustetta (3).
Suurin osa taudin uusiutumista todetaan ensimmäisten 2–3 vuoden aikana, mutta harvinaisissa tapauksissa vasta kymmenenkin vuoden kuluttua (4,5). Melanooma voi uusiutua paikallisesti tai metastasoida alueellisiin imusolmukkeisiin tai kauemmaksi. Korkean levinneisyysasteen melanooma uusiutuu todennäköisemmin kaukometastaaseina (6,7).
Melanoomalle ei ole kansainvälisesti yhdenmukaisia kuvantamisseurantasuosituksia. Suositukset pohjautuvat pitkälti sairauden levinneisyysastekohtaiseen uusiutumisriskiin, retrospektiivisiin tutkimuksiin ja asiantuntijamielipiteisiin. Yhteistä suosituksille on intensiivisempi kuvantamisseurannan tarve korkeamman levinneisyysasteen taudissa (8,9,10,11).
Tämän tutkimuksen tavoitteena oli kuvata, kuinka suuri osa melanooman uusiutumisista havaittiin seurantaohjelman rutiinikuvauksissa ja kuinka suuri osa oirelähtöisissä kuvauksissa.
Aineisto ja menetelmät
Aineistonamme oli Tampereen yliopistollisen sairaalan syövänhoidon vastuualueelle vuosina 2012–2014 lähetteellä tulleet melanoomapotilaat, joita oli yhteensä 190. Poissulkukriteereitä olivat levinneisyysasteen IV tauti, lyhyt seuranta-aika (< 2,5 kk), melanooma limakalvolla, seuranta muualla tai muu samanaikainen syöpäsairaus. Jäljelle jäi 100 potilasta, joista kerättiin seurantatiedot.
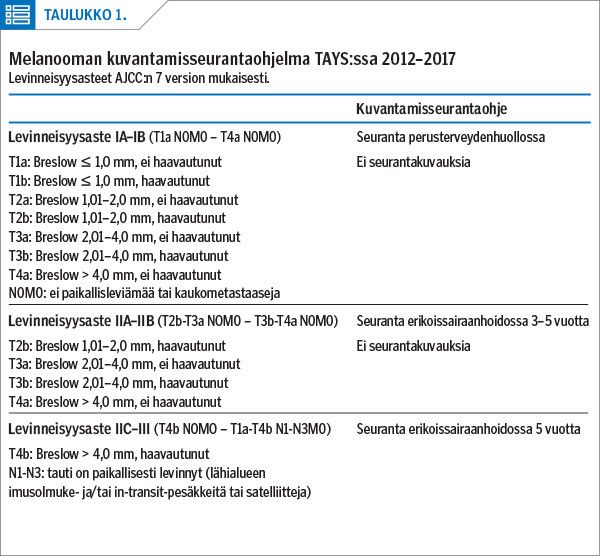
Ihomelanooman levinneisyysaste luokiteltiin tutkimuksen seurantavuosina käytössä olleen AJCC:n seitsemännen version mukaisesti sekä nykyisin käytössä olevan kahdeksannen version mukaisesti, jotta tulokset olisivat hyödynnettävissä prospektiivisesti (2,12). Tauti oli histologisesti varmistettu ja tarvittavat leikkaukset tehty ennen seurannan aloittamista. Seuranta ja kuvaukset tapahtuivat TAYS:ssa 2012–2017 käytössä olleen seurantaprotokollan mukaisesti (taulukko 1).
Luokittelimme potilaista lähetepäivämäärästä alkaen TAYS:ssa tehdyt kuvantamistutkimukset seuraavasti:
a) seurantaohjelman kuvaukset
b) oire- tai löydösperusteiset kuvaukset
c) ylimääräiset kuvaukset
d) toisen erikoisalayksikön kuvaukset.
Seurantaprotokollan mukaisesti rutiinikuvantaminen oli aiheellista vain levinneisyysasteissa IIC–IIIC. Kuvauksista analysoitiin päivämäärät ja löydökset sekä jatkotutkimukset. Vääriksi positiivisiksi löydöksiksi määriteltiin epäilyttävät löydökset, jotka eivät jatkotutkimuksissa osoittautuneet syöpään liittyviksi.
Sairauden uusiutuminen luokiteltiin paikalliseksi tai kaukometastasoinniksi. Paikallisiksi uusiutumiksi tulkittiin melanooman uusiutuminen primaariarven alueella, in-transit-metastaaseina tai lähi-imusolmukkeissa. Jos samanaikaisesti todettiin sekä paikallinen uusiutuma että kaukometastasointi, huomioitiin vain jälkimmäinen. Potilaan seuranta-aika päättyi kaukometastaasin toteamiseen, potilaan seurannan siirtyessä muualle tai tutkimuksen seuranta-ajan päättymiseen.
Ristiintaulukoinnit, frekvenssijakaumat ja taudittoman elossaoloajan kuvaaja Kaplan–Meier-menetelmällä tehtiin SPSS-ohjelman versiolla 25.
Tulokset
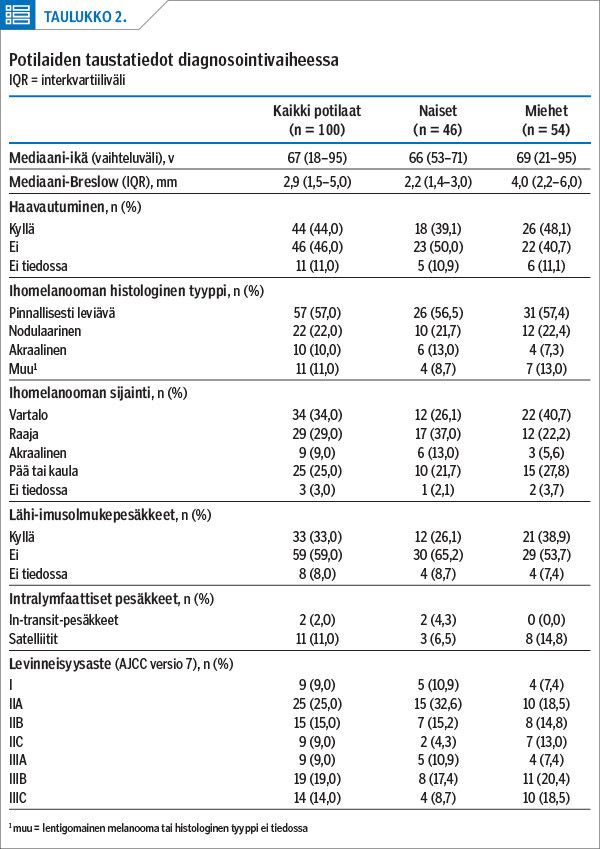
Potilaiden mediaaniseuranta-aika oli 2,9 vuotta (kvartiiliväli 1,4–3,6 v); taustatiedot esitellään taulukossa 2. Miesten melanoomissa todettiin diagnoosivaiheessa enemmän ennustetta heikentäviä tekijöitä. Pinnallisesti leviävä melanooma oli kummallakin sukupuolella yleisin histologinen alatyyppi.
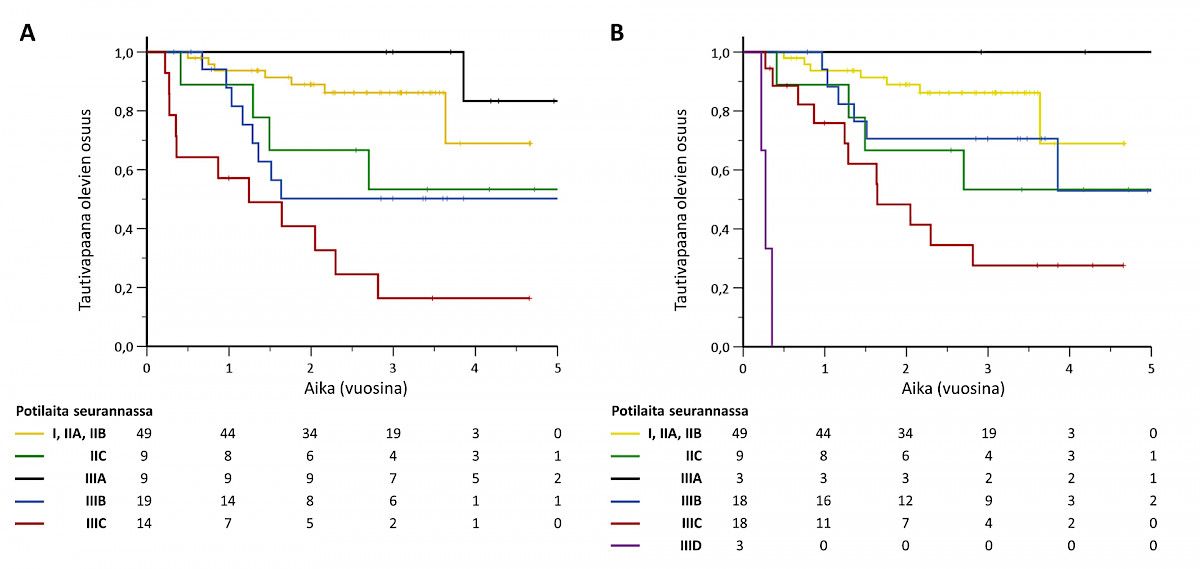
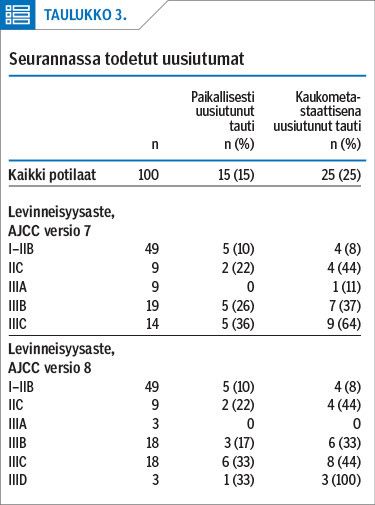
Seuranta-aikana 31 potilaan melanooma uusiutui (taulukko 3). Yhteensä uusiutumia todettiin 46 (25 kaukometastasointia, 21 paikallisuu-siutumaa). Uusiutumia todettiin eniten levinneisyysasteissa IIC ja III, lukuun ottamatta levinneisyysasteluokkaa IIIA. Melanooma uusiutui nopeammin potilailla, joilla oli lähtötilanteessa korkeampi levinneisyysaste (kuvio 1). Kaukometastaaseja todettiin keuhkoissa (n = 17), maksassa (n = 8), kaukoimusolmukkeissa (n = 3), keskushermostossa (n = 3) ja luustossa (n = 1).
Melanooman uusiutumista 23 (50 %) todettiin seurantakuvauksessa, 16 oireperusteisessa kuvauksessa ja 3 ylimääräisessä kuvauksessa. Neljällä potilaalla uusiutuminen todettiin kuvauksen sijaan seurantakäynnillä kliinisen tilan ja biopsian perusteella.
Kaukometastaaseista suurin osa, 15 (60 %) todettiin seurantakuvauksessa ja 7 oirelähtöisessä kuvauksessa. Paikallisuusiutumia todettiin lähes yhtä paljon seurantakuvauksessa ja oireperusteisessa kuvauksessa (8 vs. 9).
Tietokonetomografiatutkimuksissa todettiin kaukometastaaseista 18 (72 %), keuhkojen röntgenkuvauksessa 3 ja vatsan kaikututkimuksessa 1. Vastaavasti suurin osa paikallisuusiutumista todettiin paikallisen imusolmukealueen kaikututkimuksessa (n = 11) ja toiseksi eniten TT-kuvauksessa (n = 6). Kaikkiaan 124 TT-kuvauksesta 19 % johti paikallisuusiutuman tai kaukometastaasin toteamiseen.
Seuranta-aikana potilaille tehtiin 779 kuvantamistutkimusta, joista suurin osa (n = 446, 57 %) oli seurantatutkimuksia. Ylimääräisiä kuvantamistutkimuksia kertyi 205 (26 %) ja oireperusteisia 94 (12 %); 34 (4,4 %) oli muiden erikoisalaklinikoiden ohjelmoimia. Lähes 70 % oireperusteisista kuvantamisista tehtiin levinneisyysasteissa IIC–IIIC. Yleisimpiä kuvantamismenetelmiä olivat paikallisten imusolmukealueiden kaikukuvaus (n = 233, 30 %) ja keuhkojen röntgenkuvaus (n = 223, 29 %). TT-tutkimuksia kertyi 124 (16 %), mukaan lukien 21 positroni-emissiotomografiatutkimusta (PET-TT).
Vähintään yksi väärä positiivinen kuvantamislöydös todettiin 49 potilaalla. Vääriä positiivisia löydöksiä todettiin paikallisten imusolmuke-alueiden kaikututkimuksissa yhteensä 26 (11 % kyseisistä kaikututkimuksista), TT-kuvauksissa 23 (19 % TT-kuvista), vatsan kaikututkimuksissa 18 (10 % vatsan kaikututkimuksista) ja keuhkoröntgenkuvauksissa 14 (6 % keuhkokuvauksista). Imusolmukealueen kaikututkimuksessa todettu väärä positiivinen löydös oli usein epäselvä niukkakaikuinen muutos tai edellisestä tutkimuksesta kasvanut imusolmuke.
Yleensä kuvantamislöydös johti myös johonkin jatkotutkimukseen. Väärä positiivinen löydös johti 22 lisäkuvantamiseen, 34 kontrollikuvantamiseen ja 10 biopsiaan. Yhdellä potilaalla väärä positiivinen löydös johti solunsalpaajahoitoon, joka myöhemmin keskeytettiin.
Pohdinta
Vajaan kolmen vuoden mediaaniseuranta-aikana 31 %:lla TAYS:ssa seurannassa olleista melanoomapotilaista todettiin melanooman uusiutuminen. Suuren uusiutumisriskin potilaiden seuranta on tarkoitus keskittää erikoissairaanhoitoon. Näin lyhyellä seuranta-ajalla melanooman uusiutuminen lähes kolmanneksella kuvastaa sitä, että erikoissairaanhoitoon – ja tähän tutkimukseen – valikoituneilla potilailla uusiutumisriski on suuri.
Tutkimuksessamme merkittävin osa melanooman uusiutumista todettiin seurantaohjelman kuvauksissa (50 %) ja vain hieman yli kolmasosa oireperusteisissa kuvauksissa. Aiemmissa seurantatutkimuksissa melanooman uusiutumista 33–67 % todettiin oirelähtöisissä kuvauksissa (7,13,14,15). Suurella osalla (47–63 %) melanoomapotilaista kaukometastaattinen tauti on toteamisvaiheessa kuitenkin oireeton, jolloin uusiutuminen havaitaan todennäköisemmin rutiiniseurannassa (6,7). Oire tai kliininen löydös johti todennäköisemmin paikallisuusiutuman kuin metastaattisen taudin toteamiseen tässä ja aiemmissakin seurantatutkimuksissa (7,13,14,15).
Tutkimuksemme seuranta-aikana levinneisyysasteen IIA melanooman seuranta toteutettiin erikoissairaanhoidossa. Sen jälkeen TAYS:n seurantaohjelmaa on päivitetty, ja levinneisyysasteen IIA melanooman seuranta on nykyisin perusterveydenhuollon vastuulla (16). Tutkimuksessamme levinneisyysasteen IIA melanooman uusiutumisriski oli huomattavasti pienempi kuin levinneisyysasteissa IIB–IIIC, joten tuloksemme vahvistaa nykyistä seurantasuosituskäytäntöä. Levinneisyysasteiden IIB–III taudin seurantaohjelma on pysynyt lähes ennallaan, joten tutkimustuloksemme on hyödynnettävissä myös nykyisen seurantaohjelman aikana (16).
Melanoomapotilaita seurataan useilla kuvantamismenetelmillä, joiden herkkyys ja tarkkuus etäpesäkkeiden löytämisessä vaihtelevat. Eräässä meta-analyysissä kaikututkimuksen on todettu olevan herkin ja tarkin osoittamaan imusolmukepesäkkeet (mediaaniherkkyys 96 % ja -tarkkuus 99 %) ja PET-TT löytää parhaiten kaukometastaasit (mediaaniherkkyys 86 % ja -tarkkuus 91 %) (16). Keuhkoröntgenkuvaukseen on havaittu liittyvän suurehko väärien positiivisten löydösten mahdollisuus (herkkyys 48 %, tarkkuus 78 %) (18,19). Tässä ja aiemmissakin tutkimuksissa suurin osa kaukometastaaseista todettiin TT-kuvauksessa ja valtaosa paikallisuusiutumista imusolmukealueen kaikututkimuksessa (13,20).
Kaikukuvaus oli käytetyin kuvantamistutkimus, ja samalla se tuotti melko paljon vääriä positiivisia löydöksiä. Vatsan kaikututkimus on aiemminkin osoittautunut melko tehottomaksi kuvantamistavaksi melanooman seurannassa (19,21), ja tässä tutkimuksessa 183 vatsan kaikututkimusta johti yhden uusiutuman toteamiseen. Kaikututkimuksella löydettiin kuitenkin yli puolet imusolmukkeiden paikallisuusiutumista.
Keuhkojen röntgenkuvaus oli toiseksi yleisin kuvantamistapa ja se tuotti vähiten vääriä positiivisia löydöksiä. Sillä havaittiin kuitenkin vain kolme uusiutumaa, vaikka keuhkot olivat yleisin metastaasikohde-elin.
Melanooman kirurginen hoitokäytäntö muuttui vuonna 2018, kun rutiininomaisesta imusolmuke-evakuaatiosta vartijaimusolmukemetastasoinnin toteamisen jälkeen luovuttiin (22). Hoitokäytännön muutos pohjautuu MSLT-II- ja DeCOG-tutkimuksiin (23,24). Potilailla, joille ei tehty imusolmuke-evakuaatiota, todettiin enemmän paikallisuusiutumia, mutta kokonaiselossaoloajassa ei ollut eroja. Leikkauskäytännön muututtua konservatiivisemmaksi imusolmukealueita on seurattava tarkemmin.
Melanooman uusia lääkehoitovaihtoehtoja ovat immunologiset vasta-aineet ja täsmälääkkeet. Vuoden kestävä liitännäishoito joko immunoterapialla tai täsmälääkkeillä on parantanut suuren uusiutumisriskin potilaiden ennustetta (25,26,27). Lisäksi nämä lääkehoidot ovat parantaneet levinneen melanooman ennustetta huomattavasti ja potilaiden mediaanielossaoloaika on 2–3-kertaistunut (28,29).
Näillä lääkehoidoilla potilaan ennuste on parempi, jos taudin leviäminen todetaan varhaisessa vaiheessa, kun metastaasipaikkoja on vähän, tuumorimassa on pieni ja plasman laktaattidehydrogenaasipitoisuus on pieni (30,31,32). Suurin osa tutkimuksessamme todetuista kaukometastaaseista oli oireettomia (60 %), jolloin leviämisen toteaminen varhaisemmassa vaiheessa voi parantaa näiden potilaiden ennustetta. Seurantaohjelmaa mukautetaan harkinnan mukaan huomioiden potilaan kokonaistilanne ja edellytykset aktiiviseen syöpälääkehoitoon taudin uusiutuessa.
Metastaasien toteaminen varhaisessa vaiheessa on yhä tärkeämpää, sillä uusien lääkehoitojen ansiosta osa potilaista saa jopa vuosien hoitovasteen (33). Tämä tutkimus tukee suuren uusiutumisriskin potilaiden kuvantamisseurannan nykykäytäntöä (16). Kuvantamismenetelmistä vatsan kaikututkimus ja keuhkojen röntgenkuvaus eivät juurikaan johtaneet uusiutumisten toteamiseen. Tämän vuoksi suosittelemme suuren uusiutumisriskin potilaiden seurantaa TT-kuvauksin ja tarpeen mukaan paikallisten imusolmukealueiden kaikututkimuksin.
Maiju Anttila, Pirkko-Liisa Kellokumpu-Lehtinen: Ei sidonnaisuuksia.
Leena Tiainen: Advisory Board (BMS, Ibsen, MSD, Roche, Sanofi-Genzyme), luentopalkkiot (Amgen, BMS, MSD, Pfizer, Roche), kongressikulut laitokselle (Amgen, MSD, Novartis, Pfizer, Pierre-Fabre, Roche, Sanofi-Genzyme).
Meri-Sisko Vuoristo: Luentopalkkiot (Pihlajalinna Oy), kongressimatkakulut (Novartis).
Tämä tiedettiin
Nykyisin levinneisyysasteiden IIB–III melanoomassa suositellaan seurantaa erikoissairaanhoidossa.
Metastaattinen melanooma on varhaisvaiheessa usein oireeton.
Levinneen melanooman varhainen toteaminen voi pidentää potilaan elossaoloaikaa uusien onkologisten hoitovaihtoehtojen ansiosta.
Tutkimus opetti
Levinneisyysasteissa IIB–III uusiutumisriski on suuri.
Levinneisyysasteessa IIA uusiutumat ovat harvinaisia ja seuranta voidaan toteuttaa perusterveydenhuollossa.
Suuren uusiutumisriskin potilaat hyötyvät kuvantamisseurannasta, erityisesti paikallisten imusolmukealueiden kaikututkimuksesta ja TT-kuvauksesta.
- 1
- Syöpätilastot (verkkotietokanta). Suomen syöpärekisteri. https://syoparekisteri.fi/tilastot/tautitilastot/.
- 2
- Balch CM ym. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009;27:6199–206.
- 3
- Balch BCM ym. Prognostic factors analysis of 17,600 melanoma patients: validation of the American Joint Committee on Cancer melanoma staging system. J Clin Oncol 2001;19:3622–34.
- 4
- Rueth NM ym. Long-term follow-up for melanoma patients: is there any evidence of a benefit? Surg Oncol Clin N Am 2015;24:359–77.
- 5
- Faries MB ym. Late recurrence in melanoma: clinical implications of lost dormancy. J Am Coll Surg 2013;217:27–34.
- 6
- Romano E ym. Site and timing of first relapse in stage III melanoma patients: implications for follow-up guidelines. J Clin Oncol 2010;28:3042–7.
- 7
- Lee AY ym. Patterns and timing of initial relapse in pathologic stage II melanoma patients. Ann Surg Oncol 2017;24:939–46.
- 8
- Trotter SC ym. A global review of melanoma follow-up guidelines. J Clin Aesthet Dermatol 2013;6:18–26.
- 9
- Poo-Hwu WJ ym. Follow-up recommendations for patients with American Joint Committee on Cancer stages I-III malignant melanoma. Cancer 1999;86:2252–8.
- 10
- Rueth NM ym. Is surveillance imaging effective for detecting surgically treatable recurrences in patients with melanoma? A comparative analysis of stage-specific surveillance strategies. Ann Surg 2014;259:1215–22.
- 11
- Marciano NJ ym. To what extent are current guidelines for cutaneous melanoma follow up based on scientific evidence ? Int J Clin Pract 2014;68:761–70.
- 12
- Gershenwald JE ym. Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin 2017;67:472–92.
- 13
- Livingstone E ym. Prospective evaluation of follow-up in melanoma patients in Germany – Results of a multicentre and longitudinal study. Eur J Cancer 2015;51:653–67.
- 14
- Berger AC ym. Patient symptoms are the most frequent indicators of recurrence in patients with American Joint Committee on Cancer stage II melanoma. J Am Coll Surg 2017;224:652–9.
- 15
- Meyers MO ym. Method of detection of initial recurrence of stage II/III cutaneous melanoma: snalysis of the utility of follow-up staging. Ann Surg Oncol 2009;16:941–7.
- 16
- Vuoristo M-S ym. Miten ja missä ihomelanoomapotilasta seurataan? Duodecim 2017;133:1199–205.
- 17
- Xing Y ym. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl Cancer Inst 2011;103:129–42.
- 18
- Morton RL, Craig JC, Thompson JF. The role of surveillance chest X-rays in the follow-up of high-risk melanoma patients. Ann Surg Oncol 2009;16:571–7.
- 19
- Hofmann U ym. Primary staging and follow-up in melanoma patients-monocenter evaluation of methods, costs and patient survival. Br J Cancer 2002;87:151–7.
- 20
- Podlipnik S ym. Performance of diagnostic tests in an intensive follow-up protocol for patients with American Joint Committee on Cancer (AJCC) stage IIB, IIC, and III localized primary melanoma: A prospective cohort study. J Am Acad Dermatol 2016;75:516–24.
- 21
- Garbe C ym. Prospective evaluation of a follow-up schedule in cutaneous melanoma patients: recommendations for an effective follow-up strategy. J Clin Oncol 2003;21:520–9.
- 22
- Suomen onkologiayhdistyksen melanoomaryhmä. Primaarimelanooman kirurginen hoito 2018 (päivitetty 21.5.2018). https://www.onkologiayhdistys.fi/fin/alaryhmat/melanoomaryhma/hoitosuositukset/
- 23
- Faries MB ym. Completion dissection or observation for sentinel-node metastasis in melanoma. N Engl J Med 2017;376:2211–22.
- 24
- Leiter U ym. Final analysis of DeCOG-SLT trial: No survival benefit for complete lymph node dissection in patients with melanoma with positive sentinel node. J Clin Oncol 2019;37:3000–8.
- 25
- Hauschild A D ym. Longer follow-up confirms relapse-free survival benefit with adjuvant dabrafenib plus trametinib in patients with resected BRAF V600-mutant stage III melanoma. J Clin Oncol 2018;36:3441–9.
- 26
- Eggermont AMM ym. Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med 2018;378:1789–801.
- 27
- Weber J ym. Adjuvant nivolumab versus ppilimumab in resected stage III or IV melanoma. N Engl J Med 2017;377:1824–35.
- 28
- Ugurel S ym. Survival of patients with advanced metastatic melanoma: the impact of novel therapies–update 2017. Eur J Cancer 2017;83:247–57.
- 29
- Forschner A, ym. Improvement of overall survival in stage IV melanoma patients during 2011-2014: analysis of real-world data in 441 patients of the German Central Malignant Melanoma Registry (CMMR). J Cancer Res Clin Oncol 2017;143:533–40.
- 30
- Schadendorf D ym. Three-year pooled analysis of factors associated with clinical outcomes across dabrafenib and trametinib combination therapy phase 3 randomised trials. Eur J Cancer 2017;82:45–55.
- 31
- Schachter J ym. Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006). Lancet 2017;390:1853–62.
- 32
- Hodi FS ym. Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab alone in advanced melanoma (CheckMate 067): 4-year outcomes of a multicentre, randomised, phase 3 trial. Lancet Oncol 2018;19:1480–92.
- 33
- Hamid O ym. Five-year survival outcomes in patients with advanced melanoma treated with pembrolizumab in KEYNOTE-001. Ann Oncol 2019;30:582–8.
Routine imaging is worthwhile in follow-up of high-risk melanoma patients
Background There is no international consensus on follow-up imaging in cutaneous melanoma. The aim of our study was to examine whether melanoma recurrences were detected by routine follow-up imaging or by symptom-based imaging.
Methods We analysed the methods of recurrence detection for 100 stage I–III melanoma patients referred to the Department of Oncology at Tampere University Hospital during 2012–2014.
Results One third of high-risk melanoma patients had a relapse during the first three years of follow-up. Half (50%) of all the melanoma recurrences were detected by routine imaging and 35% by symptom-based imaging. In the case of systemic recurrences 60% were identified by routine imaging and only 28% by symptoms. Locoregional relapses were detected almost equally by routine and symptom-based imaging (38% vs. 42%). In terms of imaging modalities, systemic relapses were most commonly detected by CT scans (72%) and locoregional recurrences by lymph node ultrasound examinations (52%).
Conclusions Due to the considerable number of recurrences follow-up of stage IIB-III melanoma patients in specialized medical care is justified. New treatment strategies have improved survival in metastatic melanoma. Routine CT imaging and regional US examinations are recommended for high-risk melanoma patients in order to detect recurrences earlier.