Syvä laskimotukos tai keuhkoembolia – mitä taustalta löytyy?
Lähtökohdat Keuhkoembolian ja syvän laskimotukoksen taustalta löytyy riskitekijöitä, jotka eivät aina ole tiedossa potilaan tullessa sairaalaan.
Menetelmät OYS:ssa ensimmäisen keuhkoembolian tai syvän laskimotukoksen takia 1.1.–30.6.2010 tai 1.1.–30.6.2015 hoidettujen yli 16-vuotiaiden potilaiden sairauskertomuksia seurattiin lokakuulle 2017 asti.
Tulokset Vuoden 2010 potilasaineistossa syöpiä löytyi sairaalahoidon aikana 7 %:lta ja seuranta-aikana 5 %:lta, vuoden 2015 aineistossa vastaavasti 5 %:lta ja 6 %:lta. Suurin osa näistä löytyi vuoden kuluessa tromboosista. Vuoden 2010 aineistossa trombofilia löytyi vain 4 %:lta ja 2015 aineistossa 2 %:lta. Erityisesti antikoagulanttihoidon loputtua uusiutumisriski on merkittävä.
Päätelmät Ilman selvää altistetta syntyneen keuhkoembolian tai syvän laskimotukoksen taustalla piilevät syyt kannattaa ainakin kertaalleen selvittää.

Keuhkoemboliat ja syvät laskimotukokset ovat tyypillisiä päivystysongelmia. Tunnettuja altistavia riskitekijöitä ovat pitkä immobilisaatio, vaikea infektio, sydämen vajaatoiminta, aiemmin sairastettu laskimotukos tai keuhkoembolia, ylipaino, leikkaus, raskaus tai estrogeenihoito, yhdistelmäehkäisypillerit, syöpä sekä perinnölliset tai hankinnaiset trombofiliat tai suvun poikkeava tukosalttius (1).
Keuhkoembolia tai syvä laskimotukos voi olla syöpätaudin tai trombofilian ensimmäinen ilmentymä. Tavallisimpia perinnöllisiä trombofilioita ovat hyytymistekijä V:n pistemutaatio (FV Leiden-mutaatio), protrombiinigeenin pistemutaatio (FII G20120A-mutaatio) sekä antitrombiinin ja proteiini C:n ja S:n vajaukset (2). Trombofilian selvittelyihin kuuluu tavallisesti myös fosfolipidivasta-aineiden tutkiminen.
Käypä hoito -suosituksen mukaan trombofilioiden mahdollisuus on tarpeen selvittää, kun idiopaattinen tukos ilmenee nuorella, alle 50-vuotiaalla potilaalla tai kun yli 50-vuotiaalla potilaalla on toistuvia idiopaattisia tukoksia, hänen lähisukulaisellaan on todettu tukoksia tai hänellä on ollut lisäksi valtimotukoksia, toistuvia keskenmenoja tai sikiökuolemia tai kun tukos ilmenee epätyypillisessä paikassa (aivo-, maksa-, perna-, portti-, mesenteriaali- tai munuaislaskimossa) (1).
Ruotsalaisessa aineistossa syöpä löydettiin 13 %:lta syvään laskimotukokseen tai keuhkoemboliaan sairastuneista seurannan aikana (keskimäärin 8,1 v). Eniten syöpiä löytyi ensimmäisen seurantavuoden aikana, 3,4 %:lta (3). Uudemmassa kanadalaisessa aineistossa syövän ilmaantuvuus oli samaa luokkaa, noin 3,9 % ensimmäisen vuoden aikana (4).
Tuoreita suomalaisaineistoja aiheesta ei ole kuvattu, ja siksi halusimme kerätä tietoa siitä, kuinka usein keuhkoembolian tai syvän laskimotukoksen taustalta löytyy syöpä tai trombofilia. Halusimme myös verrata tukosten uusiutumisriskiä vuonna 2010 (pääsääntöisesti varfariinilla hoidettuja) ja vuonna 2015 (mukana myös uudempia antikoagulantteja) sekä tutkia vuotokomplikaatioita hoidon aikana.
Aineisto ja menetelmät
Keräsimme sairauskertomuksista tiedot kaikista yli 16-vuotiaista 1.1.–30.6.2010 ja 1.1.–30.6.2015 OYS:ssa hoidetuista potilaista, jotka ovat sairastaneet ensimmäisen keuhkoembolian tai syvän laskimotukoksen ja jotka asuvat Pohjois-Pohjanmaan sairaanhoitopiirin alueella. Sairauskertomuksia seurattiin lokakuuhun 2017, jotta voitiin tilastoida tukosten uusiutumiset ja seuranta-aikana ilmaantuneet syövät. Seuranta-ajat olivat tällöin 7,2–7,8 vuotta (vuoden 2010 aineisto) sekä 3,2–3,8 vuotta (vuoden 2015 aineisto). Potilaisiin ei oltu yhteydessä henkilökohtaisesti.
Selvitimme, kuinka monelta keuhkoembolia- tai laskimotukospotilaalta on löytynyt joko sairaalahoidon aikana tai sen jälkeisessä seurannassa syöpä tai trombofilia (periytyvä trombofilia tai fosfolipidivasta-aineita). Tukokselle altistaneiden tekijöiden selvittelyä ei ollut tuolloin erikseen sairaalassa ohjeistettu, vaan lääkäreillä oli omat käytäntönsä.
Saimme aineistoa kerätessämme tietoa myös siitä, minkälaisia antikoagulanttihoitoja potilaille oli aloitettu vuonna 2010 ja miten tämä lääkekäytäntö oli muuttunut vuonna 2015, kun varfariinin ja pienimolekyylisten hepariinien rinnalle oli saatu uusia antikoagulantteja.
Aineisto analysoitiin SPSS-ohjelmistolla.
Tulokset
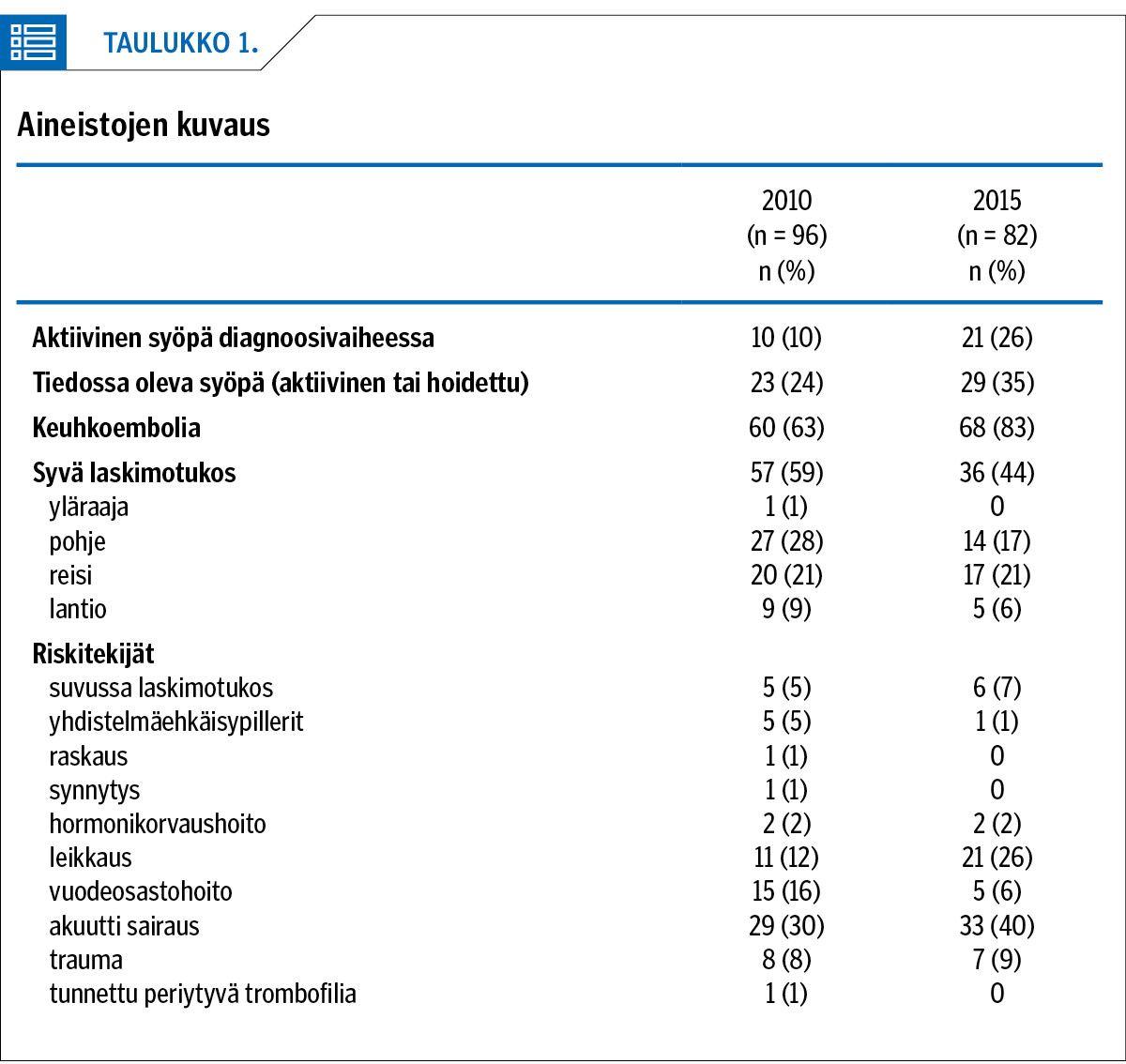
Kahdelta ajanjaksolta kerätyt aineistot (taulukko 1) ovat ikä- ja sukupuolijakaumiltaan sekä riskitekijäprofiililtaan melko samankaltaiset ja hyvin vertailtavissa. Vuoden 2010 aineistossa keski-ikä oli 61,9 vuotta (vaihteluväli 18,8–92,4 v) ja vuoden 2015 aineistossa 66,5 vuotta (25–89). Miehiä oli vuoden 2010 aineistossa 47 % ja vuoden 2015 aineistossa 56 % potilaista.
Tärkeimmiksi riskitekijöiksi nousivat edeltävä leikkaus tai akuutti sairaus (pneumonia, pyelonefriitti sekä akuutit sydäntapahtumat). Vuoden 2010 aineistossa suurempi osa potilaista oli ollut vuodeosastohoidossa ennen keuhkoembolian tai syvän laskimotukoksen diagnoosia (16 % vs. 6 %). Molemmissa aineistoissa näkyy myös trauman aiheuttaman immobilisaation aiheuttama tukosriskin lisääntyminen.
Oireista tärkeimpiä olivat hengenahdistus, jalan turvotus, kipu (myös rintakipu) ja kuume. Tyypillisenä keuhkoembolian oireena pidetty veriyskä ei ollut tässä aineistossa yleinen.
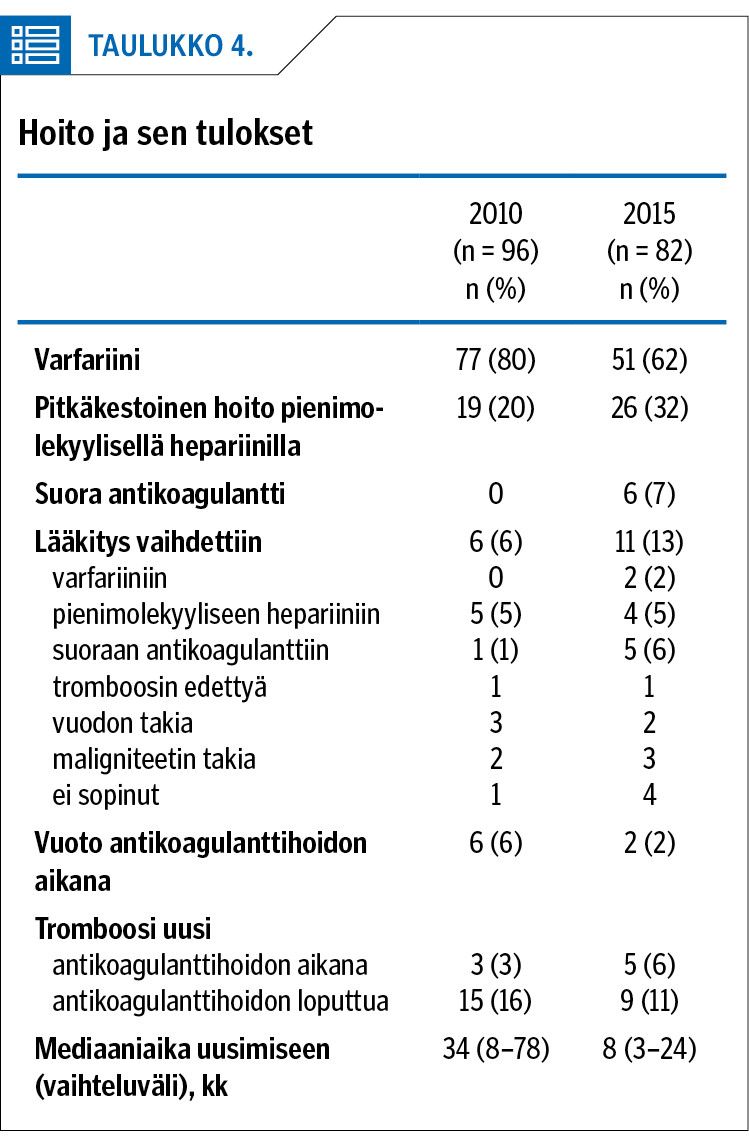
Syöpiä haettiin keuhkoembolia- ja laskimotukospotilailta aktiivisemmin vuoden 2015 aineistossa, ja ehkä siksi niitä myös löytyi hieman enemmän seuranta-aikana (taulukko 2). Mediaaniaika syöpätaudin löytymiseen keuhkoembolian tai syvän laskimotukoksen jälkeen potilailla, joiden syöpä ei löytynyt sairaalahoitojaksolla, oli vuoden 2010 aineistossa 19 kuukautta ja vuoden 2015 aineistossa 5 kuukautta. Yleisimpiä olivat keuhkosyöpä, ruoansulatuskanavan syöpä, aivokasvain, munuaissyöpä sekä gynekologiset syövät.
Tiedossa oleva syöpäsairaus oli 2010 aineistossa 24 %:lla ja 2015 aineistossa 35 %:lla. Yhteensä 4 iäkkäältä ja huonokuntoiselta potilaalta syöpää ei etsitty millään tutkimuksella, ja 12 potilaalla oli selvä altistava tekijä eikä syöpää sen takia haettu. Tärkeimpiä tutkimusmenetelmiä syöpää etsittäessä olivat thoraxin ja vatsan TT, thoraxin röntgentutkimus, vatsan kaikututkimus ja miehiltä prostataspesifisen antigeenin testaus (taulukko 2).
Trombofilioita oli diagnoosihetkellä tiedossa hyvin vähän, koska aineistoon otettiin ensimmäiseen syvään laskimotukokseen tai keuhkoemboliaan sairastuneet potilaat. Trombofilioita testattiin noin kolmannekselta aineiston potilaista. Vuoden 2010 aineistossa perinnöllinen trombofilia löytyi 4 %:lta ja 2015 aineistossa 2 %:lta potilaista (taulukko 3).
Sairaalahoitoajat olivat 2015 aineistossa keskimäärin kaksi päivää lyhemmät kuin vuonna 2010. Sairaalahoitoon jäi 2010 potilaista 75 % ja 2015 potilaista 88 %. Päivystyspoliklinikalta kotiutettiin vastaavasti 17 % potilaista vuonna 2010 mutta vain 5 % vuonna 2015. Osa oli hoidossa terveyskeskusten vuodeosastoilla.
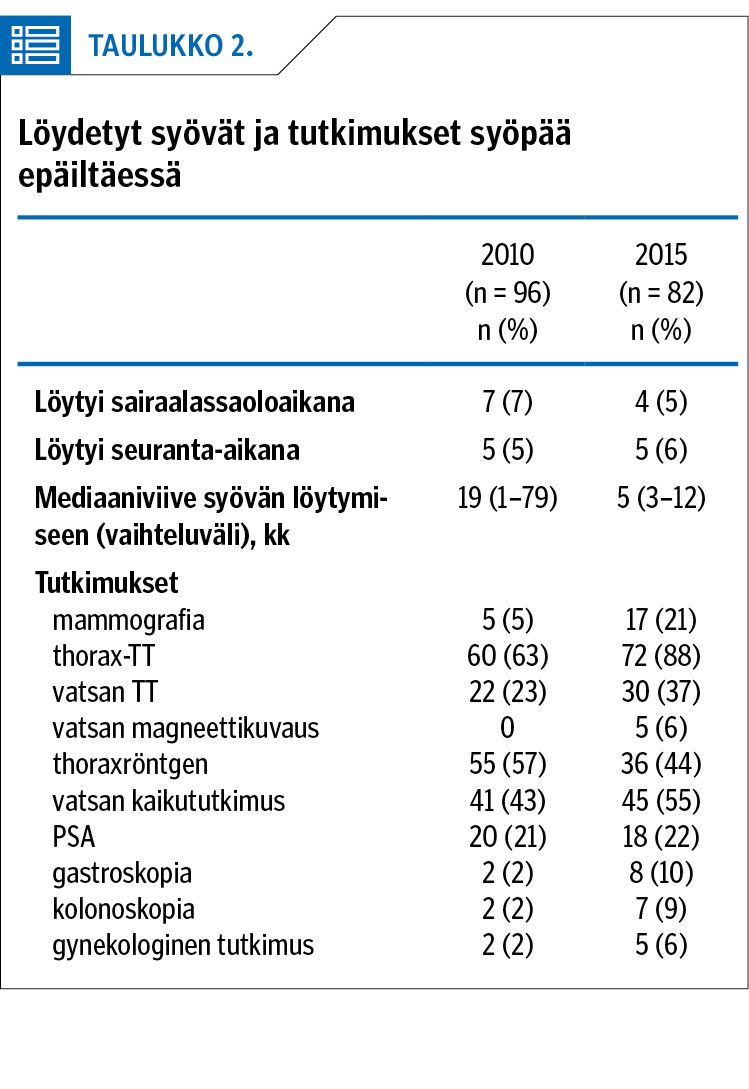
Suurimman eron hoitoon aiheuttivat suun kautta annettavien suorien antikoagulanttien käytön yleistyminen ja varfariinin käytön vähentyminen vuoden 2015 aineistossa (taulukko 4). Vuotoja antikoagulanttihoidon aikana oli 2015 hieman vähemmän. Tromboosit uusivat antikoagulanttihoidon jälkeen molemmissa aineistoissa melko usein (16 % ja 11 %) eli tähän lääkityksen muutos ei vaikuttanut. Mediaaniaika tukoksen uusimiseen oli vuoden 2010 aineistossa 34 kuukautta ja vuoden 2015 aineistossa 8 kuukautta.
Pohdinta
Kliinikoille tärkein löydös tutkimuksessamme on, että potilaan saadessa ensimmäisen keuhkoembolian tai syvän laskimotukoksen syöpää kannattaa etsiä aktiivisemmin kuin trombofiliaa. Vuoden 2010 aineistossa syöpiä löytyi 3 kertaa niin paljon kuin trombofilioita ja vuoden 2015 aineistossa 4,5-kertainen määrä, kun lasketaan yhteen sairaalassa ja seuranta-aikana todetut syövät. Syöpäpotilaiden suurentunut tromboosiriski on myös syytä muistaa, etenkin jos potilas joutuu vuodeosastohoitoon.
Perinnöllisten trombofilioiden etsiminen ei tutkimuksemme valossa ole ensilinjan tutkimus kaikille potilaille eikä varsinkaan potilaille, joilla on selvä altistava tekijä tiedossa. Tämä todetaan niin Käypä hoito -suosituksessa (1) kuin kansainvälisissä katsausartikkeleissakin (4). Mikäli muuta altistetta ei löydy, potilas on nuori tai suvussa on tukoksia, yleisimmät tukosalttiudet on syytä sulkea pois Käypä hoito -suosituksen mukaisesti.
Aineistossamme idiopaattisen tukoksen sairastaneilta löytyi syöpiä enemmän kuin Käypä hoito -suosituksen mukaan oli odotettavissa (4–5 %). Suositus pohjautuu suurimmaksi osaksi ulkomaisiin lähteisiin (3,4). Vuoden 2010 aineistossa syöpä löytyi sairaalassa ollessa kolmelta potilaalta, joilla ei ollut mitään riskitekijöitä (9 % idiopaattisen tukoksen sairastaneista), ja kahdelta löytyi syöpä seuranta-aikana (6 % idiopaattisen tukoksen sairastaneista). Vuoden 2015 aineistossa yhdeltäkään idiopaattisen tukoksen sairastaneelta ei löydetty syöpää sairaalahoitoaikana, mutta seuranta-aikana syöpä löytyi kahdelta (8 % idiopaattisen tukoksen sairastaneista). Kummassakin aineistossa täysin idiopaattisten tukosten määrä jäi varsin pieneksi; suurimmalla osalla oli jokin riskitekijä – aktiivinen syöpäkin 11 %:lla ja 26 %:lla.
Vuoden 2010 aineistossa kolmella potilaalla, joilta löytyi uusi syöpä, tukokset uusiutuivat ja vuoden 2015 aineistossa neljällä. Käypä hoito -suosituksen mukaan potilaista, joilla idiopaattinen tukos uusiutuu, 15 %:lta löytyy syöpä vuoden kuluessa. Tukos, etenkin uusiutuessaan, voi siis kertoa, että tiedossa oleva syöpätauti on aktivoitunut, tai täysin uudesta syöpätaudista.
Lepäntalon katsausartikkelissa (6) todetaan, että verisuonitukokset ovat syöpäpotilaan toiseksi yleisin kuolemansyy, syövän jälkeen. Normaaliväestöön verrattuna laskimotukoksen riski on syöpäpotilailla nelinkertainen ja suurenee edelleen solunsalpaajahoitojen vuoksi.
Joka viides syöpäpotilas sairastaa laskimotukoksen (6), ja tämä näkyi myös meidän aineistossamme syöpäpotilaiden suurena määränä. Laskimotukoksen sairastaminen lisää syöpäpotilaan kuolemanvaaraa. Lisäksi joka viidennellä laskimotukoksen sairastaneella todetaan syöpä seurannassa, kuten myös tässä aineistossa. Lepäntalo suosittelee artikkelissaan, että ainakin antikoagulaatiohoidon lopettamista pohdittaessa idiopaattisen tukoksen sairastaneille tulisi harkita anamneesin ja statuksen perusteella suunnattuja lisätutkimuksia. Tätä näkemystä vahvistavat myös tutkimuksemme havainnot.
Syvät laskimotukokset ja keuhkoemboliat uusivat Käypä hoito -suosituksen mukaan noin 5 %:lla vuoden kuluessa antikoagulaatiohoidon lopettamisesta. Aineistoissamme tromboosi uusi ensimmäisen seurantavuoden aikana 3 %:lla ja 6 %:lla. Syöpäpotilaiden tukoksen vuosittaiseksi uusiutumisriskiksi on arvioitu 15–20 % (6), siis selvästi enemmän kuin ilman syöpää. Toisaalta on syytä muistaa, että syöpäpotilaiden antikoagulaatiohoitoon liittyy suurentunut vuotoriski (6).
Väestössä 10–15 %:lla on piilevä hankinnainen tai perinnöllinen trombofilia (1). Vuoden 2010 aineistossa trombofiliaa löytyi 4 %:lta ja vuoden 2015 aineistossa 2 %:lta. Periytyvien trombofilioiden testaamista ohjaa Käypä hoito -suositus, ja sen mukaisesti OYS:ssakin testit tehtiin noin kolmasosalle. Useimmiten tukoksen kehittymiseen tarvitaan trombofilian lisäksi jokin lisäaltiste (1). Laboratoriotutkimuksissa löydetään vain noin 60 % suvussa periytyvän tukostaipumuksen syistä (1), joten vahvaan sukuanamneesiin pitää suhtautua kuten trombofiliaan, vaikka testeissä ei löytyisi poikkeavaa.
Ilmeisesti vuodeosastohoidossa olevien potilaiden tromboosiprofylaksia on parantunut, sillä vuodeosastohoidossa olleiden potilaiden trombooseja oli vähemmän vuoden 2015 aineistossa. Leikkauksenjälkeisessä tromboosiprofylaksiassa voi olla parannettavaa, sillä 26 % vuoden 2015 aineiston potilaista oli ollut leikkauksessa ennen sairaalahoitoon johtanutta keuhkoemboliaa tai syvää laskimotukosta.
Tutkimuksen vahvuuksia ovat pitkä seuranta-aika ja selkeästi rajattu potilasaineisto. Tutkimukseen otettiin mukaan vain OYS:n alueen potilaita, joten tietoa saatiin koko seuranta-ajalta. Heikkouksia ovat potilasaineiston pienuus ja se, että terveyskeskuksessa potilaille on voitu tehdä tutkimuksia, joista erikoissairaanhoidon sairauskertomuksissa ei ole tietoja. Oikeiden ja riittävien jatkotutkimusten tekemiseen ohjaavat Käypä hoito -suositus sekä hyvä anamneesi ja kliininen tutkimus.
Jenni Hookana, Susanna Voipio, Sakari Kakko, Timo Lauri: Ei sidonnaisuuksia.
Tämä tiedettiin
Syöpäpotilailla on lisääntynyt tukosalttius.
Keuhkoembolioiden ja syvien laskimotukosten taustalta voi löytyä syöpä tai perinnöllinen tukostaipumus.
Tutkimus opetti
Ilman selvää altistetta syntyneen keuhkoembolian tai syvän laskimotukoksen taustalla piilevät syyt kannattaa ainakin kertaalleen selvittää.
- 1
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Kardiologisen Seuran asettama työryhmä. Laskimotukos ja keuhkoembolia. Käypä hoito -suositus 16.12.2016. www.kaypahoito.fi
- 2
- Szanto T, Laasila K. Tukostaipumuksen selvittely. Duodecim 2018;134:1609–16.
- 3
- Schulman S, Lindmarker P. Incidence of cancer after prophylaxis with warfarin against recurrent venous thromboembolism. Duration of Anticoagulation Trial. N Engl J Med 2000;342:1953–8.
- 4
- Carrier M, Lazo-Langner A, Shivakumar S ym; SOME Investigators. Screening for occult cancer in unprovoked venous thromboembolism. N Engl J Med 2015;373:697–704.
- 5
- Connors JM. Thrombophilia testing and venous thrombosis.N Engl J Med 2017;377:1177–87.
- 6
- Lepäntalo A. Syöpäpotilaan laskimotukoksen hoito. Duodecim 2015;131:637–44.
Deep venous thrombosis and pulmonary embolism – what’s behind them?
Background There are many known risk factors for pulmonary embolism (PE) and deep venous thrombosis (DVT). In this study, we focused on cancers and genetic thrombophilia. These conditions may not be known before the patient comes to the hospital for the treatment of PE or DVT. We wanted to find out how widespread they are as underlying factors in the northern Finnish patient material.
Methods The study was carried out by going through the records of all more than 16-year-old patients suffering from their first PE/DVT and treated in Oulu University hospital during the periods 1.1.2010 - 30.6.2010 and 1.1.2015 - 30.6.2015. The patients were followed up on the basis of their medical files up to October 2017. Patients were not contacted in person.
Results In the 2010 patient material (n = 96), 7% of the PE/DVT patients had new cancer diagnosed during their hospital care and 5% had a new cancer diagnosis during the follow up period. In the 2015 patient material (n = 82), new cancers were found during hospital care in 5% of the PE/DVT patients and 6% had a cancer diagnosis during the follow up period. Most of the cancers were diagnosed within a year from their PE/DVT diagnosis. Genetic thrombophilia was found in only 4% of the 2010 patients and 2% of the 2015 patients. During anticoagulation treatment a new thrombosis occurred in 3% of the 2010 patients and 6% of the 2015 patients. A new thrombosis after anticoagulation treatment occurred in 16% of the 2010 patients and 11% of the 2015 patients. During anticoagulation treatment 6% of the 2010 patients and 2% of the 2015 patients had a bleeding episode that needed hospital care.
Conclusions When a patient is diagnosed with their first pulmonary embolism or deep vein thrombosis, the possibility of underlying cancer should be considered. In the light of our research, testing for genetic thrombophilia is not the first-line study for all patients.