Ateroskleroottisen valtimotaudin riskin vähentäminen ruokavalion keinoin – mitä uutta?
Ateroskleroottiset valtimotaudit aiheuttavat maailmassa yhä eniten kuolemia.
Pienentämällä LDL-kolesterolipitoisuutta valtimotautitapahtumien riski vähenee.
Ruokavalion muutos on keskeinen LDL-kolesterolipitoisuuden pienentämisessä.
Kasvistanoli rasvahappoesterinä vähentää kolesterolin imeytymistä ja pienentää LDL-kolesterolipitoisuutta.
FINRISKI-laskurin mukaan ruokavalion rasvan laadun muutos yhdistettynä kasvistanoliesterituotteiden käyttöön vähentäisi sepelvaltimotaudin ilmaantuvuutta 23 %.

Sydän- ja verisuonitaudit aiheuttavat enemmän menetettyjä terveitä elinvuosia ja kuolemia kuin mikään muu sairausryhmä maailmassa (1,2). Vuonna 2017 sydän- ja verisuonitaudit olivat syynä noin joka kolmanteen eli lähes 18 miljoonaan kuolemantapaukseen (1). Näistä suurimman osan, noin 12 miljoonaa, aiheuttivat ateroskleroottiset valtimotaudit (sepelvaltimo-, aivovaltimo- ja perifeerinen valtimotauti) (1).
COVID-19-pandemia on aiheuttanut maailmassa noin 3,7 miljoonaa kuolemaa 17 kuukauden aikana (3). Näin ollen sydän- ja verisuonitautikuolleisuus on karkeasti arvioiden moninkertainen verrattuna pandemiakuolleisuuteen, mikä kuvastaa sydän- ja verisuonitautien merkitystä ihmiskunnan terveydelle. Tämän vuoksi esitämme viimeaikaista tutkimustietoa ateroskleroottisista valtimotaudeista ja mahdollisuuksista vaikuttaa niiden etenemiseen väestötasolla ruokavalion keinoin. Lisäksi esitämme uusia laskelmia valtimotaudin riskin vähentämiseksi näillä keinoin.
Ateroskleroottisen valtimotaudin kehittyminen
Ateroskleroosin ja veren kolesterolin välinen yhteys kuvattiin jo 1900-luvun alussa (4), mutta vasta vuosikymmenien tutkimusnäyttö on selventänyt valtimotaudin syntymekanismeja. Kolesterolia kuljettavat verenkierrossa lipoproteiinit, joiden rakenneproteiineja ovat apolipoproteiini B (apoB) tai apolipoproteiini A1 (apoA1). ApoB-lipoproteiineista low-density-lipoproteiini (LDL) kuljettaa keskimäärin 70 % veressä kiertävästä kolesterolista, ja very-low-density-lipoproteiini (VLDL), intermediate-density-lipoproteiini (IDL) ja lipoproteiini (a) (Lp(a)) kuljettavat yhteensä noin 10 %.
Maksa erittää VLDL-partikkeleita, joissa on sekä triglyseridejä että kolesterolia. Suurin osa triglyserideistä siirtyy rasvakudokseen varastoitavaksi, VLDL muuntuu IDL-partikkeleiksi ja lopulta pääasiassa kolesterolia sisältäviksi LDL-partikkeleiksi. Nämä luovuttavat kudossoluille niiden tarvitsemaa kolesterolia. Solut kykenevät myös itse muodostamaan kolesterolia, joten osa LDL:stä palaa maksaan LDL-reseptoreiden välityksellä.
LDL-partikkeleita kulkeutuu myös valtimon seinämän sisäkerrokseen (intimaan), jossa ne voivat hapettua ja aggregoitua, minkä seurauksena niiden sisältämä kolesteroli kertyy intimaan. Näin ateroskleroottisen plakin syntyyn johtava tapahtumasarja käynnistyy. LDL-partikkelit ja niiden sisältämä kolesteroli ovat ateroskleroosin alku- ja perussyy, eikä ilman kolesterolin kertymistä valtimoon ole ateroskleroosiakaan (5,6). Kolesterolin kertyminen on suoraan suhteessa seerumin LDL-kolesterolipitoisuuteen ja LDL-partikkelien määrään. Hapettuneessa LDL-partikkelissa oleva kolesteroli voi kiteytyä ja aiheuttaa paikallisen tulehduksen plakissa (7). Tulehdus puolestaan kiihdyttää plakin kehittymistä ja muuntumista repeämäherkäksi akuutteja aterotromboottisia komplikaatioita aiheuttavaksi plakiksi (8).
ApoA1 on high-density-lipoproteiinin (HDL) rakenneproteiini ja sillä on tulehdusta ehkäiseviä vaikutuksia. HDL-partikkelit kuljettavat keskimäärin 20 % verenkierron kolesterolista. HDL kuljettaa kudossoluista vapautuvaa kolesterolia poistettavaksi elimistöstä etupäässä maksan ja jonkin verran myös suoraan ohutsuolen kautta. Kuitenkaan HDL-kolesterolipitoisuuden suurentuminen geenimuunnoksien tai lääkekokeilujen seurauksena ei ole tuottanut kliinistä hyötyä (9,10).
Ateroskleroosiriskin arvioinnissa käytetään ensisijaisesti seerumin LDL-kolesterolipitoisuutta, koska se edustaa valtaosaa veressä kiertävästä kolesterolista ja kuvastaa luotettavasti LDL-partikkelien lukumäärää henkilöillä, joilla on normaali seerumin triglyseridipitoisuus (5). Lisäksi sen pitoisuuden määritysmenetelmät ovat yleisesti saatavilla ja tulokset ovat vertailukelpoisia eri laboratorioiden välillä myös kansainvälisesti. Myös niin sanotun ei-HDL-kolesterolipitoisuuden (non-HDL-kolesteroli) määrittämistä käytetään. Se kuvastaa kaikkien aterogeenisten apoB-lipoproteiinien kuljettamaa kolesterolia verenkierrossa, ja tämä lisäinformaatio on hyödyllistä erityisesti seerumin triglyseridien ollessa koholla. HDL-kolesterolipitoisuus on yleensä pienentynyt ja LDL-partikkelit ovat muuntuneet vielä aterogeenisemmiksi niin sanotuiksi small-dense-LDL-partikkeleiksi (11).
Ateroskleroottisten valtimotautien ennusteeseen voidaan vaikuttaa
Suuret ravinto- ja lääkeinterventiot ja geneettiset tutkimukset ovat vahvistaneet, että seerumin LDL-kolesterolipitoisuus on ateroskleroottisen valtimotaudin pääasiallisin alkuunpanija (5,6,12,13,14). Valtimotapahtumien (sepelvaltimotauti, sepelvaltimoiden revaskularisaatio ja aivovaltimotauti) riski vähenee LDL-kolesterolipitoisuuden pienentyessä ja vastaavasti kasvaa sen suuretessa (5,6,12,13,14,15). Riskin muutos ei ole sattumanvarainen, vaan se on suoraan suhteessa LDL-kolesterolipitoisuuden muutokseen ja saavutettuun tasoon. Tämä havainto voidaan esittää myös matemaattisesti, mikä auttaa konkretisoimaan ehkäisyn merkitystä.
Tulokset ovat osoittaneet, että kun LDL-kolesterolipitoisuus pienenee 1 mmol/l, valtimotapahtumien riski vähenee 5–10 vuoden sisällä 21–25 % (13,14). Nämä laskelmat ovat perustuneet tutkimusaineistoihin, joissa on ollut satoja tuhansia tutkimuspotilaita ja joissa LDL-kolesterolipitoisuus on pienentynyt siten, että ravintomuutos tai lääkehoito (statiini, resiini tai etsetimibi) on lisännyt maksan LDL-reseptorien määrää. Kuitenkin vähäisempikin LDL-kolesterolipitoisuuden pieneneminen on tärkeää. Esimerkiksi etsetimibi pienensi statiinin käyttäjien LDL-kolesterolipitoisuutta keskimäärin 0,43 mmol/l, minkä seurauksena joka 16:s valtimotapahtuma estyi (15).
Subkliinisen ateroskleroosin esiintyvyys ja merkitys
Subkliininen ateroskleroosi tarkoittaa sepelvaltimoiden ja suurten valtimoiden ateroskleroosimuutoksia oireettomilla henkilöillä. Äskettäin on osoitettu, kuinka yleinen varhaisvaiheen ateroskleroosi on "terveillä" keski-ikäisillä ja kuinka nopeasti se voi edetä merkitykselliseksi valtimotaudiksi (16,17,18). Tutkittavat olivat oireettomia 40–54-vuotiaita pankkitoimihenkilöitä (n = 4 066), joiden LDL-kolesterolipitoisuuden keskiarvo oli 3,4 ± 0,8 (SD) mmol/l (16). Subkliininen ateroskleroosi todettiin 63 %:lla tutkimuspotilaista ja 41 %:lla se oli laaja-alainen. Uusintatutkimuksessa 2,8 vuoden kuluttua ateroskleroosi oli edennyt 42 %:lla tutkittavista (17).
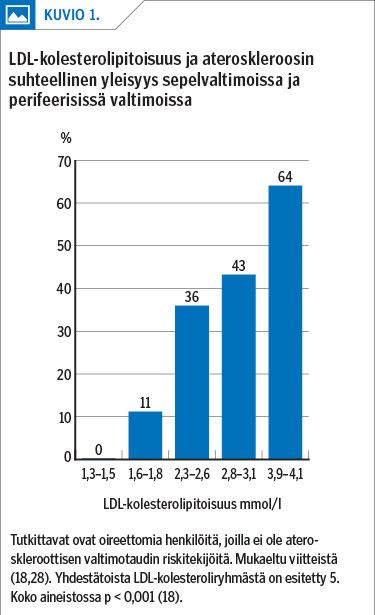
Samasta tutkimusaineistosta valittiin ateroskleroosin riskitekijöistä "vapaa" alaryhmä (n = 1 779), jonka keski-ikä oli 45 ± 4 (SD) vuotta (18). Naisten osuus oli 50,3 %. Sisäänottokriteereinä olivat LDL- ja HDL-kolesterolipitoisuus < 4,1 ja ≥ 1,0 mmol/l, tupakoimattomuus sekä normaalit verenpaine ja paastosokeri. Tutkittavista 95 %:lla oli vähäinen 10 vuoden valtimotaudin riski. Kuitenkin puolella todettiin subkliininen ateroskleroosi, jonka esiintyvyys LDL-kolesterolipitoisuuden suuretessa lisääntyi lineaarisesti ja tilastollisesti merkitsevästi (p < 0,001) (kuvio 1). On merkille pantavaa, että ateroskleroosimuutoksia todettiin lähes puolella tutkittavista jo silloin, kun LDL-kolesterolipitoisuus oli 2,8–3,1 mmol/l – alle tai hieman yli väestötason suositusrajan (< 3,0 mmol/l) (9,11).
Subkliininen ateroskleroosi voi edetä oireettomana kliinisesti merkitseväksi valtimotaudiksi. Etenemistä säätelevät sekä LDL- että ei-HDL-kolesterolipitoisuus. Tämä osoitettiin kahdessa suuressa tutkimusaineistossa, joissa oireettomia, pienen valtimotautiriskin omaavia 36–60-vuotiaita henkilöitä seurattiin 26,8 vuotta (mediaani, vaihteluväli 21–31 vuotta) (19) ja 13,5 vuotta (mediaani, kvartiiliväli 7–20 vuotta) (20). Päätetapahtumina olivat sydän- ja verisuonitautikuolleisuus (19), ei-fataali tai fataali sydäntapahtuma tai iskeeminen aivohalvaus (20). Lähtötilanteessa LDL-kolesterolipitoisuuden mediaanit olivat 3,3 mmol/l ja 3,6 mmol/l.
Molemmissa tutkimuksissa LDL- ja ei-HDL-kolesterolipitoisuudet liittyivät seurannan aikaiseen valtimotautikuolemien riskiin. Kun LDL-kolesterolipitoisuus oli ≥ 4,1 mmol/l, valtimotautikuolemien riski kasvoi 50–80 % (19). Sen sijaan pienennettäessä seurannan aikana LDL- ja ei-HDL-kolesterolipitoisuudet puoleen, päätetapahtumien riski 75 vuoden ikään mennessä pieneni – sitä enemmän, mitä nuorempana näiden lipoproteiinien kolesterolipitoisuus oli pienentynyt (20).
Nämä tutkimukset ovat vahvistaneet, että jo 40 vuoden iässä oireettomilla pienen valtimotautiriskin henkilöillä esiintyy subkliinistä ateroskleroosia. Sen esiintyvyys ja vaikeusaste liittyvät LDL-kolesterolipitoisuuteen, ja ateroskleroosi etenee valtimotaudiksi, jos LDL-kolesterolipitoisuutta ei pienennetä.
Subkliininen ateroskleroosi on merkittävä äkkikuoleman syy myös suomalaisilla alle 50-vuotiailla (21). Väestöpohjaisessa ruumiinavausaineistossa todettiin, että sepelvaltimotauti oli yleisin sydänperäisen äkkikuoleman syy nuorilla aikuisilla (keski-ikä 44 vuotta) selittäen noin 44 % äkkikuolemista. Valtaosalla (90 %) ei ollut todettu sepelvaltimotautia ennen äkkikuolemaa, mutta 65 %:lla oli vähintään yksi sepelvaltimotaudin riskitekijä. Valtimotaudin riskitekijöihin tulisi tämänkin tutkimuksen pohjalta kiinnittää huomiota jo varhaisessa keski-iässä. Dyslipidemian hoitosuositukset eivät nykyisellään riittävästi huomioi LDL-kolesterolipitoisuuden tasoja, joilla subkliininen ateroskleroosi voi alkaa kehittyä jo varhaisessa keski-iässä, ja sen eteneminen kliinisesti merkittäväksi valtimotaudiksi jää ehkäisemättä.
LDL-kolesterolin elämänaikaista merkitystä ovat toistuvasti häirinneet epidemiologiset havainnot siitä, että valikoimattomassa iäkkäässä väestössä mataliin LDL-kolesterolipitoisuuksiin on liittynyt suurempi kuolemanvaara. Uusimmat väestötutkimukset ovat kuitenkin osoittaneet, että pienempään LDL-kolesterolipitoisuuteen liittyy pienempi ateroskleroottisen valtimotaudin vaara myös 70–100-vuotiailla (22). Mendeliaanisella satunnaistamistekniikalla tehty tutkimus puolestaan osoitti matalan LDL-kolesterolitason liittyvän pitkäikäisyyteen (23).
Havaitut käänteiset yhteydet vanhuusiässä selittyvät sisäsyntyisillä (vajaaravitsemus, gerastenia, piilevä sairaus, "inflammaging") tekijöillä, jotka sekä pienentävät LDL-kolesterolipitoisuutta että lisäävät kuolemanvaaraa. Tätä tukee myös se, että LDL-kolesterolipitoisuuden lääkkeellinen pienentäminen vähentää valtimotautitapahtumia yli 75-vuotiailla yhtä tehokkaasti kuin nuoremmillakin (24).
LDL-kolesterolipitoisuuden pienentäminen ruokavalion keinoin
Dyslipidemian hoitosuosituksissa LDL-kolesterolipitoisuuden tavoite väestötasolla, primaaripreventiossa ja pienen valtimotautiriskin henkilöillä on alle 3 mmol/l, ja siihen pyritään ensisijaisesti elämäntapamuutoksin (9,11). Ravintomuutoksissa rasvojen määrän ja etenkin niiden laadun tarkistaminen on keskeistä, mutta usein tarvitaan myös laajempaa ruokavalion muutosta LDL-kolesterolipitoisuuden merkittävään pienentämiseen.
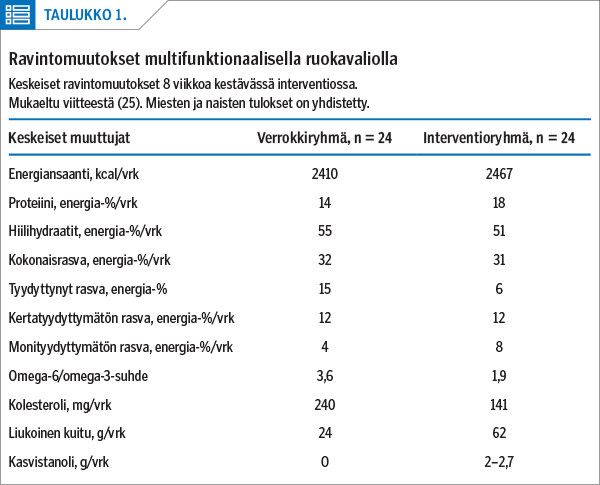
Esimerkkinä laajemmasta ruokavaliomuutoksesta kuvaamme niin sanotun multifunktionaalisen ruokavalion tehoa seerumin rasvoihin. Tätä on selvitetty satunnaistetussa ja kontrolloidussa interventiossa (25). Keskeisimmät ravintomuutokset on esitetty taulukossa 1. Muutokset toteutettiin lisäämällä perusruokaruokavalioon etenkin rasvaista kalaa, matalan glykeemisen indeksin omaavia ja runsaasti kuitua sisältäviä elintarvikkeita, marjoja, pähkinöitä, rypsiöljyä ja kasvistanoliesteriä (2–2,7 g kasvistanolia vuorokaudessa).
LDL-kolesterolipitoisuus pieneni interventioryhmässä keskimäärin 1,45 mmol/l (35 %). Lisäksi interventioryhmässä seerumin kolesterolipitoisuus pieneni 26 %, seerumin triglyseridit vähenivät 16 % ja LDL-kolesterolin ja HDL-kolesterolin suhde pieneni 27 %. Erot verrokkiryhmään olivat tilastollisesti merkitseviä.
Näin suuren LDL-kolesterolipitoisuuden muutoksen pitäisi näkyä myös valtimotautiriskin pienenemisenä, sillä kasvistanoliesteri pienentää LDL-kolesterolipitoisuutta lisäämällä maksan LDL-reseptorien määrää kuten esimerkiksi statiini ja etsetimibi (13,14,15,26). Kasvistanoliesteri ja etsetimibi vähentävät kolesterolin imeytymistä ja statiini kolesterolin uudismuodostusta, mutta kumpikin mekanismi lisää LDL-reseptorien määrää johtaen LDL-kolesterolipitoisuuden pienenemiseen.
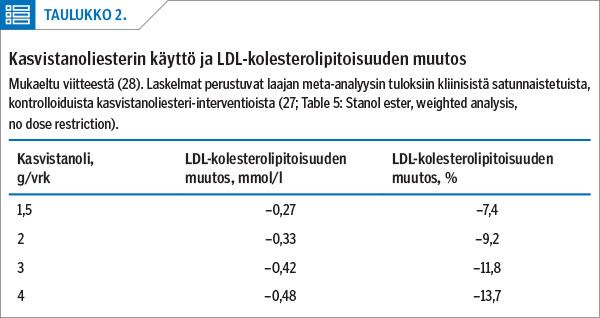
Kasvistanolit rasvahappoesterinä vähentävät ravinnosta ja sapesta suolistoon tulevan kolesterolin imeytymistä noin 50 %. Ne pienentävät 2–3 g:n päiväannoksina LDL-kolesterolipitoisuutta keskimäärin 0,33–0,42 mmol/l (9–12 %) (taulukko 2) (27,28). Kasvistanolien imeytyminen ravinnosta ihmiskehoon on hyvin vähäistä, alle 0,2 % (29), joten niiden pitoisuudet sekä veressä että kudoksissa jäävät 10 000 kertaa pienemmiksi kuin kolesterolin (30). Kasvistanolista kehitettiin vuonna 1989 kasvistanoliesteri, joka elintarvikeainesosana teki mahdolliseksi sitä sisältävien elintarvikkeiden valmistamisen osaksi kolesterolia alentavaa ruokavaliota. EU-komissio hyväksyi vuonna 2009 terveysväitteen: "Kasvistanoliesterin on osoitettu pienentävän veren kolesterolipitoisuutta. Korkea kolesterolipitoisuus on sepelvaltimotaudin riskitekijä".
Dyslipidemian Käypä hoito- ja eurooppalaisen 2019 ESC/EAS dyslipidemioiden hoitosuosituksen mukaan kasvistanoliesteri voidaan yhdistää statiinihoitoon (9,11), jolloin LDL-kolesterolipitoisuus pienenee edelleen noin 10–15% (30). Sen sijaan kasvistanoliesterin ja etsetimibin yhteiskäytön hyödystä ei ole selkeää näyttöä (30).
Kasvistanoliesterin päivittäinen käyttö osana sydänterveellistä ruokavaliota pienentää LDL-kolesterolipitoisuutta riippumatta henkilön iästä, sukupuolesta, painoindeksistä, LDL-kolesterolitasosta tai muista sairauksista (30). Lisäksi kasvistanoliesteri vähentää LDL-lipoproteiinien määrää ja aggregaatioherkkyyttä, plasman hapettuneen LDL:n pitoisuutta ja lievästi koholla olevaa seerumin triglyseridipitoisuutta – kaikki muutoksia, jotka vähentävät LDL-kolesterolipitoisuuden pienentämisen lisäksi ateroskleroottisen valtimotaudin riskiä (30,31,32).
Koska päätetapahtumatutkimuksia ei ole – eikä Euroopan ateroskleroosiyhdistyksen asiantuntijapaneelin arvion mukaan ole käytännössä mahdollistakaan toteuttaa (30) – joudutaan kasvistanoliesterin merkitystä valtimotautiriskille arvioimaan riskilaskurin ja sijaispäätetapahtumien (surrogaattien) avulla.
Ravintomuutokset ja kasvistanoliesterit näyttäisivät vähentävän valtimotaudin riskiä
Keysin, Andersonin ja Granden (33) kaavalla laskettuna tyydyttyneen rasvan vähentäminen suomalaisilla nykyisestä 15:sta 10 energiaprosenttiin ja monityydyttymättömien rasvojen lisääminen nykyisestä 7:stä 10 energiaprosenttiin pienentäisi seerumin kolesterolipitoisuutta 0,40 mmol/l. Toisaalta kasvistanoliesterimargariinin käyttö pienensi vuoden kestävässä interventiossa seerumin kolesterolipitoisuutta 0,6 mmol/l (10 %) (34). FINRISKI-laskurin (35) kaavalla laskettuna edellä esitetyn ruokavalion rasvan laadun muutos aiheuttaisi 11 %:n laskun sepelvaltimotaudin ilmaantuvuudessa. Kasvistanoliesterituotteiden käytön seurauksena sepelvaltimotaudin ilmaantuvuus pienenisi 15 %. Kun molemmat muutokset toteutetaan, väheneminen sepelvaltimotaudin ilmaantuvuudessa olisi 23 %. Näin ollen sepelvaltimotaudin vaaraa voitaisiin tehokkaasti ehkäistä ravitsemuksen keinoin.
FINRISKI-laskurin, jonka ikäraja on nostettu 75 vuoteen, tulokset ruokavalion rasvan laadun muutoksesta seerumin kolesterolipitoisuuteen ja valtimotaudin riskiin ovat hämmästyttävän samanlaiset kuin äskettäin julkaistussa norjalaisessa tutkimuksessa, jossa rasvan laadun muutokset pienensivät seerumin kolesterolipitoisuutta 0,44 mmol/l ja vähensivät laskennallista valtimotaudin riskiä 8 % (36,37).
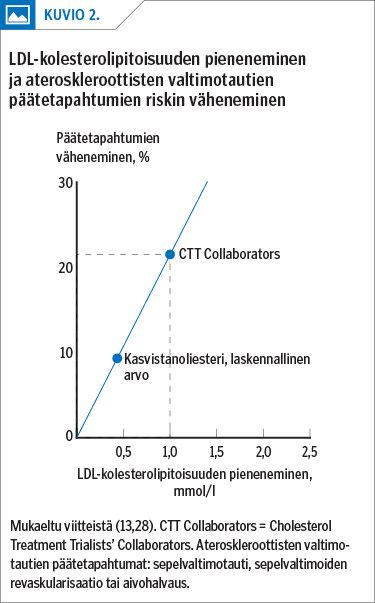
Lisäksi olemme aikaisemmin osoittaneet kasvistanolitutkimusten meta-analyysin (27) tuloksiin perustuen, että 3 g/vrk kasvistanolia kasvistanoliesterinä pienentää LDL-kolesterolipitoisuutta 0,42 mmol/l (11,8 %) (taulukko 2), joka sijoitettuna Cholesterol Treatment Trialists’ (CTT) Collaboratorsin valtimotaudin riskiyhtälöön (13) antaa tulokseksi valtimotaudin päätetapahtumien riskin vähenemisen noin 9 %:lla (kuvio 2) (28,38). Vastaavasti 4 g/vrk kasvistanolia kasvistanoliesterinä vähentäisi valtimotaudin päätetapahtumien riskiä noin 10 %.
Sijaispäätetapahtuman käyttö on mahdollista, jos menetelmän käytölle asetetut tieteelliset kriteerit täyttyvät. Arvioimme näiden toteutuneen tapahtumasarjassa: kasvistanoliesterin käyttö –> LDL-kolesterolipitoisuuden muutos –> ateroskleroottisen valtimotaudin riskin muutos (39). Lisäksi CTT Collaborators -regressioyhtälön käyttöä puoltaa se, että myös kasvistanoliesteri pienentää verenkierron LDL-kolesterolipitoisuutta lisäämällä maksan LDL-reseptorien määrää.
Lopuksi
Ateroskleroottisen valtimotaudin ennusteeseen voidaan vaikuttaa pienentämällä LDL-kolesterolipitoisuutta. Sekä FINRISKI-laskurin että CTT Collaborators -regressioyhtälön avulla suoritetut laskelmat viittaavat siihen, että kasvistanolit rasvahappoesterinä osana terveellistä ruokavaliota pienentävät LDL-kolesterolipitoisuutta niin paljon, että ateroskleroottisen valtimotaudin vaaraa voidaan vähentää ruokavalion keinoin.
Tätä voidaan käyttää hyväksi etenkin pyrittäessä ehkäisemään sekä subkliinisen ateroskleroosin kehittymistä terveessä keski-ikäisessä väestössä että taudin etenemistä kliinisesti merkittäväksi valtimotaudiksi. Yksinkertaisten ja jokaisen toteutettavissa olevien ruokavaliomuutosten lopputulos olisi merkittävä: vähentynyt kuolleisuus, lisääntynyt terveiden elinvuosien määrä ja terveydenhuollon kustannuksien väheneminen.
Petri Kovanen: Konsultointi (Amgen, Novartis), luentopalkkiot (Amgen), lisenssitulot ja tekijänpalkkiot (Kustannus Oy Duodecim), osakkeet/optiot (Orion). Muut kirjoittajat: Ei sidonnaisuuksia.
- 1
- GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392:1736–88.
- 2
- Khan MA, Hashim MJ, Mustafa H ym. Global epidemiology of ischemic heart disease: Results from the Global Burden of Disease Study. Cureus 2020;23;12:e9349.
- 3
- WHO Coronavirus (COVID-19) Dashboard. Covid19who.int
- 4
- Goldstein JL, Brown MS. A century of cholesterol and coronaries: from plaques to genes to statins. Cell 2015;161:161–72.
- 5
- Ference BA, Ginsberg HN, Graham I ym. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 38:2459–72.
- 6
- Borén J, Chapman MJ, Krauss RM ym. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2020;41;2313–30.
- 7
- Rajamäki K, Lappalainen J, Öörni K ym. Cholesterol crystals activate the NLRP3 inflammasome in human macrophages: a novel link between cholesterol metabolism and inflammation. PLoS One 2010;23;5:e11765.
- 8
- Janoudi A, Shamoun FE, Kalavakunta JK, Abela GS. Cholesterol crystal induced arterial inflammation and destabilization of atherosclerotic plaque. Eur Heart J 2016;37:1959–67.
- 9
- 2019 ESC/EAS guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J 2020;41:111–88.
- 10
- Vitali C, Khetarpal SA, Rader DJ. HDL cholesterol metabolism and the risk of CHD: New insights from human genetics. Curr Cardiol Rep 2017;19:132.
- 11
- Suomalaisen Lääkäriseuran Duodecimin ja Suomen Sisätautilääkärien Yhdistys ry:n asettama työryhmä. Dyslipidemiat. Käypä hoito -suositus 25.1.2021. www.kaypahoito.fi
- 12
- Ference BA, Yoo W, Alesh I ym. Effect of long-term exposure to lower low-density lipoprotein cholesterol beginning early in life on the risk of coronary heart disease. A Mendelian randomization analysis. J Am Coll Cardiol 2012;60:2631–9.
- 13
- Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90 056 participants in 14 randomized trials of statins. Lancet 2005;366:1267–78.
- 14
- Silverman MG, Ference BA, Im K ym. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions. A systematic review and meta-analysis JAMA 2016;316:1289–97.
- 15
- Cannon CP, Blazing MA, Giugliano RP ym. for the IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015;372:2387–97.
- 16
- Fernández-Friera L, Peñalvo JL, Fernández-Ortiz A ym. Prevalence, vascular distribution, and multiterritorial extent of subclinical atherosclerosis in a middle-aged cohort. The PESA (Progression of Early Subclinical Atherosclerosis) Study. Circulation 2015;131:2104–13.
- 17
- López-Melgar B, Fernández-Friera L, Oliva B ym. Short-term progression of multiterritorial subclinical atherosclerosis. J Am Coll Cardiol 2020;75:1617–27.
- 18
- Fernández-Friera L, Fuster V, López-Melgar B ym. Normal LDL-cholesterol levels are associated with subclinical atherosclerosis in the absence of risk factors. J Am Coll Cardiol 2017;70:2979–91.
- 19
- Abdullah SM, Defina LF, Leonard D ym. Long-term association of low-density lipoprotein cholesterol with cardiovascular mortality in individuals at low 10-year risk of atherosclerotic cardiovascular disease. Circulation 2018;138:2315–25.
- 20
- Brunner FJ, Waldeyer C, Ojeda F ym. Application of non-HDL cholesterol for population-based cardiovascular risk stratification: results from the Multinational Cardiovascular Risk Consortium. Lancet 2019;394:2173–83.
- 21
- Vähätalo J, Holmström L, Pakanen L ym. Coronary artery disease as the cause of sudden cardiac death among victims < 50 years of age. Am J Cardiol 2021;147:33–8.
- 22
- Mortensen MB, Nordestgaard BG. Elevated LDL cholesterol and increased risk of myocardial infarction and atherosclerotic cardiovascular disease in individuals aged 70–100 years: a contemporary primary prevention cohort. Lancet 2020;396:1644–52.
- 23
- Postmus I, Deelen J, Sedaghat S ym. LDL cholesterol still a problem in old age? A Mendelian randomization study. Int J Epidemiol 2015;44:604–12.
- 24
- Gencer B, Marston NA, Im KA ym. Efficacy and safety of lowering LDL cholesterol in older patients: a systematic review and meta-analysis of randomised controlled trials. Lancet 2020;396:1637–43.
- 25
- Tovar J, Johansson M, Björck I. A multifunctional diet improves cardiometabolic-related biomarkers independently of weight changes: an 8-week randomized controlled intervention in healthy overweight and obese subjects. Eur J Nutr 2016;55:2295–306.
- 26
- Plat J, Mensink RP. Effects of plant stanol esters on LDL receptor protein expression and on LDL receptor and HMG-CoA reductase mRNA expression in mononuclear blood cells of healthy men and women. FASEB J 2002;16:258–60.
- 27
- Musa-Veloso K, Poon TH, Elliot JA, Chung C. A comparison of the LDL-cholesterol lowering efficacy of plant stanols and plant sterols over a continuous dose range: results of a meta-analysis of randomized, placebo-controlled trials. Prostaglandins Leukot Essent Fatty Acids 2011;85:9–28.
- 28
- Gylling H, Strandberg TE, Kovanen PT, Simonen P. Lowering low-density lipoprotein cholesterol concentration with plant stanol esters to reduce the risk of atherosclerotic cardiovascular disease events at a population level: a critical discussion. Nutrients 2020;12:2346.
- 29
- Ostlund RE Jr, McGill JB, Zeng CM ym. Gastrointestinal absorption and plasma kinetics of soy Δ5-phytosterols and phytostanols in humans. Am J Physiol Endocrinol Metab 2002;282: E911–6.
- 30
- Gylling H, Plat J, Turley S ym. for the European Atherosclerosis Society Consensus Panel on Phytosterols. Plant sterols and plant stanols in the management of dyslipidaemia and prevention of cardiovascular disease. Atherosclerosis 2014;232:346–60.
- 31
- Ruuth M, Äikäs L, Tigistu-Sahle F ym. Plant stanol esters reduce LDL (Low-Density Lipoprotein) aggregation by altering LDL surface lipids. The BLOOD FLOW randomized intervention study. Arterioscler Thromb Vasc Biol 2020;40:2310–21.
- 32
- Homma Y, Ikeda I, Ishikawa T, Tateno M, Sugano M, Nakamura H. Decrease in plasma low-density lipoprotein cholesterol, apolipoprotein B, cholesteryl ester transfer protein, and oxidized low-density lipoprotein by plant stanol ester-containing spread: a randomized, placebo-controlled trial. Nutrition 2003;19:369–74.
- 33
- Keys A, Anderson JT, Grande F. Serum cholesterol response to changes in the diet: IV. Particular saturated fatty acids in the diet. Metabolism 1965;14:776–87.
- 34
- Miettinen TA, Puska P, Gylling H, Vanhanen H, Vartiainen E. Reduction of serum cholesterol with sitostanol-ester margarine in a mildly hypercholesterolemic population. N Engl J Med 1995;333:1308–12.
- 35
- Vartiainen E, Laatikainen T, Jousilahti, Peltonen M, Niiranen T, Salomaa V. Sepelvaltimotaudin ja aivohalvauksen riskin arviointi FINRISKI 2.0 -laskurilla. Suom Lääkäril 2020;75:2778–84.
- 36
- Sundfør TM, Svendsen M, Heggen E, Dushanov S, Klemsdal TO, Tonstad S. BMI modifies the effect of dietary fat on atherogenic lipids: a randomized clinical trial. Am J Clin Nutr 2019;110:832–41.
- 37
- Maki KC. The fat of the matter: lipoprotein effects of dietary fatty acids vary by body weight status. Am J Clin Nutr 2019;110:795–6.
- 38
- Gylling H, Simonen P, Kovanen PT, Strandberg TE. Kasvistanoliesteri pienentää LDL-kolesterolipitoisuutta ravitsemuksen keinoin. Duodecim 2020;136:2209–11.
- 39
- DeMets DL, Psaty BM, Fleming TR. When can intermediate outcomes be used as surrogate outcomes? JAMA 2020;323:1184–5.
Reducing the risk of atherosclerotic cardiovascular diseases by dietary means: anything new?
Atherosclerotic cardiovascular diseases (ASCVDs) cause more deaths than any other disease group worldwide. However, it is possible to prevent the progression of atherosclerosis and the risk of ASCVD events by reducing the circulating concentrations of low-density-lipoprotein cholesterol (LDL-C). Large meta-analyses have demonstrated that decreasing the dietary intake of saturated fat and cholesterol can reduce the risk of ASCVD events. Here, we discuss the recent information regarding the prevention of subclinical atherosclerosis, ASCVD, and the risk of ASCVD events with a focus on dietary means. Plant stanols as fatty-acid esters were developed as a dietary adjunct to reduce LDL-C levels as part of a heart-healthy diet. They reduce cholesterol absorption so that less cholesterol is transported to the liver, the expression of LDL receptors is upregulated, and LDL-C concentrations are reduced on average by 0.40 mmol/L (12%) by consuming 3 g of plant stanols as esters/day. Using the equations of Keys, Anderson, and Grande, and the FINRISKI-counter equation, we also demonstrate that a heart-healthy diet combined with plant stanol ester consumption plausibly reduces the risk of coronary artery disease events by 23%. Thus, plant stanol esters as part of a heart-healthy diet seem to offer an effective means to reduce the risk of ASCVD events both at a population level and for subjects with different risk levels of ASCVD, when needed, in combination with statins.