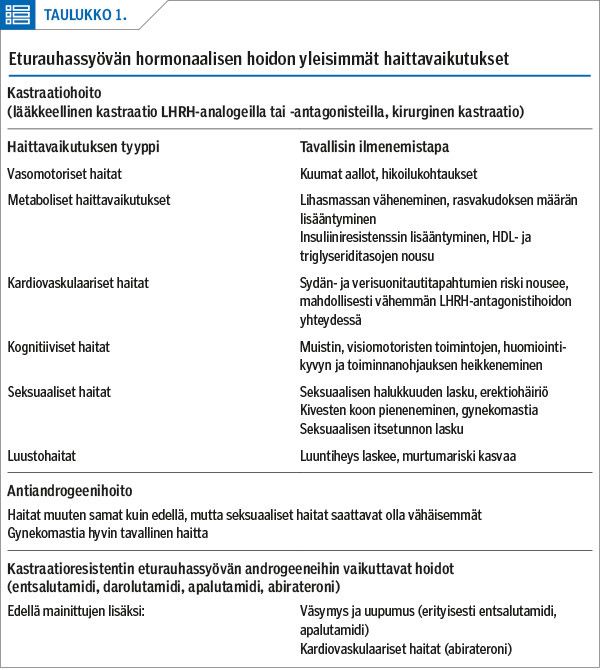
Eturauhassyövän kastraatiohoidon haittavaikutukset
Eturauhassyövän hormonaalinen hoito aiheuttaa välittömiä ja pitkäaikaisia haittavaikutuksia.
Välittömiä haittavaikutuksia ovat vasomotoriset oireet sekä libidon lasku.
Pitkäaikaisia haittavaikutuksia ovat lihaksiston ja luuston heikkeneminen, rasvakudoksen määrän ja insuliiniresistenssin lisääntyminen sekä veren rasvaprofiilin muutokset.
Säännöllinen liikunta on avainasemassa hormonaalisen hoidon haittojen ehkäisyssä.
Kehittyneiden syöpähoitojen myötä levinnyttäkin eturauhassyöpää sairastavat miehet elävät aiempaa pidempään, mikä korostaa hoidon haittojen ehkäisyn tärkeyttä.

Eturauhassyöpä on länsimaissa miesten yleisin syöpätyyppi. Androgeenideprivaatio (ADT) eli kastraatio, joko kirurgisesti tai lääkkeellisesti, on ollut levinneen eturauhassyövän tärkein hoitomuoto jo vuosikymmenien ajan (1). Lisäksi lääkkeellistä kastraatiota käytetään eturauhassyövän sädehoidon liitännäishoitona sekä potilailla, joilla on radikaalihoitojen jälkeen uusiutunut tauti. Lääkkeellistä kastraatiota on varsinkin aiemmin käytetty monoterapiana myös potilailla, joilla on korkean riskin paikallinen eturauhassyöpä, mutta näyttöä sen sairauden ennustetta parantavasta hyödystä tässä tilanteessa ei ole.
Nykyään kastraatio toteutetaan lähes aina lääkkeellisesti, jolloin teho on sama kuin kivesten poistamisella; seerumin testosteronipitoisuus laskee hyvin matalalle, niin sanotulle kastraatiotasolle. Yleisimmin käytetään LHRH (luliberiini) -analogeja, jotka annostellaan tyypillisesti 3 tai 6 kuukauden välein ihonalaisina pistoksina. LHRH-analogeilla kastraatiotason saavuttaminen kestää 2–4 viikkoa hoidon aloituksesta ja niihin liittyy hoidon alkuvaiheessa testosteronin erityksen kiihtyminen ennen sen tuotannon loppumista (flare-ilmiö).
Vaihtoehtona LHRH-analogeille on LHRH-antagonisti degareliksi. Sitä käytetään erityisesti hoitojen aloituksissa potilailla, joilla on laajalle levinnyt tauti. Degareliksi laskee testosteronin kastraatiotasolle jo muutamassa vuorokaudessa, eikä sen aloitukseen liity flare-ilmiötä.
Eturauhassyövän hormonaalinen hoito toteutetaan joissakin tapauksissa antiandrogeeni bikalutamidilla, joka ei vaikuta testosteronin tuotantoon, vaan estää sen vaikutuksen kehossa salpaamalla androgeenireseptoria.
Kastraatiohoidon yleisyydestä huolimatta potilaat usein kokevat, ettei heitä ole riittävästi informoitu hoidon haitoista (2). Monia kastraatiohoidon haittoja on mahdollista lieventää ja/tai ehkäistä, minkä vuoksi niiden huomioiminen on tärkeää potilaan elämänlaadun ja toimintakyvyn säilymisen tukemiseksi. Tässä katsauksessa käsitellään kastraatiohoidon yleisimpiä haittoja sekä niiden ehkäisyä.
Metaboliset haittavaikutukset
Huolimatta kastraation kiistattomista hyödyistä levinnyttä tautia sairastavilla eturauhassyöpäpotilailla, hoito aiheuttaa monille elämänlaatua heikentäviä haittoja (taulukko 1). Kastraatiohoidon metabolisina haittavaikutuksina kehon lihasmassa ja -voima heikkenevät, rasvakudoksen suhteellinen määrä lisääntyy ja kudosten insuliiniherkkyys heikkenee (3).
Miehen elimistössä testosteroni lisää poikkijuovaisen lihaskudoksen muodostumista ja vähentää rasvakudoksen määrää (4). Kastraatiohoito taas päinvastoin lisää rasvakudoksen määrää ja vähentää luurankolihasmassaa (5,6). Kastraatiohoito lisää pääasiassa ihonalaista rasvakudosta eikä niinkään vaikuta viskeraalisen rasvan määrään (6). Vuoden kastraatiohoidon aikana luurankolihasmassan on todettu vähentyvän noin 3,5–4 % ja rasvakudoksen määrän lisääntyvän noin 11 % (7).
Kastraatiohoito aiheuttaa myös veren rasvaprofiilin muutoksia. Sekä HDL-kolesterolin että triglyseridien määrä kasvaa, kun taas LDL-kolesteroli ei yleensä muutu (7). LHRH-analogihoito lisää insuliiniresistenssiä, nostaa paastoinsuliinin määrää verenkierrossa ja vähentää kudosten insuliiniherkkyyttä. Näiden muutosten on todettu tapahtuvan nopeasti, jo ensimmäisten kolmen hoitokuukauden aikana (8).
Kaiken kaikkiaan kastraatiohoito aiheuttaa metabolisen oireyhtymän tyyppisen tilanteen, jossa keskeisenä tekijänä on insuliiniresistenssi. Toisin kuin tavanomaisessa metabolisessa oireyhtymässä, kastraatiohoito nostaa HDL-kolesterolitasoa, eikä juuri vaikuta potilaan verenpainetasoihin. Diabeteksen riski lisääntyy noin 30 % insuliiniresistenssin kautta (3).
Kardiovaskulaariset haittavaikutukset
LHRH-analogihoitoon liittyvää sydän- ja verisuonitautitapahtumien ja niiden aiheuttaman kuolleisuuden riskiä on ollut vaikea luotettavasti selvittää. Laajassa rekisteripohjaisessa yhdysvaltalaistutkimuksessa todettiin, että LHRH-analogihoitoa saaneilla oli 16 % suurempi sepelvaltimotaudin ja sydänperäisen kuoleman sekä 11 % suurempi sydäninfarktin riski verrattuna niihin eturauhassyöpäpotilaisiin, jotka eivät käyttäneet kastraatiohoitoa. Kirurgiseen kastraatioon tätä lisäriskiä ei näyttänyt liittyvän (9). Muissakin tutkimuksissa nimenomaan lääkkeellinen kastraatio on vaikuttanut lisäävän sydänkuoleman riskiä (10,11).
Useissa seurantatutkimuksissa on todettu sydän- ja verisuonitapahtumien lisääntyvän LHRH-analogihoitoa saavilla. Kuitenkaan etenevissä kontrolloiduissa vertailevissa tutkimuksissa ei ole voitu osoittaa selkeää vaikutusta sydän- ja verisuonitapahtumiin tai kuolleisuuteen (3).
Viime vuosina on kiinnitetty huomiota siihen, että LHRH-antagonisti degareliksiin saattaisi liittyä pienempi sydän- ja verisuonihaittojen riski kuin LHRH-analogihoitoon. Kuuden etenevän tutkimuksen pohjalta degareliksiin näytti liittyvän pienempi sydän- ja verisuonitapahtumien riski kuin LHRH-analogi leuproreliiniin potilailla, joilla oli aiemmin todettu sydän- tai aivoinfarkti (12). Satunnaistettu tutkimus ei kuitenkaan pystynyt osoittamaan eroa sydäntapahtumien riskissä degareliksin ja LHRH-analogi leuproreliinin välillä (13).
Kuumat aallot
Jopa 80 prosentilla kastraatiohoitoa saavista miehistä on häiritseviä kuumien aaltojen oireita. Kastraatiosta johtuva pieni testosteronipitoisuus johtaa hypotalamuksen negatiivisen palautesäätelyn loppumiseen myös noradrenaliinin tuotantoon liittyen. Hypotalamuksen lämmönsäätelykeskuksen toiminnan häiriintyessä ilmenee vasomotorisia "kuumia aaltoja". Oireet ovat useimmiten päivittäisiä ja ne heikentävät merkittävästi elämänlaatua.
Kuumia aaltoja voi lievittää syproteroniasetaatilla, medroksiprogesteronilla, gabapentiinilla, venlafaksiinilla tai akupunktiolla (3). Näiden kaikkien on todettu vähentävän kuumia aaltoja ainakin yhdessä tutkimuksessa. Paras teho näistä on tutkimusten valossa syproteroniasetaatilla ja medroksiprogesteronilla, joista Suomessa on eniten käytetty syproteroniasetaattia. Kuumien aaltojen ja muidenkin kastraatiohoidon haittojen tulevaisuuden hoitovaihtoehdoksi on esitetty pieniannoksista estradiolia (14).
Kognitiiviset haittavaikutukset
Lääkkeellisen kastraation on todettu vaikuttavan heikentävästi potilaiden muistiin, visiomotorisiin toimintoihin, huomiointikykyyn ja toiminnanohjaukseen. Kognitiivisten toimintojen heikkeneminen liittyy normaaliinkin ikääntymiseen, mutta heikkeneminen etenee tavallista nopeammin kastraatiohoidon aikana.
Muistisairauden riskin on esitetty jopa kaksinkertaistuvan kastraatiohoidon mukana, varsinkin jos hoito jatkuu pitkään (15). Tutkimustulokset ovat kuitenkin tämänkin asian suhteen ristiriitaisia. Laajimman etenevän vertailevan tutkimuksen perusteella 12 kuukauden pituinen kastraatiohoito heikensi yksittäisissä testeissä välitöntä muistia, työmuistia ja visiomotorisia toimintoja, mutta tulokset eivät olleet toistettavissa muilla samoja suureita mittaavilla testeillä (16).
Seksuaaliset haitat
Testosteroni on keskeinen seksuaaliseen halukkuuteen eli libidoon vaikuttava hormoni. Eturauhassyövän kastraatiohoidon aikaansaama testosteronin puute heikentää seksuaalista toimintakykyä useilla mekanismeilla. Alentunut libido ilmenee vaikeutena kiihottua ja sitä kautta erektio-ongelmina. Myös kyky saada orgasmi saattaa heikentyä. Erektiokykyä heikentävät edelleen kastraatiohoidon haitalliset vaikutukset verisuoniin ja metaboliaan, mitkä johtavat myös peniksen paisuvaisten verenkierron heikkenemiseen.
Kehossa kastraation seurauksena ilmenevät muutokset, kuten kivesten pieneneminen ja gynekomastia, voivat vaikuttaa negatiivisesti itsetuntoon ja seksuaaliseen halukkuuteen.
Kastraatiohoidon aikana erektiohäiriö onkin erittäin tavallinen ja sitä ilmenee jopa 95 %:lla potilaista (17). Tämä johtaa usein penetraatioon perustuvan seksin loppumiseen, joskin niin tablettimuotoisia erektiolääkkeitä kuin penikseen paikallisesti annosteltavia alprostadiililääkkeitäkin käytetään usein erektiohäiriön hoitona. Muutokset seksuaalisuudessa saattavat johtaa vaikeuksiin parisuhteessa, vaikkakin merkittävä osa pariskunnista löytää myös sopeutumiskeinoja tilanteeseen (18).
Kastraatiohoidon toteutusmuoto ei vaikuta seksuaalisten haittavaikutusten esiintymiseen. Sen sijaan antiandrogeenihoitoon liittyy vähemmän seksuaalisia haittavaikutuksia kuin kastraatiohoitoon (19). Tämä liittynee siihen, että antiandrogeenihoidossa seerumin testosteronitaso ei laske. Siten testosteroni voi edelleen metaboloitua muun muassa estrogeeniksi, jolla on todennäköisesti libidoa ylläpitävä vaikutus. Satunnaistetun kliinisen tutkimuksen alaryhmäanalyysissä bikalutamidimonoterapiaan liittyi vähemmän libidon heikkenemistä ja erektiohäiriöitä kuin kastraatiohoidon ja antiandrogeenin yhdistelmään (20).
Luustohaitat
Eturauhassyöpään sairastuvilla ikääntyneillä miehillä on usein jo diagnoosivaiheessa pienentynyt luuntiheys tai osteoporoosi. Androgeenideprivaatio kiihdyttää luun hajoamista ja muodostumista, hajoamista kuitenkin enemmän, ja nettovaikutuksena luuston massa pienenee ja luu haurastuu. Jo ensimmäisen kastraatiovuoden aikana lannerangan luuntiheys heikkenee noin 4 %, ja luuntiheyden pieneneminen jatkuu hiljalleen hormonihoidon aikana (21).
Kastraatiohoito lisää murtumariskiä sitä enemmän, mitä pidempään hoito jatkuu. Androgeenideprivaatiota käyttävien miesten murtumariski on 20 % eturauhassyövän diagnoosia seuraavien viiden vuoden aikana, kun ilman hormonihoitoa murtumia todetaan 13 %:lla sairastuneista (22). Suurin murtumariski on yli 80-vuotiailla ja pitkään hormonihoidetuilla miehillä (23).
Uusien eturauhassyövän hormonihoitojen haitat
Androgeenireseptorivälitteisen signaloinnin tunnistaminen kastraatioresistenssin päämekanismiksi on johtanut uusien niin sanottujen toisen sukupolven hormonihoitojen kehitykseen ja laajaan käyttöön kastraatioresistentin levinneen eturauhassyövän hoidossa. Abirateroniasetaatti estää androgeenisynteesin CYP17A1-entsyymiä ja entsalutamidi estää androgeenireseptorin signaalivälitystä.
Abirateronin ja entsalutamidin teho on osoittautunut melko samankaltaiseksi vaiheen 3 satunnaistetuissa tutkimuksissa etäpesäkkeistä kastraatioresistenttiä syöpää sairastavilla sekä ennen että jälkeen solunsalpaajahoidon (24). Lääkkeillä on Suomessa erityiskorvattavuus näissä käyttöaiheissa. Uuden polven antiandrogeeneillä, apalutamidilla, entsalutamidilla ja darolutamidilla, on käyttöaihe myös kastraatioresistentin etäpesäkkeettömän eturauhassyövän (M0-vaihe) hoidossa. Apalutamidi ja darolutamidi ovat peruskorvattavia, entsalutamidi erityiskorvattava niissä M0-taudeissa, joissa PSA kahdentuu alle 10 kuukaudessa ja näin ollen potilaalla on suuri etäpesäkkeisen taudin kehittymisen riski.
Näitä uusia hoitoja ei ole suoraan verrattu keskenään, mutta lääkkeiden siedettävyysprofiilit poikkeavat jonkin verran toisistaan. Niillä näyttäisi olevan myös niin sanottua ristiresistenssiä keskenään, eikä prospektiivisen näytön puuttuessa ole toistaiseksi ollut mahdollista osoittaa lääkkeiden optimaalista käyttöjärjestystä (25).
Abirateroniin ja entsalutamidiin liittyvissä kardiovaskulaarisissa haittavaikutuksissa on eroa siten, että abirateronilla on systemaattisessa katsauksessa ja meta-analyysissä osoitettu olevan enemmän vakavia kardiologisia haittoja ja entsalutamidiin puolestaan liittyy enemmän verenpaineen nousua (26).
Entsalutamidiin ja apalutamidiin liittyy todennäköisesti veri-aivoesteen läpäisykyvyn seurauksena tyypillisenä haittana uupumusoireistoa. Entsalutamidihoitoon on osassa tutkimuksista yhdistetty kognitiivisen suorituskyvyn laskua ja neurologisia oireita, kuten kouristelua (27). Tuoreessa meta-analyysissä kognitiivisessa suorituskyvyssä ei kuitenkaan voitu osoittaa eroa lumelääkkeeseen verrattuna (28).
Uusia hormonihoitoja käytetään pääosin yhdistettynä kastraatiohoitoon ja usein myös peräkkäin, jolloin hoitoajat ovat pitkiä ja jopa vuosien pituisia. Näin ollen pitkäaikaishaittojen seurannan tärkeys korostuu, etenkin kun potilaat ovat usein iäkkäitä ja ennestäänkin monisairaita. Esimerkiksi kardiovaskulaariset oheissairaudet ja hoitojen aiheuttama väsymysoireyhtymä tulee huomioida hoidon valinnassa ja seurannassa.
Kastraatiohoidon haittojen ehkäisy
Kastraatiohoidon haittojen ehkäisyn (taulukko 2) tärkein periaate on välttää hoitoa silloin, kun sille ei ole selkeää kliinistä tarvetta. Tämä tarkoittaa erityisesti kastraatiohoidon välttämistä paikallisen eturauhassyövän hoitona, ellei se ole välttämätöntä. Joissakin tapauksissa kastraatiohoitoa voidaan käyttää jaksoittaisesti, jolloin hoito tauotetaan hyvän hoitovasteen yhteydessä.
Testosteronituotanto toipuu vaihtelevalla nopeudella ja kastraatiohoito aloitetaan tyypillisesti uudestaan, kun PSA-arvo kääntyy jälleen nousuun. Intermittoivan eli jaksottaisen kastraatiohoidon on todettu vähentävän hoidon aiheuttamia elämänlaatuhaittoja (29).
Kastraatiohoidon haitat kohdistuvat todennäköisesti eniten niihin, joilla hoito jatkuu hyvin pitkään, vuosien ja jopa vuosikymmenten ajan. Koska potilaat ovat yleensä iäkkäitä miehiä, he ovat alttiita toimintakyvyn ja kotona selviämisen haasteille lihasvoiman heikkenemisen tai kognition huononemisen seurauksena. Potilaan haitta-alttiutta onkin tärkeä arvioida jo kastraatiohoidon alkaessa. Oheissairauksien, kuten diabeteksen, hyperkolesterolemian ja verenpainetaudin hoito tulee optimoida ja luunmurtumariski arvioida kastraatiohoidon aikana (30).
Säännöllinen liikunta on yksi parhaista keinoista vähentää kastraatiohoidon haittoja. Sillä on todettu selkeä elämänlaatua parantava vaikutus (31). Optimaalinen liikuntaohjelma sisältää sekä lihaskuntoa ylläpitävää lihasvoimaharjoittelua että aerobista harjoittelua. Tällaisen ohjelman on todettu vähentävän hoidon aiheuttamaa insuliiniresistenssiä ja rasvakudoksen lisääntymistä sekä parantavan suorituskykyä (32).
Jokaista kastraatiohoidon aloittavaa potilasta tulisi kannustaa monipuolisen, säännöllisen liikunnan pariin. Käytännön ongelmaksi saattaa muodostua se, että monella potilaalla ei ole aiempaa kokemusta lihasvoimaharjoittelusta ja harjoittelun omatoiminen aloitus saattaa tuntua iäkkäästä miehestä hankalalta harjoitteiden ja kuntosaliympäristön ollessa vieraita.
Osallistuminen kolmen kuukauden pituiseen ohjattuun kuntosaliryhmään tutustutti kastraatiohoitoa saavat saliharjoitteluun ja tehosti sen hyötyjä pelkkään omatoimiseen liikuntaan verrattuna (33). Euroopan Urologiyhdistys suosittaa ohjatun liikuntajakson tarjoamista kastraatiohoitoa aloittaville eturauhassyöpäpotilaille (30). Pohjoismaista muun muassa Tanskan Herlevin sairaalassa ja Ruotsin Karoliinisessa instituutissa tämä kuluu rutiinihoitoon.
Suomessa on toistaiseksi vain harvoilla paikkakunnilla vastaavaa mahdollisuutta ohjattuun liikuntajaksoon kastraatiohoidon yhteydessä, vaikka näin voitaisiin mahdollisesti vähentää julkisen terveydenhuollon kustannuksia kohentuneen elämänlaadun, paremman kotona selviämisen ja vähentyneen sairaalahoitotarpeen kautta tässä hauraassa potilasryhmässä. Suomessa on valmistumassa satunnaistettu tutkimus, joka vertaa ohjatun liikuntaintervention vaikutusta elämänlaatuun ja metabolisiin merkkiaineisiin omatoimiseen liikuntaan verrattuna (34).
Kalkki-D-vitamiinivalmisteiden käyttö näyttää hiukan vähentävän murtumariskiä yli 50-vuotiailla normaaliväestöön kuuluvilla (35,36). Eturauhassyövän hoidon yhteydessä kalsiumia tulisi saada vähintään 1 000–1 200 mg ja D-vitamiinia 10–20 μg vuorokaudessa. Luustolääkkeistä sekä bisfosfonaatit että RANK-ligandin estäjä denosumabi estävät kastraatiohoitoon liittyvää luuntiheyden pienenemistä (37,38,39). Murtuman estossa paras näyttö on denosumabilla, joka annoksella 60 mg ihonalaisesti 6 kuukauden välein puolittaa kastraatiohoitoon liittyvän rankamurtumariskin (39).
Osteoporoosikäyttöaiheisen luustolääkityksen tulisi kansainvälisten suositusten mukaan perustua FRAX–riskilaskurin ja luustontiheysmittauksen käyttöön, mutta luustolääkkeiden kohderyhmä ja käyttö eivät ole riittävästi vakiintuneet. Osteoporoosilääkityksen yhteydessä tulee huomioida leukaluun osteonekroosin riski etenkin hammastoimenpiteiden yhteydessä, vaikka leukaongelmien riski onkin huomattavasti suurempi ongelma luuhun levinneen kastraatioresistentin syövän hoidossa käytetyillä tiheämmillä ja suuremmilla luustolääkeannoksilla (40).
Lopuksi
Kastraatiohoito on tehokas taudin etenemistä jarruttava hoito levinneessä eturauhassyövässä. Se on yleensä mahdollinen, vaikka potilaan yleistila ei sallisi muita eturauhassyövän hoitoja. Uudet tehokkaat ja potilaan elossaoloa pidentävät lääkehoidot johtavat siihen, että kastraatiohoitokin jatkuu entistä pidempään. Elämänlaatua ja toimintakykyä heikentävien haittojen tunnistaminen ja ehkäisy on tärkeää hoidon alusta lähtien.
Tärkein ehkäisykeino on hoidon välttäminen sellaisilla potilailla, joilla se ei kliinisen tilanteen vuoksi ole välttämätöntä. Lihaskuntoa ja aerobista harjoittelua sisältävä säännöllinen liikuntaohjelma todistetusti vähentää kastraatiohoidon haittoja, ja kaikkia potilaita tulisikin kannustaa liikunnan pariin. Jo lyhyt ohjattu liikuntaharjoittelu parantaa ehkäisevää vaikutusta. Sairaanhoitopiirien tulisi pohtia keinoja miten sellaista voitaisiin tarjota kastraatiohoidon aloittaville potilaille varsinkin, jos heillä ei ole aiempaa kokemusta liikuntaharjoittelusta. Kyseessä on todennäköisesti erittäin kustannusvaikuttava tapa ylläpitää tämän hauraan potilasryhmän toimintakykyä.
Teemu Murtola: Henkilökohtaiset palkkiot (Astellas, Janssen–Cilag, Novartis, Sanofi, Pfizer), osakkeet/optiot (Arocelle). Heikki Seikkula: Luentopalkkiot (Astellas), konsultointipalkkiot (Astellas), matka-, majoitus- tai kokouskulut (Janssen, Ferring,Astellas). Leena Vehmanen: Asiantuntijalautakunnan jäsen (Pfizer), luentopalkkiot (Amgen, Roche), konsultointipalkkiot (Ipsen), matka-, majoitus- tai kokouskulut (Pfizer, Roche). Petteri Hervonen: Asiantuntijatehtävät (Astellas, Janssen, Bayer, Sanofi).
- 1
- Huggins C, Stevens R, Hodges C. Studies on prostatic cancer: II. The effects of castration on advanced carcinoma of the prostate gland. Arch Surg 1941;43:209–23.
- 2
- Walker LM, Tran S, Wassersug RJ, Thomas B, Robinson JW. Patients and partners lack knowledge of androgen deprivation therapy side effects. Urol Oncol 2013;31:1098–105.
- 3
- Nguyen PL, Alibhai SM, Basaria S ym. Adverse effects of androgen deprivation therapy and strategies to mitigate them. Eur Urol 2015;67:825–36.
- 4
- Vermeulen A, Goemaere S, Kaufman JM. Testosterone, body composition and aging. J Endocrinol invest 1999;22(5 suppl):110–6.
- 5
- Berruti A, Dogliotti L, Terrone C ym. Changes in bone mineral density, lean body mass and fat content as measured by dual energy x-ray absorptiometry in patients with prostate cancer without apparent bone metastases given androgen deprivation therapy. J Urol 2002;167:2361–7.
- 6
- Smith MR, Finkelstein JS, McGovern FJ ym. Changes in body composition during androgen deprivation therapy for prostate cancer. J Clin Endocrinol Metab 2002;87:599–603.
- 7
- Saylor PJ, Smith MR. Metabolic complications of androgen deprivation therapy for prostate cancer. J Urol 2013;189(1 suppl):S34–42.
- 8
- Dockery F, Bulpitt CJ, Agarwal S, Donaldson M, Rajkumar C. Testosterone suppression in men with prostate cancer leads to an increase in arterial stiffness and hyperinsulinaemia. Clin Sci (Lond) 2003;104:195–201.
- 9
- Keating NL, O’Malley AJ, Smith MR. Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J Clin Oncol 2006;24:4448–56.
- 10
- Tsai HK, D’Amico AV, Sadetsky N, Chen MH, Carroll PR. Androgen deprivation therapy for localized prostate cancer and the risk of cardiovascular mortality. J Natl Cancer Inst 2007;99:1516–24.
- 11
- Keating NL, O’Malley AJ, Freedland SJ, Smith MR. Diabetes and cardiovascular disease during androgen deprivation therapy: observational study of veterans with prostate cancer. J Natl Cancer Inst. 2010;102:39–46.
- 12
- Albertsen PC, Klotz L, Tombal B, Grady J, Olesen TK, Nilsson J. Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 2014;65:565–73.
- 13
- Lopes RD, Higano CS, Slovin SF ym. Cardiovascular safety of degarelix versus leuprolide in patients with prostate cancer: The primary results of the PRONOUNCE randomized trial. Circulation 2021;144:1295–307.
- 14
- Russell N, Hoermann R, Cheung AS ym. Short-term effects of transdermal estradiol in men undergoing androgen deprivation therapy for prostate cancer: a randomized placebo-controlled trial. Eur J Endocrinol 2018;178:565–76.
- 15
- Mundell NL, Daly RM, Macpherson H, Fraser SF. Cognitive decline in prostate cancer patients undergoing ADT: a potential role for exercise training. Endocr Relat Cancer 2017;24:R145–55.
- 16
- Alibhai SM, Breunis H, Timilshina N ym. Impact of androgen-deprivation therapy on cognitive function in men with nonmetastatic prostate cancer. J Clin Oncol 2010;28:5030–7.
- 17
- DiBlasio CJ, Malcolm JB, Derweesh IH ym. Patterns of sexual and erectile dysfunction and response to treatment in patients receiving androgen deprivation therapy for prostate cancer. BJU Int 2008;102:39–43.
- 18
- Walker LM, Robinson JW. Sexual adjustment to androgen deprivation therapy: struggles and strategies. Qual Health Res 2012;22:452–65.
- 19
- Iversen P, Melezinek I, Schmidt A. Nonsteroidal antiandrogens: a therapeutic option for patients with advanced prostate cancer who wish to retain sexual interest and function. BJU Int 2001;87:47–56.
- 20
- Boccardo F, Rubagotti A, Barichello M, ym. Bicalutamide monotherapy versus flutamide plus goserelin in prostate cancer patients: results of an Italian Prostate Cancer Project study. J Clin Oncol 1999;17:2027–38.
- 21
- Rachner TD, Coleman R, Hadji P, Hofbauer LC. Bone health during endocrine therapy for cancer. Lancet Diab Endocrinol 2018;6:901–10.
- 22
- Shahinian VB, Kuo YF, Freeman JL, Goodwin JS. Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005;352:154–64.
- 23
- Smith MR, Lee WC, Brandman J, ym. Gonadotropin-releasing hormone agonists and fracture risk: a claims-based cohort study of men with nonmetastatic prostate cancer. J Clin Oncol 2005;23:7897–903.
- 24
- Virtanen V, Rautiola H, Poutanen M ym. Uusia työkaluja paikallisesti edenneen ja etäpesäkkeisen eturauhassyövän lääkehoitoon. Duodecim 2020;18:2013–21.
- 25
- Khalaf D, Annala M, Taavitsainen S ym. Optimal sequencing of enzalutamide and abiraterone acetate plus prednisone in metastatic castration-resistant prostate cancer: a multicenter, randomized, open-label, phase 2, crossover trial. Lancet Oncol 2019;20:1730–9.
- 26
- Lee H, Chen H-L, Teoh J ym. Abiraterone and enzalutamide had different adverse effects on the cardiovascular system: a systematic review with pairwise and network meta-analysesProstate Cancer Prostatic Dis 2021;24:244–52.
- 27
- Ruiz Gracia P, Dearden L, Antoni L, ym. Meta-analysis of randomized clinical trials in metastatic castration resistant prostate cancer: comparison of hypertension, neurological and psychiatric adverse events on enzalutamide and abiraterone acetate plus prednisone treatment. Ann Oncol 2016;27:vi243–65.
- 28
- Wang X, Yang H, Hu X ym. Comparing the clinical efficacy and safety of abiraterone and enzalutamide in metastatic castration-resistant prostate cancer: A systematic review and meta-analysis J Oncol Pharm Pract 2021;27:614–22.
- 29
- Salonen AJ, Taari K, Ala-Opas M ym. Advanced prostate cancer treated with intermittent or continuous androgen deprivation in the randomised FinnProstate Study VII: quality of life and adverse effects. Eur Urol 2013;63:111–20.
- 30
- European Association of Urology guidelines: prostate cancer 2021. (siteerattu 2.7.2021). uroweb.org/guideline/prostate-cancer/
- 31
- Teleni L, Chan RJ, Chan A ym. Exercise improves quality of life in androgen deprivation therapy-treated prostate cancer: systematic review of randomised controlled trials. Endocr Relat Cancer. 2016;23:101–12.
- 32
- Bigaran A, Zopf E, Gardner J ym. The effect of exercise training on cardiometabolic health in men with prostate cancer receiving androgen deprivation therapy: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2021;24:35–48.
- 33
- Buffart LM, Kalter J, Sweegers MG ym. Effects and moderators of exercise on quality of life and physical function in patients with cancer: An individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev. 2017;52:91–104.
- 34
- Exercise and quality of life during androgen deprivation therapy, clinicaltrials.gov/ct2/show/NCT04050397
- 35
- Tang BM, Eslick GD, Nowson C, ym. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: A meta-analysis. Lancet 2007;370:657–66.
- 36
- Suomalaisen Lääkäriseuran Duodecimin, Suomen Endokrinologiyhdistyksen ja Suomen Gynekologiyhdistyksen asettama työryhmäOsteoporoosi. Käypä hoito -suositus (päivitetty 14.2.2018). www.kaypahoito.fi
- 37
- Michaelson MD, Kaufman DS, Lee H, ym. Randomized controlled trial of annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer. J Clin Oncol 2007; 25:1038–42.
- 38
- Greenspan SL, Nelson JB, Trump DL, ym. Effect of once-weekly oral alendronate on bone loss in men receiving androgen deprivation therapy for prostate cancer: A randomized trial. Ann Intern Med 2007;146:416–24.
- 39
- Smith MR, Egerdie B, Hernandez Toriz N, ym. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med 2009;361:745–55.
- 40
- Coleman R, Hadji P, Body JJ, ym. Bone health in cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2020;31:1650–63.
The adverse effects of androgen deprivation therapy in the management of prostate cancer
Management of advanced prostate cancer is based on androgen deprivation therapy. Androgen deprivation is initially effective but has several adverse effects affecting quality of life. The most common adverse effects include decreased libido, vasomotor symptoms, sarcopenic obesity and reduced bone mass. Increased risks for cardiovascular events and cognitive impairment have been reported. Due to effective oncological treatment, men with advanced prostate cancer live longer than before, many men are on androgen deprivation therapy for years. Therefore, prevention of adverse effects of androgen deprivation is more important than ever. Regular exercise that improves endurance and maintains muscles and strength has been proven to improve quality of life during androgen deprivation therapy. Regular exercise should be encouraged and supported in this patient group. The risk of skeletal adverse effects can be lowered medically.