Iäkkään potilaan muistisairaus: Diagnostiikan ja hoidon erityispiirteet
• Valtaosa muistisairauteen sairastuneista on iäkkäitä. Oikea-aikainen diagnostiikka ja hoito tukevat toimintakykyä ja elämänlaatua.
• Haurastuminen, monisairastavuus, neuropsykiatriset oireet ja toiminnanvajeet aiheuttavat muutoksia muistisairauden kulkuun. Kokonaisvaltainen geriatrinen arviointi on oleellinen osa diagnostiikkaa ja seurantaa.
• Erityispiirteiden ymmärtäminen auttaa hoitamaan kokonaisvaltaisesti ja vaikuttavia hoitoja valiten. Muistisairaan potilaan kuntoutuksen ja tukemisen vaikuttavuudesta on näyttöä.

On yleistä, että ikääntyneellä muistisairaalla potilaalla esiintyy yhtä aikaa monenlaista aivopatologiaa. Oirekuva on siten moninainen. Ensioireena voi olla samojen asioiden kyseleminen, tavaroiden hukkaaminen, sanojen hakeminen tai toiminnanohjauksen heikkeneminen (1). Joskus muistisairaus voi alkaa käyttäytymisen muutoksella, masennuksella, apatialla tai harhaluuloilla. Vanhuksilla myös painon lasku saattaa olla ensioire (2).
Omaisilta voi saada arvokasta lisätietoa näistä oireista. Perusterveydenhuollon tehtävä on tunnistaa muistisairauden oireet mahdollisimman varhaisessa vaiheessa ja tehdä perusselvitykset.
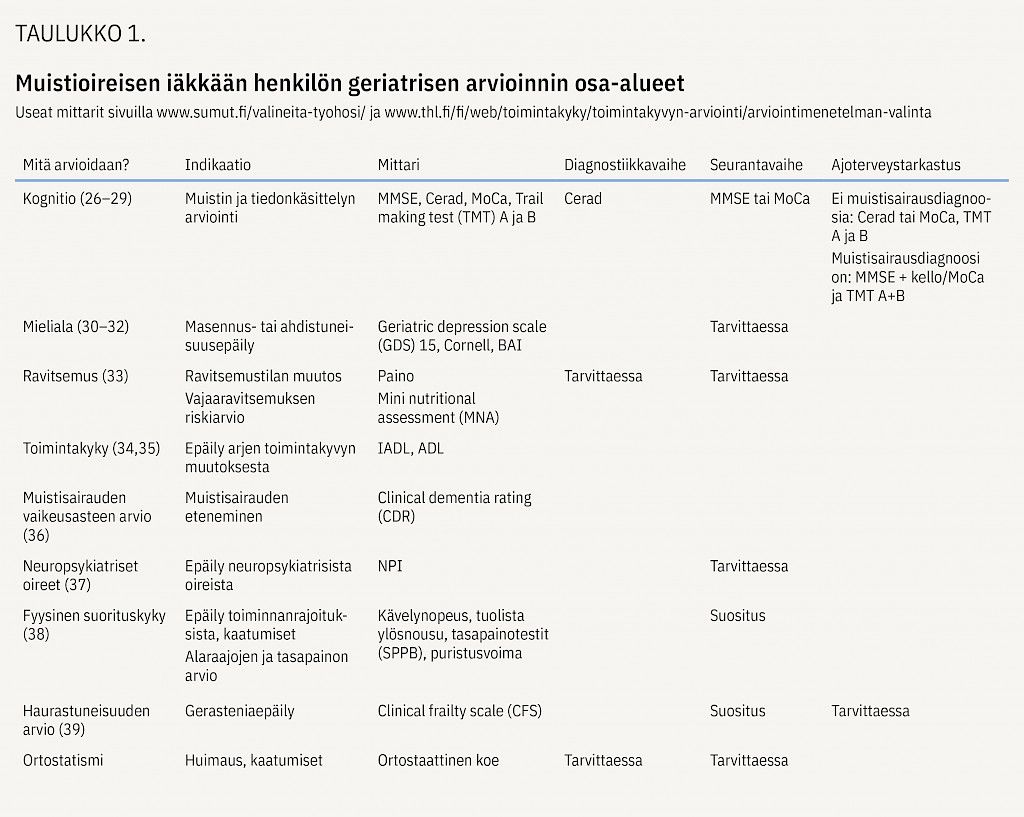
Potilaan tilanne arvioidaan moniammatillisena yhteistyönä kokonaisvaltaisen geriatrisen arvioinnin periaattein. Siinä käytetään kognitiivisen, fyysisen, psyykkisen ja sosiaalisen toimintakyvyn validoituja mittareita (taulukko 1).
Arviossa käydään systemaattisesti läpi sairaudet, oireet, riskitekijät, ravitsemustila ja lääkitys sekä potilaan arkiympäristön olosuhteet, sosiaalinen tukiverkosto, omaisten toiveet ja hyvinvointi. Tärkeää on selvittää potilaan omat toiveet, motivaatio ja voimavarat. Arviointi on potilas- ja omaislähtöistä ja toivoa luovaa (3). Ennakoiva hoidon suunnittelu ja potilaan autonomian vahvistaminen sisältävät myös oikeudellisen toimintakyvyn ja ajoterveyden arvion (4).
Monisairailla on usein monilääkitys. Siksi on tärkeää arvioida kokonaislääkitys yksilöllisesti, erityisesti kognitiota heikentävät lääkkeet, kuten antikolinergit (5). Kognition heikentymisen selvittämiseen kuuluu myös elintapojen, kuten nukkumisen ja päihteiden käytön arviointi.
Diagnoosista hoidon aloitukseen
Diagnostiikka on keskitetty muistipoliklinikoille, ja se etenee samoin kuin nuoremmilla (1). Muistitestejä tehtäessä varmistetaan, että potilas käyttää silmälasejaan ja kuulokojettaan, jos hänellä on sellaiset. Muistitutkimuksia ei kannata toteuttaa akuuttisairaalajaksolla, koska vieras ympäristö ja somaattisen sairauden kuorma voivat heikentää suoriutumista testissä.
Muistisairauden hoidon kokonaisuus suunnitellaan yksilöllisesti. Muistisairauden lääkehoito suunnitellaan niille, joiden sairaus sitä edellyttää (1). Sen rinnalle rakennetaan yksilöllisen neuvonnan ja motivoivan ohjauksen ketju lääkkeettömistä näyttöön perustuvista hoidoista.
Kun muistisairauslääke valitaan, tulee sivuvaikutusprofiilin lisäksi huomioida potilaan kaikki sairaudet ja yhteisvaikutuksia aiheuttavat muut lääkkeet. Erityisesti sydänsairaus ja munuaisen vajaatoiminta voivat vaikuttaa muistisairauslääkkeen valintaan iäkkäällä. Vaskulaaristen vaaratekijöiden hoito on tärkeää.
Siedettävyyden parantamiseksi muistisairauslääkkeen annosta suurennetaan iäkkäillä usein tavallista hitaammin. Lääkehoidon toteutumista tulee seurata säännöllisesti. Yksinasuvilla hoidon toteutus saattaa edellyttää sopimuksia apteekin tai kotihoidon kanssa.
Näyttöön perustuva lääkkeetön hoito
Hoito ja kuntoutus tulisi pohtia kokonaisuutena, koska muistisairauden seuraukset kohdistuvat sekä muistisairaaseen että hänen perheeseensä. Hoidon ja kuntoutuksen tavoitteet asetetaan oireiden ja kokonaistilanteen mukaisesti huomioiden kognitio, toimintakyky, neuropsykiatriset oireet, ravitsemus, omaisen hyvinvointi ja käytettävissä oleva palvelut.
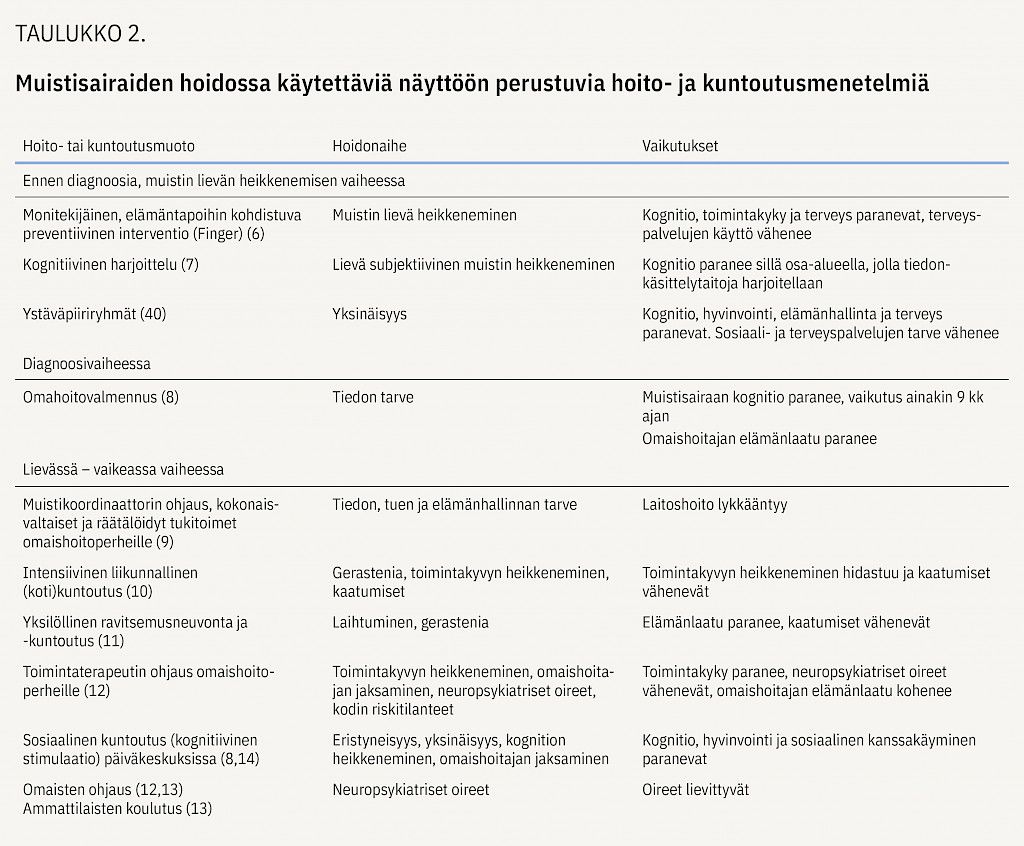
Taudin kaikissa vaiheissa on sovellettavissa erilaisia näyttöön perustuvia interventioita, joilla voidaan hidastaa taudin etenemistä, vahvistaa muistisairaan ja hänen läheistensä kotona selviytymistä ja parantaa heidän elämänlaatuaan (taulukko 2). Vaikuttavissa interventioissa ovat keskeisiä piirteitä asiakaslähtöisyys, yksilöllisyys sekä muistisairaan ja hänen läheisensä aktiivisen toimijuuden tukeminen.
Jo muistin lievän heikkenemisen vaiheessa on näyttöä elämäntapoihin kohdistuvan monitekijäisen intervention vaikutuksesta (liikunta, kognitiivinen harjoittelu, verenpaineen ja kolesterolipitoisuuden hoito, painon hallinta). Kaksi vuotta kestänyt interventio Finger-tutkimuksessa paransi tutkittavien kognitiota ja toimintakykyä sekä vähensi sairaalahoidon tarvetta (6). Kognitiivinen harjoittelu saattaa olla hyödyllistä muistin lievän heikkenemisen vaiheessa mutta ei enää muistisairaudessa (7).
Kun muistisairaus on diagnosoitu, potilaat ja heidän omaisensa hyötyvät ensitiedosta ja ryhmävalmennuksesta. Tästä on esimerkkinä ryhmämuotoisena toteutettu Omahoitovalmennus, jossa vahvistetaan kuntoutujien pystyvyyden tunnetta ja ongelmanratkaisutaitoja. Valmennus parantaa muistisairaan kognitiota ja omaishoitajan elämänlaatua (8).
Potilaat ohjataan varhain muistikoordinaattorille, joka tukee heitä ja omaisia arjessa. Koordinaattoritoiminnan tiedetään pidentävän kotona asumisen aikaa (9). On näyttöä, että muistikoordinaattori voi parhaimmillaan auttaa tuen tarpeiden määrittelyssä ja hoidon oikea-aikaisessa kohdentumisessa.
Liikunnallisen kuntoutuksen vaikuttavuudesta on saatu näyttöä suomalaisessa tutkimuksessa (10). Muistisairaan tarpeisiin räätälöity valmentava, intensiivinen ja pitkäkestoinen kuntoutus kahdesti viikossa kotona lykkää toiminnanvajeita ja vähentää kaatumisia sekä terveyspalvelujen käyttöä.
Muistisairas haurastuu ja hänen ravitsemustilansa heikkenee jo hyvin varhain. Yksilöllinen ravitsemusohjaus parantaa elämänlaatua ja vähentää kaatumisia (11).
Toimintaterapeutin antaman kokonaisvaltaisen toimintojen ohjauksen ja kodin riskitekijöiden arvioinnin vaikuttavuudesta on näyttöä (12). Omaisten koulutuksesta ja ohjauksesta on hyötyä potilaan neuropsykiatristen oireiden lievittymisessä (13). Useissa tutkimuksissa on osoitettu, että sosiaalisesti miellyttävät tilanteet, kuten päivätoiminta, parantavat muistisairaiden kognitiota (14).
Puolison ja läheisten tuki muistisairaan arjen turvaamisessa on hyvin merkityksellistä. Omaisen hyvinvointi on keskeistä sekä pariskunnilla että yksin asuvalla, etenkin jos läheinen on tiiviissä yhteydessä sairastuneeseen. Ulkopuolista tukea, usein kunnan kotihoitoa, tarvitaan monesti jo sairauden lievässä vaiheessa varmistamaan yksin asuvan potilaan kokonaisvaltainen hoito.
Seuranta perusterveydenhuollossa
Seurannassa pyritään tukemaan muistisairaan autonomiaa ja toimintakykyä sekä hidastamaan taudin etenemistä (1). Hoito on moniammatillista ja noudattaa kokonaisvaltaista geriatrista lähestymistapaa (taulukko 1). Tarvittaessa potilas ohjataan lääkärin vastaanoton lisäksi muistikoordinaattorin/muistihoitajan, fysioterapeutin, toimintaterapeutin, ravitsemusterapeutin, puheterapeutin tai sosiaalityöntekijän vastaanotolle. Seuranta järjestetään 6–12 kuukauden välein (1).
Muistisairauden hoito perustuu iäkkäällä kognition, toimintakyvyn, ravitsemustilan ja psyykkisen voinnin seurantaan, ei pelkkään MMSE-pistemäärään. Seurannassa on tärkeintä havaita muutos. Apuna voidaan käyttää kyselylomakkeita (taulukko 1). Jos potilaalla on ajokortti, ajoterveyttä tulee arvioida säännöllisesti (4). Sairauden alusta lähtien on hyvä ottaa puheeksi tulevaisuuden suunnittelu, esimerkiksi edunvalvontavaltuutus ja hoitotahto.
Iäkkäillä muistisairailla esiintyy enemmän gerasteniaa kuin nuoremmilla. Sen ehkäisyssä ovat tuottaneet hyviä tuloksia proteiinin saanti ja liikunta. Liikkumisen heikentyminen ja kaatuminen ovat aiheita fysioterapeutin arvioon liikkumissuunnitelmaa ja apuvälinearviota varten (taulukko 2).
Suurimmalla osalla muistisairaista ilmenee taudin jossain vaiheessa neuropsykiatrisia oireita, kuten apatiaa, masennusta tai harhaluuloja. Ympäristöä kuormittavat ja muistisairaalle vaaralliset oireet, esimerkiksi vaeltelu ja aggressiivisuus, painottuvat muistisairauden edenneisiin vaiheisiin (15). Niiden ilmaantuessa on tärkeä selvittää, onko taustalta esimerkiksi puutteellisesti hoidettu kipu, ummetus, nälkä, haitallinen lääke tai sekavuustilan muu elimellinen syy (16).
Neuropsykiatrisia oireita hoidetaan muistisairauslääkkeiden ohella ensisijaisesti lääkkeettömin hoitokeinoin (1,17). Hankalien neuropsykiatristen oireiden hoitoon voidaan joskus tarvita tilapäisesti psyykenlääkettä. Näiden lääkkeiden teho on kuitenkin usein vaatimaton, ja niillä on iäkkäisiin kohdistuvia haittavaikutuksia (1,18). Lääkevastetta ja haittoja seurataan tiheästi.
Kun toimintakyky heikkenee, muistisairaalle tarjotaan palvelutarpeen arvio ja sen perusteella kotihoitoa tukipalveluineen. Myös sosiaalisen kuntoutuksen mahdollisuudet tulee huomioida ja ohjata potilas mukaan ryhmätoimintaan tai tuetumpaan päivätoimintaan. Lyhytaikaishoito voi tukea kotona selviytymistä ja läheisten jaksamista. Eksymisten varalta voidaan käyttää GPS-paikannusjärjestelmää. Kun toimintakyky heikkenee, tarkistetaan potilaan mahdollisuus eläkettä saavan hoitotukeen, omaishoidon tukeen ja vammaispalvelulain mukaiseen kuljetustukeen (liitetaulukko 1).
Sairauden loppuvaihe
Muistisairauden edettyä vaikeaan vaiheeseen on syytä pohtia, mistä lääkkeistä potilas yhä hyötyy ja mitä lääkitystä voi purkaa (19). Kun toimintakykyä ei enää ole tai neuropsykiatriset oireet ovat sammuneet, voi harkita muistisairauslääkityksen keventämistä, ja jos ongelmia ei ilmene, sen lopettamista. Ympärivuorokautiseen hoitoon siirtyminen ei sinänsä ole syy lopettaa muistisairauslääkkeen käyttöä (1,20).
Edetessään muistisairaus lisää päivittäistä avun ja hoivan tarvetta usein siinä määrin, ettei omaishoitaja enää jaksa vastata tarpeeseen ja/tai kotihoidon tukikeinot eivät riitä potilaan turvalliseen hoitoon kotona. Iäkkään muistisairaus on ympärivuorokautisen hoidon tarpeen merkittävin syy (21). Pitkäaikaishoidon suunnittelussa korostuu moniammatillisuus ja yhteistyö omaisten kanssa.
Loppuvaiheessa hoidossa painottuu perushoivan ja oirehoidon lisäksi elämänlaatu. Potilas voi neuropsykiatristen oireiden ohella kärsiä esimerkiksi kivusta, nielemisvaikeuksista, hengenahdistuksesta tai ummetuksesta. Kun hän ei enää pysty ilmaisemaan itseään sanallisesti, suositellaan käytettäväksi validoituja oiremittareita, kuten Painad-kipumittaria (22).
Dementia on Suomessa yli 75-vuotiaiden toiseksi yleisin kuolinsyy verenkiertoelinsairauksien jälkeen (23). Lähestyvä kuolema on kuitenkin vaikea tunnistaa muistisairaalta. Sairauden kulku ja kesto vaihtelevat hyvin paljon. Lähestyvän kuoleman merkkejä ovat syömisen ongelmat, itsenäisen liikkumisen heikentyminen, hengitysvaikeudet ja se, ettei muistisairas tunnista läheisiään (24,25). On tärkeää tunnistaa edennyt muistisairaus, jotta hoidon painopistettä osataan siirtää oireita lievittäviin hoitomuotoihin (25).
Muistisairauden edetessä on tärkeää myös päivittää elämän loppuvaihetta koskevat konkreettiset suunnitelmat, vaikka potilaan hoitotahto olisikin tiedossa ja ennakoiva hoitosuunnitelma tehty (24). Jos potilas ei enää itse kykene ilmaisemaan mielipidettään, hoitosuunnitelmasta on syytä keskustella lähiomaisen kanssa. Ennakoivalla hoitosuunnitelmalla pyritään takaamaan muistisairaalle häntä hyödyttävä hoito tutussa paikassa ja välttämään tarpeettomia sairaalasiirtoja elämän loppuvaiheessa (liitetaulukko 1).
Tulevaisuus
Noin kymmenen vuoden kuluttua 85-vuotiaita on 40 % enemmän kuin nyt ja 2,5-kertaisesti vuonna 2050. Karkeasti arvioiden noin neljännes heistä sairastuu muistisairauteen. Muistisairaiden määrä tulee siis moninkertaistumaan, koska sairauteen ei vieläkään ole parantavaa hoitoa.
Taudin etenemistä voidaan kuitenkin merkittävästi hidastaa hyvällä hoidolla ja kuntoutuksella. Palvelujen laatu, sujuvuus ja tavoitettavuus sekä hoidon jatkuvuus ovat oleellisia tekijöitä, joilla voimme auttaa ja tukea muistisairaita ja heidän läheisiään. Sote-uudistuksen suunnittelussa palvelujen järjestäminen muistisairaille ratkaisee sosiaali- ja terveydenhuollon kantokyvyn.
Liitetaulukko 1. Muistisairauden seurannassa huomioitavia asioita kognition seurannan lisäksi
Marja-Liisa Laakkonen, Hanna-Maria Roitto, Ulla Aalto, Kaisu Pitkälä: Ei sidonnaisuuksia.
- 1
- Suomalaisen Lääkäriseuran Duodecimin, Societas Gerontologica Fennican, Suomen Geriatrit -yhdistyksen ym. asettama työryhmä. Muistisairaudet. Käypä hoito -suositus 29.01.2021. www.kaypahoito.fi
- 2
- Astell-Burt T, Navakatikyan MA, Feng X. Behavioural change, weight loss and risk of dementia: A longitudinal study. Prev Med 2021 Apr;145:106386. doi: 10.1016/j.ypmed.2020.106386. Epub 2020 Dec 25.PMID: 33370594
- 3
- Pitkälä KH, Tilvis R. Geriatrinen asiantuntemus vähentää vanhusten avuntarvetta. Suom Lääkäril 2012;67:564.
- 4
- Roitto HM, Öhman H. Ajoterveyden arviointi muistisairaalta. Suom Lääkäril 2020;75:1996–9.
- 5
- Uusvaara J. Adverse events among older people associated with use of drugs with anticholinergic properties. Väitöskirja. Helsingin yliopisto 2013. http://urn.fi/URN:ISBN:978-952-10-9176-6
- 6
- Kulmala J, Ngandu T, Havulinna S ym. The effect of multidomain lifestyle intervention on daily functioning in older people. J Am Geriatr Soc 2019;67:1138–44.
- 7
- Kallio EL, Öhman H, Kautiainen H ym. Cognitive training interventions for patients with Alzheimer's Disease: A systematic review. J Alzheimers Dis 2017;56:1349–72.
- 8
- Laakkonen ML, Kautiainen H, Hölttä E ym. Effects of self-management groups for people with dementia and their spouses – randomized controlled trial. J Am Geriatr Soc 2016;64:752–60.
- 9
- Eloniemi-Sulkava U, Saarenheimo M, Laakkonen ML ym. Family care as collaboration: effectiveness of a multicomponent support program for elderly couples with dementia. Randomized controlled intervention study. J Am Geriatr Soc 2009;57:2200-8.
- 10
- Pitkälä KH, Pöysti MM, Laakkonen ML ym. Effects of Finnish Alzheimer Disease Exercise Trial (Finalex). A randomized, controlled trial. JAMA Intern Med 2013;173:894–901.
- 11
- Suominen MH, Puranen TM, Jyväkorpi SK ym. Nutritional guidance improves nutrient intake and quality of life, and may prevent falls in aged persons with Alzheimer Disease living with a spouse (NuAD Trial). J Nutr Health Aging 2015;19:901–7.
- 12
- Bennett S, Laver K, Voigt-Radloff S ym. Occupational therapy for people with dementia and their family carers provided at home: a systematic review and meta-analysis. BMJ Open 2019;11;9(11):e026308.
- 13
- Brodaty H, Arasaratnam C. Meta-analysis of nonpharmacological interventions for neuropsychiatric symptoms of dementia. Am J Psychiatry 2012;169:946–53.
- 14
- Woods B, Aguirre E, Spector AE, Orrell M. Cognitive stimulation to improve cognitive functioning in people with dementia. Cochrane Database Syst Rev.2012;15:CD005562.
- 15
- Borsje P, Wetzels R, Lucassen P, Pot A, Koopmans R. The course of neuropsychiatric symptoms in community-dwelling patients with dementia: A systematic review. Int Psychogeriatrics 2015;27:385–405. doi:10.1017/S1041610214002282
- 16
- Bessey LJ, Walaszek A. management of behavioral and psychological symptoms of dementia. Curr Psychiatry Rep 2019;21:66. doi: 10.1007/s11920-019-1049-5.
- 17
- Hölttä E, Pitkälä K. Muistisairauden neuropsykiatristen oireiden hoito. Suom Lääkäril 2019;74:242–7.
- 18
- Capiau A, Foubert K, Somers A ym. Guidance for appropriate use of psychotropic drugs in older people. Eur Geriatr Med 2021:12;577–83. https://doi.org/10.1007/s41999-020-00439-3
- 19
- Renom-Guiteras A. Potentially inappropriate medication among people with dementia: towards individualized decision-making. Eur Geriatr Med 2021:12;569–75. https://doi.org/10.1007/s41999-021-00502-7
- 20
- Rosenvall A, Hallikainen M, Strandberg T. Alzheimerin taudin lääkehoito taudin eri vaiheissa. Duodecim 2018;134:2531–7.
- 21
- Halonen P, Raitanen J, Jämsen E, Enroth L, Jylhä M. Chronic conditions and multimorbidity in population aged 90 years and over: associations with mortality and long-term care admission. Age Ageing 2019:48:564–70. doi: 10.1093/ageing/afz019. PMID: 30843581.
- 22
- Björkman M, Palviainen L, Laurila J, Tilvis R. Iäkkäiden dementiapotilaiden kivun arviointi. Kahden kipumittarin vertailu. Suom Lääkäril 2007;62:2547–53.
- 23
- Suomen virallinen tilasto (SVT): Kuolemansyyt (verkkojulkaisu). ISSN=1799-5051. Kuolemansyyt 2019. Helsinki: Tilastokeskus (viitattu 15.6.2021). http://www.stat.fi/til/ksyyt/2019/ksyyt_2019_2020-12-14_kat_001_fi.html
- 24
- Lehto J, Marjamäki E, Saarto T. Elämän loppuvaiheen ennakoiva hoitosuunnitelma. Duodecim 2019;135:335–42.
- 25
- Eisenmann Y, Golla H, Schmidt H, Voltz R, Perrar KM. Palliative Care in Advanced Dementia. Front Psychiatry 2020;11:699. doi: 10.3389/fpsyt.2020.00699.
- 26
- Folstein MF, Folstein SE, McHugh PR. ‘Mini-mental state’. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975;12:189–98.
- 27
- http://www.cerad.fi/fi/etusivu
- 28
- Nasreddine ZS, Phillips N, Bédirian V ym. The Montreal Cognitive Assessment (MoCA): A brief screening tool for mild cognitive impairment. J Am Ger Soc 2005;53:695–9.
- 29
- Papandonatos GD, Ott BR, Davis JD ym. Clinical utility of the Trail-Making Test as a predictor of driving performance in older adults. J Am Geriatr Soc 2015;63:2358–64.
- 30
- Yesavage JA, Brink TL, Rose TL ym. Development and validation of a geriatric depression screening scale: a preliminary report. Psych Res 1983;17:31–49.
- 31
- Alexopoulos GS, Abrams RC, Young RC, Shamoian CA. Cornell Scale for Depression in Dementia. Biol Psychiatry 1988;23:271–84.
- 32
- Beck AT, Epstein N, Brown G ym. An inventory for measuring clinical anxiety: psychometric properties. J Consult Clin Psychol 1988;56:893–7.
- 33
- Rubenstein LZ, Harker JO, Salva A ym. Screening for undernutrition in geriatric practice: Developing the short-fom Mini Nutritional Assessment (MNA-SF). J. Geront 2001;56A:M366-77.
- 34
- Katz S, Downs TD, Cash HR, Grotz CR. Progress in development of index of ADL. Gerontologist 1970;10:20–30.
- 35
- Lawton MP, Brody EM. Assessment of older people: Self-maintaining and instrumental activities of daily living. The Gerontologist 1969;9:179–86.
- 36
- Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology 1993:43;2412–14.
- 37
- Cummings JL, Mega M, Gray K, Rosenberg-Thompson S, Carusi DA, Gornbein J. The Neuropsychiatric Inventory: Comprehensive assessment of psychopathology in dementia. Neurology 1994;44:2308–14.
- 38
- Freiberger E, de Vreed P, Schoene D ym. Performance-based physical function in older community-dwelling persons: a systematic review of instruments. Age Ageing 2012;41:712–21.
- 39
- Rockwood K, Song X, MacKnight C ym. A global clinical measure of fitness and frailty in elderly people. CMAJ 2005;173:489–95.
- 40
- Savikko N, Jansson A, Pitkälä K. Yksinäisyys on kognition heikkenemisen merkittävä riskitekijä ikääntyneellä. Suom Lääkäril 2019:74;1189–96.
Characteristics of diagnostics and care of older people with neurocognitive disorders
The majority of people with neurocognitive disorders are older adults. Timely diagnosis and treatment maintain functioning and quality of life.
Frailty, multimorbidity, neuropsychiatric symptoms and functional impairment are common changes in older adults as dementia progresses. Comprehensive geriatric assessment is an integral part of diagnostics and follow-up. Understanding the characteristics of older adults with neurocognitive disorders helps to provide comprehensive care with evidence-based treatments. There is scientific evidence on how to rehabilitate and support older adults with dementia and their families.
Marja-Liisa Laakkonen
M.D., Ph.D., Associate Professor, Geriatrician
Chief Physician, Geriatric Outpatient Clinic, Social Services and Health Care Division, City of Helsinki
email: marja-liisa.laakkonen@hel.fi
Hanna-Maria Roitto
Ulla Aalto
Kaisu Pitkälä