Lasiaisinjektiot mullistivat silmänpohjan kostean ikärappeuman hoidon
• Lasiaiseen annettavat lääkkeet ovat mullistaneet silmänpohjan kostean ikärappeuman hoidon 2000-luvulla ja vähentäneet näkövammaisuuden riskiä.
• Kuivaan ikärappeumaa ei vielä ole tehokasta hoitoa.
• Kostean ikärappeuman hoitoon on odotettavissa lähivuosina biosimilaareja nykyisten lääkeaineiden rinnalle.

Maailman terveysjärjestön WHO:n mukaan maailmassa on 1,3 miljardia näköhäiriöistä kärsivää ihmistä, joista 188,5 miljoonalla on lievä näköhäiriö, 217 miljoonalla keskivaikea ja 36 miljoonaa ihmistä luokitellaan sokeiksi. Silmänpohjan ikärappeuma on Suomessa ja länsimaissa yleisin näkövammaisuuden aiheuttaja vanhuksilla (1,2).
Maailmassa on arvioitu olevan lähes 200 miljoonaa ikärappeumapotilasta, ja määrän ennustetaan nousevan noin 300 miljoonaan vuoteen 2040 mennessä. Suomessa ikärappeumapotilaita arvellaan olevan yli 100 000, ja noin 60 % yli 65-vuotiaiden näkövammadiagnooseista johtuu ikärappeumasta (2). Joka kolmas yli 80-vuotias eurooppalainen sairastaa ikärappeumaa (3).
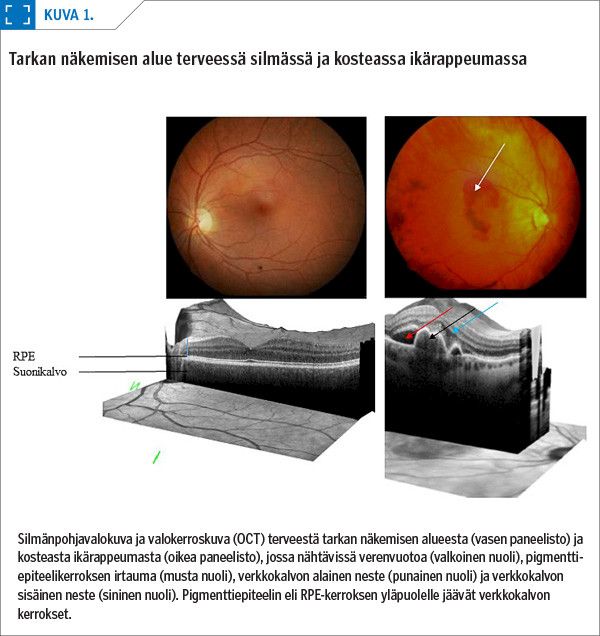
Ikärappeumassa vaurioituu makulan alue, ja tämä johtaa tarkan näkemisen häiriöihin. Suurin osa (80–90 %) ikärappeumapotilaista sairastaa kuivaa muotoa, johon ei toistaiseksi ole tehokasta hoitoa. Kostean muodon diagnostinen piirre on uusien verisuonien kasvaminen suonikalvosta verkkokalvolle (kuva 1). Nämä suonet vuotavat herkästi kudosnestettä ja verta tarkan näkemisen alueelle, ja tästä seuraa verkkokalvon turvotusta ja näön heikkenemistä.
Kosteaa ikärappeumaa (10–20 %) hoidetaan verisuonikasvutekijöiden estäjillä (anti-VEGF), jotka injisoidaan lasiaistilaan. Hoidolla voidaan vähentää uusien verisuonten aktiivisuutta ja näin ollen hidastaa kostean ikärappeuman etenemistä ja sen aiheuttamaa pysyvää näön heikkenemistä.
Ikärappeumaa diagnosoitaessa tulisi päästä varmuuteen siitä, onko kyseessä sairauden kuiva vai kostea muoto. Kosteaa ikärappeumaa epäiltäessä potilas tulisi ohjata tutkimuksiin ja hoidon aloitukseen silmätautien klinikkaan kuukauden kuluessa oirekuvan ilmaantumisesta. Kostean ikärappeuman hoito on mullistunut viime vuosina hoitotulosten parantuessa, mutta samalla silmäklinikoiden kuormitus on kasvanut.
Maailmassa annetaan noin 20 miljoonaa ja Suomessa yli 50 000 lasiaisinjektiota kosteaan ikärappumaan vuosittain (4,5). Kostean ikärappeuman suoritemäärät ovat satakertaistuneet 15 vuodessa (6). Ikärappeuman aiheuttamat vuosikustannukset maailmanlaajuisesti ovat noin 350 miljardia Yhdysvaltain dollaria (4).
Riskitekijät, oireet ja diagnostiikka
Ikääntymisen lisäksi silmänpohjan kuivan ja kostean ikärappeuman riskitekijöitä ovat geneettiset syyt, tupakointi, valtimonkovettumistauti, verenpainetauti, hyperkolesterolemia, ylipaino ja epäterveellinen ruokavalio (7). Lisäksi kostealle ikärappeumalle altistavat runsas kookkaiden drusenien lukumäärä; näitä ikääntymiseen liittyviä täplämäisiä vaaleita kertymiä esiintyy silmänpohjassa pigmenttiepiteelin alla erityisesti tarkan näkemisen alueella. Riskitekijöitä ovat myös huonokuntoinen ja irtautunut pigmenttiepiteelikerros sekä kostea ikärappeuma toisessa silmässä.
Geneettiset assosiaatiot yhdistyvät voimakkaimmin komplementtijärjestelmän geeneihin CFH, CFB, CFI C3 ja C2. Lisäksi ARMS2/HTRA1-geenilokus esiintyy vahvana ikärappeuman taustalla (8).
Kuivassa ja kosteassa ikärappeumassa oirekuva on usein sama, mutta kosteassa muodossa oireet voivat olla voimakkaammat ja etenevät nopeammin, jopa päivissä tai viikoissa (9). Kuiva ikärappeuma etenee vuosien kuluessa.
Tyypillisiä oireita ovat monimuotoiset lähi- ja kaukonäön häiriöt. Yleensä keskeisessä näkökentässä on tumma varjostuma, suorat viivat mutkittelevat tai vinoutuvat. Väri- ja kontrastinäkö heikkenevät, ja tämä vaikeuttaa nimenomaan tarkkaa näkemistä. Näkökentän laidat säästyvät sairaudessa. Oireisiin ei liity kipua.
Diagnoosiluokittelu tehdään anamneesiin, näöntarkkuuden määrityksen, biomikroskooppitutkimuksen ja verkkokalvon valokerroskuvauksen perusteella (optical coherent tomography, OCT tai -angiography, OCT-A). Erotusdiagnostisissa ongelmissa voidaan hyödyntää fluoreseiiniväriainetutkimusta (FAG) tai indosyaniinivihreäväriainetutkimusta (ICG) (10).
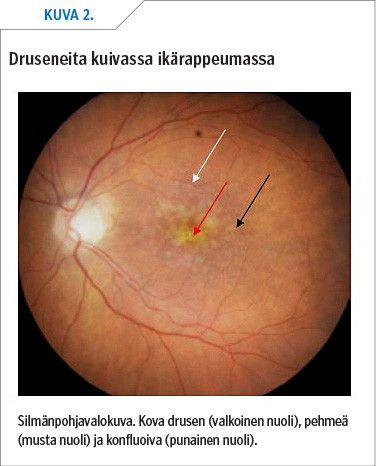
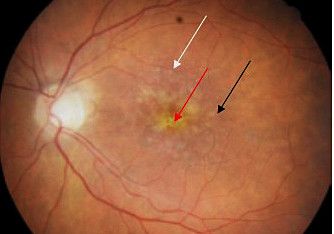
Kuivassa ikärappeumassa havaitaan verkkokalvon pigmenttiepiteelin atrofiaa, drusenkertymiä ja verkkokalvon ohentumista (kuva 2). Kosteassa ikärappeumassa esiintyy verkkokalvon pigmenttiepiteelin (RPE) irtaumaa ja vaurioita, verkkokalvon sisäistä ja verkkokalvon alaista nestekertymää (kuva 1). FAG- ja ICG-kuvissa nähdään väriaineen tihkuminen uudissuonituksesta (10).
Patogeneesi
Makulassa on elimistön voimakkain verenkierto kudospinta-alaan suhteutettuna. Jatkuva valoaltistus, voimakas kudosmetabolia ja suuri happiradikaalipitoisuus altistavat makulan poikkeavan voimakkaalle stressille (11).
Ikääntyessä verkkokalvon pigmenttiepiteelin RPE-solujen kapasiteetti vastata stressiin heikkenee, ja tämä korostuu patologisissa prosesseissa. Antioksidatiiviset, kaitsijaproteiinivälitteiset tai proteolyyttiset puolustusjärjestelmät (proteasomit ja autofagia) eivät kykene selviytymään stressikuormasta. Tämä johtaa haitallisten proteiinikertymien muodostukseen RPE-soluissa (8), mikä näkyy kuvantamistutkimuksissa autofluoresoivan lipofuskiinin lisääntymisenä.
Lisäksi RPE-solujen ja Bruchin kalvon väliin kertyy druseneita osoituksena proteolyysin häiriöstä. Drusenit jaetaan kokonsa perusteella pieniin, keskikokoisiin ja suuriin kertymiin (pienet alle 63 µm, suuret yli 125 µm) tai morfologisesti koviin ja pehmeisiin kertymiin (kuva 2). Lisääntynyt lipofuskiinin ja drusenien määrä korreloi ikärappeuman vaikeusasteeseen ja progressioon (12).
Keskeisessä roolissa ikärappeuman kehittymisessä on mitokondrioiden toimintahäiriö, joka lisää happiradikaalien muodostusta, proteiinivaurioita ja -kertymiä (8). Nämä muutokset lisäävät tulehdusreaktiota, joka osalla potilaista voi johtaa kosteaan ikärappeumaan.
Uudissuonimuodostuksen aktiivisuutta säädellään useiden verisuonikasvutekijöiden avulla, joista VEGF-A on keskeisessä roolissa. VEGF-A:n vaikutukset välittyvät sen reseptorien VEGFR-1:n ja VEGFR-2:n kautta. Hapenpuutteesta kärsivän pigmenttiepiteelisolun on osoitettu tuottavan myös istukkakasvutekijää (13).
Kostean ikärappeuman hoito
Kostean ikärappeuman hoidossa on käytössä kolme vasta-ainepohjaista kasvutekijän estäjää, bevasitsumabi, ranibitsumabi ja brolusitsumabi (9), joista bevasitsumabia käytetään tähän tarkoitukseen myyntiluvasta poiketen (off label). Lisäksi käytössä on aflibersepti.
Bevasitsumabi ja ranibitsumabi sitoutuvat ihmisen vaskulaarisen endoteelikasvutekijä A:n (VEGF-A) isoformeihin ja estävät sitoutumisen VEGFR-1- ja VEGFR-2-reseptoreihin (13). Bevasitsumabi on humanisoitu rekombinantti monoklonaalinen vasta-aine (149 kDa), jota annetaan lasiaistilaan 1,25 mg (0,05 ml). Ranibitsumabi on humanisoitu rekombinantti monoklonaalinen vasta-ainefragmentti (48 kDa), jonka suositeltu annos lasiaistilaan on 0,5 mg (0,05 ml) (9).
Brolisitsumabi on humanisoitu rekombinantti monoklonaalinen yksiketjuinen Fv-vasta-ainefragmentti (26 kDa). Tällä fragmentilla on spesifisen sitoutumisen mahdollistava osa vasta-ainemolekyylin päässä. Lasiaistilaan annettuna suositeltu annos on 6 mg (0,05 ml).
Neljäs ikärappeuman hoidossa käytetty lääke, aflibersepti, on puolestaan fuusioproteiini (97–115 kDa), joka sisältää osia ihmisen verisuonten endoteelin kasvutekijän reseptorien 1 ja 2 solunulkoisista alueista yhdistettynä ihmisen IgG:n Fc-osaan. Lasiaistilaan annettava annos on 2 mg (0,05 ml). Aflibersepti toimii liukoisena syöttireseptorina, joka sitoo VEGF-A:n lisäksi istukkakasvutekijää suuremmalla affiniteetilla kuin näiden luonnolliset reseptorit.
Kaikki nämä anti-VEGF-lääkkeet estävät endoteelisolujen proliferaatiota ja uudissuonimuodostusta sekä vakauttavat verisuonten seinämiä (läpäisevyys vähenee). Istukkakasvutekijä voi lisäksi vähentää tulehduksellista prosessia uudissuonimuodotuksessa. Eri lääkeaineiden tehossa ja turvallisuudessa ei ole kliinisesti merkittäviä eroja muutaman vuoden seurannassa, mutta hoitoresistenteissä tapauksissa on hyvä kokeilla lääkeaineen vaihtoa (14). Lääkkeiden patenttien umpeutuessa markkinoille on odotettavissa biosimilaareja (15).
Kostean ikärappeuman Käypä hoito -suosituksen mukaisesti anti-VEGF-hoito alkaa kolmella kuukauden välein annettavalla injektiohoidolla (6). Nykyisin injektiohoidon antaa usein hoitaja. Klinikan käytännön mukaan hoito toteutetaan tarvittaessa annettavana (pro re nata, PRN) tai hoida ja pidennä (treat and extend, TAE) -hoitoprotokollan mukaisesti. PRN-protokollassa potilaat kontrolloidaan 4–6 viikon välein ja uusi injektiohoitosarja (3 pistosta tai enemmän) annetaan, jos ikärappeumassa todetaan aktiivisuutta. TAE-protokollassa aloitusinjektiosarjan jälkeen pistosväliä pidennetään korkeintaan 2 viikkoa kerrallaan enintään 12 viikkoon saakka, yksittäisillä potilailla tosin jopa 16 viikkoon. Tässä hoidossa annetaan injektio, vaikka aktiivista kosteaa ikärappeumaa ei todetakaan. Jos aktiivisuutta todetaan, tulee kontrolliväliä lyhentää kahdella viikolla. Kontrolloinnissa käytetään ensisijaisesti valokerroskuvausta (OCT). Potilaat tulisi kuitenkin hoitosuosituksen mukaisesti tutkia lääkärin vastaanotolla vähintään 1–2 kertaa vuodessa.
Riittäväksi hoitovasteeksi hyväksytään usein se, että valokerroskuvauksessa ei todeta verkkokalvon turvotusta tai subretinaalista nestettä; pigmenttiepiteelin irtauma sallitaan, jos se ei ole progredioiva (kuva 1). Sairauden aktiivisuutta voidaan arvioida myös OCT-A- tai FAG-tutkimuksella tai kokeilemalla pistostaukoa.
Lopuksi
Silmänpohjan kostean ikärappeuman hoidot ovat muuttaneet silmäklinikoiden toimintaa todennäköisesti enemmän kuin mikään muu aiemmin. Laser- ja fotodynaamiset hoidot osoittautuivat varsin heikoiksi ikärappeumaan vuosikymmeniä sitten. Nykyisin laajentuva lääkearsenaali tarjoaa aiempaa paremman mahdollisuuden yksilölliseen kostean ikärappeuman hoitoon. Tästä syystä ikärappeumasta johtuvaa näkövammaisuutta pystytään hidastamaan varsin tehokkaasti.
Anti-VEGF-valmisteet ovat tuoneet uusia hoitomahdollisuuksia myös diabeettisen makulopatian, laskimotukoksista aiheutuvan makulaturvotuksen ja yksittäisissä tapauksissa myös muiden verkkokalvosairauksien hoitoon.
Lisääntyvä potilasmäärä on johtanut suuriin toimintatapojen ja ammattiryhmien työnjaon muutoksiin silmäklinikoissa. Lasiaiseen annettavia VEGF-estäjiä voidaan pitää yhtenä lääketieteen historian suurimmista innovaatioista.
Niko Kivinen: Koulutuskuluja (Bayer, Novartis).
Kai Kaarniranta: Asiantuntijakorvaukset (Alcon-Novartis, Piiloset, Roche, Santen, Thea)
- 1
- Wong WL, Su X, Li X ym. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014;2:e106–16.
- 2
- Ojamo M. Näkövammarekisterin vuosikirja 2019.
- 3
- Li JQ, Welchowski T, Schmid M ym., Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. Br J Ophthalmol 2020;104:1077–84.
- 4
- Aged-related macular degeneration: facts & figures. BrightFocus Foundation. https://www.brightfocus.org/macular/article/age-related-macular-facts-figures. 5.1. 2019.
- 5
- Kuoppala J, Härkönen U. Loppuraportti: Biologiset lääkkeet silmänpohjan kostean ikärappeuman hoidossa. Lääkealan turvallisuus ja kehittämiskeskus Fimea 2019.
- 6
- Jørstad ØK, Steffensen LA, Eriksen K, Bragadóttir R, Moe MC. Thirteen years of intravitreal anti-vascular endothelial growth factor therapy: the promises and burdens of a paradigm shift told from the perspective of the largest retina service in Norway. Acta Ophthalmol 2020;98:774–9.
- 7
- Suomalaisen Lääkäriseuran Duodecimin, Suomen Silmälääkäriyhdistyksen ja sairaanhoitopiirien silmätautien klinikoiden asettama työryhmä. Kostea silmänpohjan ikärappeuma (AMD). Käypä hoito -suositus 21.3.2017. www.kaypahoito.fi
- 8
- Kaarniranta K, Uusitalo H, Blasiak J ym. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Prog Retin Eye Res 2020;79:100858.
- 9
- Seppänen M, Kaarniranta K, Setälä N, Uusitalo H, toim. Silmätautien käsikirja. Kustannus Oy Duodecim 2021.
- 10
- Kivinen N, Tuulonen A, Kaarniranta K. Silmänpohjan kuvantaminen yleistyy ja tarkentuu. Duodecim 2018;134:1235–43.
- 11
- Kivinen N, Koskela A, Kauppinen A, Kaarniranta K. Silmänpohjan ikärappeuman patogeneesi – autofagian ja inflammasomien vuoropuhelua. Duodecim 2017;133:641–6.
- 12
- Ferrington DA, Sinha D, Kaarniranta K. Defects in retinal pigment epithelial cell proteolysis and the pathology associated with age-related macular degeneration. Prog Retin Eye Res 2016;51:69–89.
- 13
- Kinnunen K, Kaarniranta K. Silmänpohjan kostea ikärappeuma pitää hoitaa ajoissa. Suom Lääkäril 2014;69:2265–8.
- 14
- Karesvuo P, Hakkala L, Kaarniranta K, Uusitalo H, Ojamo M, Tuuminen R. Correlation between the rate of intravitreal injections, use of aflibercept as a second-line treatment and visual impairment for wet AMD in Finland. Acta Ophthalmol, verkossa ensin 24.2.2020. doi: 10.1111/aos.14376
- 15
- Sharma A, Reddy P, Kupperman B, Bandello F, Lowenstein A. Biosimilars in ophthalmology: ”Is there a big change in the horizon?”. Clin Ophthalmol 2018;12:2137–43.
VEGF-A inhibitors have revolutionized the treatment of age-related macular degeneration
Age-related macular degeneration (AMD) is a complex eye disease which is the leading cause of legal blindness in the elderly in western countries. AMD occurs in either dry (80–90%) or wet (10–20%) neovascular) forms. Wet AMD is characterized by the sprouting of new vessels from the choriocapillaris through the Bruch’s membrane into the sub-retinal space or the retina layers. Vascular endothelial growth factor A (VEGF-A) and its receptor are crucial regulators of choroidal neovascularization (CNV) in wet AMD. Bevacizumab, ranibizumab, aflibercept and broclizumab are used to prevent CNV activity. Due to the relatively short half-life of anti-VEGF-A drugs, they have to be administered monthly or at least require close monitoring of the state of the retina. The aim of anti-VEGFA therapy in wet AMD is to decelerate the worsening of visual acuity and to prevent the loss of vision. The use of VEGF-A inhibitors has revolutionized wet AMD therapy.