Lasten ja nuorten myokardiitti – mitä uutta?
• Lasten ja nuorten myokardiitti on useimmiten virusinfektion aiheuttama.
• Diagnoosi edellyttää kliinistä epäilyä ja useiden kliinisten ja laboratoriotutkimustulosten sekä sydämen kuvantamislöydösten yhdistämistä.
• Lasten myokardiitti edellyttää aina sairaalaseurantaa. Hoito on pääsääntöisesti oireenmukaista; verenkierron tukilääkkeitä tai hengitystukea tarvitaan vain harvoin.
• Immunosuppressiivisia lääkkeitä tai immunoglobuliineja ei edelleenkään suositella lasten virusmyokardiitin hoitoon, sillä tutkimusnäyttö ei ole riittävä.
• Myokardiitin ennuste on yleensä hyvä.
Myokardiitti on sydänlihastulehdus, jonka tavallisimpia aiheuttajia ovat infektiot sekä autoimmuuni-, allergiset ja toksiset reaktiot (1,2). Tämä katsaus keskittyy virusmyokardiittiin, joka on kehittyneissä maissa lasten myokardiitin yleisin muoto.
Lasten myokardiitti on todennäköisesti alidiagnosoitu, sillä se voi olla täysin oireeton tai jäädä esimerkiksi akuutissa infektiossa huomaamatta muiden oireiden hallitessa. Toisaalta myokardiitti todetaan akuutin infektion vuoksi sairaalahoitoon joutuneilla lapsilla vain harvoin (3), eikä sen seulonta lievissä virusinfektioissa olekaan aiheellista.
Myokardiitteja esiintyy kaikenikäisillä lapsilla ja nuorilla, mutta ilmaantuvuushuiput todetaan alle 1-vuotiailla ja teini-iässä (4). Suomalaisessa rekisteritutkimuksessa lasten myokardiitin ilmaantuvuudeksi arvioitiin 1,95/100 000 henkilövuotta (5) ja sairaus alkoi yleistyä selvästi varhaisesta teini-iästä lähtien. Yli 75 % sairastuneista oli poikia. Poikien yliedustusta on selitetty mm. suuremmalla fyysisellä aktiivisuudella ja hormonaalisilla tekijöillä (5).
Koska myokardiittia aiheuttavat virukset ovat tavallisia ja infektoivat suurta osaa normaaliväestöstä, sairauden syntyyn tarvitaan geneettinen alttius ja siihen liittyvä immunologinen reaktiomalli (6). Myokardiittipotilaista 16–23 %:lla onkin todettu myös kardiomyopatioihin ja neuromuskulaarisiin sairauksiin liittyviä patogeenisia variantteja mm. sydänlihassolun sarkomeeri-, desmosomi- ja tukirangan proteiineja koodaavissa geeneissä (7,8). Näissä tapauksissa jo olemassa oleva, mahdollisesti latentti sydänlihasvika saattaa altistaa sydämen kardiotrooppisille virusinfektioille.
Patogeneesi
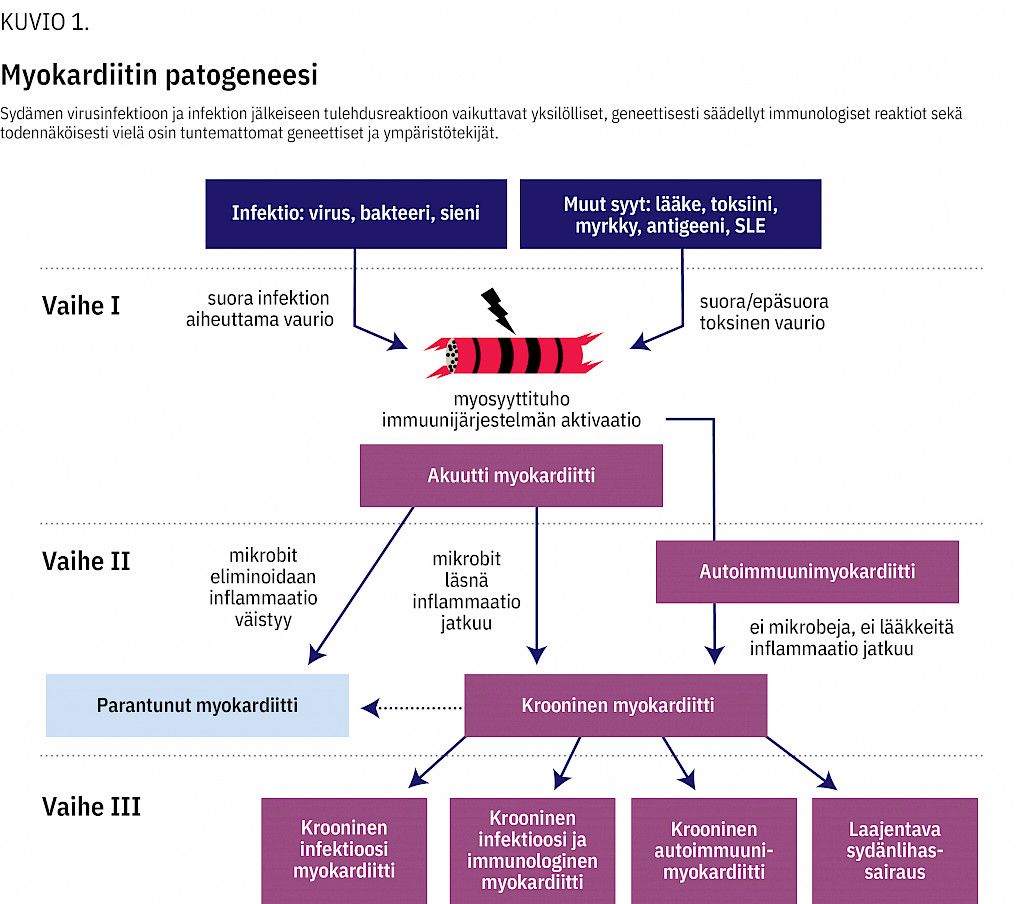
Tietämyksemme myokardiitin patogeneesista perustuu pääosin koe-eläinmalleissa tutkittuihin virusinfektioihin. Niissä myokardiitti voidaan jakaa kolmeen vaiheeseen (9) (kuvio 1).
Ensimmäisessä vaiheessa sydänlihaksen virusinfektio aiheuttaa myosyyttituhoa ja aktivoi elimistön immuunivasteen. Tämä immunologinen reaktio on hyödyllinen, sillä se pyrkii estämään viruksen leviämistä ja eliminoimaan viruksen elimistöstä.
Jos immunologinen reaktio jatkuu, seuraa toinen vaihe, jossa toimijoina ovat mm. spesifiset T-solut, niiden tuottamat proinflammatoriset sytokiinit sekä aktivoituneiden B-solujen tuottamat vasta-aineet. Ensimmäinen vaihe voi olla oireeton ja toinenkin voi väistyä, jos virus eliminoidaan ja immunologinen reaktio sammuu.
Joskus sydänlihasvaurio etenee kolmanteen vaiheeseen, jolle tyypillisiä piirteitä ovat krooninen inflammaatio, arpimuodostus, sydämen supistumishäiriö ja lopulta kammiodilataatio ja sydämen vajaatoiminta. Tätä vaihetta voi edeltää kuukausien tai jopa vuosien oireeton vaihe (1,10,11).
Etiologia
Tavallisimpia akuutin myokardiitin aiheuttajia ovat entero- ja adenovirukset, herpesryhmän viruksista ihmisen herpesvirus 6 (HHV-6), sytomegalovirus ja Epstein–Barrin virus sekä ihmisen parvovirus B19 (12,13). Suomalaistutkimuksessa sytomegalovirus osoittautui yleisimmäksi fataalin myokardiitin aiheuttajaksi sekä lapsilla että aikuisilla (14).
Koronapandemian aikana olemme oppineet, että myös SARS-CoV2-virus ja COVID-19-infektiota vastaan kehitetyt rokotteet voivat aiheuttaa sydänlihasvaurion (15). Lapsilla ja nuorilla COVID-19-infektioon liittyvät myokardiitit ovat harvinaisia ja yleensä lieväoireisia, mutta osalla potilaista taudinkuva on ollut vaikea, jopa fataali (16,17,18).
Lapsilla on kuvattu myös COVID-19-infektioon liittyvä harvinainen hyperinflammatorinen oireyhtymä (multi-inflammatory syndrome in children, MIS-C), joka muistuttaa kliinisesti Kawasakin tautia (19,20). Sille on tyypillistä elimistön yleistynyt tulehdusreaktio sairastetun COVID-19-infektion jälkeen, mutta myös viruksen laukaisema akuutti hyperinflammatorinen reaktio on mahdollinen. Sydänmanifestaatioina on kuvattu mm. myo- ja perikardiittia, sydämen vajaatoimintaa sekä sepelvaltimoaneurysmia (20).
SARS-CoV-2-rokotteisiin liittyvät sydänlihastulehdukset ovat harvinaisia, ja suurentunut riski viikon kuluessa toisesta rokoteannoksesta on todettu lähinnä teini-ikäisillä pojilla ja nuorilla miehillä (21,22). Myokardiitin oireet ovat olleet lieviä, tavallisimmin rintakipua, kuumetta ja hengenahdistusta, ja sairaalahoidon kesto on ollut vain muutamia päiviä (21,22). Tuoreessa brittitutkimuksessa myokardiitin riski oli kahden rokoteannoksen jälkeen selvästi pienempi kuin COVID-19-infektioon liittyvä, eikä rokotetuilla esiintynyt perikardiittia tai rytmihäiriöitä (15). Rokotusten hyötyjen onkin katsottu ylittävän niiden potentiaaliset sydämeen kohdistuvat haitat (15,21,22).
Oireet
Myokardiitti voi olla oireeton. Toisaalta oireet voivat vaihdella pienen lapsen kuumeesta, hengitystieinfektio-oireista, syöttöongelmista ja oksentelusta leikki- tai kouluikäisen lapsen poikkeavaan väsymykseen, huonontuneeseen suorituskykyyn ja rasitushengenahdistukseen (9). Kouluikäisillä lapsilla ja nuorilla myös sydänperäiset oireet, kuten rintakipu ja rytmihäiriötuntemukset ovat tavallisia.
Oireet ovat sitä epäspesifisempiä, mitä nuorempi lapsi on. Vastasyntyneen akuutti myokardiitti on tyypillisesti osa yleisinfektiota ja muistuttaa taudinkuvaltaan bakteerisepsistä (23). Myokardiitti on myös merkittävä lasten ja nuorten äkkikuoleman syy (24). Osa sydänlihastulehduksista voi geneettisesti alttiilla yksilöillä johtaa sydämen vajaatoimintaan ja kroonisen sydänlihasvaurion, laajentavan kardiomyopatian syntyyn (12) (kuvio 1).
Diagnoosi
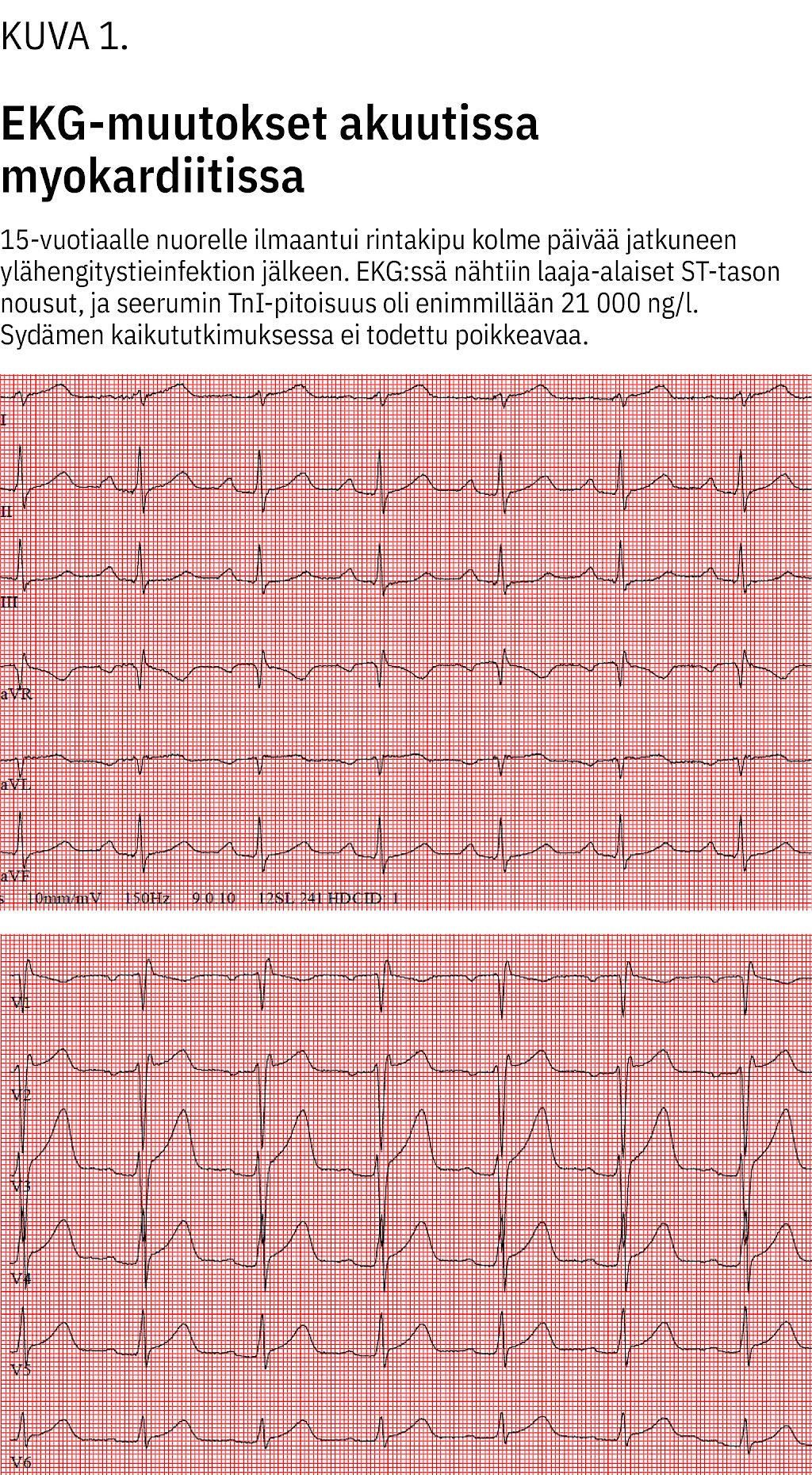
Yhteenveto myokardiitin diagnostisista tutkimuksista, tyypillisistä löydöksistä ja muista huomioon otettavista tekijöistä on esitetty liitetaulukossa (liitetaulukko 1). Akuuttiin myokardiittiin liittyviä EKG-muutoksia nähdään kuvassa (kuva 1).
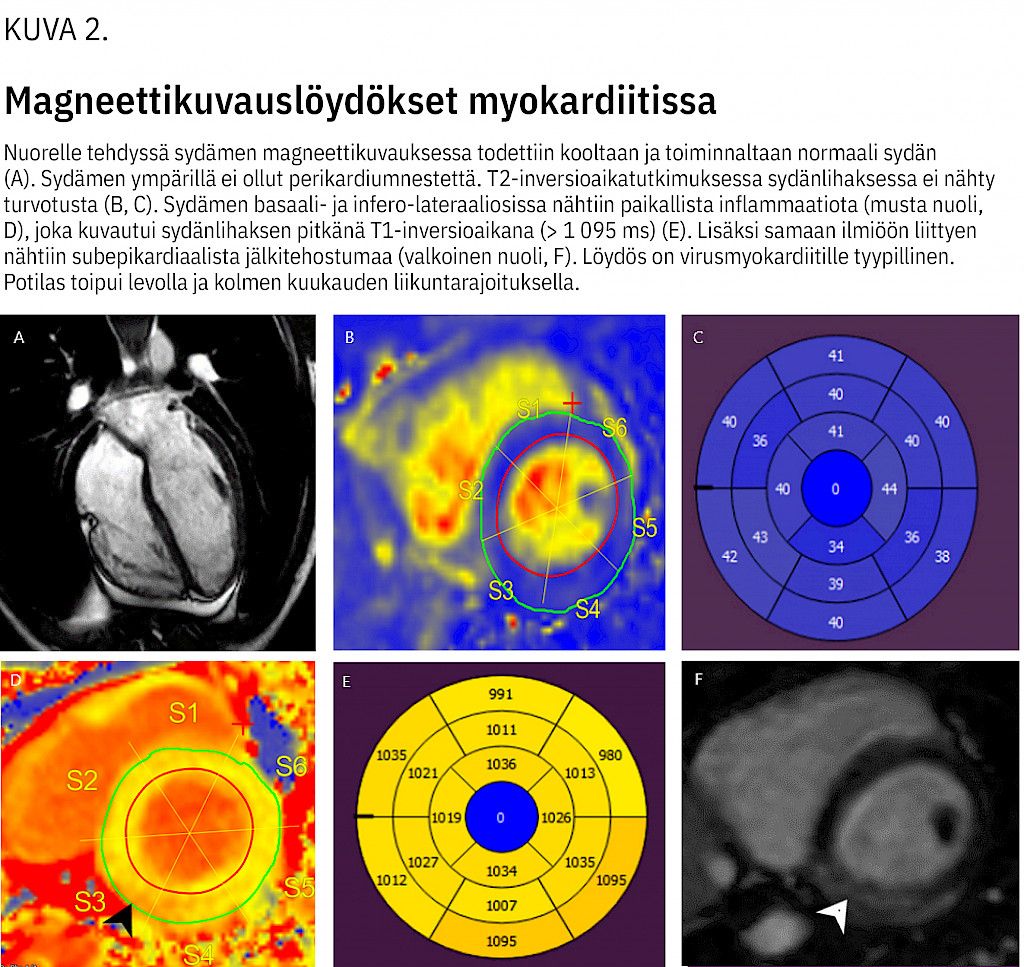
Kuvantamistutkimuksista sydämen kaikututkimus on ensisijainen, mutta viime vuosina magneettikuvaus on saanut yhä enemmän jalansijaa aikuisten myokardiitin diagnostiikassa (25). Magneettikuvauksessa myokardiittiin viittaavat sydänlihassolujen ja soluvälitilan edeemaa kuvaavan T2-signaalin intensiteetin lisääntyminen sekä myosyyttinekroosiin ja fibroosiin liittyvä sydämen myöhäinen tehostuminen gadolinium-merkkiaineella tai T1-signaalilisällä mitattuna (kuva 2).
Seinämäliikehäiriöt ja perikardiumeffuusio tukevat diagnoosia. Magneettikuvauslöydöksiä voitaneen hyödyntää tulevaisuudessa myös lasten myokardiitin hoidon ja seurannan suunnittelussa ja sekä pitkäaikaisennusteen arvioinnissa (26,27,28).
Sydänlihasnäytteen mikroskooppitutkimuksessa todettavat myosyyttien degeneraatio ja nekroosi sekä samalla alueella todettava tulehdussolukertymä ovat olleet perinteisesti myokardiitin diagnostiikan kulmakivi (11). Koska endomyokardiaalibiopsia (EMB) on epäherkkä myokardiitin fokaalisen luonteen vuoksi ja siihen liittyy pienillä lapsilla merkittävä komplikaatioriski eikä siitä saatava informaatio aina vaikuta hoitoon, sen käyttö rajoittuu erikoistilanteisiin (29) (liitetaulukko 1).
Hoito
Jo myokardiittiepäily edellyttää sairaalaseurantaa. Akuutissa vaiheessa vuodelepo ja jatkuva EKG-monitorointi ovat aiheellisia suurentuneen rytmihäiriöriskin vuoksi. Lääkehoito on oireenmukaista kuumeen, kivun ja mahdollisten rytmihäiriöiden hoitoa; perikardiittia hoidetaan tulehduskipulääkkeillä. Lapsi, jolla ei ole sydämen pumpputoiminnan häiriötä, voi kotiutua, kun hän on oireeton ja EKG ja sydänlihasentsyymien pitoisuudet seerumissa ovat normaalistumassa.
Fulminanttiin virusmyokardiittiin, joka todetaan 20–30 %:ssa tapauksista, liittyy usein vaikea sydämen vajaatoiminta sekä rytmi- ja johtumishäiriöitä (30). Näiden potilaiden hoito ja seuranta toteutetaan aina yksilöllisesti tehovalvonnassa, jossa voidaan aloittaa suonensisäinen inotrooppi- ja hengitystukihoito sekä tarvittaessa sydämen tukipumppuhoito tai kehonulkoinen happeuttaminen (ECMO) (12). Myokardiitin spontaani paranemistaipumus on hyvä ottaa huomioon sydämensiirtoa harkittaessa.
Akuutin vaiheen jälkeen sydämen vajaatoimintaa hoidetaan ACE:n estäjillä, beetasalpaajilla ja spironolaktonilla. Takyarytmiat hoidetaan tavanomaisten periaatteiden mukaan. Hemodynaamisesti merkittävä bradykardia ja 2.–3. asteen eteis-kammiokatkos edellyttävät väliaikaista sydämen tahdistusta. Profylaktista antikoagulanttihoitoa harkitaan vaikeassa vasemman kammion systolisessa vajaatoiminnassa (12).
Sekä antiviraalisen, immunosuppressiivisen että immunomodulatorisen hoidon tehoa on ollut vaikea arvioida, koska tutkimusaineistot ovat olleet pieniä, heterogeenisiä ja kontrolloimattomia. Arviointia vaikeuttaa myös se, että suuri osa virusmyokardiiteista paranee spontaanisti. Oikea ajoitus, olipa se sitten viruksen replikaatio-, autoimmuuni- tai kroonisessa vaiheessa, näyttää olevan keskeinen hoidon onnistumisen kannalta (11).
Viruslääkkeiden tehosta myokardiitin hoidossa ei ole satunnaistettuja kontrolloituja tutkimuksia. Interferonia voidaan harkita vaikeissa infektioissa ja virusspesifisiä lääkkeitä mm. herpesryhmän sekä entero-, adeno- ja influenssavirusinfektioissa (1,9,12).
Immunoglobuliineilla on soluviljelmissä sekä antiviraalisia, anti-inflammatorisia että antioksidatiivisia vaikutuksia (6). Niiden tehosta kliinisessä myokardiitissa ei kuitenkaan ole näyttöä (9,30,31). Siksi niitä ei suositella käytettäväksi lasten myokardiitin hoidossa muutoin kuin vakavassa, henkeä uhkaavassa tai muuhun hoitoon reagoimattomassa infektiossa erillisen harkinnan mukaan (9,12,31).
Tutkimustulokset immunosuppressiivisten lääkkeiden tehosta myokardiitin hoidossa ovat olleet ristiriitaisia. Kokeellisessa myokardiitissa immunosuppression on todettu olevan jopa haitallista aktiivisen virusinfektion aikana (6). Nykytietämyksen perusteella immunosuppressiivisia lääkkeitä ei suositella käytettäväksi lasten myokardiitin hoidossa (9,12). Toistaiseksi käyttöaiheina voidaan pitää ainoastaan jättisolumyokardiittia sekä sydämen autoimmuuni- tai yliherkkyysreaktioita (11,32).
COVID-19-infektioon ja SARS-CoV-2-rokotteisiin liittyvät myokardiitit hoidetaan edellä mainittujen periaatteiden mukaan. Tukosriskissä oleville COVID-19-myokardiittipotilaille suositellaan profylaktista antikoagulaatiota sairaalahoidon aikana (20). MIS-C:hen ja COVID-19-infektioon liittyvää hyperinflammaatiota – sydänlihas- tai sepelvaltimomuutoksista riippumatta – hoidetaan immunomodulatorisilla, immunosuppressiivisilla ja antitromboottisilla lääkkeillä (20).
Liikuntarajoitukset
Lievässä myokardiitissa, jossa sydämen kuvantamislöydökset ovat normaalit, liikuntarajoitukset voidaan purkaa yleensä 3 kuukauden kuluessa.
Mikäli akuutissa vaiheessa tehdyissä sydämen kaikututkimuksessa tai magneettikuvauksessa todetaan poikkeavuuksia, liikuntarajoituksia on syytä jatkaa jopa 3–6 kuukauden ajan (33,34). Ennen niiden purkamista suositellaan sydämen kuvantamista, kliinistä rasituskoetta ja EKG:n pitkäaikaisrekisteröintiä.
Koska myokardiittiin liittyy uusiutumisriski ja akuutti sydänlihastulehdus voi johtaa sydänlihaksen krooniseen inflammaatioon (12), myokardiitin sairastaneita lapsia ja nuoria on syytä seurata vähintään kahden vuoden ajan (34).
Ennuste
Lasten myokardiitin ennuste on yleensä hyvä vastasyntyneitä lukuun ottamatta (35). Valtaosa lapsista paranee ilman hoitoa (5), alle 10 % menehtyy tai päätyy sydämensiirtoon (4,36,37).
Sydämen pumppufunktion ja EKG:n normaalistuminen saattaa kuitenkin kestää kuukausia tai jopa vuosia (36). Osalle niistä, jotka näyttävät toipuvan akuutista vaiheesta, voi kehittyä vuosien oireettoman vaiheen jälkeen krooninen sydänlihassairaus (10) (kuvio 1).
Huonoon ennusteeseen viittaavat sydämen vajaatoiminta ja rytmihäiriöt sekä kuvantamistutkimuksissa todettavat vasemman kammion laajeneminen, toimintahäiriö ja fibroosi (10,36,37,38,39,40).
Lopuksi
Lasten myokardiitin diagnostiikka on edelleen haasteellista. Tärkeintä on muistaa epäillä myokardiittia silloin, kun usein epämääräiset oireet ja löydökset eivät selity tavallisemmilla sairauksilla.
On mahdollista, että rytmihäiriöitä ja äkkikuolemia voidaan estää pidättäytymällä liikunnasta aina akuuttien infektioiden aikana (12). Myöhäiskomplikaatioita pyritään estämään myös akuutin vaiheen jälkeisillä liikuntarajoituksilla (34).
Sydämen kuvantamistutkimuksia voidaan käyttää sydänlihasvaurion ja tulehdusreaktion asteen ja myokardiitin ennusteen arvioinnissa sekä yhä enemmän myös hoidon suunnittelussa. Myokardiitin vaiheittaisen patogeneesin ymmärtäminen saattaa tulevaisuudessa mahdollistaa yksilöllisesti räätälöidyn oikea-aikaisen hoidon.
Liitetaulukko 1. Diagnostiset tutkimukset lapsen myokardiittia epäiltäessäAnita Arola: Luentopalkkiot (Suomen Kardiologinen Seura, Sydänlapset ja -aikuiset ry).
Tiina Ojala: Konsultointipalkkio (Sairaala Nova, Keski-Suomen shp), apurahat (Lastentautien tutkimussäätiö, Sydäntutkimussäätiö, HYKS, TYH-rahoitus).
- 1
- Arola A, Ojala T, Lauerma K ym. Lasten myokardiitti – diagnostinen ja hoidollinen haaste. Duodecim 2014;130:317–25.
- 2
- Fung G, Luo H, Qiu Y, Yang D, McManus B. Myocarditis. Circ Res 2016;118:496–514.
- 3
- Renko M, Leskinen M, Kontiokari T, Tapiainen T, Hedberg P, Uhari M. Cardiac troponin-I as a screening tool for myocarditis in children hospitalized for viral infection. Acta Paediatr 2010;99:283–5.
- 4
- Ghelani SJ, Spaeder MC, Pastor W, Spurney CF, Klugman D. Demographics, trends, and outcomes in pediatric acute myocarditis in the United States, 2006 to 2011. Circ Cardiovasc Qual Outcomes 2012;5:622–7.
- 5
- Arola A, Pikkarainen E, Sipilä JOT ym. Occurrence and features of childhood myocarditis: a nationwide study in Finland. J Am Heart Assoc 2017;6:e005306. doi: 10.1161/JAHA.116005306
- 6
- Andréoletti L, Lévêque N, Boulagnon C, Brasselet C, Fornes P. Viral causes of human myocarditis. Arch Cardiovasc Dis 2009;102:559–68.
- 7
- Kontorovich AR, Patel N, Moscati A ym. Myopathic cardiac genotypes increase risk of myocarditis. J Am Coll Cardiol Basic Trans Science 2021;6:584–92.
- 8
- Kontorovich AR, Tang Y, Patel N ym. Burden of cardiomyopathic genetic variation in lethal pediatric myocarditis. Circ Genom Precis Med 2021;14:e003426. doi: 10.1161/CIRCGEN.121.003426
- 9
- Farinha IT, Miranda JO. Myocarditis in paediatric patients: unveiling the progression to dilated cardiomyopathy and heart failure. J Cardiovasc Dev Dis 2016;3:31. doi: 10.3390/jcdd3040031
- 10
- Sagar S, Liu PP, Cooper LT Jr. Myocarditis. Lancet 2012;379:738–47.
- 11
- Caforio AL, Pankuweit S, Arbustini E ym. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013;34:2636–48.
- 12
- Law YM, Lal AK, Chen S ym. Diagnosis and management of myocarditis in children. A scientific statement from the American Heart Association. Circulation 2021;144:e123–35. doi: 10.1161/CIR.0000000000001001
- 13
- Tunuguntla H, Jeewa A, Denfiled SW. Acute myocarditis and pericarditis in children. Pediatr Rev 2019;40:14–25.
- 14
- Kytö V, Vuorinen T, Saukko P ym. Cytomegalovirus infection of the heart is common in patients with fatal myocarditis. Clin Infect Dis 2005;40:683–8.
- 15
- Patone M, Mei XW, Handunnetthi L ym. Risks of myocarditis, pericarditis, and cardiac arrhythmias associated with covid-19 vaccination or SARS-CoV-2 infection. Nat Med 2022;28:410–22.
- 16
- Gnecchi M, Moretti F, Bassi EM ym. Myocarditis in a 16-year-old boy positive for SARS-CoV-2. Lancet 2020;395:e116.
- 17
- Giacomet V, Manfredini VA, Meraviglia G ym. Acute inflammation and elevated cardiac markers in a two-month-old infant with severe acute respiratory syndrome coronavirus 2 infection presenting with cardiac symptoms. Pediatr Infect Dis J 2020;39:e149–51. doi: 10.1097/INF.0000000000002750
- 18
- Nathan N, Prevost B, Sileo C ym. The wide spectrum of covid-19 clinical presentation in children. J Clin Med 2020;9:2950.
- 19
- Helle E, Nieminen T, Ojala T, Vapalahti O, Saxen H, Heinonen S. COVID-19-infektioon liittyvä lasten hyperinflammatorinen oireyhtymä. Duodecim 2021;137:25–35.
- 20
- Henderson LA, Canna SW, Friedman KG ym. American College of Rheumatology Clinical Guidance for multisystem inflammatory syndrome in children associated with SARS-CoV-2 and hyperinflammation in pediatric covid-19: Version 3. Arthritis Rheumatol 2022;74:e1–20 DOI 10.1002/art.42062
- 21
- Das BB, Moskowitz WB, Taylor MB, Palmer A. Myocarditis and pericarditis following mRNA COVID-19 vaccination: What do we know so far? Children 2021;8:607. doi: 10.3390/children8070607
- 22
- Truong DT, Dionne A, Muniz JC ym. Clinically suspected myocarditis temporally related to COVID-19 vaccination in adolescents and young adults. Circulation 2022;145:345–56.
- 23
- Verma NA, Zheng XT, Harris MU ym. Outbreak of life-threatening coxsackievirus B1 myocarditis in neonates. Clin Infect Dis 2009;49:759–63.
- 24
- Lipshultz SE, Sleeper LA, Towbin JA ym. The incidence of pediatric cardiomyopathy in two regions of the United States. N Engl J Med 2003;348:1647–55.
- 25
- Ferreira VM, Schulz-Menger J, Holmvang G ym. Cardiovascuar magnetic resonance in nonischemic myocardial inflammation. Expert recommendations. J Am Coll Cardiol 2018;72:3158–76.
- 26
- Aquaro GD, Ghebru Habtenicael Y, Gamastra G ym. Cardiac Magnetic Resonanance Working Group of the Italian Society of Cardiology. Prognostic value of repeating cardiac magnetic resonance in patients with acute myocarditis. J Am Coll Cardiol 2019;74:2439–48.
- 27
- Gannon MP, Schaub E, Grines CL, Saba SG. State of the art: Evaluation and prognostication of myocarditis using cardiac MRI. J Magn Reson Imaging 2019;49:e122–31. doi: 10.1002/jmri.26611
- 28
- Ammirati E, Frigerio M, Adler ED ym. Management of acute myocarditis and chronic inflammatory cardiomyopathy. An expert consensus document. Circ Heart Fail 2020;13:e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007.405
- 29
- Cooper LT, Baughman KL, Feldman AM ym. American Heart Association; American College of Cardiology; European Society of Cardiology; Heart Failure Society of America; Heart Failure Association of the European Society of Cardiology. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol 2007;50:1914–31.
- 30
- Saji T, Matsuura H, Hasegawa K ym. Comparison of the clinical presentation, treatment, and outcome of fulminant and acute myocarditis in children. Circ J 2012;76:1222–8.
- 31
- Bergmann KR, Kharbanda A, Haveman L. Myocarditis and pericarditis in the pediatric patients: validated management strategies. Pediatr Emerg Med Pract 2015;12:1–22.
- 32
- McDonagh TA, Metra M, Adamo M ym. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2021;42:3599–726.
- 33
- Maron BJ, Udelson JE, Bonow RO ym. Eligibility and disqualification recommendations for competitive athletes with cardiovascular abnormalities: Task Force 3: Hypertrophic cardiomyopathy, arrhythmogenic right ventricular cardiomyopathy and other cardiomyopathies, and myocarditis. A scientific statement from the American Heart Association and American College of Cardiology. Circulation 2015;132:e273–80.
- 34
- Pelliccia A, Solberg EE, Papadakis M ym. Recommendations for participation in competitive and leisure sports in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology. Eur Heart J 2019;40:19–33.
- 35
- Lee KJ, McCrindle BW, Bohn DJ ym. Clinical outcomes of acute myocarditis in childhood. Heart 1999;82:226–33.
- 36
- Abe T, Tsuda E, Miyazaki A, Ishibashi-Ueda H, Yamada O. Clinical characteristics and long-term outcome of acute myocarditis in children. Heart Vessels 2013;28:632–8.
- 37
- Freund MW, Kleinveld G, Krediet TG, van Loon AM, Verboon-Maciolek MA. Prognosis for neonates with enterovirus myocarditis. Arch Dis Child Fetal Neonatal Ed 2010;95:F206–12.
- 38
- Andrews RE, Fenton MJ, Ridout DA, Burch M, on behalf of the British Congenital Cardiac Association. New-onset heart failure due to heart muscle disease in childhood. A prospective study in the United Kingdom and Ireland. Circulation 2008;117:79–84.
- 39
- Foerster SR, Canter CE, Cinar A ym. Ventricular remodeling and survival are more favorable for myocarditis than for idiopathic dilated cardiomyopathy in childhood: an outcomes study from the Pediatric Cardiomyopathy Registry. Circ Heart Fail 2010;3:689–97.
- 40
- Alvarez JA, Orav EJ, Wilkinson JD ym. Pediatric Cardiomyopathy Registry Investigators. Competing risks for death and cardiac transplantation in children with dilated cardiomyopathy: results from the Pediatric Cardiomyopathy Registry. Circulation 2011;124:814–23.
Myocarditis in children and adolescents – what’s new?
Myocarditis is a cardiac inflammatory disease, commonly caused by viral infections in paediatric patients. Diagnosis is challenging because symptoms are nonspecific, especially in infants and small children, often masquerading as respiratory or gastrointestinal infections. Clinical suspicion is crucial and diagnostic workup should be planned accordingly. In the majority of cases, absence of a histologic diagnosis is partly compensated by findings in non-invasive cardiac imaging techniques combined with ECG and biomarkers, such as elevated troponin levels.
Myocarditis can be asymptomatic but may also present with chest pain, arrhythmias, congestive heart failure, and sudden death. In some cases, acute myocarditis may possibly lead to dilated cardiomyopathy, characterized by heart failure, chronic inflammation, and myocyte injury with or without viral persistence.
In most cases, myocarditis resolves spontaneously without any sequelae. Treatment is supportive and includes abstinence from strenuous physical exercise until the disease has resolved completely. Intensive care with invasive circulatory and respiratory support may be needed in some cases. Immunosuppressive therapy and immunoglobulins cannot be recommended in the treatment of childhood myocarditis.
The prognosis of myocarditis is usually fair. However, genetically susceptible individuals may experience recurrences of acute myocarditis episodes and a minority may develop chronic inflammatory heart disease months, years or even decades after the acute phase. During the covid-19 pandemic, we have learned that mRNA vaccines against SARS-CoV-2 can also induce myocarditis, mostly in young male patients, but symptoms are usually mild and clinical outcome favourable. Thus, the risk of complications of covid-19 infection with or without cardiac involvement far exceeds that of the vaccines.
Anita Arola, Tiina Ojala
Tiina Ojala
Associate Professor, Specialist in Paediatric Cardiology
HUS, New Children’s Hospital, Department of Pediatric Cardiology