Metabolinen oireyhtymä yleistyy lapsilla ja nuorilla
Ylipainon yleistyessä myös metabolinen oireyhtymä (MBO) yleistyy jo lapsilla.
Liiallisen energiansaannin lisäksi muun muassa geneettinen alttius ja suoliston mikrobisto vaikuttavat ylipainon kehittymiseen.
Lasten ja nuorten MBO:n eri määritelmien yhteisiä tekijöitä ovat ylipaino sekä koholla oleva verenpaine ja poikkeavat rasva- ja glukoosiarvot.
Liiallinen sokerin saanti altistaa ei-alkoholiperäisen rasvamaksan synnylle jo lapsuudessa ja fruktoosia pidetään yhtenä MBO:n riskitekijänä.
Suurentuneella veren uraattipitoisuudella on merkitystä MBO:n kehittymisessä.
MBO:n hoidossa keskeistä on terveellisten elämäntapojen tukeminen.

Suomalaisista aikuisista 56 % on ylipainoisia ja määrä lisääntyy jatkuvasti. Myös lasten ylipainon esiintyvyys on moninkertaistunut viime vuosikymmenien aikana (1). Liiallinen painonnousu on tärkeää tunnistaa mahdollisimman varhain, koska ylipaino kasvattaa metabolisen oireyhtymän (MBO) riskiä jo lapsuusiässä (2) ja ylipainoisista lapsista tulee ilman hoitoa todennäköisesti myös ylipainoisia aikuisia (3).
Vaikka ylipainolle altistavia geneettisiä tekijöitä tunnetaan jo varsin paljon, ympäristötekijät, erityisesti ravitsemus ja liikunta, ovat keskiössä ylipainon ja metabolisen oireyhtymän ehkäisyssä. Hiljattain havaittiin, että esimerkiksi fruktoosin liiallinen saanti sokeroiduista juomista, makeisista ja pitkälle prosessoiduista ruoista lisää MBO:n riskiä (4).
Määritelmä ja varhaiset riskitekijät
Terveyden ja hyvinvoinnin pohja luodaan sikiökaudella ja ensimmäisten elinvuosien aikana. Jo raskauden aikaiset stressitekijät voivat vaikuttaa siihen, kenelle metabolinen oireyhtymä kehittyy (5). Kroonisten sairauksien riskin kasvamisessa ennen syntymää tai varhaislapsuudessa ympäristötekijöiden vaikutuksesta on kyse geneettisestä ohjelmoinnista eli epigenetiikasta.
Todennäköisyyttä sairastua metaboliseen oireyhtymään (2) ja tyypin 2 diabetekseen (3) myöhemmällä iällä kasvattaa erityisesti useampi yhtäaikainen riskitekijä lapsuudessa (taulukko 1). Ne lisäävät myös ennenaikaisen kuoleman riskiä (3).
Lapsuusiän ylipainoon liittyy aineenvaihdunnallisia muutoksia, jotka altistavat metaboliselle oireyhtymälle. Näitä ovat korkea triglyseridi-, insuliini-, uraatti- ja CRP-pitoisuus sekä matala HDL-kolesterolipitoisuus, kohonnut verenpaine, kasvanut vyötäröympärys, paksuuntunut kaulavaltimo ja rasvamaksa (6).
Ensimmäiset muutokset voidaan havaita jo varhain (2). Suomalaisen tutkimuksen mukaan yli 80 %:lla ylipainoisista lapsista oli kardiovaskulaarisia riskitekijöitä, kuten korkea verenpaine, diabeteksen esiaste tai rasvamaksa ja vain 3 % kyseisistä lapsista oli metabolisesti terveitä (7).
Lasten ja nuorten metabolisen oireyhtymän määritelmiä on lukuisia (8). Niille kaikille yhteisiä tekijöitä ovat ylipaino yhdistyneenä korkeaan verenpaineeseen tai normaalialueen rajat ylittäviin tai alittaviin veren rasva- ja glukoosiarvoihin. Kahden yleisimmän määritelmän (taulukko 2) keskeisiä piirteitä ovat vyötärönympärys, plasman triglyseridi- ja HDL-kolesterolipitoisuus, systolinen (tai systolinen ja diastolinen) verenpaine ja verensokerin paastoarvo. Määritelmät ovat laatineet International Diabetes Federation (IDF) ja National Cholesterol Education Program (NCEP). Näiden kriteerien käyttöä vaikeuttaa kuitenkin se, ettei suomalaislasten vyötärönympärykselle ole olemassa kansallisia viitearvoja.
Riippumatta käytetystä määritelmästä lihavuus korreloi MBO:n esiintyvyyteen: normaalipainoisista lapsista ja nuorista sitä esiintyy noin 1 %:lla, mutta ylipainoisista jo 7–9 %:lla ja lihavista peräti 25–35 %:lla (8).
Ylipainon geneettiset ja ympäristötekijät
Suomalaisessa Hyvän kasvun avaimet -tutkimuksessa (9) uusien kasvustandardien mukaan (10) ylipainoisia oli 30 % 2-vuotiaista pojista ja 17 % tytöistä ja lihavia 5 % pojista ja 4 % tytöistä (11). 2000-luvun puolivälissä suomalaisin pituuspainokriteerein määriteltynä 14 % pojista ja noin 20 % tytöistä oli ylipainoisia. Lihavia oli 4 % pojista ja 6 % tytöistä (12). Lasten ja nuorten terveysseurantatutkimuksessa (LATE 2007–2009) leikki-ikäisistä pojista oli kansainvälisten painoindeksikriteerien mukaan ylipainoisia 10 % ja tytöistä 15 %, kouluikäisistä ylipainoisia oli noin 20 % (13).
Lasten ja nuorten ylipainoepidemia jatkaa leviämistään Suomessa kuten muissakin maissa (1,14). Taustalla vaikuttavat samat elintavat sekä geneettiset, sosiaaliset ja psyykkiset tekijät kuin aikuisillakin. Ylipainolle ja lihavuudelle altistavana tekijänä voidaan pitää erityisesti radikaalisti muuttunutta ruokaympäristöä (mm. elintarvikkeiden helppo saatavuus, isot pakkauskoot, ruokien suurempi näkyvyys ja lapsille suunnatut ruokamainokset) (15).
Samanaikaisesti lasten liikunta-aktiivisuus on vähentynyt. Vain viidesosa kouluikäisistä liikkuu suositusten mukaan (16). Ruutuaika puolestaan on lisääntynyt: vain viisi prosenttia lapsista ja nuorista noudattaa ruutuaikasuosituksia (korkeintaan kaksi tuntia ruutuaikaa päivässä).
Vanhempien ylipaino on yksi suurimmista lapsen ylipainoriskiä kasvattavista tekijöistä. Vaikeasti lihavista lapsista noin 80 %:lla ainakin toinen vanhemmista on lihava ja noin 25–30 %:lla molemmat vanhemmat (17). Myös Hyvän kasvun avaimet -tutkimuksessa ylipainoisten äitien lapset painoivat enemmän ja heillä oli suurempi painoindeksi (Body mass index, BMI) kuin normaalipainoisten äitien lapsilla (11). Vanhempien ylipaino on yleisempää alemmissa sosiaaliluokissa, joissa myös muut lapsen ylipainon riskitekijät korostuvat (18,19).
BMI:n perinnöllisyysaste on tutkimusten mukaan 40–70 % (20). Voimakas periytyvyys saattaa osin selittää lihavuuden hoidon vaikeutta.
Vaikka yksittäiset geenimutaatiot selittävät vain pienen osan ylipainosta lapsilla, ne ovat usein yhteydessä sairaalloiseen lihavuuteen nuorella iällä (21). Useimmiten ylipainolla katsotaan kuitenkin olevan polygeeninen tausta.
Hyvän kasvun avaimet -tutkimuksessa selvitettiin ylipainon geneettistä taustaa 83:sta ylipainoon liittyvästä yhden emäksen variaatiosta (single nucleotide polymorphism, SNP) lasketun geneettisen riskipisteytyksen avulla. Tulokset osoittivat, että lapset, joilla oli suurempi geneettinen riski ylipainoon, painoivat jo kahden vuoden iässä 0,7–1,9 kg enemmän kuin lapset, joilla oli pienempi geneettinen riski (22). Tämä ero on 13 kg painavan kaksivuotiaan painosta jopa noin 15 %.
Äidinmaito suojaa ylipainolta
Varhaisella ravitsemuksella on keskeinen vaikutus myöhempään lihavuusriskiin, kuten tuoreessa kotimaisessa katsauksessa on kuvattu (23). Imetettyjen vauvojen paino nousee keskimäärin korvikeruokittuja hitaammin (24). Imetys (25,26,27) ja vastikään julkaistun kanadalaistutkimuksen mukaan myös osittainen imetys (26) pienentää hieman lapsen ylipainoriskiä. Metabolisen oireyhtymänkin kehittymiseltä imetys voi suojata (27).
Suomessa jopa 87 % lapsista saa äidinmaitoa kuukauden iässä (28). Meillä kuitenkin täysimetetään lapsia huomattavasti lyhyemmän aikaa kuin muissa Pohjoismaissa (24). Hyvän kasvun avaimet -tutkimuksessa täysimetyksen keskimääräinen kesto oli vain 2,6 kuukautta ja imetyksen kokonaiskesto noin 8 kuukautta (11).
Tutkimuksessa havaittiin ylipainoisten äitien lopettavan imetyksen keskimäärin lähes 2 kuukautta normaalipainoisia äitejä aiemmin ja aloittavan aiemmin kiinteiden ruokien antamisen vauvoilleen (11). Myös rintamaidon koostumuksessa on havaittu eroja: ylipainoisten äitien maito sisältää enemmän tyydyttyneitä rasvahappoja ja vähemmän n-3-sarjan monityydyttymättömiä rasvahappoja kuin normaalipainoisten äitien (29).
Yksipuolinen mikrobikanta altistaa ylipainolle
Tätä nykyä tiedetään, että suoliston mikrobikanta ja elimistö ovat symbioottisessa suhteessa ja että ravitsemus vaikuttaa suolistomikrobiston välityksellä paitsi painonhallintaan, myös esimerkiksi ruoansulatukseen, hormonaaliseen ja hermoston toimintaan, tulehdustilaan, immuunipuolustukseen sekä vitamiinien ja entsyymien tuotantoon (30).
Suoliston mikrobikannat eroavat toisistaan lihavilla ja normaalipainoisilla, ja niiden diversiteetti on vähäisempi lihavilla (31).
Koska ensimmäiset vuodet ovat erityisen tärkeitä myöhemmän ylipainoriskin kannalta, suoliston mikrobikannan tasapainoisen kehittymisen arvellaan olevan keskeistä ylipainon ehkäisyssä (30). Kehitys alkaa jo sikiökaudella ja synnytystavallakin on merkitystä: keisarileikkauksella syntyneillä lapsilla on 34 % alateitse syntyneitä suurempi riski tulla ylipainoisiksi (32).
Myös mikrobiston tasapainoa horjuttavien antibioottihoitojen ja ylipainon kehittymisen välillä on todettu yhteys (33).
Rasvapitoinen ruokavaliokin muuttaa suoliston mikrobikantaa aiheuttaen endotoksemiaa ja suoliston läpäisevyyden lisääntymistä. Suoliston läpäisevyyden lisääntymisestä taas seuraa ruoan sisältämän energian tehokkaampi talteenotto ja lihominen (31).
Myös kuidun ja suolistomikrobiston yhteydestä on saatu näyttöä. Mikrobisto erittää entsyymejä ja osallistuu näin kuitujen fermentoimiseen lyhytketjuisiksi rasvahapoiksi. Ne puolestaan lisäävät kylläisyyden tunnetta ja hillitsevät tulehdusta sekä rasvan kertymistä (34).
Viimeaikainen tutkimus onkin osoittanut, että ravitsemuksen yhteyttä lihavuuteen tulee tarkastella aiempaa kokonaisvaltaisemmin. Energiasisältöä suurempi merkitys saattaa olla sillä, miten ruoka vaikuttaa suoliston mikrobikantaan, hermoston toimintaan, kylläisyyteen sekä epigenomiin (35).
Sokerit ja metabolinen oireyhtymä
Pohjimmiltaan ylipainon kehittymisessä on kyse energian saannin ja kulutuksen epäsuhdasta. Lihavuusepidemian taustalla on sekä lapsilla että aikuisilla ruokailutottumusten muutoksen myötä lisääntynyt energiansaanti (15). Yksi keskeisistä muutoksista on energiapitoisten ruokien ja juomien lisääntynyt käyttö.
Suomalaislapset saavat ylimääräisen energian tätä nykyä pääosin sakkaroosista, joka on disakkaridi. Se pilkkoutuu monosakkarideiksi eli glukoosiksi ja fruktoosiksi. Fruktoosin, jota on esimerkiksi hunajassa, liiallinen saanti lisää MBO:n riskiä. Hedelmien pääasiallinen makeuttaja on sakkaroosi, mutta nekin sisältävät fruktoosia. Hedelmien oma fruktoosi ei kuitenkaan kuormita maksaa ja muuta elimistöä, koska niiden energiasisältö on suuren vesipitoisuuden vuoksi kokoon suhteutettuna pieni ja fruktoosi kulkeutuu hitaasti maksan käsiteltäväksi. Hedelmien ja vihannesten syöminen vaikuttaakin myönteisesti painonhallintaan.
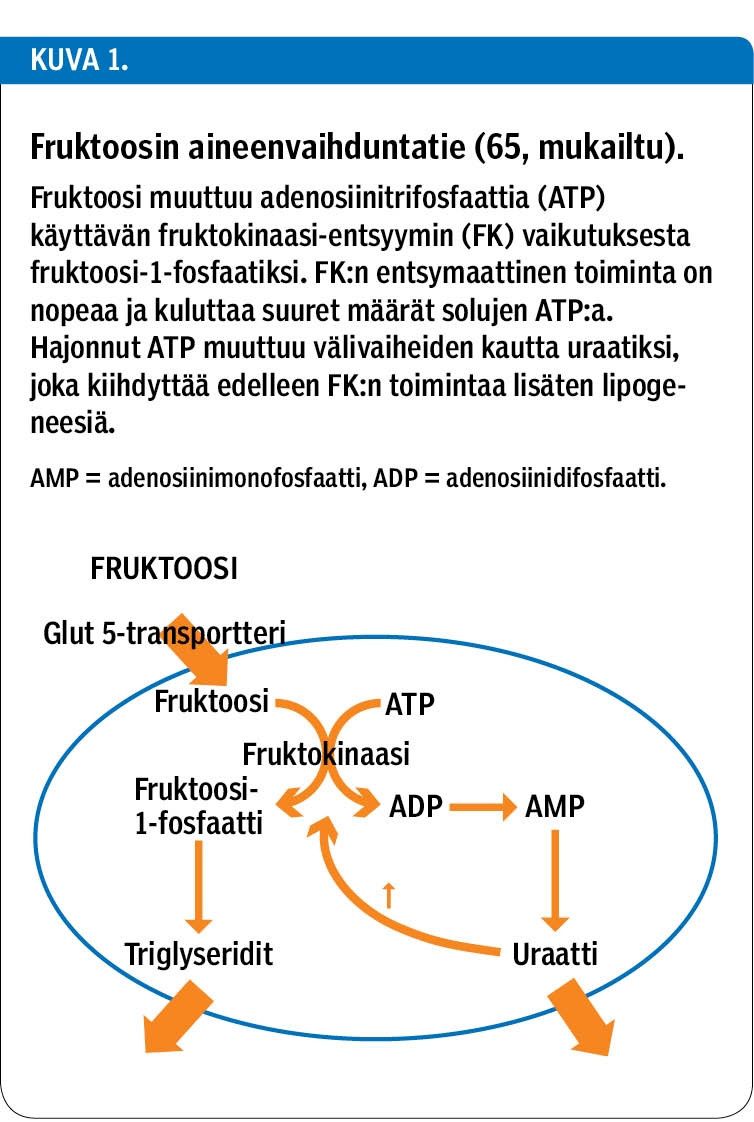
Edullisuutensa vuoksi fruktoosia käytetään elintarviketeollisuudessa esimerkiksi juomissa ja makeisissa. Fruktoosi on kuitenkin monella tapaa erilainen sokeri kuin glukoosi. Se ei aiheuta aivoissa leptiinin välittämää kylläisyyden tunnetta. Myös fruktoosin aineenvaihduntatie on erilainen kuin glukoosin (kuva 1). Fruktoosi metaboloituu yksinomaan maksassa ja käyttää runsaasti adenosiinitrifosfaattia (ATP). Lopputuotteina syntyy rasvahappoja, triglyseridejä ja uraattia. Rasvahapot ja triglyseridit (36) aiheuttavat dyslipidemiaa, maksan ja lihasten rasvoittumista ja edesauttavat insuliiniresistenssin syntyä (4).
Lisääntyneestä rasvakudoksen määrästä seuraa metabolista ja oksidatiivista stressiä. Rasvakudoksesta vapautuu tulehdusvälittäjäaineita, adiposytokiineja (kuten mm. TNF-alfaa), interleukiini 6:a ja leptiiniä, jotka niin ikään edesauttavat insuliiniresistenssin, ei-alkoholiperäisen rasvamaksataudin ja MBO:n kehittymistä (37,38). Suuri fruktoosin saanti aiheuttaa myös verenpaineen kohoamista, todennäköisesti seurauksena natriumin retentiosta, endoteelin toimintahäiriöstä ja uraatin muodostumisesta (39).
Lisätyn sokerin saannin vähentäminen on keskeisessä roolissa MBO:n ennaltaehkäisyssä ja hoidossa. Terveyden ja hyvinvoinnin laitoksen kouluterveyskyselyn perusteella yläasteikäisistä pojista 11 % nauttii sokeroituja mehuja tai virvoitusjuomia 6–7 päivänä viikossa (40). Suomessa on jo vuosia suositeltu lisätyn sokerin (sakkaroosi) osuudeksi korkeintaan 10 % sekä lasten että aikuisten kokonaisenergiansaannista. Lasten fruktoosin saannin rajoittaminen tarkoittaa käytännössä sokeroitujen juomien, makeisten ja pitkälle prosessoitujen ruokien (esim. aamiaismurojen, keksien jne.) säännöstelemistä.
Ei-alkoholiperäistä rasvamaksatautia (NAFLD) esiintyy jo lapsilla
Maksalla on happiradikaalien ja inflammaatiotekijöiden välityksellä ilmeisen keskeinen rooli MBO:ssa. Rasvamaksatautia (non-alcoholic fatty liver disease, NAFLD) pidetäänkin sen maksailmentymänä (41).
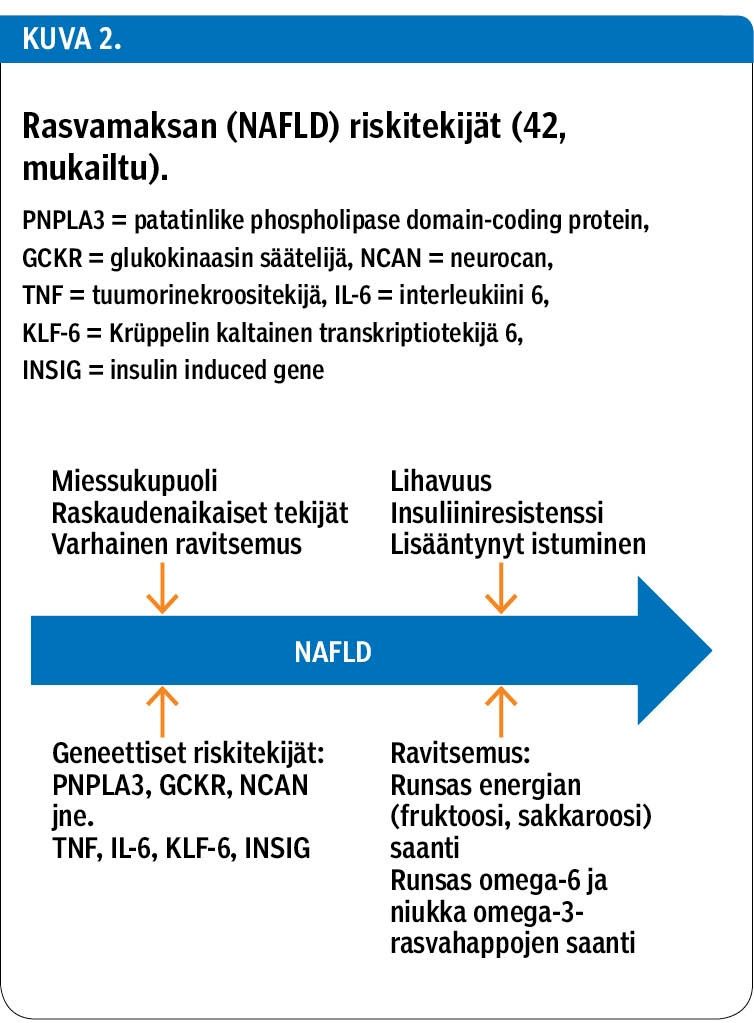
Maksan rasvoittumisen keskeiset riskitekijät ovat lihavuus ja insuliiniresistenssi, mutta NAFLD:n etiologia on monitekijäinen: sen syntyyn vaikuttavat geneettiset tekijät, syntymää edeltävät olosuhteet ja elämäntavat (42) (kuva 2).
NAFLD on tavallisin krooninen maksasairaus länsimaissa. Sitä sairastaa arvioiden mukaan noin 2,6 % kaikista lapsista, mutta lihavista lapsista jopa 53 % (43). Tapaturmaisesti menehtyneistä lihavista amerikkalaisnuorista lähes joka toisella todettiin ruumiinavauksen yhteydessä rasvamaksa (44). NAFLD:n diagnoosi perustuu koepalatutkimukseen ja muiden sairauksien poissulkemiseen.
NAFLD:a sairastavilla lihavilla lapsilla on sekä terveisiin, normaalipainoisiin lapsiin että yhtä lihaviin maksaltaan terveisiin verrokkeihin nähden suurempi kokonaiskolesteroli-, LDL- ja triglyseridipitoisuus. NAFLD:in liittyy tutkimusten mukaan myös kasvanut veren uraattipitoisuus (45,46).
Uraatin merkitys
Uraattia eli virtsahappoa muodostuu normaalisti maksasoluissa ravinnosta saatavien ja elimistössä hajoavien puriiniemästen aineenvaihdunnan lopputuotteena.
Uraatti poistuu pääosin virtsaan. Plasman suurentuneita uraattipitoisuuksia tavataan sairauksissa, joissa uraatin tuottaminen tai poistaminen elimistöstä on häiriintynyt.
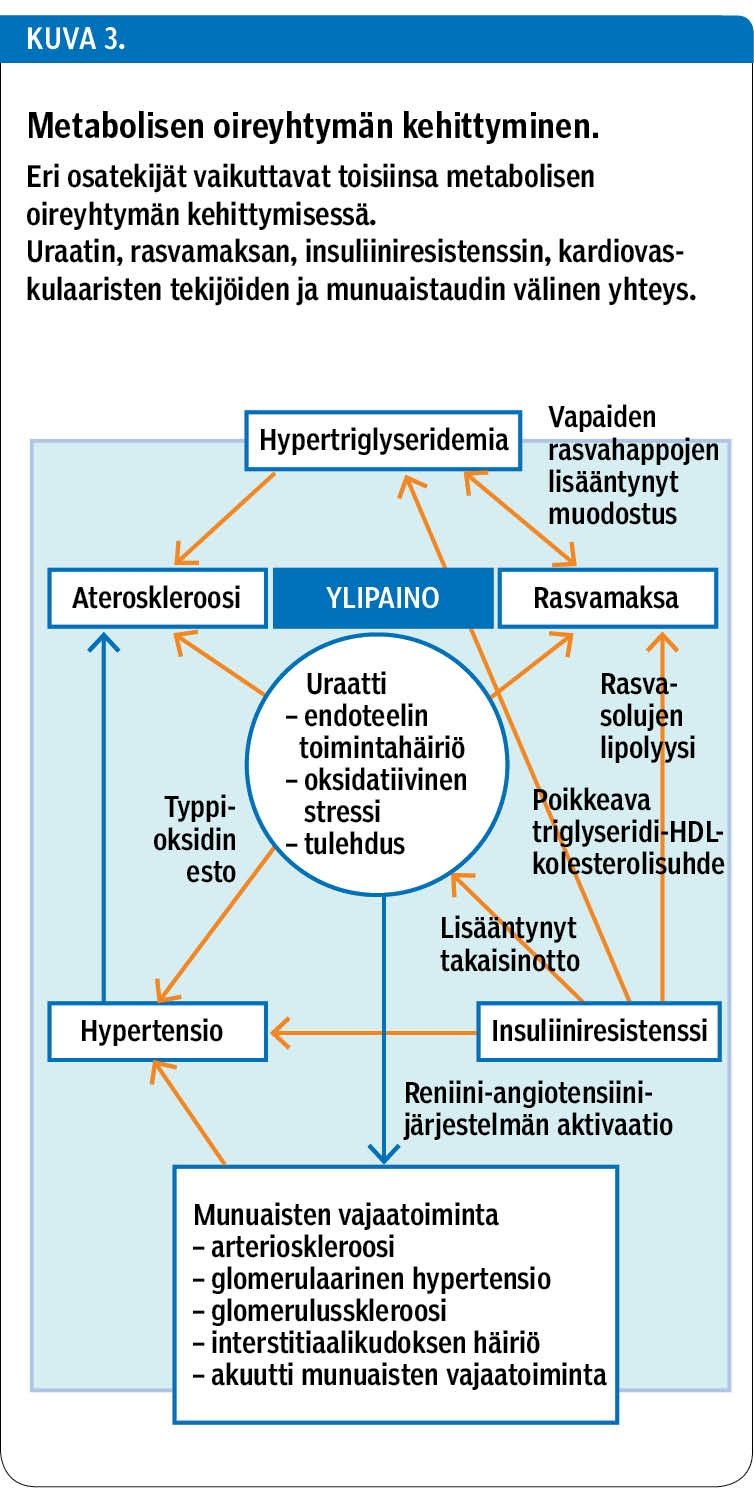
Suurentuneen uraattipitoisuuden tavallisin syy on kuitenkin länsimainen ruokavalio, johon liittyy energian liiallinen saanti erityisesti sokerista ja alkoholista. Hyperurikemian klassinen ilmenemismuoto, kihti, on tiedetty MBO:n itsenäiseksi riskitekijäksi, mutta viime aikoina on korostettu myös oireettoman hyperurikemian merkitystä (47). Uraattipitoisuuden kasvamisella on haitallisia vaikutuksia muun muassa endoteelitoimintaan ja systeemiseen tulehdusvasteeseen (kuva 3) (48,49).
Vaikka laajat epidemiologiset tutkimukset ovat jo aiemmin yhdistäneet uraattipitoisuuden suurenemisen muun muassa lihavuuteen, kohonneeseen verenpaineeseen, sydän- ja verisuonitauteihin, munuaisten vajaatoimintaan, dyslipidemiaan ja tyypin 2 diabetekseen, syy-seuraus-suhteet ovat jääneet epäselviksi. Tuoreissa laajoissa meta-analyyseissä aikuisia koskevista tutkimuksista on osoitettu, että kun uraattipitoisuus kasvaa, sekä metabolisen oireyhtymän että rasvamaksataudin riski kasvaa lineaarisesti (45,46). Lapsilla uraatin ja MBO:n yhteys on todettu muun muassa laajoissa amerikkalaisissa Bogalusa Heart Study- ja NHANES-tutkimuksissa (48,50).
MBO:n kasvaneen riskin tunnistaminen
Ylipainoisen lapsen ja nuoren MBO:n selvittely pitää sisällään neljä osa-aluetta: lääketieteen, ravitsemuksen, liikunnan ja mielenterveyden.
Lääketieteellinen selvittely kohdistuu lapsen kehitykseen ja kasvuun, mahdollisiin muihin sairauksiin (mm. sairastettu maligniteetti), suun terveyteen ja lääkitykseen (51,52). Tutkimuksessa huomioidaan mitat, kehonrakenne, vyötärönympärys, puberteettiaste, tuki- ja liikuntaelimistön kuormituksen merkit, sydän- ja hengitystielöydökset, kilpirauhanen, maksan koko, verenpaine sekä acanthosis nigricans-ihomuutokset (viitteenä insuliiniresistenssistä). Metabolinen tilanne kartoitetaan laboratoriokokeilla.
Muut lihavuutta aiheuttavat sairaudet tulee sulkea pois, mikäli esitiedot, psykofyysisen kehityksen kulku, potilaan tila tai kasvukäyrä antaa aihetta epäillä sellaista. Myös ylipainon mahdollisesti aiheuttamat oireet, joihin kuuluvat esimerkiksi kuorsaus ja apneointi, tulee selvittää. Mikäli niitä esiintyy, on harkittava korvalääkärin konsultaatiota.
Ravitsemukselliseen arviointiin kuuluu ruokailutottumusten selvittäminen, kuten vihannesten, hedelmien, virvoitusjuomien ja mehujen käyttö, aterioiden säännöllisyys ja napostelu sekä pikaruoan ja kotiruoan osuus ruokavaliossa (53).
Liikunnallisessa arvioinnissa kiinnitetään huomiota sekä fyysisen aktiivisuuden määrään ja laatuun että istumiseen ja päätteiden äärellä vietettyyn ruutuaikaan.
Mielenterveydellisessä arvioinnissa taas selvitetään itsetuntoon, kehonkuvaan ja syömisasenteisiin ja -käyttäytymiseen liittyviä kysymyksiä.
Neuvola ja kouluterveydenhuolto löytävät MBO:n riskissä olevat ylipainoiset lapset ja nuoret yleensä kasvukäyrien perusteella. Vaikeampaa on tunnistaa normaalipainoiset, mutta metabolisesti "lihavat" (’’metabolically obese normal weight’’) lapset, joita on arvioiden mukaan 10 % normaalipainoisista (53). Nämä lapset voidaan tunnistaa sukuanamneesin (tyypin 2 diabetes ja/tai kohonnut verenpaine) ja lisääntyneen viskeraalirasvan määrän perusteella (54).
Lihavuuteen ja metaboliseen oireyhtymään liittyvä sydämen ja verenkiertoelimistön kuormittuminen alkaa jo lapsuudessa. Sydämen kuormittuminen (kammiohypertrofia) liittyy suureen BMI:n ja keskivartalolihavuuteen, kohonneeseen verenpaineeseen sekä insuliiniresistenssiin (55,56). Amerikkalaistutkimuksessa 44 %:lla metabolista oireyhtymää sairastavista lapsista todettiin kammiohypertrofia – itsenäisiksi riskitekijöiksi osoittautuivat kohonnut verenpaine ja lihassolujen kasvua kiihdyttävä insuliiniresistenssi (55).
Verenpaineen vuorokausiseuranta on hyödyksi, mikäli arvot ovat yksittäisissä verenpainemittauksissa toistuvasti asianmukaisia viitearvoja korkeammat. Seurannalla saadaan arvioitua tarkemmin verenpaineen vuorokausivaihtelua, niin sanotun piilevän hypertension (joka ei välttämättä näy vastaanotolla) esiintymistä, painoindeksin ja hypertension vaikeusasteen korrelaatiota ja jopa pääte-elinvaurioiden mahdollisuutta (57).
Mikäli verenpaine todetaan rekisteröinnissä kohonneeksi, pääte-elinvauriot arvioidaan sydämen kaikututkimuksella ja silmänpohjatutkimuksella. Sekundaariset korkean verenpaineen syyt suljetaan pois. Kardiometaboliseen riskiarvioon kuuluu myös seerumin rasva-arvojen määrittäminen. Poikkeaviksi katsotaan kokonaiskolesteroliarvo > 5,0 mmol/l, HDL-taso < 1,0 mmol/l, LDL-taso ≥ 3,0 mmol/l ja triglyseridipitoisuus ≥ 1,7 mmol/l.
NAFLD:n diagnoosi perustuu edelleen maksabiopsiaan, joka on kajoava tutkimus ja vaatii yleisanestesian. Maksan tutkiminen joko kaiku- tai magneettikuvauksella tulee suunnitella tapauskohtaisesti.
Alaniiniaminotransferaasin (ALAT) määritystä verestä on käytetty maksan solutuhon ilmaisijana. Nykyistä normaalin ALAT:n viitealueen ylärajaa pidetään kuitenkin viime vuosien tutkimusten perusteella liian korkeana rasvamaksan diagnosoinnin kannalta. Uudeksi viiterajaksi on esitetty pojille arvoa 26 U/l ja tytöille arvoa 22 U/l (58). Hiljattain ilmestyneessä tutkimuksessa maksan rasvoittumiseen viittasi pojilla, mutta ei tytöillä, niinkin pieni seerumin ALAT-pitoisuus kuin > 20 U/l, kun se yhdistyi muihin riskitekijöihin, kuten suurentuneeseen vyötärönympärykseen ja metaboliseen oireyhtymään (59).
Tutkimusnäytön rohkaisemana myös veren uraattipitoisuuden mittaaminen saatetaan tulevaisuudessa ottaa osaksi NAFLD:n selvittelyä. Tulkintaa vaikeuttaa kuitenkin se, että normaalistikin veren uraattipitoisuus kasvaa iän myötä ja on tytöillä tutkimusten mukaan hieman poikia pienempi (52). Laboratorioiden viitearvot on laadittu pääasiassa aikuisten kihtidiagnostiikkaa varten.
Hoito terveellisillä elämäntavoilla
Ravitsemustottumukset muodostuvat varhaislapsuudessa ja pohja myöhemmälle terveydelle rakennetaan jo silloin. Lasten ylipainon varhainen tunnistaminen auttaa ehkäisemään myös metabolisen oireyhtymän syntyä.
Elämäntavat ja normaalipainon tavoitteleminen ovat keskiössä MBO:n ehkäisyssä ja hoidossa. Kuitenkin jo 5 %:n painonlasku parantaa metabolista terveyttä (60).
Kaikkein oleellisinta on saada lapsen tai nuoren liiallinen painonnousu kuriin. Pituutta kasvavalla lapsella jo painonnousun pysäyttäminen usein riittää, sillä pituuskasvun myötä suhteellinen painoprosentti pienentyy ja lapsi hoikistuu.
Hoidon tulee olla moniammatillista. Keskeistä sen onnistumiselle on lapsen koko perheen vahva sitoutuminen. Koko perhettä tulee kannustaa terveellisiin elämäntapoihin ja painonhallintaan. Erityisesti raskautta suunnittelevan naisen ylipainon hoito on tärkeää. Imetystä kannattaa niin ikään tukea, sillä se pienentää lapsen lihomisriskiä ja auttaa myös äitiä painonhallinnassa raskauden jälkeen, mikä on tärkeää erityisesti ylipainoiselle äidille.
Liikunnan myönteinen vaikutus MBO:n hoidossa on selvä. Säännöllisen liikunnan lisääminen auttaa laihtumaan. Liikunta myös vähentää metabolisesti aktiivisen rasvan määrää ja vaikuttaa myönteisesti veriarvoihin (mm. triglyseridit ja insuliini) (61,62).
Varhaiskasvatuksen tuoreet alle kahdeksanvuotiaiden lasten liikuntasuositukset ohjeistavat liikkumaan vähintään kolme tuntia päivässä (63). Isommille koululaisille (8–18-vuotiaille) suositellaan vähintään 1–2 tunnin monipuolista liikkumista päivittäin sekä ruutuajan rajoittamista enintään kahteen tuntiin päivässä (64). Pitkiä yhtämittaisia istumisjaksoja koulupäivän aikana ja vapaa-aikana tulee välttää.
Lopuksi
Lapsen liiallinen painonnousu on tärkeää tunnistaa ajoissa. Ensimmäiset merkit metabolisen oireyhtymän synnystä ovat havaittavissa varhain ja ne voivat johtaa oireyhtymään jo lapsuudessa.
Oireyhtymää sairastavalla nuorella on aikuisena selvästi lisääntynyt sairastavuuden ja ennenaikaisen kuoleman riski, mutta mikäli kuormittavat riskitekijät korjaantuvat ennen aikuisuutta, eliniän ennuste on sama kuin niillä, jotka ovat aina olleet normaalipainoisia. Yhteiskunnan tulisikin osallistua tämän tulevaisuuden merkittävimmän terveyshaasteen voittamiseen tukemalla terveellisiä elintapoja.
Janne Kataja, Johanna Mäkelä,
Hanna Lagström: ei sidonnaisuuksia.
Harri Niinikoski: Kokous- ja kongressikulut (Genzyme, Novo Nordisk, Sandoz), luentopalkkiot (Abbvie, Alexion, Amgen, Shire).
- 1
- Vuorela N, Saha MT, Salo MK. Change in prevalence of overweight and obesity in finnish children – comparison between 1974 and 2001. Acta Paediatr 2011;100:109–15.
- 2
- Mattsson N, Rönnemaa T, Juonala M, Viikari JS, Raitakari OT. Childhood predictors of the metabolic syndrome in adulthood. The Cardiovascular Risk in Young Finns study. Ann Med 2008;40:542–52.
- 3
- Juonala M, Magnussen CG, Berenson GS ym. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med 2011;365:1876–85.
- 4
- Jia G, Aroor AR, Whaley-Connell AT ym. Fructose and uric acid: is there a role in endothelial function? Curr Hypertens Rep 2014;16:434.
- 5
- Maniam J, Antoniadis C, Morris MJ. Early-life stress, HPA axis adaptation, and mechanisms contributing to later health outcomes. Front Endocrinol 2014;5:73.
- 6
- Hakanen M, Lagström H, Pahkala K ym. Dietary and lifestyle counselling reduces the clustering of overweight-related cardiometabolic risk factors in adolescents. Acta Paediatr 2010;99:888–95.
- 7
- Dalla Valle M, Laatikainen T, Kalliokoski T ym. Childhood obesity in specialist care – searching for a healthy obese child. Ann Med 2015;47:639–54.
- 8
- Owens S, Galloway R: Childhood obesity and metabolic syndrome. Curr Atheroscler Rep 2014;16:436.
- 9
- Lagström H, Rautava P, Kaljonen A ym. Cohort profile: Steps to the healthy development and well-being of children (the STEPS study). Int J Epidemiol 2013;42:1273–84.
- 10
- Saari A, Sankilampi U, Hannila ML, Kiviniemi V, Kesseli K, Dunkel L. New Finnish growth references for children and adolescents aged 0 to 20 years: Length/height-for-age, weight-for-length/height, and body mass index-for-age. Ann Med 2011;43:235–48.
- 11
- Mäkelä J, Vaarno J, Kaljonen A, Niinikoski H, Lagström H. Maternal overweight impacts infant feeding patterns – the STEPS Study. Eur J Clin Nutr 2014;68:43–9.
- 12
- Kautiainen S, Koljonen S, Takkinen HM ym. Leikki-ikäisten ylipainoisuus ja lihavuus. Suom Lääkäril 2010;34:2675–83.
- 13
- Mäki P, Hakulinen-Viitanen T, Kaikkonen R ym. Lasten terveys – LATE-tutkimuksen perustulokset lasten kasvusta, kehityksestä, terveydestä, terveystottumuksista ja kasvuympäristöstä. Raportti 2/2010. Helsinki: Terveyden ja hyvinvoinnin laitos.
- 14
- Ng M, Fleming T, Robinson M ym. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980–2013: A systematic analysis for the global burden of disease study 2013. Lancet 2014;384:766–81.
- 15
- Mustajoki P. Ruokaympäristön muutos selittää pääosan väestöjen lihomisesta. Duodecim 2015;131:1345–52.
- 16
- Kokko S, Hämylä R (toim.). Lasten ja nuorten liikuntakäyttäytyminen Suomessa – LIITU-tutkimuksen tuloksia 2014. Valtion liikuntaneuvoston julkaisuja 2015:2. Opetus- ja kulttuuriministeriö.
- 17
- Danielzik S, Langnase K, Mast M, Spethmann C, Muller MJ. Impact of parental BMI on the manifestation of overweight 5–7 year old children. Eur J Nutr 2002;41:132–8.
- 18
- Laitinen J, Power C, Järvelin MR. Family social class, maternal body mass index, childhood body mass index, and age at menarche as predictors of adult obesity. Am J Clin Nutr 2001;74:287–94.
- 19
- Kaikkonen R, Mäki P, Hakulinen-Viitanen T ym. (toim.) Lasten ja lapsiperheiden terveys- ja hyvinvointierot. Raportti 16/2012. Terveyden ja hyvinvoinnin laitos.
- 20
- Wardle J, Carnell S, Haworth CM, Plomin R. Evidence for a strong genetic influence on childhood adiposity despite the force of the obesogenic environment. Am J Clin Nutr 2008;87:398–404.
- 21
- Alharbi KK, Spanakis E, Tan K ym. Prevalence and functionality of paucimorphic and private MC4R mutations in a large, unselected European British population, scanned by meltMADGE. Hum Mutat 2007;28:294–302.
- 22
- Mäkelä J, Lagström H, Pitkänen N ym. Genetic risk clustering increases children’s body weight at 24 months of age – the STEPS Study. Pediatr Obesity 2015. doi 10.1111/ijpo 12087
- 23
- Laine S, Schwab U, Salminen S ym. Imeväisen ravitsemuksen merkitys lihavuuden kehittymisessä. Suom Lääkäril 2015;70:1991–7.
- 24
- Hörnell A, Lagström H, Lande B, Thorsdottir I. Breastfeeding, introduction of other foods and effects on health: A systematic literature review for the 5th Nordic Nutrition Recommendations. Food Nutr Res 2013;57: 10.3402/fnr.v57i0.20823
- 25
- Owen CG, Martin RM, Whincup PH, Smith GD, Cook DG. Effect of infant feeding on the risk of obesity across the life course: A quantitative review of published evidence. Pediatrics 2005;115:1367–77.
- 26
- Rossiter MD, Colapinto CK, Khan MK ym. Breast, formula and combination feeding in relation to childhood obesity in Nova Scotia, Canada. Matern Child Health J 2015;19:2048–56.
- 27
- Zalewski BM, Patro B, Veldhorst M ym. Nutrition of infants and young children (1–3 Years) and its effect on later health: A systematic review of current recommendations (EarlyNutrition Project). Crit Rev Food Sci Nutr, verkossa ensin 9.3.2015. dx.doi.org/10.1080/10408398.2014.888701
- 28
- Uusitalo L, Nyberg H, Pelkonen M, Sarlio-Lähteenkorva S, Hakulinen-Viitanen T, Virtanen S. Imeväisikäisten ruokinta suomessa 2010. Raportti 8/2012. Helsinki: Terveyden ja hyvinvoinnin laitos.
- 29
- Mäkelä J, Linderborg K, Niinikoski H ym. Breast milk fatty acid composition differs between overweight and normal weight women. Eur J Nutr 2013;52:727–735.
- 30
- Rautava S. Lapsen varhaisen mikrobikontaktin terveysvaikutukset. Duodecim 2015;131:2099–106
- 31
- Turnbaugh PJ, Ley RE, Mahowald MA ym. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 2006;444:1027–31.
- 32
- Kuhle S, Tong OS, Woolcott CG. Association between caesarean section and childhood obesity: a systematic review and meta-analysis. Obes Rev 2015;16:295–303.
- 33
- Cox LM, Yamanishi S, Sohn J ym. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. Cell 2014;158:705–21.
- 34
- Hur KY, Lee MS. Gut microbiota and metabolic disorders. Diabetes Metab J 2015;39:198–203.
- 35
- Stenvinkel P. Obesity – a disease with many aetiologies disguised in the same oversized phenotype: has the overeating theory failed? Nephrol Dial Transplant 2015;30:1656–64.
- 36
- Lyssiotis CA, Cantley LC. Metabolic syndrome: F stands for fructose and fat. Nature 2013;502:181–2.
- 37
- Alterio A, Alisi A, Liccardo D ym. Non-alcoholic fatty liver and metabolic syndrome in children: a vicious circle. Horm Res Paediatr 2014;82:283–9.
- 38
- Malik VS, Hu FB. Fructose and cardiometabolic health: What the evidence from sugar-sweetened beverages tells us. J Am Coll Cardiol 2015;66:1615–24.
- 39
- Klein AV, Kiat H. The mechanisms underlying fructose-induced hypertension: a review. J Hypertens 2015;33:912–20.
- 40
- Kouluterveyskysely 2015. Terveyden ja hyvinvoinnin laitos 2015. www.thl.fi/fi/tutkimus-ja-asiantuntijatyo/vaestotutkimukset/kouluterveyskysely
- 41
- Kelishadi R, Cook SR, Adibi A ym. Association of the components of the metabolic syndrome with non-alcoholic fatty liver disease among normal-weight, overweight and obese children and adolescents. Diabetol Metab Syndr 2009;1:29.
- 42
- Nobili V, Alkhouri N, Alisi A ym. Nonalcoholic fatty liver disease: a challenge for pediatricians. JAMA Pediatr 2015;169:170–6.
- 43
- Alisi A, Manco M, Vania A ym. Pediatric nonalcoholic fatty liver disease in 2009. J Pediatr 2009;155:469–74.
- 44
- Schwimmer JB, Deutsch R, Kahen T ym. Prevalence of fatty liver in children and adolescents. Pediatrics 2006;118:1388–93.
- 45
- Liu Z, Que S, Zhou L ym. Dose-response relationship of serum uric acid with Metabolic Syndrome and Non-alcoholic Fatty Liver Disease Incidence: A Meta-analysis of prospective studies. Sci Rep 2015;5:14325.
- 46
- Yuan H, Yu C, Li X ym. Serum uric acid levels and risk of metabolic syndrome: A dose-response meta-analysis of prospective studies. J Clin Endocrinol Metab 2015;100:4198–207
- 47
- Johnson RJ. Why focus on uric acid? Curr Med Res Opin 2015;31(Suppl 2):3–7.
- 48
- Sun D, Li S, Zhang X ym. Uric acid is associated with metabolic syndrome in children and adults in a community: the Bogalusa Heart Study. PLoS One 2014 24;9:e89696.
- 49
- Valle M, Martos R, Cañete MD ym. Association of serum uric acid levels to inflammation biomarkers and endothelial dysfunction in obese prepubertal children. Pediatr Diabetes 2015;16:441–7.
- 50
- Ford ES, Li C, Cook S ym. Serum concentrations of uric acid and the metabolic syndrome among US children and adolescents. Circulation 2007;115:2526–32.
- 51
- Osawa H, Sugihara N, Ukiya T. Metabolic syndrome, lifestyle, and dental caries in Japanese school children. Bull Tokyo Dent Coll 2015;56:233–41.
- 52
- Pulkki-Råback L, Elovainio M, Kivimäki M ym. Depressive symptoms and the metabolic syndrome in childhood and adulthood: a prospective cohort study. Health Psychol 2009;28:108–16.
- 53
- Bridger TL, Wareham A. Beyond BMI: The next chapter in childhood obesity management. Curr Obes Rep 2014;3:321–9.
- 54
- Guerrero-Romero F, Rodriguez-Moran M. Metabolically obese normal-weight children. World J Clin Pediatr 2012;1:37–9.
- 55
- Bostanci BK, Civilibal M, Elevli M ym. Ambulatory blood pressure monitoring and cardiac hypertrophy in children with metabolic syndrome. Pediatr Nephrol 2012;27:1929–35.
- 56
- Skinner AC, Perrin EM, Moss LA ym. Cardiometabolic risks and severity of obesity in children and young adults. N Engl J Med 2015;373:1307–17.
- 57
- Flynn JT, Daniels SR, Hayman LL ym. Update: ambulatory blood pressure monitoring in children and adolescents: a scientific statement from the American Heart Association. Hypertension 2014;63:1116–35.
- 58
- Schwimmer JB, Dunn W, Norman GJ ym. SAFETY study: alanine aminotransferase cutoff values are set too high for reliable detection of pediatric chronic liver disease. Gastroenterology 2010;138:1357–64.
- 59
- Saad V, Wicklow B, Wittmeier K ym. A clinically relevant method to screen for hepatic steatosis in overweight adolescents: a cross sectional study. BMC Pediatr 2015;15:151.
- 60
- Magkos F, Fraterrigo G, Yoshino J ym. Effects of moderate and subsequent progressive weight loss on metabolic function and adipose tissue biology in humans with obesity. Cell Metab 2016;23:591–601.
- 61
- Kelley GA, Kelley KS, Pate RR. Effects of exercise on BMI z-score in overweight and obese children and adolescents: a systematic review with meta-analysis. BMC Pediatr 2014;14:225.
- 62
- Peplies J, Börnhorst C, Günther K ym. Longitudinal associations of lifestyle factors and weight status with insulin resistance (HOMA-IR) in preadolescent children: the large prospective cohort study IDEFICS. Int J Behav Nutr Phys Act 2016;13:97.
- 63
- Iloa, leikkiä ja yhdessä tekemistä – varhaisvuosien fyysisen aktiivisuuden suositukset. Opetus- ja kulttuuriministeriön julkaisuja 21/2016. http://www.minedu.fi/OPM/Julkaisut/2016/Iloa_leikkia.html
- 64
- Ahonen T, Hakkarainen H, Heinonen OJ ym. Fyysisen aktiivisuuden suositus kouluikäisille (7–18 vuotiaille). Opetusministeriö ja Nuori Suomi ry 2008. http://www.ukkinstituutti.fi/filebank/1477-Fyysisen_aktiivisuuden_suositus_kouluikaisille.pdf
- 65
- Feig DI. Serum uric acid and the risk of hypertension and chronic kidney disease. Curr Opin Rheumatol 2014;26:176–85.
Metabolic syndrome in children and adolescents
The incidence of metabolic syndrome has been increasing along with that of obesity. Risk factors for childhood obesity include diet, genetics and the intestinal microbiome. Excess sugar intake in childhood predisposes to metabolic syndrome and, recently, roles of fructose and uric acid in metabolic syndrome have been recognized. Diet and lifestyle advice are the cornerstones of treatment of childhood metabolic syndrome.