Miksi kipu pitkittyy ja voiko sitä ehkäistä?
• Krooninen kipu on yleistä. Se heikentää elämänlaatua ja työkykyä ja tulee yhteiskunnalle kalliiksi.
• Taustalla on perimään, inflammaatioon ja aivojen plastisuuteen liittyviä sekä psykososiaalisia tekijöitä.
• Kivun pitkittymistä voi estää puuttumalla varhain paikallisiin kiputiloihin. Akuutti kipu ja taustasairaudet tulee hoitaa tehokkaasti.
• Tärkeää on myös poistaa psykososiaaliset paranemisen esteet.
• Elintavat vaikuttavat kivun taustasairauksien syntyyn ja herkistävät kivulle. Terveellisiä elintapoja tulisi tukea lapsuudesta lähtien.
Kansainvälisen kivuntutkimusyhdistyksen (IASP) määritelmän mukaisesti kipu on epämiellyttävä sensorinen ja emotionaalinen kokemus, johon liittyy todellinen tai mahdollinen kudosvaurio tai jota kuvataan kudosvaurion käsittein. Kipu on kroonista, jos se on kestänyt 2–6 kuukautta tai pitempään kuin mitä kudosten normaali paraneminen edellyttäisi.
Krooniset kiputilat jaetaan kolmeen luokkaan: 1) kudosvauriosta ja tulehduksesta johtuva (esim. nivelrikko, reuma) 2) hermovaurion seurauksena syntynyt (esim. traumaattinen, infektioon tai metaboliseen sairauteen liittyvä, aivoinfarktin jälkeinen) ja 3) idiopaattinen (patofysiologiaa ei tunneta).
Krooninen kipu – oire vai sairaus?
Akuutti kipu on hengissä pysymisen kannalta välttämätön viesti, joka auttaa akuutin vaurion korjaamisprosessissa. Evoluution näkökulmasta myös kipuun liittyvä pelko ja ahdistus ovat hyödyllisiä, koska ne opettavat välttämään elimistölle vahingollista käyttäytymistä. Kivun kroonistuessa tämä suojaava ja varoittava merkitys jää taka-alalle ja kipu muuttuu lähinnä haitalliseksi oireeksi. Lisäksi siihen liittyvä pelko ja ahdistus saattavat liiallisina muodostua kuntoutumisen esteiksi.
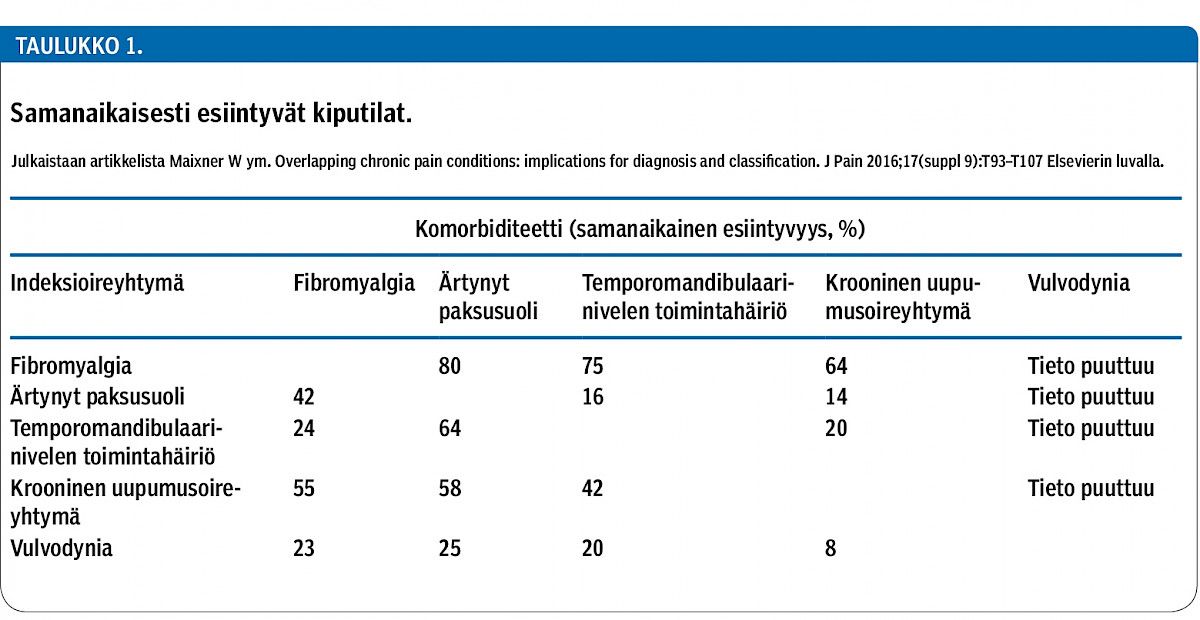
Pitkäaikainen kipu voidaan käsittää myös sairaudeksi, jos se jatkuu alkuperäisen vaurion korjaantumisesta huolimatta tai jos se on muuttunut potilaan oirekokonaisuuden keskeiseksi tekijäksi. Esimerkiksi nivelrikkoon liittyvä kipu jatkuu noin 10–15 %:lla potilaista, vaikka vaurioitunut nivel on korvattu tekonivelellä. "Kipusairauden" käsite voi kattaa myös laaja-alaiset, päällekkäiset tai kumuloituvat kiputilat (taulukko 1) (1).
Krooniseen kipuun liittyy paljon liitännäisongelmia kuten ahdistusta, masennusta, unettomuutta ja kognitiivista heikentymistä. Ne voivat olla kivun seurausta, mutta myös ylläpitää sitä ja altistaa kivun pitkittymiselle. Ongelmilla on osin yhteinen geneettinen tausta.
Biopsykososiaalinen kokonaisuus
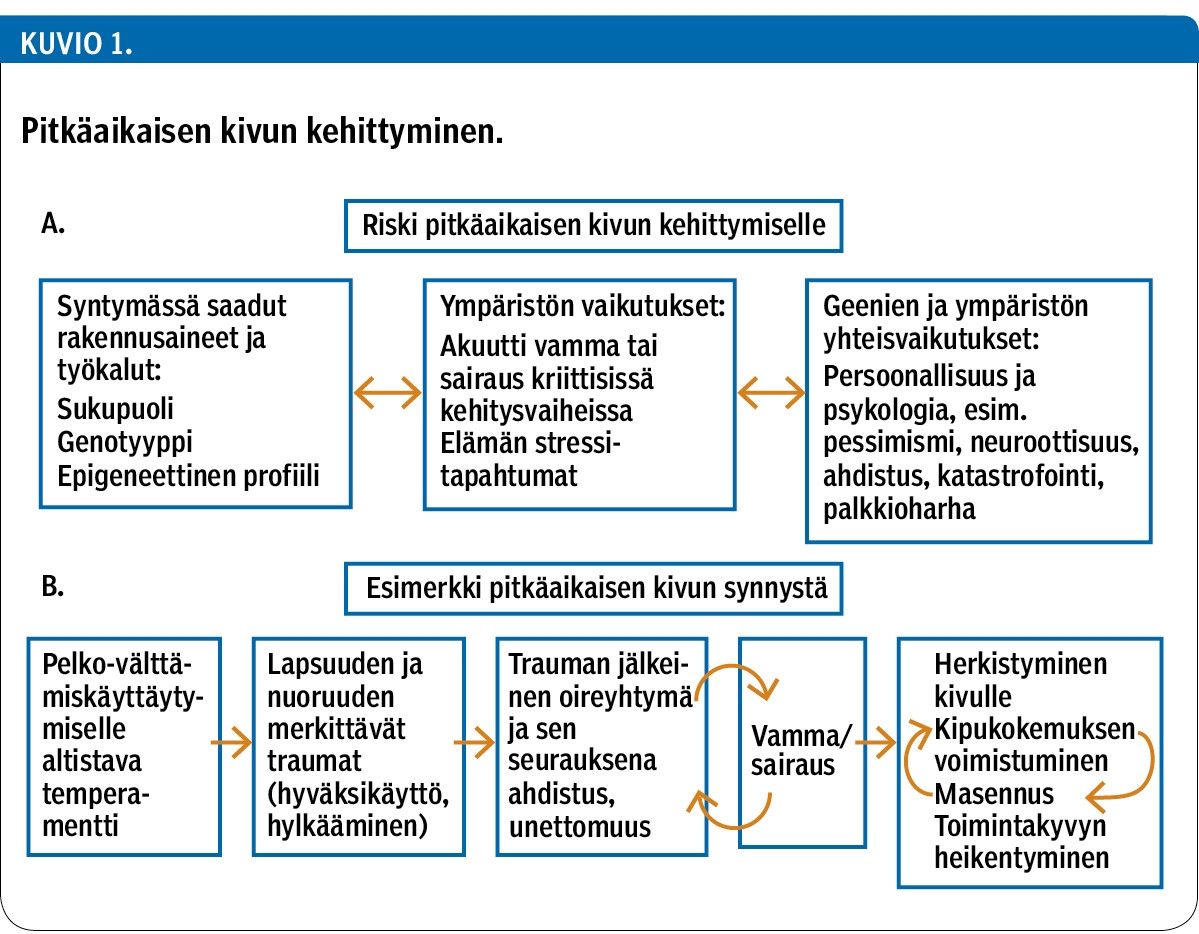
Ongelmalliselle kivulle voi altistaa esimerkiksi kivulle herkistävien perinnöllisten tekijöiden ja elämäntapahtumien (esim. fyysiset tai psyykkiset traumat) kasautuminen (kuvio 1A). Ongelman kehittymistä voivat edesauttaa myös elintavat ja sairaudet metabolisten ja inflammatoristen tekijöiden välityksellä.
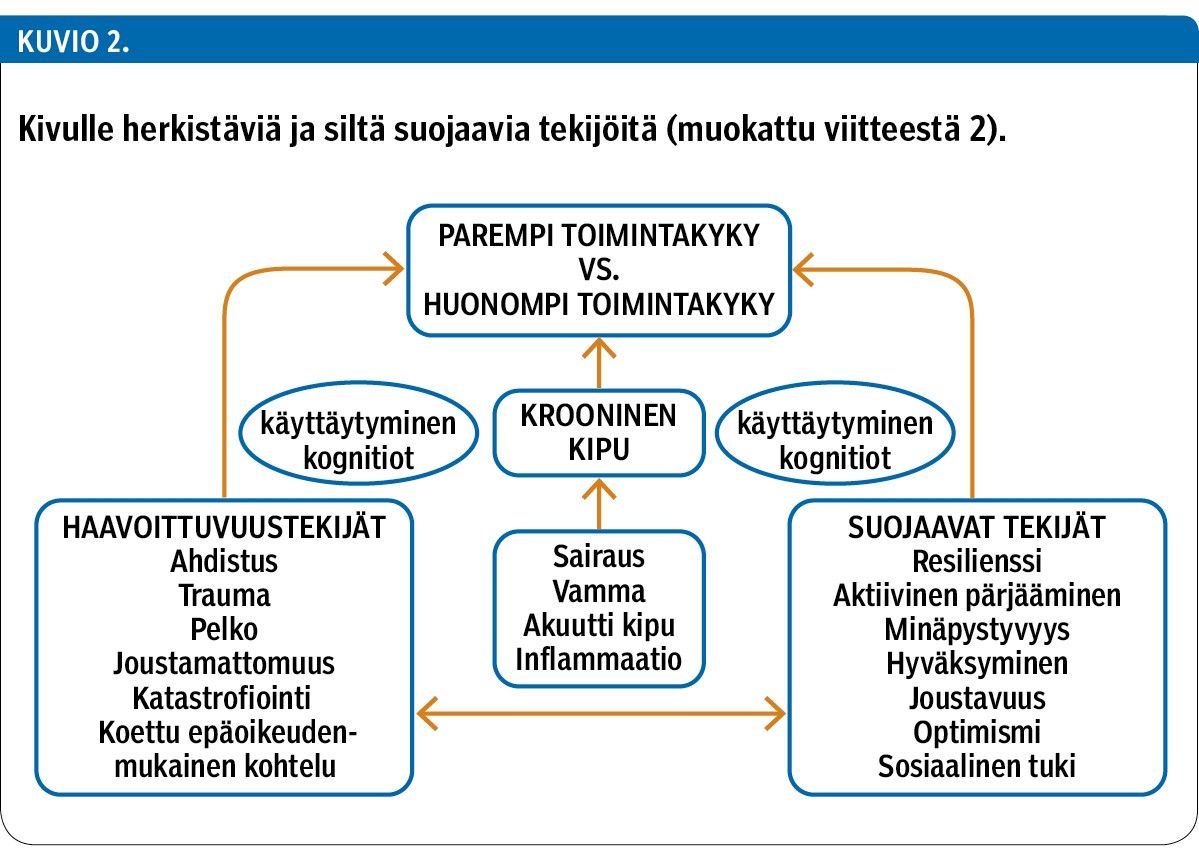
Henkilön psyykkiset voimavarat määrittelevät pitkälti, miten suurta haittaa kivusta aiheutuu (kuvio 2) (2). Pelko-välttämiskäyttäytyminen voi johtaa liikunnan vähentymiseen, mikä huonontaa tilannetta edelleen. Jatkuva kipuun liittyvien ongelmien märehtiminen ja joustamattomuus voivat estää uusien käyttäytymismallien löytämistä.
Perimä
Tutkimus on vahvistanut perimän osuuden esim. migreenin (3) ja fibromyalgian taustalla (4). Yhden geenin mutaatiot voivat aiheuttaa harvinaisia vaikeita kiputiloja tai kyvyttömyyttä aistia kipua. Näistä tunnetuimpia ovat hermokasvutekijän (NGF) kohdereseptoria koodaavan NTRK1-geenin (5) ja kipuhermosyiden erästä Na+-kanavaa säätelevän SCN9A-geenin mutaatiot (6). Lisäksi tunnetaan useita geenejä, joiden mutaatiot herkistävät kivulle tai suojaavat siltä. Sellaisia ovat esimerkiksi katekoliamiinien metaboliaan vaikuttava COMT-geeni (7,8), purinergiseen järjestelmään kuuluva P2X7-geeni (9,10) sekä tiettyä K+-kanavaa säätelevä KCNS1-geeni (11). Perimän vaikutus voi heijastua kipuun myös persoonallisuuspiirteiden välityksellä (12).
Kivulla ja siihen liittyvillä muilla sairauksilla on myös yhteistä geneettistä taustaa. Näin on esimerkiksi migreenin ja sepelvaltimotaudin (13) sekä kroonisen kivun, masennuksen, sydän- ja verisuonisairauksien ja uupumuksen tapauksessa (14,15).
Infektiot, immunologia ja inflammaatio
Vyöruusun aiheuttama neuralgia on parhaiten tutkittu infektioon liittyvä krooninen neuropaattinen kiputila. Hermon takajuuriganglioon asettunut virus aktivoituu immunologisen tilan heikentyessä ja voi aiheuttaa voimakkaan akuutin kivun. Sen seurauksena osalle potilaista kehittyy pahimmillaan sietämätön hermosärky kyseisen dermatomin alueelle. Myös herpes simplex 2 -virusinfektio (HSV-2) voi otollisen immunologisen tilan avittamana johtaa neuropaattiseen kipuun (16). Bakteeri-infektioista tunnetuin kroonisen kivun aiheuttaja on borrelioosi.
Immunologisten tekijöiden osuus pitkäaikaisissa kiputiloissa on noussut uudeksi tutkimusalueeksi. Toistaiseksi selvin näyttö on kiputiloista, jotka liittyvät jänniteherkkiä K+-kanavakomplekseja vastaan kehittyneisiin autovasta-aineisiin. VGKC-IgG-kompleksit lisäävät kipua välittävien hermojen ärtyvyyttä ja voivat näin lisätä kipuherkkyyttä (17).
Monimuotoinen alueellinen kipuoireyhtymä (CRPS) (ks. s. 1131–6) on vaikeahoitoinen kiputila, jonka yhdeksi taustatekijäksi on ehdotettu poikkeavaa immuunivastetta. Pieni osa sairastuneista on hyötynyt immunologisista hoidoista (18).
Inflammaatio on keskeinen tekijä kudosvauriokivussa, jossa se herkistää hermopäätteitä. Kudosvaurioon liittyvä pitkittynyt kipu saattaa niin ikään osalla potilaista johtua pitkään jatkuvasta inflammaatiosta. Tätä on pystytty selvittämään uudenlaisella PET/TT-kuvantamistutkimuksella, jossa käytetään [11C]-D-deprenyyli-merkkiainetta (19). Yksi merkittävä matala-asteista tulehdusta ylläpitävä tekijä on suuri painoindeksi (20), joka on yhdistetty useisiin erilaisiin kiputiloihin.
Tulehduksellisiin sairauksiin, esimerkiksi reumaan, voi liittyä myös keskushermoston inflammaatiota (21). Tämä voi selittää, miksi joillekin potilaille jää kipua ("remaining pain"), vaikka biologiset hoidot ovat lievittäneet hyvin nivelten tulehdusta. Suuria selkäydinnesteen kemokiinipitoisuuksia on mitattu sekä fibromyalgia- että hermovauriokipupotilailta (22,23,24). Kemokiinit voivat vaikuttaa vaurioituneen hermokudoksen ja sen tukisolujen vuorovaikutukseen. Mikroglian ja astrosyyttien osuutta tutkitaankin intensiivisesti hermovauriokivun ja sentraalisen herkistymisen synnyssä ja ylläpidossa (25). Anti- ja proinflammatorisen mikroglian tasapainoa on tutkittu aivojen PET-kuvantamisella mm. pitkäaikaisessa selkäkivussa (26). Tulehdus on keskeinen linkki monessa kivun pitkittymistä edistävässä prosessissa (unihäiriöt, masennus, ylipaino) (27).
Elintavat, metabolinen oireyhtymä ja ylipaino
Elintapoihin liittyvät tekijät, jotka altistavat sydän- ja verisuonisairauksille (tupakointi, metabolinen oireyhtymä, lihavuus), altistavat myös tuki- ja liikuntaelimistön kroonisten kiputilojen kehittymiselle (28). Diabetes on tavallinen kivuliaan polyneuropatian aiheuttaja (29), ja suurentuneiden verensokeriarvojen on osoitettu liittyvän laaja-alaiseen kipuun (30).
Brittiläisessä kaksosrekisteritutkimuksessa selvitettiin suuren painoindeksin ja laaja-alaisen kivun yhteyttä. Kehon koostumuksesta rasvamassaindeksi (rasvamassa/pituuden neliö, kg/m2) korreloi voimakkaimmin laaja-alaisen kivun kanssa, ja epiandrosteronisulfaatti (EAS) oli vahvasti yhteydessä sekä laaja-alaiseen kipuun että rasvamassaindeksiin (31). Tutkimuksen johtopäätöksenä oli, että epiandrosteronin pitoisuuksien muutokset olivat seurausta laaja-alaisesta kivusta ja että näiden muutosten soveltuvuutta laaja-alaisen kivun biomarkkereiksi voisi tutkia. Tutkimuksen tehnyt ryhmä on selvittänyt myös uupumuksen ja laaja-alaisen kivun metabolomiikkaa. Laaja-alaisesta kivusta kärsivillä potilailla havaittiin pienentyneitä EPA-omega-3-rasvahappopitoisuuksia, jotka liittyivät uupumukseen (32).
Uni, stressi ja lapsuuden traumaattiset kokemukset
Kroonisen kivun tiedetään särkevän unta, mikä voi johtaa väsymykseen, kognitiiviseen heikentymiseen ja masennukseen (33). Unideprivaation tiedetään lisäävän kipuherkkyyttä (34). Uusimpien seurantatutkimusten perusteella unihäiriöt voivat myös edeltää kroonisia kiputiloja ja altistaa kivun pitkittymiselle (35,36). Unihäiriöiden merkitys neurodegeneratiivisten sairauksien riskitekijänä on konkretisoitunut, kun glymfaattisen järjestelmän osuus aivojen toiminnassa on selvinnyt (37,38). Järjestelmä toimii vain unen aikana. Se poistaa aivoista kuona-aineita, jotka voivat edesauttaa neuroinflammaation syntyä.
Kipu aiheuttaa stressiä, joka voi herkistää kivulle tai kanavoitua kipukokemuksena (39). Joskus vaikeiden kiputilojen taustalta löytyy merkittäviä lapsuuden tai nuoruuden traumaattisia kokemuksia, jotka voivat myös aiheuttaa vakavia unihäiriöitä ja ahdistusta (40). Tällaisissa tilanteissa saattaa syntyä kierre, joka johtaa kivun pahenemiseen, masennukseen ja toimintakyvyn heikentymiseen (kuvio 1B). Esimerkiksi laaja-alaisesta kiputilasta ja fibromyalgiasta kärsivillä potilailla on raportoitu tavallista enemmän lapsuuden tai nuoruuden traumakokemuksia (41,42). Niiden vaikutukset voivat osittain liittyä myös telomeerien lyhenemiseen (43), mikä voi edesauttaa fibromyalgian kehittymistä (44).
Psykososiaaliset tekijät
Psykologisilla prosesseilla on keskeinen merkitys kroonisen kivun kehittymisessä ja ylläpidossa. Taulukossa 2 on lueteltu tekijöitä, joiden on osoitettu liittyvän kivun pitkittymiseen. Ahdistus kytkeytyy läheisesti kipuun ja on sinänsä normaali reaktio. Ahdistusherkillä henkilöillä siitä voi kuitenkin tulla merkittävä kipua ylläpitävä tekijä.
Pääsääntöisesti ahdistus edeltää kivun pitkittymistä, kun taas masennus on kivun seuraus (45). Molemmat huonontavat unta, mikä puolestaan laskee mielialaa ja lisää koetun kivun voimakkuutta. Vyyhti voi johtaa kiputilan pahenemiseen myös painon nousun ja inflammaation kautta. Lisäksi pelko-välttämiskäyttäytyminen ja masennus vähentävät voimavaroja, joita potilas tarvitsisi kuntoutumiseen.
Kivun pitkittymisen taustalla saattaa olla myös oppimis- ja palkitsemisjärjestelmän hermoverkkojen "kytkentähäiriöitä". Näiden hermoverkkojen funktionaalisen kuvantamisen avulla on väitetty voitavan ennustaa jo subakuutissa vaiheessa, pitkittyykö selkäkipu (46). Selkäkivun pitkittyessä kipukokemus siirtyy aivojen sensorisista verkostoista emotionaalisiin. Tämä on osoitettu seurantatutkimuksissa, joissa on tehty useita fMRI-kuvauksia (47).
Huomiota on alettu kiinnittää myös kivun pitkittymiseltä suojaaviin tekijöihin. Niitä ovat mm. joustavuus (flexibility) (48) ja kyky toipua vastoinkäymisistä (resilienssi) (49). Haavoittuvuustekijöiden ja suojaavien tekijöiden voimasuhteet säätävät, miten potilas pystyy sopeutumaan kipuunsa ja laatimaan strategioita pärjätäkseen kivusta huolimatta (kuvio 2).
Myös sosiaaliset tekijät ovat tärkeitä kipupotilaan ennusteen kannalta. Perheen ja työyhteisön ymmärtävä, kannustava ja aktivoiva ote suojaa kivun pitkittymiseltä. Liiallinen, vaikka hyvää tarkoittava, suojelu ja huolehtiminen voivat johtaa passiivisiin toimintamalleihin ja edistää näin kivun kroonistumista sekä heikentää kuntoutusmahdollisuuksia. Myös kokemus epäoikeudenmukaisesta kohtelusta ja pitkät vakuutusoikeudelliset prosessit vaikeuttavat kuntoutumista ja altistavat kipuongelman pitkittymiselle.
Voiko kivun kroonistumista ehkäistä?
Kroonisen kivun kehittymisen ehkäiseminen edellyttää, että kivun alkuperäinen aiheuttaja ja kroonistumisen mekanismit tunnetaan ja että niihin voidaan vaikuttaa. Monissa tapauksissa taustalla olevan sairauden patofysiologia tunnetaan hyvin, ja perussairauden ehkäisy ja hoito ovat tehokasta kroonisen kivun ehkäisyä. Myös kivulle herkistymisen ja kivun laajenemisen mekanismeista tiedetään paljon, mutta tutkitusti tehokasta estolääkitystä ei ole. Tämän vuoksi akuutin kivun oikea-aikainen ja tehokas hoito sekä aktivoiva kuntoutus ovat ensisijaisia.
Usein systeemisairauksien ja kivun pitkittymisen taustalla on korjausta vaativia elintapoja ja psykologisia tekijöitä. Niihin tulisi puuttua tehokkaasti ja mahdollisimman varhain. Jotta tämä olisi mahdollista, perusterveydenhuollossa tarvitaan uusia työkaluja. Apua olisi esimerkiksi kivun hoitoon ja ehkäisyyn perehtyneistä moniammatillisista tiimeistä, joissa olisi lääkäreiden, fysioterapeuttien ja sairaanhoitajien ohella myös riittävästi terveyspsykologeja.
Sairauden tai vamman aiheuttaman kivun pitkittymisen ehkäisy
Hyvän esimerkin sietämättömästä pitkäaikaisesta kivusta ja sen ehkäisystä tarjoaa vyöruusuneuralgia. Herpes zoster -virusta vastaan kehitetyn rokotteen teho on yli 70-vuotiailla vyöruusuun 91,3 % ja sen aiheuttamaan neuralgiaan 88,8 % (50). Rokote sai myyntiluvan Euroopassa tammikuussa 2018. Kahden vuorokauden sisällä sairastumisesta aloitettu oraalinen antiviraalinen lääkitys ei ilmeisesti lyhennä vyöruusuneuralgian kestoa, vaikka lyhentääkin infektioon liittyvän kivun kestoa (51,52). Sen sijaan on viitteitä siitä, että välittömästi aloitettu, kolme kuukautta kestävä hoito amitriptyliinillä (25 mg/vrk) vähentää vyöruusuneuralgian kehittymisen todennäköisyyttä yli 60-vuotiailla potilailla (53).
Leikkauksen jälkeisessä vaikeassa, pitkittyneessä kivussa on yleensä kyse neuropaattisesta kivusta, jota kehittyy noin 15 %:lle potilaista. Sen on osoitettu olevan muita yleisempää naisilla, nuorilla ja tietyillä potilasryhmillä. Sellaisia ovat muun muassa opioideja käyttävät, ahdistuneet, pelokkaat ja aiemmin kroonisista kiputiloista kärsineet potilaat ja ne, joilla on edeltävää kipua alueella, jolle leikkaus kohdistuu tai jotka uskovat kokevansa voimakasta kipua leikkauksen jälkeen (54,55).
Lukuisia estolääkityksiä on kokeiltu, mutta tehokasta vaihtoehtoa ei ole löytynyt. Todennäköisesti tutkimukset ovat olleet tehon selvittämiseksi liian pieniä ja epäherkkiä, koska niitä ei ole kohdennettu suuren kipuriskin ryhmiin. Rintasyöpäleikkauksen jälkikipujen todennäköisyyden arvioimiseksi on kehitetty työkalu (56), jonka avulla voidaan tunnistaa potilaat, joita estolääkitystutkimuksiin on mielekästä ottaa mukaan.
Leikkauksen jälkeisen kivun pitkittymisen ehkäisyyn kannattaisi valita lääkitys, joka vahvistaa endogeenista kivunsäätelyjärjestelmää. Sellaisia ovat esim. kaksoisvaikutteiset masennuslääkkeet (57). Vastaavaa vaikutusta ei ole todettu gabapentinoideilla. Opioidit eivät ole hyvä vaihtoehto, koska ne heikentävät elimistön omaa kivunsäätelyjärjestelmää ja voivat johtaa riippuvuuteen (58).
Leikkaustekniikoiden kehittyminen saattaa vähentää kroonisia postoperatiivisia kipuja (59). Leikkausalueelle kehittyneen kivun vuoksi ei pitäisi tehdä toistuvia operaatioita ilman selvää perustetta. Mikäli potilaalle on kehittynyt leikkauksen yhteydessä kivulias hermovaurio, sitä hoidetaan neuropaattisen kivun lääkkeillä (amitriptyliini/nortriptyliini, kaksoisvaikutteiset masennuslääkkeet, gabapentinoidit) (60).
Erityisen ahdistuneille ja pelokkaille potilaille pitkittyneeseen kipuun voi kokeilla lyhyitä psykologisia interventioita. Myös erilaisten mindfulness-ohjelmien käyttöä ennen ja jälkeen leikkauksen tutkitaan parhaillaan. Vamman tai leikkauksen jälkeen on tärkeää tunnistaa varhain monimuotoiseen alueelliseen kipuoireyhtymään viittaavat oireet ja saada potilas kuntouttamaan ja käyttämään kivuliasta raajaansa. Tämä voi estää oireyhtymän kehittymisen. Kipulääkityksen lisäksi tarvitaan psyykkistä tukea ja fysioterapeuttista ohjausta (61).
Terveydenhuollon järjestelmien tulisi tukea kehittymässä olevan kipuongelman varhaista havaitsemista ja siihen puuttumista. Postoperatiivisen kivun osalta eräs toimiva malli on riskiryhmässä oleville potilaille suunnattu nopean palvelun kipuvastaanotto (62).
Tuki- ja liikuntaelimistön sairauksien ja laaja-alaisten kipujen ehkäisy
Tuki- ja liikuntaelimistön sairaudet ovat suurin ja kallein kroonisen kivun aiheuttaja. Kustannukset syntyvät erityisesti sairauspoissaoloista ja työkyvyttömyyseläkkeistä, eivät niinkään hoidosta tai kuntoutuksesta.
Suomalaisilla kaksosilla tehdyssä pitkässä seurantatutkimuksessa kävi ilmi, että alun perin paikallinen kipu (niskakipu, selkäkipu, krooninen päänsärky) oli tärkein itsenäinen selittäjä laaja-alaisen kivun kehittymiselle (63). Siksikin paikallisiin kiputiloihin on tärkeää puuttua varhain.
Aiemmissa tutkimuksissa havaittuja kivusta aiheutuvan työkyvyttömyyden vaaratekijöitä voidaan hyödyntää potilaan riskin arvioinnissa (taulukko 3) (64). Keskeistä on seuloa univaikeuksia, ahdistuneisuutta, masentuneisuutta sekä pelkoa pysyvästä vauriosta tai kivun pahenemisesta. Varoitusmerkkejä ovat myös laajalti kehossa ilmenevä kipu, passiivisuus ja välttämiskäyttäytyminen sekä ongelmat tai tyytymättömyys työssä. Näitä laaja-alaiselle kivulle altistavia tekijöitä tulisi selvittää rutiininomaisesti esimerkiksi niskahartiaseudun ja selän kiputilojen yhteydessä. Kyselylomakkeella saadun tiedon perusteella potilaat on mahdollista ohjata tapaamaan fysioterapeuttia, sairaanhoitajaa tai psykologia tai sopivaan kivunhallintaryhmään. Muiden potilasryhmien tavoin myös kipupotilaat kokevat saavansa tukea vertaisryhmistä.
Kipulääkkeillä ja passiivisilla hoitomuodoilla (lepo, hieronta) mahdollistetaan kuntoutuksen alku. Sen jälkeen painopiste siirretään aktivoivaan kuntoutukseen. Lääkehoitoa tai psykoterapiaa vaativat psykiatriset ongelmat tulee havaita ja hoitaa tehokkaasti. Masennuksen, kivun ja unettomuuden noidankehän purkaminen onnistuu parhaiten vaikuttamalla kaikkiin kolmeen tekijään. Sellaisia tukitoimia taas tulee välttää, jotka ovat lääketieteellisesti arvioituna liiallisia tai jopa vammaisuutta lisääviä.
Kivun pitkittymisen ehkäisyn tärkein moottori ovat potilaan oma aktiivisuus ja motivaatio. Kulkuneuvona puolestaan ovat elintapamuutokset. Terveydenhuolto toimii mekaanikkona varikolla. Parantumisen hidasteita (kuten viivettä hoitoon ja kuntoutukseen pääsyssä sekä pitkiä vakuutusoikeudellisia prosesseja) on tärkeä purkaa.
Tuoreiden kotimaistenkin tutkimusten mukaan lapsilla ja nuorilla on huomattavan paljon paikallisia (niska-hartiaseutu, ristiselkä, pään alue) ja myös laaja-alaisia kipuja (65). Parhaiten kipuja selittävät huono fyysinen suorituskyky ja rikkonainen tai vähäinen uni. Kroonisen kivun ehkäiseminen olisi ensiarvoisen tärkeää jo lapsuudessa ja nuoruudessa. Huolehtia tulee riittävästä unesta ja liikunnasta, hyvästä fyysisestä ja henkisestä kunnosta, terveellisestä ravinnosta sekä turvallisesta kasvuympäristöstä. Turvallinen ja vastuullinen kotiympäristö voi estää yhteiskunnallisten trendien aiheuttamien riskien toteutumisen (epäterveellinen ravinto, sosiaalisessa mediassa ja tietokonepeleissä kulutettu aika, vähäinen uni ja fyysinen aktiivisuus). Ehkäiseviä toimia voivat toki tukea myös koulu ja yhteiskunta. Lasten kaltoin kohtelun estämiseen ja psyykkisten traumojen varhaiseen hoitoon kannattaa panostaa ajoissa. Aikuisena traumojen hoito osana kroonisen kivun vyyhtiä on vaativaa.
Lopuksi
Kroonisen kivun ehkäisyn merkitys kasvaa yhteiskunnassamme, koska nykyiset elintapamme altistavat sille jo lapsuudesta lähtien. Päivittäiset vaikeat kivut lisääntyvät iän myötä, joten eliniän kasvu kasvattaa myös kroonisen kivun lastia. Krooninen kipu syö henkistä pääomaa ja vaikuttaa kognitiiviseen suorituskykyyn, jota tulevaisuuden työ erityisesti vaatii.
Sosiaali- ja terveysministeriön työryhmän helmikuussa 2017 peruspalveluministerille luovuttamassa raportissa on kartoitettu kroonisen kivun hoidon ja ehkäisyn kannalta keskeiset toimenpiteet (66). Raportissa korostetaan varhaisen puuttumisen lisäksi tehokkaampien konsultaatiokanavien luomista perus- ja erikoissairaanhoidon välille. Kansalaisten eriarvoisuuden vähentämiseksi tulisi tavanomaisen hoidon tueksi kehittää virtuaalisairaalan palveluita. Kivunhallintataloon suunnitellaankin kaikille avoimen koulutuksellisen osion lisäksi terapiapolkuja, joihin potilaat ohjataan lähetteellä (www.kivunhallintatalo.fi).
Kansallinen etu edellyttää raportin suositusten toimeenpanoa uudessa sote-järjestelmässä.
Eija Kalso: Konsultointi (Gruenenthal, Pierre-Fabre), osakkeet ja optiot (Orion).
- 1
- Maixner W, Fillingim RB, Williams DA, Smith SB, Slade GD. Overlapping chronic pain conditions: implications for diagnosis and classification. J Pain 2016;17(suppl 9):T93–T107.
- 2
- Edwards RR, Dworking RH, Sullivan MD, Turk DC, Wasan AD. The role of psychosocial processes in the development and maintenance of chronic pain. J Pain 2016;17(suppl 9):T70–92.
- 3
- Gormley P, Anttila V, Winsvold BS, Palta P, Esko T, Pers TH ym. Meta-analysis of 375 000 individuals identifies 38 susceptibility loci for migraine. Nat Genet 2016;48:856–66.
- 4
- Markkula R, Järvinen P, Leino-Arjas P, Koskenvuo M, Kalso E, Kaprio J. Clustering of symptoms associated with fibromyalgia in a Finnish Twin Cohort. Eur J Pain 2009;13:744–50.
- 5
- Indo Y. Nerve growth factor and the physiology of pain: lessons from congenital insensitivity to pain with anhidrosis. Clin Genet 2012;82:341–50.
- 6
- McDonnell A, Schulman B, Ali Z, Dib-Hajj SD, Brock F, Cobain S ym. Inherited erythromelalgia due to mutations in SCN9A: natural history, clinical phenotype and somatosensory profile. Brain 2016;139:1052–65.
- 7
- Diatchenko L, Nackley AG, Slade GD, Bhalang K, Belfer I, Max MB ym. Catechol-O-methyltransferase gene polymorphisms are associated with multiple pain-evoking stimuli. Pain 2006;125:216–24.
- 8
- Kambur O, Kaunisto MA, Tikkanen E, Leal SM, Ripatti S, Kalso EA. Effect of catechol-o-methyltransferase-gene (COMT) variants on experimental and acute postoperative pain in 1,000 women undergoing surgery for breast cancer. Anesthesiology 2013;119:1422–33.
- 9
- Sorge RE, Trang T, Dorfman R, Smith SB, Beggs S, Ritchie J ym. Genetically determined P2X7 receptor pore formation regulates variability in chronic pain sensitivity. Nat Med 2012;18:595–9.
- 10
- Kambur O, Kaunisto MA, Winsvold BS, Wilsgaard T, Stubhaug A, Zwart JA, Kalso E, Nielsen CS. Genetic variation in P2rx7 and pain tolerance. Pain 2018 (painossa).
- 11
- Costigan M, Belfer I, Griffin RS, Dai F, Barrett LB, Coppola G ym. Multiple chronic pain states are associated with a common amino acid-changing allele in KCNS1. Brain 2010;133:2519–27, erratum 2011;134:2186.
- 12
- Naylor B, Boag S, Gustin SM. New evidence for a pain personality? A critical review of the last 120 years of pain and personality. Scand J Pain 2017;17:58–67.
- 13
- Winsvold BS, Bettella F, Witoelar A, Anttila V, Gormley P, Kurth T ym. Shared genetic risk between migraine and coronary artery disease: A genome-wide analysis of common variants. PLoS One 2017;12:e0185663. doi:10.1371/journal.pone.0185663
- 14
- Burri A, Ogata S, Livshits G, Williams F. The association between chronic widespread musculoskeletal pain, depression and fatigue is genetically mediated. PLoS One 2015;10:e0140289. doi:10.1371/journal.pone.0140289
- 15
- van Hecke O, Hocking LJ, Torrance N, Campbell A, Padmanabhan S, Porteous DJ ym. Chronic pain, depression and cardiovascular disease linked through a shared genetic predisposition: Analysis of a family-based cohort and twin study. PLoS One 2017;12:e0170653. doi:10.1371/journal.pone.0170653
- 16
- Kallio-Laine K, Seppänen M, Lokki ML, Lappalainen M, Notkola IL, Seppälä I ym. Widespread unilateral pain associated with herpes simplex virus infections. J Pain. 2008;9:658–65.
- 17
- Klein C, Lennon VA, Aston PA, McKeon A, Pittock SJ. Chronic pain as a manifestation of potassium channel-complex autoimmunity. Neurology 2012;79:1136–44.
- 18
- Dubuis E, Thompson V, Leite MI, Blaes F, Maihöfner C, Greensmith D ym. Longstanding complex regional pain syndrome is associated with activating autoantibodies against alpha-aa adrenoceptros. Pain 2014;155:2408–17.
- 19
- Aarnio M, Appel L, Fredrikson M, Gordh T, Wolf O, Sörensen J ym. Visualization of painful inflammation in patients with pain after traumatic ankle sprain using [11C]-D-deprenyl PET/CT. Scand J Pain 2017;17:418–424.
- 20
- Oddy WH, Allen KL, Trapp GSA, Ambrosini GL, Black LJ, Huang RC ym. Dietary patterns, body mass index and inflammation: pathways to depression and mental health problems in adolescents. Brain Behav Immun 12.1.2018. doi:10.1016/j.bbi.2018.01.002
- 21
- Lampa J, Westman M, Kadetoff D, Agréus AN, Le Maître E, Gillis-Haegerstrand C ym. Peripheral inflammatory disease associated with centrally activated IL-1 system in humans and mice. Proc Natl Acad Sci U S A 2012;109:12728–33.
- 22
- Kadetoff D, Lampa J, Westman M, Andersson M, Kosek E. Evidence of central inflammation in fibromyalgia-increased cerebrospinal fluid interleukin-8 levels. J Neuroimmunol 2012;242:33–8.
- 23
- Bäckryd E, Tanum L, Lind AL, Larsson A, Gordh T. Evidence of both systemic inflammation and neuroinflammation in fibromyalgia patients, as assessed by a multiplex protein panel applied to the cerebrospinal fluid and to plasma. J Pain Res 2017;10:515–525.
- 24
- Bäckryd E, Lind AL, Thulin M, Larsson A, Gerdle B, Gordh T. High levels of cerebrospinal fluid chemokines point to the presence of neuroinflammation in peripheral neuropathic pain: a cross-sectional study of 2 cohorts of patients compared with healthy controls. Pain 2017;158:2487–2495.
- 25
- Salter MW, Stevens B. Microglia emerge as central players in brain disease. Nature Med 2017;23:1018–1027.
- 26
- Loggia ML, Chonde DB, Akeju O, Arabasz G, Catana C, Edwards RR ym. Evidence for brain glial activation in chronic pain patients. Brain 2015;138:604–15.
- 27
- Walker AK, Kavelaars A, Heijnen CJ, Dantzer R. Neuroinflammation and comorbidity of pain and depression. Pharmacol Rev 2013;66:80–101.
- 28
- Bierhaus A, Fleming T, Stoyanov S, Leffler A, Babes A, Neacsu C ym. Methylglyoxal modification of Nav1.8 facilitates nociceptive neuron firing and causes hyperalgesia in diabetic neuropathy. Nat Med 2012;18:926–33.
- 29
- Rechardt M, Shiri R, Karppinen J, Jula A, Heliövaara M, Viikari-Juntura R. Lifestyle and metabolic factors in relation to shoulder pain and rotator cuff tendinitis: a population-based study. BMC Musculoskelet Disord 2010;11:165.
- 30
- Mäntyselkä P, Miettola J, Niskanen L, Kumpusalo E. Persistent pain at multiple sites – Connectin to glucose derangement. Diab Res Clin Pract 2009;84:e30–2.
- 31
- Livshits G, Macgregor AJ, Gieger C, Malkin I, Moayyeri A, Grallert H ym. An omics investigation into chronic widespread musculoskeletal pain reveals epiandrosterone sulfate as a potential biomarker. Pain 2015;156:1845–51.
- 32
- Freidin MB, Wells HRR, Potter T, Livshits G, Menni C, Williams FMK. Metabolomic markers of fatigue: Association between circulating metabolome and fatigue in women with chronic widespread pain. Biochim Biophys Acta 2018;1864:601–606.
- 33
- Meyer-Rosberg K, Kvarnström A, Kinnman E, Gordh T, Nordfors LO, Kristofferson A. Peripheral neuropathic pain – a multidimensional burden for patients. Eur J Pain 2001;5:379–89.
- 34
- Iacovides S, George K, Kamerman P, Baker FC. Sleep fragmentation hypersensitizes healthy young women to deep and superficial experimental pain. J Pain 2017;18:844–854.
- 35
- Harrison L, Wilson S, Munafò MR. Exploring the associations between sleep problems and chronic musculoskeletal pain in adolescents: a prospective cohort study. Pain Res Manag 2014;19:e139–45.
- 36
- Palermo TM, Law E, Churchill SS, Walker A. Longitudinal course and impact of insomnia symptoms in adolescents with and without chronic pain. J Pain 2012;13:1099–106.
- 37
- Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M ym. Sleep drives metabolite clearance from the adult brain. Science 2013;342:373–7.
- 38
- Jessen NA, Munk AS, Lundgaard I, Nedergaard M. The glymphatic system: a beginner’s guide. Neurochem Res 2015;40:2583–99.
- 39
- Meerveld BG, Johnson AC. Mechanisms of stress-induced visceral pain. J Neurogastroenterol Motil 2018;24:7–18.
- 40
- Baiden P, Fallon B, den Dunnen W, Boateng GO. The enduring effects of early-childhood adversities and troubled sleep among Canadian adults: a population-based study. Sleep Med 2015;16:760–7.
- 41
- Coppens E, Van Wambeke P, Morlion B, Weltens N, Giao Ly H, Tack J ym. Prevalence and impact of childhood adversities and post-traumatic stress disorder in women with fibromyalgia and chronic widespread pain. Eur J Pain 2017;21:1582–1590.
- 42
- Varinen A, Kosunen E, Mattila K, Koskela T, Sumanen M. The relationship between childhood adversities and fibromyalgia in the general population. J Psychosom Res 2017;99:137–142.
- 43
- Kananen L, Surakka I, Pirkola S, Suvisaari J, Lönnqvist J, Peltonen L ym. Childhood adversities are associated with shorter telomere length at adult age both in individuals with an anxiety disorder and controls. PLoS One 2010;5:e10826. doi:10.1371/journal.pone.0010826
- 44
- Hassett AL, Epel E, Clauw DJ, Harris RE, Harte SE, Kairys A ym. Pain is associated with short leukocyte telomere length in women with fibromyalgia. J Pain 2012;13:959–69.
- 45
- Knaster P, Karlsson H, Estlander AM, Kalso E. Psychiatric disorders as assessed with SCID in chronic pain patients: the anxiety disorders precede the onset of pain. Gen Hosp Psychiatry 2012;34:46–52.
- 46
- Baliki MN, Petre B, Torbey S, Herrmann KM, Huang L, Schnitzer TJ ym. Corticostriatal functional connectivity predicts transition to chronic back pain. Nat Neurosci 2012;15:1117–9.
- 47
- Hashmi JA, Baliki MN, Huang L, Baria AT, Torbey S, Hermann KM ym. Shape shifting pain: chronification of back pain shifts brain representation from nociceptive to emotional circuits. Brain 2013;136:2751–68.
- 48
- Wicksell RK, Lekander M, Sorjonen K, Olsson GL. The Psychological Inflexibility in Pain Scale (PIPS) – statistical properties and model fit of an instrument to assess change processes in pain related disability. Eur J Pain 2010;14:771.e1–14.
- 49
- Goubert L, Trompetter H. Towards a science and practice of resilience in the face of pain. Eur J Pain 2017;21:1301–1315.
- 50
- Cunningham AL, Lal H, Kovac M, Chlibek R, Hwang S-J, Díez-Domino J ym. Efficacy of the Herpes Zoster subunit vaccine in adults 70 years of age or older. N Engl J Med 2016;375, 1019–32.
- 51
- Wood MJ, Kay R, Dworkin RH, Soong SJ, Whitley RJ. Oral acyclovir therapy accelerates pain resolution in patients with herpes zoster: a meta-analysis of placebo-controlled trials. Clin Infect Dis 1996;22:341–7.
- 52
- Chen N, Li Q, Yang J, Zhou M, Zhou D ym. Antiviral treatment for preventing postherpetic neuralgia. Cochrane Database Syst Rev 2014;2:CD006866.
- 53
- Bowsher D. The effects of pre-emptive treatment of postherpetic neuralgia with amitriptyline: a randomized, double-blind, placebo-controlled trial. J Pain Symptom Manage 1997;13:327–31.
- 54
- Johansen A, Romundstad L, Nielsen CS, Schirmer H, Stubhaug A. Persistent postsurgical pain in a general population: prevalence and predictors in the Tromsø study. Pain 2012;153:1390–6.
- 55
- Sipilä RM, Haasio L, Meretoja TJ, Ripatti S, Estlander AM, Kalso EA. Does expecting more pain make it more intense? Factors associated with the first week pain trajectories after breast cancer surgery. Pain 2017;158:922–930.
- 56
- Meretoja TJ, Andersen KG, Bruce J, Haasio L, Sipilä R, Scott NW ym. Clinical prediction model and tool for assessing risk of persistent pain after breast cancer surgery. J Clin Oncol 2017;35:1660–1667.
- 57
- Yarnitsky D, Granot M, Nahman-Averbuch H, Khamaisi M, Granovsky Y. Conditioned pain modulation predicts duloxetine efficacy in painful diabetic neuropathy. Pain 2012;153:1193–8.
- 58
- Sun EC, Darnall BD, Baker LC, Mackey S. Incidence of and risk factors for chronic opioid use among opioid-naive patients in the postoperative period. JAMA Intern Med 2016;176:1286–93.
- 59
- Kehlet H, Roumen RM, Reinpold W, Miserez M. Invited commentary: Persistent pain after inguinal hernia repair: what do we know and what do we need to know? Hernia 2013;17:293–7.
- 60
- Finnerup NB, Attal N, Haroutounian S, McNicol E Baron R, Dworkin RH ym. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol 2015;14:162–73.
- 61
- Gierthmühlen J, Binder A, Baron R. Mechanism-based treatment in complex regional pain syndromes. Nat Rev Neurol 2014;10:518–28.
- 62
- Tiippana E, Hamunen K, Heiskanen T, Nieminen T, Kalso E, Kontinen VK. New approach for treatment of prolonged postoperative pain: APS Out-Patient Clinic. Scand J Pain 2016;12:19–24.
- 63
- Markkula RA, Kalso EA, Kaprio JA. Predictors of fibromyalgia: a population-based twin cohort study. BMC Musculoskelet Disord 2016;17:29.
- 64
- Nicholas MK, Linton SJ, Watson PJ, Main CJ. Early identification and management of psychological risk factors (“yellow flags”) in patients with low back pain: a reappraisal. Physical Therapy 2011;91:737–53.
- 65
- Vierola A, Suominen AL, Lindi A, Viitasalo A, Ikävalko T, Lintu N ym. Associations of sedentary behavior, physical activity, cardiorespiratory fitness and body fat content with pain conditions in children: the Physical activity and nutrition in children study. J Pain 2016;17:845–53.
- 66
- Kroonisen ja syövän aiheuttaman kivun hoidon asiantuntijaryhmä. Kroonisen kivun ja syöpäkivun hoidon kansallinen toimintasuunnitelma vuosille 2017–2020. Sosiaali- ja terveysministeriön raportteja ja muistioita 2017:4. http://urn.fi/URN:ISBN:978-952-00-3850-2
Can pain becoming chronic be prevented?
Chronic pain is a common condition that significantly impairs health-related quality of life and ability to work. Chronic pain is also a major economic burden both to the patient and to society. Factors predisposing to chronic pain include genetic risk, systemic and neuroinflammation, plastic changes in the central nervous system, and psychosocial factors, for example. Many of the known pathophysiological factors cannot, however, be targeted with the currently available treatments or preventive measures. Early psychosocial interventions and changes in life style (e.g. sleep, physical activity, nutrition) should be activated early and efficiently. This is particularly important in children and adolescents. Also, regional pain should be managed actively as it can lead to chronic widespread pain.