Munasarjasyöpä
Munasarjasyövistä 80 % uusiutuu kahdessa vuodessa taudin toteamisesta. Yli puolet potilaista menehtyy viiden vuoden kuluessa sairastumisesta.
Tehokasta seulontamenetelmää ei ole. Suurin osa syövistä todetaan vasta edenneessä vaiheessa.
Hoidon kulmakivi on leikkaushoito. Sen tavoitteena on kasvainkudoksen täydellinen poistaminen.
Lääkehoidon runko on solunsalpaajahoito, johon suuren riskin potilaille yhdistetään verisuonten kasvutekijän estäjä. Parp-estäjät ylläpitohoitona näyttävät lupaavilta tietyissä munasarjakasvaintyypeissä.
Suomen Syöpärekisterin mukaan munasarjasyöpään sairastui 422 ja kuoli 343 naista Suomessa vuonna 2014. Ilmaantuvuus 7–8/100 000 on pysynyt varsin vakaana viime vuosikymmeninä, eikä esiintyvyydessä ole odotettavissa merkittäviä muutoksia lähitulevaisuudessa. Vaikka munasarjasyöpä on suhteellisen harvinainen sairaus, se on yksi huonoennusteisimmista syöpätyypeistä.
Keskimääräinen sairastumistodennäköisyys suurenee heti 60 ikävuoden jälkeen (1). Munasarjasyövistä 95 % on epiteliaalisia kasvaimia , joista 70 % serooseja, 10 % endometrioideja, 5 % kirkassolukasvaimia, 5 % musinooseja ja 10 % sekatyyppisiä kasvaimia.
Noin 5 % pahanlaatuisista munasarjakasvaimista on itusolukasvaimia tai sukupienakasvaimia. Potilaat ovat yleensä nuorempia, ja taudin kulku sekä hoito poikkeavat epiteliaalisista kasvaimista. Nämä kasvaimet on jätetty tämän katsauksen ulkopuolelle.
Munasarjasyövän riskitekijöinä pidetään mm. lapsettomuutta, endometrioosia ja pitkäaikaista hormonikorvaushoitoa. Lähisukulaisella todettu munasarjasyöpä suurentaa sairastumisriskiä. Jos suvussa esiintyvän sairastuvuuden taustalla on BRCA1- tai BRCA2-geenin mutaatio, elinikäinen sairastumisriski on vastaavasti 40 % ja 20 %. HNPCC (ei-polypoottinen paksusuolisyöpä) -sukuun kuuluvan geenivirheen kantajalla on noin 10 %:n riski sairastua munasarjasyöpään. Suojaavia tekijöitä ovat mm. monisynnyttäjyys, imetys, yhdistelmäehkäisypillerien käyttö, sterilisaatio, kohdunpoisto ja munajohtimien poisto (2) (taulukko 1).
Munasarjasyövälle ei ole onnistuttu kehittämään tehokasta seulontamallia laajoissa tutkimuksissa vuosikymmenien aikana. Taudilla ei ole myöskään tyypillistä kliinistä oirekuvaa. Varhaisdiagnostiikan keinojen puute vaikuttaa merkittävästi siihen, että tauti löydetään yleensä vasta edenneessä vaiheessa (3).
Patogeneesi
Kasvaintyyppi, jonka solunjakautuminen on hidasta, kehittyy mitä ilmeisimmin esiastemuutoksista, joissa solut muuttuvat ensin rajalaatuisesti poikkeaviksi ja sitten vähitellen syövän kriteerit täyttäviksi kasvaimiksi. Nämä epiteliaaliset kasvaimet, joiden pahanlaatuisuusaste on pieni, edustavat kuitenkin vain pientä osaa munasarjasyövistä. Suurin osa epiteliaalisista kasvaimista on varsin pahanlaatuisia, ja ne leviävät nopeasti sekä imu- että veriteitse koko vatsaontelon alueelle ja muihin elimiin.
BRCA 1 - tai 2 -geenivirheen kantajille on tehty riskiä pienentäviä munasarjojen ja munanjohtimien poistoleikkauksia. Niissä on todettu, että ensimmäiset solumuutokset suurimmassa osassa serooseista munasarjakasvaimista ovatkin tapahtuneet munanjohtimissa. Nykyään oletetaankin, että useimmat pahanlaatuiset sivuelinten kasvaimet ovat lähtöisin munanjohtimesta eikä munasarjoista, kuten aiemmin otaksuttiin (4).
Munasarjasyövät ovat monimuotoisia kasvaimia. Samassa kasvaimessa voi olla useita eri solutyyppejä, jotka poikkeavat toisistaan kyvyltään muodostaa etäpesäkkeitä ja vasteeltaan lääkehoitoihin. Tämä on haastanut tutkijat panostamaan perinteisen immunohistokemiaan perustuvan tutkimuksen lisäksi tarkempaan molekyylitason diagnostiikkaan.
Epiteliaaliset kasvaimet voidaankin nykyisin luokitella ryhmiin, joista osa ilmentää verisuonikasvutekijäominaisuuksia, osa immunologisia ominaisuuksia ja osa molempia tai sidekudosvälitteisiä kasvutekijöitä. Diagnostiikassa edetään jo kohti vieläkin tarkempaa erottelua, eli tärkeimpien kasvunsäätelygeenien mutaatioiden analyyseihin (5,6,7).
Diagnostiikka
Munasarjasyövän yksi tavallisimmista oireista on nopeasti ilmaantuva vatsan turpoaminen. Se voi johtua kasvaimesta tai siihen liittyvästä askiteksesta. Joskus ensimmäinen oire saattaa olla alaraajan syvä laskimotukos. Näihin oireisiin voi liittyä suolen ja virtsarakon toiminnan muutoksia.
Radiologisista tutkimuksista ensisijaisia ovat vaginaalinen kaikututkimus ja vatsan kaikututkimus. Levinneisyyttä voidaan arvioida vartalon tietokonetomografiatutkimuksella. Sitä voidaan tarvittaessa täydentää magneettikuvauksella ja positroniemissiotietokonetomografialla (PET-TT).
Kasvainmerkkiaineista on ensisijainen CA 125. Kun potilas on alle 50-vuotias, erotusdiagnostiikassa on toisinaan hyötyä merkkiaineesta HE4, jolla syöpä voidaan erottaa endometrioomasta.
Osa kasvaimista on solutyypiltään varsin monimuotoisia, ja niissä voidaan nähdä myös merkkiaineiden CEA ja CA 19-9 ilmaantuvuutta. Kliinisessä päätöksenteossa munasarjasyöpää pidetään suolistosyöpää todennäköisempänä, jos CA 125/CEA -suhde on yli 25. CA 19-9:n esiintyminen kasvaimessa viittaa yleensä huonoon ennusteeseen.
Kasvainmerkkiaineet ilmaantuvat vasta munasarjasyövän edenneessä vaiheessa eivätkä palvele varhaisdiagnostiikkaa. Varhaisvaiheen kasvaimien löytämiseksi on esitetty useita uusia merkkiaineiden yhdistelmiä, mutta mikään niistä ei vielä auta kliinisessä diagnostiikassa (8,9).
Kirurginen hoito
Hoidon kulmakivet ovat laaja kirurginen hoito ja monivaiheinen lääkehoito. Kummassakin on edistytty merkittävästi 10 viime vuoden aikana.
Munasarjasyövän kirurginen hoito on STM:n asetuksen (2006/767) mukaisesti keskitetty yliopistosairaaloiden gynekologisen syövänhoidon keskuksiin, joista vastaavat gynekologisiin syöpätauteihin erikoistuneet lääkärit. Useiden tutkimusten mukaan hoidon keskittäminen osaamiskeskuksiin parantaa potilaan ennustetta (10,11).
Kirurgisen hoidon valinta, sen toteuttamistapa (tähystys-, robotti-, avoleikkaus), laajuus ja ajankohta hoitoprosessissa voidaan yleensä suunnitella huolellisten radiologisten tutkimusten perusteella. Toisinaan hoidon suunnitteluun tarvitaan diagnostinen vatsaontelon tähystys. Leikkauksella pyritään poistamaan kasvain mahdollisimman täydellisesti ja määrittämään levinneisyys alkuvaiheen taudeissa.
Käytännössä leikkaus on suurimmalle osalle potilaista hoidon ensimmäinen vaihe. Leikkauksessa poistetaan vähintään kohtu ja sen sivuelimet, lantion ja para-aortaalisten alueiden imusolmukkeet sekä osa vatsapaidasta. Jopa kolmasosalla potilaista kasvain on kiinnittynyt paksu- tai ohutsuoleen siten, että kasvaimen radikaali poisto edellyttää myös suolen osapoistoja, suolisaumoja tai avanteita.
Kun leikkaustulos on optimaalinen, vatsaonteloon ei jää näkyvää kasvainkudosta lainkaan. Tämä on kaikkein merkittävin tekijä potilaan ennusteen kannalta. Yhä radikaalimpiin leikkauksiin on siksi pyritty myös silloin, kun perinteisellä leikkaustavalla ei voida poistaa esimerkiksi vatsaontelon seinämän kasvainkylvöä (12,13).
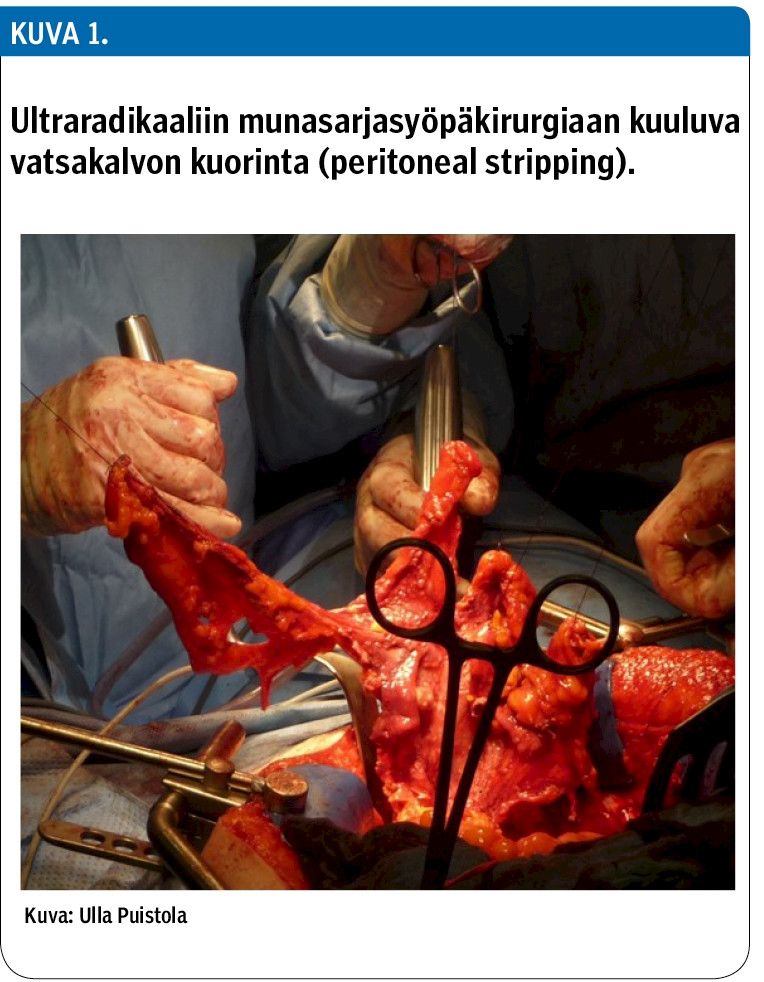
Leikkaus- ja anestesiavalmiuksien parannuttua voidaan näissäkin tilanteissa pyrkiä radikaalimpaan leikkaukseen vatsakalvon kuorinnalla koko vastaontelon alueelta palleakaaria myöten (peritonektomia) (kuva 1). Tämä tietysti suurentaa leikkaukseen liittyvää morbiditeettiä, mikä on huomioitava potilasvalinnassa (taulukko 2). Tällaisen ultraradikaalin leikkauksen vaikuttavuudesta ei kuitenkaan vielä ole vahvaa tutkimusnäyttöä (14,15,16,17).
Jos nuori potilas toivoo hedelmällisyyden säilyvän, voidaan harkita toisen munasarjan ja kohdun säästämistä, mikäli tauti näyttäisi rajoittuvan vain toiseen munasarjaan. Sitä ennen on kuitenkin selvitettävä kasvaimen kirurginen levinneisyys. Tällöin voidaan myös harkita levinneisyysleikkausta tähystyksessä tai robottiavusteisena.
Leikkaushoito solunsalpaajahoidon jälkeen (neoadjuvanttihoito)
Noin 20 %:lla potilaista tauti on levinnyt alueille, joilta se ei ole poistettavissa radikaalillakaan leikkauksella. Tällaisia ovat mm. maksaportin seutuun paikallistuvat ja intestinaalisesti levinneet kasvaimet, joissa merkittävä osa kasvaimesta on ohutsuolen suoliliepeessä.
Potilas voidaan tällöin hoitaa aluksi muutamalla solunsalpaajahoidolla ja siirtää kirurginen hoito myöhemmäksi. Jos neoadjuvanttihoidon jälkeen tehdyllä leikkauksella päästään optimaaliseen leikkaustulokseen, sen vaikuttavuus on potilaan ennusteen kannalta yhtä hyvä kuin primaarisen leikkauksen. Jos potilas on iäkäs tai leikkausriski on muuten suuri, voidaan harkita neoadjuvanttihoitoista vaihtoehtoa siihen liittyvän pienemmän morbiditeetin vuoksi (18,19,20,21).
Solunsalpaajahoito
Ensi linjan hoito
Kaikki munasarjasyöpäpotilaat saavat liitännäishoitona sytostaattihoidon lukuun ottamatta potilaita, joiden aivan alkuvaiheessa olevan kasvaimen pahanlaatuisuusriski on pieni. Standardihoidoksi on parin vuosikymmen aikana tullut paklitakselin ja karboplatiinin yhdistelmähoito (22).
Paklitakseli voidaan annostella joko 3 viikon välein tai viikoittain. Tällöin sen apoptoottiset ominaisuudet syöpäsolua vastaan lisännevät sen vaikuttavuutta (23,24). Muut sytostaatit tai niiden yhdistelmät eivät ole vertailevissa tutkimuksissa osoittautuneet tätä standardihoitoa paremmiksi (25). Paklitakseliin liittyvän kohtalaisen suuren yliherkkyysriskin vuoksi se voidaan korvata dosetakselilla. Myös karboplatiinille voi pitempään käytettynä kehittyä yliherkkyys. Se voidaan tällöin korvata sisplatiinilla. Ensilinjan hoitoon kuuluu yleensä kuusi hoitokertaa.
Uusiutuneen taudin hoito
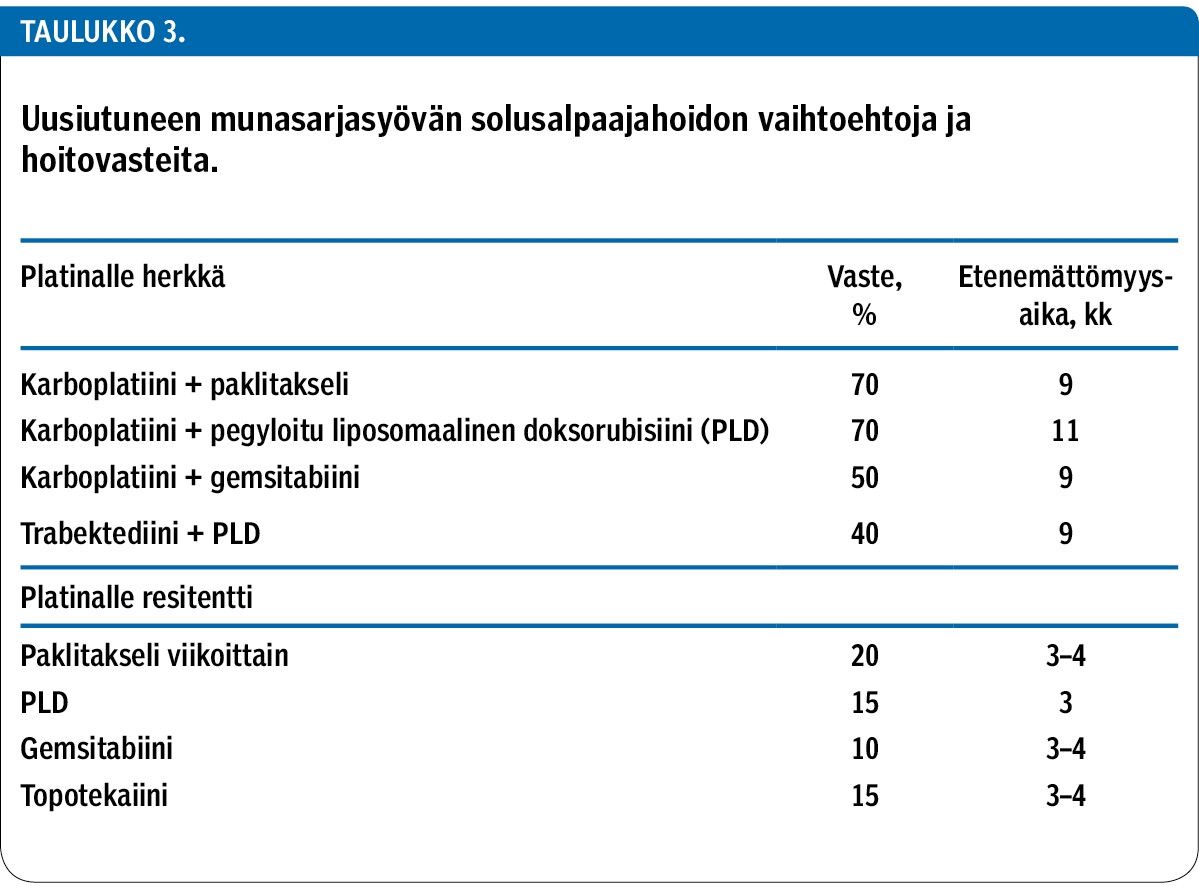
Munasarjasyövistä 75–80 % uusiutuu kahden seuraavan vuoden kuluessa taudin toteamisesta. Uusiutunutta tautia pidetään platinalle herkkänä, jos edeltävän hoidon päättymisestä on kulunut yli 6 kuukautta, ja platinalle resistenttinä, jos tauti uusiutuu puolen vuoden kuluessa.
Platinalle herkissä taudeissa hoitovaste on suurella todennäköisyydellä suotuisa käytettäessä platinapohjaisia sytostaatteja. Niistä valitaan useimmiten paklitakselin ja karboplatiinin yhdistelmä, jos se on ollut aiemmin hyvin siedetty. Muita vaihtoehtoja ovat dosetakseli, PLD (pegyloitu liposomaalinen doksorubisiini) tai gemsitabiini yhdistettynä karboplatiiniin.
Platinalle resistenteissä taudeissa voidaan käyttää paklitakseli- (viikoittain), dosetakseli-, PLD-, gemsitabiini- tai topotekaanihoitoja. Vasteodotukset ovat kuitenkin kohtalaisen vaatimattomia ja lyhytaikaisia vaihtoehdosta riippumatta (26,27,28,29,30) (taulukko 3).
Uusiutuneessa taudissa voidaan harkita leikkaushoitoa, kun taudin uusiutumisesta on kulunut yli 12 kuukautta, ensimmäisen leikkauksen tulos on ollut optimaalinen, todettu muutos on yksittäinen eikä potilaalla ole askitesta. Näillä ehdoilla potilaan odotetaan hyötyvän leikkauksesta. Tähän toivotaan saatavan vahvistusta meneillään olevassa satunnaistetussa eurooppalaisessa tutkimuksessa. Parhaillaan tutkitaan muuhun kuin platinaan pohjautuvaa uutta hoitovaihtoehtoa potilaille, joiden tauti uusiutuu 6–12 kk:n kuluttua edellisen hoidon päättymisestä. Sen tehosta tai vaikuttavuudesta platinaherkkyyden säilymiseen saadaan tietoa lähivuosina.
Biologiset lääkkeet
Bevasitsumabi on verisuonten kasvutekijän (VEGF) monoklonaalinen vasta-aine, joka on tullut munasarjasyövän ensilinjan ja toisen linjan lääkehoitovalikoimaan. Ensilinjan hoidossa se voidaan liittää sytostaattihoitoon suuren riskin potilaille, joiden tauti on edennyt. Bevasitsumabihoitoa jatketaan ylläpitohoitona sytostaattihoidon jälkeen 12–15 kuukautta (31,32).
Uusiutuneissa taudeissa bevasitsumabi on todettu vaikuttavaksi sekä platinalle herkissä että resistenteissä tautimuodoissa (33,34). Niissä hoito jatkuu aina taudin etenemiseen asti.
Munasarjasyövän eri vaiheissa toistetun bevasitsumabihoidon hyödyistä ei ole julkaistu tutkimuksia. Osaksi tämän takia, osaksi kustannussyistä ainakin Pohjoismaissa ja monissa Euroopan maissa on käytäntönä hoitaa potilasta bevasitsumabilla vain yhdessä hoitolinjassa. Muilla verisuonten kasvutekijöillä, kuten pienimolekulaarisilla tyrosiinikinaasin estäjillä, on saatu vain vaatimattomia hoitovasteita.
PARP-entsyymin estäjät
Poly-ADP-riboosipolymeraasi 1 (PARP) on DNA:n yksöisketjun korjausmekanismeihin liittyvä entsyymi. Jos ketju ei korjaannu ennen DNA:n replikaatiota, kaksoisketju vaurioituu. Jopa 60 %:ssa epiteliaalisista munasarjasyövistä on vaurio jossakin kaksoisketjun korjausmekanismissa.
Kaksoiskierteen korjausta estävistä muutoksista tärkeimpiä ovat BRCA1- ja BRCA2-geeneihin liittyvät mutaatiot sekä lukuisiin muihin homologisen rekombinaation korjaukseen liittyvien proteiinien poikkeavuudet (HRD). Kun syöpäsolussa on tällainen mutaatio, PARP-entsyymin estäminen johtaa herkästi syöpäsolun toivottuun kuolemaan.
Munasarjasyövästä onkin tullut yksi PARP-entsyymin inhibiittorihoidon tärkeimmistä kohteista (35,36,37). Munasarjasyövän hoitoon on rekisteröity jo kolme PARP-estäjää. Yhdysvaltain lääke- ja elintarvikevirasto (FDA) ja Euroopan Lääkevirasto (EMA) ovat hyväksyneet olaparibin käytettäväksi uusiutuneen, platinalle herkän munasarjasyövän hoidossa potilaille, joilla on BRCA1- tai BRCA2-mutaatio.
Lisäksi FDA ja EMA ovat hyväksyneet niraparibin platinalle herkän uusiutuneen munasarjasyövän hoitoon. Se toteutetaan ylläpitohoitona sytostaattihoidon jälkeen ja sitä jatketaan niin kauan kuin saadaan hoitovastetta. Viimeaikaisten tutkimusten perusteella näyttää lisäksi siltä, että PARP-estäjien teho ei rajoitu vain BRCA-mutatoituneisiin tai HRD-kasvaimiin, vaan merkittävää hyötyä saadaan muissakin epiteliaalisissa munasarjasyövissä (37) (taulukko 4).
Immunologisten hoitojen vaikutuksia munasarjasyöpään tutkitaan hyvin aktiivisesti. Maailmassa on meneillään noin 80 kliinistä lääketutkimusta, joissa näiden hoitojen vaikuttavuutta arvioidaan munasarjasyövän eri hoitolinjoissa joko yksittäisinä lääkkeinä tai yhdistettyinä sytostaatteihin, verisuonten kasvutekijän estäjiin tai PARP:n estäjään.
Alustavien faasi I:n ja II:n tutkimusten perusteella noin 15 % munasarjasyöpäpotilaista voisi hyötyä immunologisista hoidoista. Useiden immunologisten valmisteiden, kuten pembrolitsumabin, nivolumabin, durvalumabin, atetsolitsumabin, avelumabin, tremelimumabin ja ipilimumabin vaikuttavuusprofiileja munasarjasyöpään selvitetään (38).
Ennuste
Tärkeimmät ennusteeseen vaikuttavat tekijät munasarjasyövässä ovat taudin levinneisyys, leikkaustuloksen optimaalisuus ja kasvaimen histologia. Lantioon rajoittuneissa taudeissa 5 vuoden ennuste on 70–80 %, vatsaontelon alueelle levinneissä 30–40 % ja muihin elimiin levinneissä taudeissa 20 %:n luokkaa. Suomessa keskimääräinen 5 vuoden eloonjäämisennuste on 49 %, (1) (taulukko 5).
Palliatiivinen hoito
Munasarjasyöpään menehtyy vielä nykyäänkin noin puolet sairastuneista. Taudin loppuvaiheen suurimpia ongelmia ovat askiteksen ja pleuranesteen kertyminen, joita voidaan hoitaa dreneerauksin.
Edenneelle munasarjasyövälle on usein ominaista myös kasvaimen aiheuttama suolitukos. Tällöin on syytä harkita palliatiivista avanneleikkausta potilaan elämänlaadun parantamiseksi (39). Kivunhoidon tulee noudattaa hyvän palliatiivisen hoidon linjoja (40).
Seuranta
Munasarjasyöpäpotilaiden seuranta suositellaan järjestettäväksi erikoissairaanhoidossa ensimmäiset 3 vuotta: aluksi 3–4 kk:n välein 2 vuoden ajan ja sitten puolivuosittain. Seurantaa on hyvä jatkaa avoterveydenhoidossa mahdollisuuksien mukaan kaikkiaan 5 vuotta. Taudin uusiuduttua seurantaohjelma aloitetaan aina uuden hoitojakson jälkeen alusta.
Seuranta perustuu pääosin kliiniseen tutkimukseen, jota voidaan täydentää radiologisilla tutkimuksilla löydösten tai oireiden perusteella (41). Kasvainmerkkiaineen määritystä seurannassa ei suositella, koska pelkästään sen perusteella aloitetut uudet hoitojaksot huonontavat potilaan elämänlaatua eivätkä paranna taudin ennustetta (42). Seurannan vaikuttavuudesta erityisesti taudin ennusteeseen ei ole tutkimusnäyttöä (41).
Ulla Puistola: Artikkelin ulkopuolinen, aiheen kannalta olennainen taloudellinen toiminta, palkkio maksettu laitokselle) matka-, majoitus- tai koulutuskulut (Astra Zeneca, Sobi, Amgen, Roche).
- 1
- Suomen Syöpärekisteri, Suomen Syöpäyhdistys ry. Syöpä 2012–2013. Terveyden ja hyvinvoinnin laitoksen (THL) syöpä- ja joukkotarkastustilastoja sairaanhoitopiireittäin. Suomen Syöpäyhdistyksen julkaisuja nro 90. Helsinki 2015.
- 2
- Ezzati M ym. Recent advancements in prognostic factors of epithelial ovarian carcinoma. Int Sch Res Notices 2014;2014:953509.
- 3
- Partridge EE ym. Assessing the risk of ovarian malignancy in asymptomatic women with abnormal CA 125 and transvaginal ultrasound in the prostate, lung, colorectal, and ovarian screening trial. Obstet Gynecol 2013;121:25–31.
- 4
- Kurman RJ, Shih IeM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol 2010;34:433–43.
- 5
- McCluggage WG. Morphological subtypes of ovarian carcinoma: a review with emphasis on new developments and pathogenesis. Pathology 2011;43:420–32.
- 6
- Kohn EC ym. Clinical implications of using molecular diagnostics for ovarian cancers. Ann Oncol 2013;24 Suppl 10:x22-26.
- 7
- Hollis RL, Gourley C. Genetic and molecular changes in ovarian cancer. Cancer Biol Med 2016;13:236–47.
- 8
- Yang WL ym. The role of biomarkers in the management of epithelial ovarian cancer. Expert Rev Mol Diagn 2017;17:577–91.
- 9
- Lee KC ym. Difficulty in diagnosis and different prognoses between colorectal cancer with ovarian metastasis and advanced ovarian cancer: an empirical study of different surgical adoptions. Taiwan J Obstet Gynecol 2017;56:62–7.
- 10
- Shakeel S ym. Care Delivery patterns, processes, and outcomes for primary ovarian cancer surgery: a population-based review using a national administrative database. J Obstet Gynaecol Can 2017;39:25–33.
- 11
- Kumpulainen S ym. The effect of hospital operative volume, residual tumor and first-line chemotherapy on survival of ovarian cancer- a prospective nation-wide study in Finland. Gynecol Oncol 2009;115:199–203.
- 12
- Aletti GD, Cliby WA. Primary cytoreduction: factors impacting operability and the extent of surgery. Ayhan A, Reed N, Gultekin M, Dursun P, toim. Textbook of gynaecological oncology. ESGO 2016.
- 13
- Horowitz NS ym. Does aggressive surgery improve outcomes? Interaction between preoperative disease burden and complex surgery in patients with advanced-stage ovarian cancer: an analysis of GOG 182. J Clin Oncol 2015;33:937–43.
- 14
- Soo Hoo S ym. Patient-reported outcomes after extensive (ultraradical) surgery for ovarian cancer: results from a prospective longitudinal feasibility study. Int J Gynecol Cancer 2015;25:1599–607.
- 15
- Rafii A ym. Multi-center evaluation of post-operative morbidity and mortality after optimal cytoreductive surgery for advanced ovarian cancer. PLoS One 2012;7(7):e39415.
- 16
- Rodriguez N ym. Upper abdominal procedures in advanced stage ovarian or primary peritoneal carcinoma patients with minimal or no gross residual disease: an analysis of Gynecologic Oncology Groups (GOG). Gynecol Oncol 2013;130:487–92.
- 17
- Chéreau E ym. Morbidity of diaphragmatic surgery for advanced ovarian cancer: retrospective study of 148 cases. Eur J Surg Oncol 2011;37:175–80.
- 18
- Sioulas VD ym. Optimal primary management of bulky stage IIIC ovarian, fallopian tube and peritoneal carcinoma: Are the only options complete gross resection at primary debulking surgery or neoadjuvant chemotherapy? Gynecol Oncol 2017;145:15–20. doi:10.1016/j.ygyno.2017.02.023.
- 19
- Vergote I ym.; European Organization for Research and Treatment of Cancer-Gynaecological Cancer Group; NCIC Clinical Trials Group. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010;363:943–53.
- 20
- Vergote IB ym. How to select neoadjuvant chemotherapy or primary debulking surgery in patients with stage IIIC or IV ovarian carcinoma. J Clin Oncol 2016;34:3827–8. doi: 10.1200/JCO.2016.69.7458. Epub 2016 Sep 30.
- 21
- Wright AA ym. Neoadjuvant chemotherapy for newly diagnosed, advanced ovarian cancer: Society of Gynecologic Oncology and American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol 2016;34:3460–73.
- 22
- Ozols RF ym.; the Gynecologic Oncology Group. Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer: a Gynecologic Oncology Group study. J Clin Oncol 2003;21:3194–200.
- 23
- Katsumata N ym., Japanese Gynecologic Oncology Group. Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for advanced ovarian cancer: a phase 3, open-label, randomised controlled trial. Lancet 2009;374:1331–8.
- 24
- Chan JK ym. Weekly vs. every-3-week paclitaxel and carboplatin for ovarian cancer. N Engl J Med 2016;374:738–48.
- 25
- Bookman MA ym. Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a Phase III Trial of the Gynecologic Cancer Intergroup. J Clin Oncol 2009;27:1419–25.
- 26
- Eisenhauer EA ym. Predictors of response to subsequent chemotherapy in platinum pretreated ovarian cancer: a multivariate analysis of 704 patients. Ann Oncol 1997;8:963–68.
- 27
- Markman M ym. Second-line platinum therapy in patients with ovarian cancer previously treated with cisplatin. J Clin Oncol 1991;9:389–93.
- 28
- Sharma R ym. Extended weekly dose-dense paclitaxel/carboplatin is feasible and active in heavily pre-treated platinum-resistant recurrent ovarian cancer. Br J Cancer 2009;100:707–12.
- 29
- Hanker LC ym. The impact of second to sixth line therapy on survival of relapsed ovarian cancer after primary taxane/platinum-based therapy. Ann Oncol 2012;23:2605–12.
- 30
- Oronsky B ym. A brief review of the management of platinum-resistant-platinum-refractory ovarian cancer. Med Oncol 2017;34:103.
- 31
- Burger RA ym., the Gynecologic Oncology Group. Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med 2011;365:2473–83.
- 32
- Perren TJ ym., the ICON7 Investigators. A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 2011;365:2484–96.
- 33
- Aghajanian C ym. OCEANS: a randomized, double-blind, placebo-controlled phase III trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer. J Clin Oncol 2012;30:2039–45.
- 34
- Pujade-Lauraine E ym. AURELIA: A randomized phase III trial evaluating bevacizumab (BEV) plus chemotherapy (CT) for platinum (PT)-resistant recurrent ovarian cancer (OC). 2012 Annual Meeting of the American Society of Clinical Oncology; Chicago, IL; 2012. LBA5002.
- 35
- Ledermann J ym. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med 2012;366:1382–92.
- 36
- Ledermann JA ym. Overall survival in patients with platinum-sensitive recurrent serous ovarian cancer receiving olaparib maintenance monotherapy: an updated analysis from a randomised, placebo-controlled, double-blind, phase 2 trial. Lancet Oncol 2016;17:1579–89.
- 37
- Mirza MR ym.; ENGOT-OV16/NOVA Investigators. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. N Engl J Med 2016;375:2154–64.
- 38
- Mittica G ym. Immune checkpoint inhibitors: a new opportunity in the treatment of ovarian cancer? Int J Mol Sci 2016 Jul 17(7). pii: E1169. doi: 10.3390/ijms17071169.
- 39
- Tran E ym. Malignant bowel obstruction in patients with recurrent ovarian cancer. Am J Hosp Palliat Care 2016;33:272–5.
- 40
- Saarto T ym. toim. Palliatiivisen hoidon hyvät käytännöt. Helsinki: Kustannus Oy Duodecim 2017.
- 41
- Le T ym. Follow-up of patients who are clinically disease-free after primary treatment for fallopian tube, primary peritoneal, or epithelial ovarian cancer: a Program in Evidence-Based Care guideline adaptation. Curr Oncol 2016;23:343–50. PubMed Central PMCID: PMC5081011.
- 42
- Rustin GJ ym., the MRC OV05, and the EORTC 55955 investigators. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomised trial. Lancet 2010;376:1155–63.
Ovarian cancer – the recent treatment perspectives
Even though the incidence of ovarian cancer in western countries is only 8/100 000, it causes the most cancer related deaths in gynaecological cancers, the mean progression free survival being 18 months and the five year survival 40%. There are no effective screening methods for ovarian cancer and only 15−20% of the cases are diagnosed in the early phase. According to the recent research it is evident that the first atypical changes in most high grade serous ovarian cancers are actually seen in the fallopian tube epithelium. Thus from the clinical point of view epithelial ovarian cancer, fallopian tube cancer and primary peritoneal cancer are categorized as similarly behaving and treated cancers. Surgery is the cornerstone of the treatment.
As most of the patients suffer from advanced, widespread disease in the peritoneal cavity, this demands radical or even ultra-radical surgery for optimal cytoreduction. These operations need an excellent team with good collaboration between gynaecological oncology and gastrointestinal surgery. Ultra-radical operations are often associated with substantial morbidity which means that careful patient selection is needed to find the right patients for up-front surgery or optional neoadjuvant treatment where the chemotherapy is given first, followed by less radical surgery later.
The combination of paclitaxel and carboplatin has been the standard chemotherapy over two decades. Bevacitzumab, a monoclonal antibody for VEGF, functioning as an antiangiogenic agent, adds to the progression free survival gained with the first line chemotherapy as well as in the second line setting. Recently Parp-enzyme inhibitors have shown excellent response rates not only in BRCA mutated or HRD (homologous recombinant defected) cancers but also in those high grade serous epithelial cancers without the above defects.
The latest attention and research resources have been dedicated to immunological treatments in ovarian cancer. The first phase I−II trials with these agents have shown some 15% response rates in certain types of ovarian cancers.