Sarjamagneettistimulaatio kivun ja neurologisten sairauksien hoidossa
• Aivojen sarjamagneettistimulaatio (rTMS) on kajoamaton neuromodulaatiohoito, jolla ei ole turvasuosituksia noudatettaessa vakavia haittavaikutuksia.
• Eurooppalaisessa näytönastekatsauksessa rTMS on arvioitu varmasti tehokkaaksi hermoperäiseen kipuun ja alle 6 kuukautta kestäneen aivohalvauksen kuntoutukseen (näytönaste A).
• Sarjamagneettistimulaatio on todennäköisesti tehokasta Parkinsonin taudin liikehäiriöihin, MS-potilaiden alaraajojen spastisuuteen, tinnitukseen ja fibromyalgiaan.
• Se saattaa olla tehokasta hoitoresistentin epilepsian, monimuotoisen alueellisen kiputilan (CRPS) ja neglect-oireiston hoidossa.

Vastikään valmistui uusi, päivitetty eurooppalainen suositus sarjamagneettistimulaation (rTMS) käytöstä (1,2). Kuvaamme seuraavassa rTMS-hoidon vaikutusmekanismeja ja toteutusta sekä mahdollisuuksia neurologian ja kivunhoidon aloilla uuden suosituksen valossa.
Transkraniaalinen magneettistimulaatio (TMS) on ollut käytössä yli 30 vuotta (3). Menetelmää käytettiin aluksi keskushermoston liikeratojen tutkimukseen (motoriset herätevasteet, MEP) (4). Myöhemmin havaittiin pulssisarjoina annettavan sarjamagneettistimulaation teho monien psykiatristen ja neurologisten sairauksien hoidossa (1,2,5,6) (ks. myös Taiminen ym. tässä lehdessä, s. 2853–58).
Nykyisin rTMS-hoito edeltää tai on vaihtoehtona kajoaville stimulaatiohoidoille, kuten takajuostestimulaatiolle (SCS), liikeaivokuoren stimulaatiolle (motor cortex stimulation, MCS) sekä syväaivostimulaatiolle (deep brain stimulation, DBS). Kajoavat stimulaatiomenetelmät edellyttävät anestesiaa ja leikkaustoimenpiteitä, ja niillä voi olla vakavia haittavaikutuksia. Sarjamagneettistimulaatio on hyvin siedettyä eikä sivuoireita juurikaan ilmene.
Uusia tehokkaita hoitoja tarvitaan, koska vasteet lääkehoitoon ovat usein vaatimattomia tai tehokasta muuta hoitoa ei ole. Esimerkiksi neuropaattisen kivun lääkehoito on riittävän tehokas vain kolmasosalla potilaista. Sarjamagneettistimulaatio on viime vuosina vakiintunut Suomessa osaksi masennuksen ja neuropaattisen kivun hoitoa. Tuore tutkimusnäyttö osoittaa sen mahdollisesti tehoavan myös monissa uusissa käyttöaiheissa.
Hoidon toteutus ja vaikutusmekanismit
Nopealla taajuudella (tavallisesti 10–20 Hz) magneettipulssit aktivoivat ja hitaalla taajuudella (≤ 1 Hz) jarruttavat aivokuorta ja siihen kytkeytyviä hermoverkkoja. rTMS-hoidossa annetaan 1 200–3 000 magneettipulssia hoitokerralla, joka kestää noin 30 minuuttia. Theeta-purskehoidossa (theta burst stimulation, TBS) magneettipulssit annetaan 50 Hz:n tripletteinä, jotka toistuvat theetataajuudella. Hoito voi olla joko jaksoittaista, kiihdyttävää (intermittent TBS, iTBS) tai jatkuvaa, jarruttavaa (continuous TBS, cTBS). TBS-hoidossa stimulaation kesto lyhenee alle 5 minuuttiin.
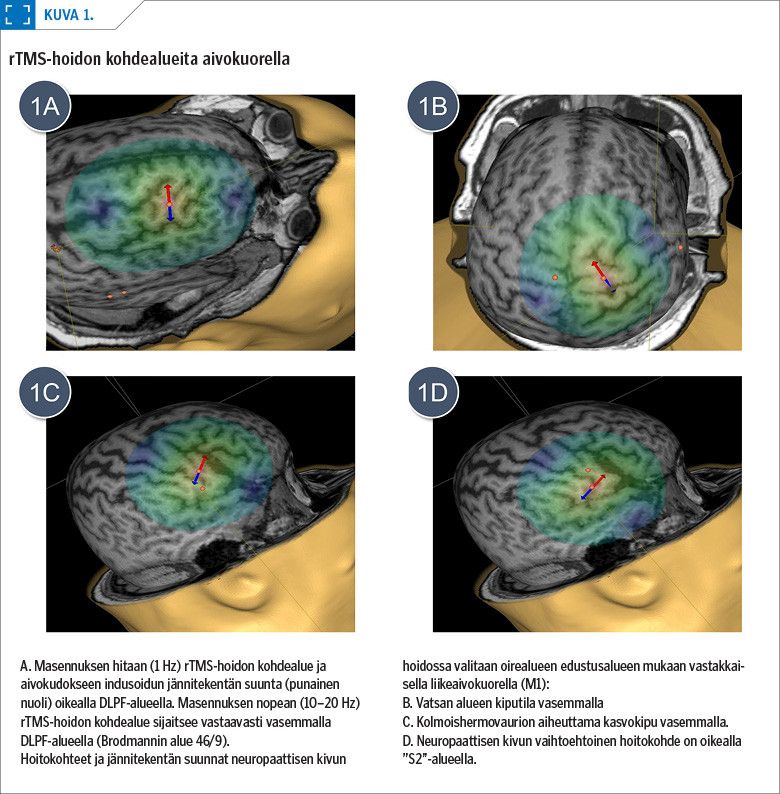
Magneettistimulaatiohoidoissa käytetään tavallisesti 8-muotoista kelaa, joka mahdollistaa hoidon tarkan kohdentamisen (kuva 1). Syviin rakenteisiin paremmin ulottuvat syväkelat (deep-TMS, dTMS) ovat aktiivisen tutkimuksen kohteena.
rTMS-hoito koostuu 10–25 päivän tiiviistä intensiivijaksosta, minkä jälkeen jatketaan harvennettuun ylläpitohoitoon, jos potilas hyötyi hoidosta. Protokolla kuvaa hoitokohteen, stimulaation taajuuden, käytetyn energian, pulssien lukumäärän ja jaksottamisen (1,2,5,6).
Nopean rTMS:n ja iTBS:n kiihdyttävä vaikutus perustuu synaptisen välittymisen tehostumiseen ja muistuttaa koe-eläimillä kuvattua LTP-ilmiötä (long-term potentiation). Hitaan rTMS:n jarrutusvaikutus taas perustuu LTD:n kaltaiseen vaikutukseen (long-term depression). Nopea rTMS vapauttaa aivojen välittäjäaineita (mm. dopamiinia, opioideja ja serotoniinia). Kaikkia rTMS:n vaikutusmekanismeja ei vielä tunneta, mutta niiden ajatellaan perustuvan neuroplastisiin muutoksiin aivojen hermoverkoissa, hemisfäärien välisessä toiminnallisessa tasapainossa sekä välittäjäainejärjestelmissä.(1,2,5,6,7,8)
Neuronavigoivilla rTMS-laitteilla (navigoiva-TMS, nTMS) magneettipulssit kohdennetaan potilaan aivojen magneettikuvan mukaisesti haluttuun kohteeseen (kuva 1). Navigointi parantaa hoitotuloksia sekä masennuksessa että hermovauriokivussa (2).
Navigoivan rTMS-hoidon toteutus
Pään kolmiulotteisen magneettikuvan avulla rTMS-laitteen navigointijärjestelmä mahdollistaa hoidon kohdentamisen aivokuorelle noin 5–6 mm:n tarkkuudella (2,5). Lääkäri – Suomessa tavallisimmin kliininen neurofysiologi – määrittää potilaan yksilöllisen lepoliikekynnyksen (resting motor threshold, RMT), johon hoitopulssien voimakkuus suhteutetaan. Potilaan magneettikuviin merkitään hoidon aiheen mukaiset kohteet ja jännitekenttien suunnat (kuva 1). Sarjahoidot toteuttaa koulutettu KNF-hoitaja tai psykiatrinen sairaanhoitaja.
Sarjamagneettistimulaation vaikutus ei ole pysyvä; yhden rTMS-hoidon teho on voimakkain kolmantena päivänä hoidon jälkeen ja ohittuu reilun viikon aikana. Toistettujen hoitokertojen vaikutus kumuloituu, ja terapeuttinen teho voi sarjahoidon jälkeen kestää useita kuukausia. Ylläpitohoitoa harkitaan, jos oireiden voimakkuus vähenee 30–50 % lähtötilanteesta ja potilas kokee hyötyneensä hoidosta (unen ja toimintakyvyn paraneminen). Ylläpitohoitojen tiheys määräytyy yksilöllisesti, ja se vaihtelee välillä 2–8 viikkoa. Yhdellä hoitokerralla on mahdollista hoitaa useampia sairauksia (1,2,5,6), kuten masennusta ja neuropaattista kipua, jotka esiintyvät usein samoilla potilailla.
Haittavaikutukset ja vasta-aiheet
Nykyisiä turvasuosituksia (9) noudattaen rTMS:llä ei ole merkittäviä sivuvaikutuksia. Tavallisimpia haittoja ovat lihaksen tai tuntohermohaarojen aktivaatiosta johtuvat epämiellyttävät tuntemukset, jännitystyyppinen päänsärky (5–10 %) ja väsymys. Epileptinen kohtaus on mahdollinen, mutta käytännössä erittäin harvinainen sivuvaikutus, kunhan vältetään voimakkaiden pulssien nopeita, pitkiä sarjoja (5).
Vasta-aiheet rTMS-hoidolle ovat samat kuin aivojen magneettikuvaukselle. Ehdottomia vasta-aiheita ovat pään alueella sijaitsevat magneettisesti aktiivisesti metalliesineet, sydämentahdistin sekä kehonsisäiset implantit (esim. sisäkorvaimplantti ja korkealla sijaitseva takajuostestimulaattori). Epilepsia ja raskaus ovat relatiivisia vasta-aiheita. Hoidosta saatava hyöty on punnittava mahdollisia riskejä vasten, koska rTMS-hoito voi lievittää hoitoresistenttiä epilepsiaa ja olla turvallisin vaihtoehto raskaudenaikaisen vaikean masennuksen hoitoon. Kouristuskynnystä alentavien lääkkeiden, kuten bupropionin ja klotsapiinin, annosta yleensä pienennetään rTMS-hoidon ajaksi. Koska magneettipulssit antavat melko voimakkaan äänen, hoidon aikana käytetään kuulonsuojaimia (5,9).
Käyttö ja näytönaste eri hoidonaiheissa
Eurooppalaisessa suosituksessa näytön asteen arviointi (1,2) perustui laatuluokiteltuihin, satunnaistettuihin ja lumekontrolloituihin (RCT) tutkimuksiin. Näytönasteluokittelu on sama kuin suomalaisissa Käypä hoito -suosituksissa: A = varmasti, B = todennäköisesti ja C = mahdollisesti tehokas (taulukko 1).
Kuten kaikissa keskushermoston stimulaatiohoidoissa, rTMS-hoidossa potilaat jakautuvat kahteen ryhmään: osa (50–70 %) hyötyy hoidosta hyvin, osa ei hyödy lainkaan ja joskus harvoin tila saattaa jopa ohimenevästi heikentyä. Kaksihuippuisen vasteprofiilin taustalla on monia tekijöitä, joiden selvittäminen on vilkkaan tutkimuksen aiheena. Osa niistä liittyy potilaan geneettisiin ominaisuuksiin ja aivojen toiminnalliseen tilaan hoidon aikana, osa diagnoosin tarkkuuteen, samanaikaiseen lääkitykseen tai rTMS-hoitoon liitettävään muuhun terapiaan (10). Kaksihuippuisen vasteprofiilin takia ryhmätason vertailuissa teho voi jäädä vaatimattomaksi ja päätelmät epävarmoiksi, etenkin jos ryhmäkoot ovat pieniä. Neuromodulaatiohoitojen tehon arvioinnissa haasteita ovat sokkoutuksen toteuttamisen vaikeus ja tutkimusprotokollien suuri vaihtelu, mikä vaikeuttaa meta-analyysejä.
Kivun rTMS-hoito
Kivun rTMS-hoidon taustalla on liikeaivokuoren sähköisen stimulaation (MCS) teho neuropaattiseen kipuun (11). Tämä vaikutus perustuu sisäsyntyisen opioidijärjestelmän aktivaatioon (12); aivojen pienentynyt opioidireseptoritiheys ennustaa heikkoa MCS-hoitovastetta (13).
Myös liikeaivokuoren nopea rTMS-hoito vapauttaa sisäsyntyisiä opioideja kipuaistimusten käsittelyyn ja modulointiin osallistuvassa hermoverkossa (5,14). Nopeajaksoinen rTMS vapauttaa dopamiinia tyvitumakkeissa (15), mikä sopii siihen, että rTMS:n analgeettinen vaikutus saattaa riippua dopamiini D2 -reseptorigeenin 957C>T polymorfiasta (16). Teho on paras henkilöillä, joilla on geenin TT-homotsygoottimuoto ja joilla myös neuropaattisen kivun riski on suurentunut.
On esitetty, että rTMS:n analgeettinen vaikutus perustuisi aivojen dopamiini-opioidiakselin toiminnan tehostamiseen ja aivojen sisäisen laskevan kivunhallintajärjestelmän vahvistamiseen (7,14,16) sekä liike- ja tuntoaivokuorella syntyviin suotuisiin neuroplastisiin muutoksiin (1,2).
Eurooppalaisen asiantuntijakatsauksen (1,2) arvion mukaan (taulukko 1) rTMS:n teho on varma (A) neuropaattisen kivun hoidossa, ja siihen menetelmälle annettiin vahva suositus. Hoito on mahdollisesti tehokas (C) CRPS-potilailla ja todennäköisesti tehokas (B) fibromyalgiapotilailla (2). Myös suomalainen HALO-katsaus (17) totesi rTMS-hoidon olevan tehokas hoitoresistentin neuropaattisen kivun ja mahdollisesti CRPS-kivun hoitoon.
Fibromyalgiassa nopean rTMS-hoidon vaikutuksen koko oli 0,67 meta-analyysissä (16 satunnaistettua 572 potilasta) (18). Samalla linjalla oli erilaisten keskushermostostimulaatiomenetelmien tehoa neuropaattiseen kipuun vertaillut katsaus (19), joka arvioi rTMS:n yhtä tehokkaaksi kuin takajuostestimulaation ja liikeaivokuoren stimulaation. Samalle tasolle arvioitiin myös näyttö aivojen transkraniaalisen tasavirtastimulaation (transcranial direct current stimulation, tDCS) tehosta neuropaattiseen kipuun (19).
Paras näyttö rTMS:n analgeettisesta tehosta on liikeaivokuoren nopeajaksoisella stimulaatiolla neuropaattisissa kivuissa (taulukko 1). Näitä ovat hermovammojen jälkitilat, postherpeettinen neuralgia, sentraalinen kipu ja raaja-amputaation jälkeinen haamukipu. Hoito kohdennetaan yleensä kipualueen edustusalueelle vastakkaisen puolen liikeaivokuorella (M1) tai vaihtoehtoisesti käden edustusalueelle kivun sijainnista riippumatta (1,2,19). Tutkimuksissa on löydetty uusia tehokkaita kivun hoitokohteita: operkuloinsulaarinen aivokuori toissijaisen tuntoaivokuoren yläpuolella oikealla ("S2") (kuva 1) (20,21) sekä vasen etuotsalohko (dorsolateraalinen prefrontaalialue, DLPF) (22), joka on hyödyllistä liittää hoitoprotokollaan, jos potilaalla on samanaikainen masennus.
Kivun rTMS-tutkimuksissa on harvoin raportoitu vaikutuksen kokoa, mutta oikean "S2"-alueen stimulaatiossa Cohenin d-luku on 0,6 lumehoitoon verrattuna (21); vaikutus on parempi kuin lääkkeiden teho masennukseen (d 0,4). Vahva opioidilääkitys heikentää rTMS-hoitovasteita (Jääskeläinen ym., julkaisematon tieto), minkä vuoksi se pyritään lopettamaan ennen rTMS-hoidon aloitusta.
Kirjallisuuden mukaan rTMS-hoito saattaa olla tehokas myös migreenin, aivovamman jälkeisen päänsäryn sekä alaselkäkipuun ja syöpäkipuun usein liittyvän hermovauriokivun hoidossa sekä kasvojen alueen kiputiloissa (esim. suupolte, Hortonin neuralgia ja kolmoishermosärky) (2,19).
Ainoa neuropaattinen kiputila, jossa rTMS-hoitovastetta ei ole pystytty osoittamaan, on selkäydinvammaan liittyvä kipu (2). Syynä voi olla se, että rTMS-hoitovaste riippuu talamokortikaalisten ratojen eheydestä (1,2), ja selkäydinvammoissa nämä sentraaliset ratayhteydet ovat useimmiten voimakkaasti häiriintyneet.
Standardoitua rTMS-hoitokokeilua on käytetty ennustamaan vastetta liikeaivokuoren sähköstimulaatiolle: yleensä 50–60 % potilaista hyötyy liikeaivokuoren stimulaatiosta, kun taas yli 90 % hyötyy, jos preoperatiivisessa rTMS-hoitokokeilussa saadaan suotuisa vaste (2).
Muita aiheita
Aivohalvauskuntoutuksessa rTMS-hoidon perusteena on hemisfäärien välisen toiminnallisen tasapainon korjaaminen kuntoutumisen tehostamiseksi. Aivoinfarktin seurauksena vaurioalueen toiminta heikkenee ja vastakkaisen, homologisen alueen toiminta kiihtyy kun normaalitilassa vallitseva hemisfäärien välinen vastavuoroinen lateraali-inhibitio häiriintyy. Tilannetta voidaan korjata joko tehostamalla vaurioalueen toimintaa nopeajaksoisella rTMS-hoidolla tai jarruttaen vastakkaista puolta hidasjaksoisella rTMS:llä.
Aivohalvauskuntoutukseen liittyvissä rTMS-tutkimuksissa sarjahoidot on annettu välittömästi ennen fysio- tai toimintaterapiaa, ja se on parantanut näiden tehoa lumestimulaatioon verrattuna merkitsevästi, kun aivoinfarktista on kulunut alle 6 kuukautta. Terveen liikeaivokuoren hitaan rTMS:n on arvioitu olevan varmasti tehokas (A) alle 6 kuukautta kestäneen aivohalvausoireiston hoidossa (2). Vauriopuolen nopeajaksoinen rTMS on todennäköisesti tehokas subakuutin aivohalvauksen kuntoutuksessa (B) (2). Kroonisessa (> 6 kk) aivohalvauksessa molempien rTMS-protokollien teho on selvästi heikompi (C) (2); tämän arvion taustalla on amerikkalainen laaja, negatiivinen monikeskustutkimus (23), jossa 199 potilasta sai 3–12 kuukauden kuluttua aivoinfarktista hidasjaksoisen rTMS-hoidon terveen hemisfäärin liikeaivokuorelle. Tutkimuksessa käytettiin tavanomaista (24) pienempää pulssimäärää (900 p/hoitokerta), mikä voi osaltaan selittää negatiivista tutkimustulosta.
Aivoinfarktin aiheuttaman afasian hoidossa hidas rTMS on kohdistettu oikean otsalohkon alapoimuun (Brodmanin alue 45); protokolla on todennäköisesti tehokas (B) ekspressiivisen afasian hoidossa puheterapian tehostajana (2).
Theetapurskestimulaatiohoitojen tehosta aivohalvauskuntoutuksessa on julkaistu vasta muutamia satunnaistettuja vertailututkimuksia. Niiden perusteella visuospatiaalisen neglect- eli katveoireen hoidossa vasemmalle takaparietaalialueelle annettu jarruttava jatkuva theeta-purskehoito (cTBS) on mahdollisesti (C) tehokas (2). Muissa aivoinfarktiin liittyvissä käyttöaiheissa suositukseen riittävää näyttöä theeta-purskehoidolle ei ole, mutta alustavat tulokset ovat kiinnostavia. Akuutissa vaiheessa 1–16 päivää aivoinfarktista vauriopuolelle annettu jaksoittainen eli iTBS-sarjahoito tehostaa merkitsevästi käden voimien palautumista lumehoitoryhmään verrattuna (25).
rTMS on todennäköisesti tehokas (B) Parkinsonin taudin liikehäiriön hoidossa (2). Useammassa meta-analyysissä sekä käden että yleisen motoriikan on todettu paranevan merkitsevästi molemmin puolin liikeaivokuorelle annetun nopeajaksoisen rTMS-sarjahoidon jälkeen (26,27). Koska tulokset ovat keskimäärin melko vaatimattomat eivätkä hoitovaikutukset ole pysyviä vaan vaativat jatkuvan ylläpitohoidon, ei rTMS-hoitoa ole otettu laajemmin kliiniseen käyttöön Parkinsonin taudin hoidossa. Samoin kuin depressiossa yleensä, myös Parkinsonin tautiin liittyvässä masennuksessa saadaan vaste vasemman etuotsalohkoalueen nopeaan rTMS-hoitoon (B) (2).
Alaraajojen edustusalueelle liikeaivokuorelle annettu tois- tai molemminpuolinen iTBS on tuoreiden tutkimusten perusteella todennäköisesti tehokas (B) multippeliskleroosiin liittyvän alaraajojen spastisuuden hoidossa (2).
Tinnituksen rTMS-hoidon näytönaste on C (taulukko 1). Hoidon tulokset ovat vaihdelleet, koska hoitoprotokollat ovat olleet hyvin erilaisia. Kohdealueena on useimmiten vasen kuuloaivokuori ylimmässä ohimopoimussa tai sen lähialueet (Wernicken alue, sekundaariset kuuloalueet). Koska tinnituksessa kuuloaivokuoren seutu on toiminnallisissa aivokuvauksissa todettu yliaktiiviseksi, käytetään tinnituksen rTMS-tutkimuksissa jarruttavaa hidasta (1 Hz) rTMS-hoitoa. Vaikka optimaalinen protokolla odottaa vahvistamista jatkotutkimuksissa, on tuoreiden meta-analyysien perusteella selvää, että rTMS lievittää tinnituksen voimakkuutta ja haittaavuutta merkitsevästi (28,29). Kaikkiaan tinnituksen rTMS-hoidosta löytyi yhteensä 19 laadukasta satunnaistettua vertailututkimusta (2), joista 14:n tulos oli positiivinen, 5 oli negatiivisia (pääosin pienissä ryhmissä). Oma arviomme hitaan rTMS-hoidon tehosta ja näytönasteesta tinnituksen hoidossa on näiden tutkimusten metodikriittisen uudelleenarvioinnin sekä kahden tuoreen, positiivisen meta-analyysin perusteella luokkaa B.
Hoidon tehoon vaikuttaa taudin kuva: normaali kuulo ja uni sekä oireen lyhyt kesto ennustavat parempaa vastetta (30), samoin kuin voimakkaat oireet alkutilanteessa (31). Vasemman kuuloaivokuoren seudun hidasta rTMS-hoitoa voidaan suositella vaikeaan, hoitoresistenttiin tinnitukseen. Jos tinnitukseen liittyy masennus, vasemman etuotsalohkoalueen yhdistelmähoito on hyödyllistä. Akuutin tinnituksen rTMS-hoidosta on yksi positiivinen, avoin tutkimus liittyen akuuttiin kuulonmenetykseen (32), mikä tukee kliinisiä havaintojamme.
Hoitoresistentti epilepsia on kiinnostava rTMS-hoidon aihe, vaikka epilepsia onkin relatiivinen vasta-aihe magneettistimulaatiolle. Hitaalla taajuudella (yleensä < 1 Hz) rTMS jarruttaa tehokkaasti kortikaalista epileptistä purkausta eläinkokeissa, ja vastaavasti kolmessa satunnaistetussa vertailututkimuksessa on osoitettu hitaan rTMS:n vähentävän merkitsevästi kohtauksien määrää ja epileptistä EEG-aktiivisuutta paikallisalkuisissa epilepsioissa (2). rTMS-hoidon katsotaan olevan mahdollisesti tehokas hoitoresistentissä epilepsiassa (C). Potilastapaussarjojen perusteella rTMS saattaa olla tehokas myös ns. superrefraktaarisen status epilepticuksen hoidossa teho-osastolla (2).
Selvää A- tai B-luokan näyttöä rTMS- tai TBS-hoitojen tehosta ei vielä ole dystonian, essentiaalisen vapinan, Alzheimerin taudin tai tajunnanhäiriöiden hoidossa, vaikka kaikissa alustavat tulokset ensimmäisistä satunnaistetuista vertailututkimuksista näyttävät lupaavilta (2).
Lopuksi
Sarjamagneettistimulaatio tuo tarpeellisen ja turvallisen lisän vaikean kivun ja tinnituksen hoitovalikoimaan sekä neurologisten sairauksien kuntoutukseen. Yli 3 kuukautta jatkuneessa vamman tai leikkauksen jälkeisessä kivussa on mukana lähes aina neuropaattinen komponentti, ja vaikeahoitoisessa tilanteessa nämä potilaat hyötyvät kokemuksemme mukaan hyvin rTMS-hoidosta.
Koska rTMS-hoidon vaikutus perustunee neuroplastisiteetin kautta tapahtuviin muutoksiin hermoverkoissa, se tehoaa parhaiten tuoreissa tilanteissa ja yhdistettynä muuhun terapiaan. Muiden liitännäishoitojen tarve ja mahdollisuudet tulisikin jatkossa arvioida neuromodulaatiohoitoprosessin varhaisvaiheessa.
Tavallisesti rTMS-hoidon tulokset ovat viikoissa tai kuukausissa ohimeneviä, joten kliinisessä työssä ja jatkotutkimuksissa tulisi erityisesti huomioida hoitotulosten pysyvyyden varmistaminen mm. rTMS-hoidon ylläpitoprotokollia kehittäen tai ylläpitohoitoa transkraniaalisella tasavirtastimulaatiolla (tDCS) hyödyntäen (33).
Satu K. Jääskeläinen: Konsultointipalkkio (Asianajotoimisto Vesa Laukkanen Oy), asiantuntijalausuntoja (Potilasvahinkolautakunta), apuraha laitokselle (Orion Pharma), luentopalkkiot (Orion Pharma, Pfizer), tekijänpalkkiot (Kustannus Oy Duodecim).
Tero Taiminen: Konsultointipalkkiot (Asianajotoimisto Jarkko Männistö, L Legal Oy, Vesa Laukkanen Oy, Orion Pharma, Janssen Cilag), apurahat laitokselle (Lundbeck, Sooma Oy), luentopalkkiot (Astra Zeneca, Bayer, Bristol-Myers-Squibb, Efeko, Eisai, GlaxoSmithKline, Janssen Cilag, Lilly, Lundbeck, Nexstim, Orion Pharma, Pfizer, Professio Finland, Schering-Plough, Mega Electroinics, UCB), korvaus käsikirjoituksen valmistelusta (Lääketeollisuuden tutkimussäätiö), tekijänpalkkiot (Kustannus Oy Duodecim), korvaus koulutusaineiston tuottamisesta (Pfizer), matka-, majoitus- ja kokouskulut (Lundbeck, Pfizer, Servier).
- 1
- Lefaucheur JP, André-Obadia N, Antal A ym. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS). Clin Neurophysiol 2014;125:2150–206.
- 2
- Lefaucheur JP, Aleman A, Baeken C ym. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): an update (2014-2018). Clin Neurophysiol 2020;131:474–528.
- 3
- Barker AT, Jalinous R, Freeston IL. Non-invasive magnetic stimulation of the human motor cortex. Lancet 1985;1:1106–7.
- 4
- Määttä S, Säisänen L, Vaalto S. Liikeradan tutkimukset (MEP). Kirjassa: Mervaala E, Haaksiluoto E, Himanen S-L, Jääskeläinen S, Kallio M, Vanhatalo S, toim. Kliininen neurofysiologia. Helsinki: Kustannus Oy Duodecim 2019:296–307.
- 5
- Vaalto S, Julkunen P, Säisänen L ym. Navigoitu TMS (nTMS) ja neuromodulaatio. Kirjassa: Mervaala E, Haaksiluoto E, Himanen S-L, Jääskeläinen S, Kallio M, Vanhatalo S, toim. Kliininen neurofysiologia. Helsinki: Kustannus Oy Duodecim 2019:354–76.
- 6
- Taiminen T, Jääskeläinen SK. Sarjamagneettistimulaation mahdollisuudet psykiatriassa ja tulevaisuuden näkymät. Suom Lääkäril 2020;75:2853–58.
- 7
- Moisset X, de Andrade DC, Bouhassira D. From pulses to pain relief: an update on the mechanisms of rTMS-induced analgesic effects. Eur J Pain 2016;20:689–700.
- 8
- Hoogendam JM, Ramakers GM, Di Lazzaro V. Physiology of repetitive transcranial magnetic stimulation of the human brain. Brain Stimul 2010;3:95–118.
- 9
- Rossi S, Hallett M, Rossini PM, Pascual-Leone A; Safety of TMS Consensus Group. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clin Neurophysiol 2009;120:2008–39.
- 10
- Ridding MC, Ziemann U. Determinants of the induction of cortical plasticity by non-invasive brain stimulation in healthy subjects. J Physiol 2010;588:2291–304.
- 11
- Tsubokawa T, Katayama Y, Yamamoto T ym. Chronic motor cortex stimulation for the treatment of central pain. Acta Neurochir Suppl 1991;52:137–9.
- 12
- Maarrawi J, Peyron R, Mertens P ym. Motor cortex stimulation for pain control induces changes in the endogenous opioid system. Neurology 2007;69:827–34.
- 13
- Maarrawi J, Peyron R, Mertens P ym. Brain opioid receptor density predicts motor cortex stimulation efficacy for chronic pain. Pain 2013;154:2563–8.
- 14
- Lamusuo S, Hirvonen J, Lindholm P ym. Neurotransmitters behind pain relief with transcranial magnetic stimulation – PET evidence for release of endogenous opioids. Eur J Pain 2017;21:1505–15.
- 15
- Strafella AP, Paus T, Fraraccio M ym. Striatal dopamine release induced by repetitive transcranial magnetic stimulation of the human motor cortex. Brain 2003;126:2609–15.
- 16
- Jääskeläinen SK, Lindholm P, Valmunen T ym. Variation in the dopamine D2 receptor gene plays a key role in human pain and its modulation by transcranial magnetic stimulation. Pain 2014;155:2180–7.
- 17
- Hagelberg N, Harno H, Saijonkari M ym. HALO-katsaus. Transkraniaalinen magneettistimulaatio neuropaattisen kivun hoidossa. Suom Lääkäril 2017;72:214.
- 18
- Hou WH, Wang TY, Kang JH. The effects of add-on non-invasive brain stimulation in fibromyalgia: a meta-analysis and meta-regression of randomized controlled trials. Rheumatology (Oxford) 2016;55:1507–17.
- 19
- Cruccu G, Garcia-Larrea L, Hansson P ym. EAN guidelines on central neurostimulation therapy in chronic pain conditions. Eur J Neurol 2016;23:1489–99.
- 20
- Valmunen T, Pertovaara A, Taiminen T ym. Modulation of facial sensitivity by navigated rTMS in healthy subjects. Pain 2009;142:149–58.
- 21
- Lindholm P, Lamusuo S, Taiminen T ym. Right secondary somatosensory cortex - a promising novel target for the treatment of drug-resistant neuropathic orofacial pain with repetitive transcranial magnetic stimulation. Pain;2015;156:1276–83.
- 22
- Umezaki Y, Badran BW, DeVries WH ym. The efficacy of daily prefrontal repetitive transcranial magnetic stimulation (rTMS) for burning mouth syndrome (BMS): A randomized controlled single-blind study. Brain Stimul 2016;9:234–42.
- 23
- Harvey RL, Edwards D, Dunning K ym. Randomized sham-controlled trial of navigated repetitive transcranial magnetic stimulation for motor recovery in stroke. Stroke 2018;49:2138–46.
- 24
- Teng S, Guo Z, Peng H ym. High-frequency repetitive transcranial magnetic stimulation over the left DLPFC for major depression: session-dependent efficacy: A meta-analysis. Eur Psychiatry 2017;41:75–84.
- 25
- Volz LJ, Rehme AK, Michely J ym. Shaping early reorganization of neural networks promotes motor function after stroke. Cereb Cortex 2016;26:2882–94.
- 26
- Chou YH, Hickey PT, Sundman M ym. Effects of repetitive transcranial magnetic stimulation on motor symptoms in Parkinson disease: a systematic review and meta-analysis. JAMA Neurol 2015;72:432–40.
- 27
- Yang C, Guo Z, Peng H ym. Repetitive transcranial magnetic stimulation therapy for motor recovery in Parkinson’s disease: A Meta-analysis. Brain Behav 2018;8:e01132.
- 28
- Soleimani R, Jalali MM, Hasandokht T. Therapeutic impact of repetitive transcranial magnetic stimulation (rTMS) on tinnitus: a systematic review and meta-analysis. Eur Arch Otorhinolaryngol 2016;273:1663–75.
- 29
- Londero A, Bonfils P, Lefaucheur JP. Transcranial magnetic stimulation and subjective tinnitus. A review of the literature, 2014-2016. Eur Ann Otorhinolaryngol Head Neck Dis 2018;135:51–8.
- 30
- Wang H, Li B, Wang M ym. Factor analysis of low-frequency repetitive transcranial magnetic stimulation to the temporoparietal junction for tinnitus. Neural Plast 2016;2016:2814056.
- 31
- Sahlsten H, Isohanni J, Haapaniemi J ym. Electric field navigated transcranial magnetic stimulation for chronic tinnitus: A pilot study. Int J Audiol 2015;54:899–909.
- 32
- Zhang D, Ma Y. Repetitive transcranial magnetic stimulation improves both hearing function and tinnitus perception in sudden sensorineural hearing loss patients. Sci Rep 2015;5:14796.
- 33
- Munoz-Ruiz M, Nordberg J, Lähdetie J, Jääskeläinen SK. Non-invasive therapeutic brain stimulation for treatment of resistant focal epilepsy in a teenager. Clin Neurophysiol Practice 2020;5:142–6.