Timololi-silmätipat vaikuttavat systeemisesti ja lisäävät kaatumisriskiä
• Timololi on silmätipoissa yleinen beetasalpaaja, josta noin 80 % imeytyy verenkiertoon.
• Sitä sisältävät silmätipat voivat aiheuttaa vakavia haittavaikutuksia, ja potilaiden kaatumisriski kasvaa.
• Sydänvaikutukset korreloivat suoraan timololin pitoisuuteen plasmassa. Systeemistä imeytymistä voi vähentää painamalla kyynelpussia silmän sisäkulmassa.
• Potilaan kokonaislääkitys pitää selvittää. CYP2D6-entsyymin estäjät, kuten paroksetiini ja fluoksetiini, sekä verapamiili, diltiatseemi ja beetasalpaajat lisäävät timololin sydänhaittojen riskiä.

Glaukooma (silmänpainetauti eli viherkaihi) on yksi yleisimmistä näkövammaisuuteen ja sokeuteen johtavista sairauksista. Sitä sairastaa noin 70 miljoonaa ihmistä maailmassa (1).
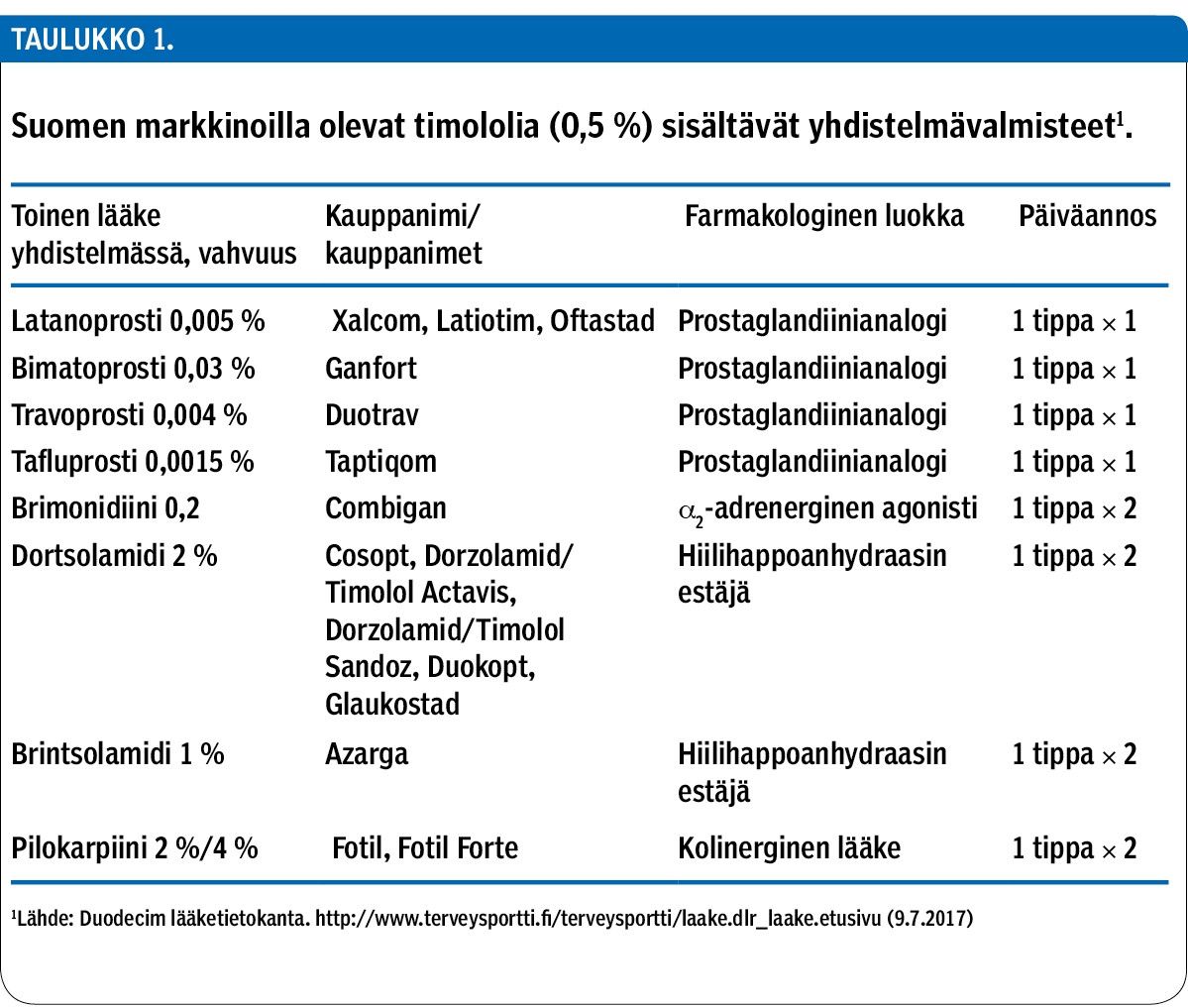
Silmän pinnalle annosteltava epäselektiivinen beetasalpaaja timololi on ollut jo 40 vuotta yksi glaukooman peruslääkkeistä. Markkinoille on hiljattain tullut lisäksi joukko uusia glaukooman hoidon yhdistelmälääkkeitä, joissa on mukana timololi ja prostaglandiinianalogi (taulukko 1).
Lääkärien tulisi tarkastella paikallisesti käytettävien silmätippojen mahdollisia systeemisiä vaikutuksia arvioidessaan potilaiden lääkehoitoja. Erityisesti yhdistelmävalmisteiden sisältämä timololi voi jäädä helposti huomioimatta (2). Sitä sisältävistä yhdistelmätipoista on viime aikoinakin julkaistu artikkeleita, joissa ei ole otettu huomioon sydämeen kohdistuvia haittavaikutuksia (3,4), Tämän on arveltu ainakin osittain johtuvan valikoivasta tai puutteellisesta raportoinnista ja tulkinnasta (5,6).
Silmätipan timololista yli 80 % imeytyy systeemisesti ja ensikierron metabolia vältetään. Näin timololia sisältävät silmätipat voivat aiheuttaa vakavia systeemisiä haittavaikutuksia, kuten oireista bradykardiaa, johtumishäiriöitä sydämessä, ortostaattista hypotensiota ja pyörtymisiä (6). Timololi-hoidon aloittaa yleensä silmälääkäri, mutta lääkehoitojen haittavaikutusten seuranta kuuluu kaikille hoitaville lääkäreille.
Vaikutus kammionestekiertoon
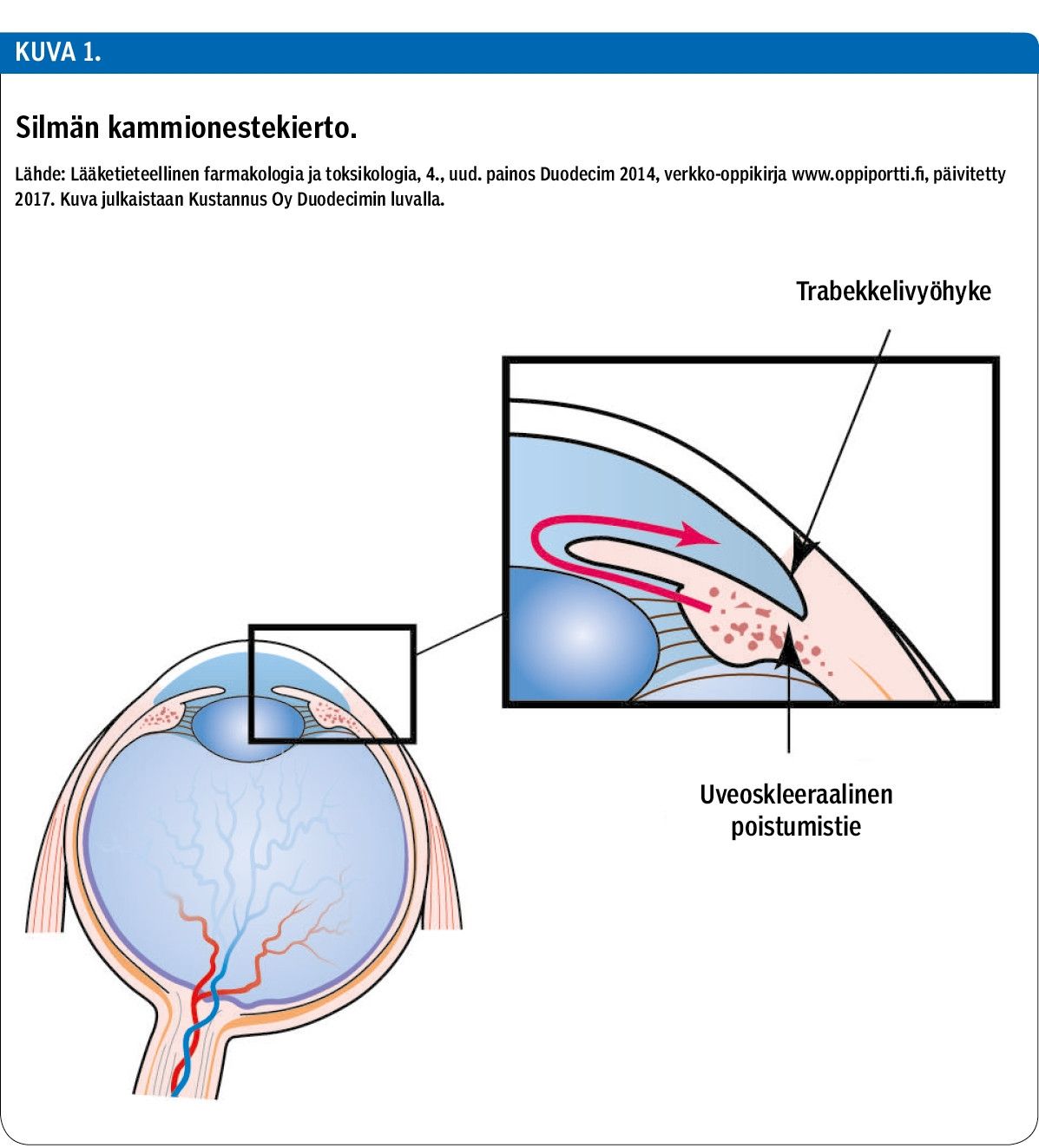
Silmän etu- ja takakammion täyttävä kammioneste (n. 200 µl) tuo ravinteita silmän eri osiin ja ylläpitää riittävää painetta silmässä (kuva 1). Kammionestettä muodostuu n. 2,5 µl/min silmän takaosassa sädekehän siliaarisoluissa. Kammioneste kulkeutuu takakammiosta mykiön ja värikalvon välistä etukammioon, josta se poistuu kammiokulmassa sijaitsevien trabekkelivyöhykkeen (n. 90 %) ja ns. uveoskleraalisen poistumistien (n. 10 %) kautta laskimoverenkiertoon (7).
Kammionestekiertoon voidaan vaikuttaa lääkeaineilla joko vähentämällä sen eritystä takakammioon tai edistämällä sen poistumista etukammiosta, minkä seurauksena silmänpaine laskee. Timololin arvellaan vähentävän kammionesteen muodostusta salpaamalla beeta2-reseptoreita sädekehän epiteelisoluissa (8).
Bradykardia ja eteis-kammiojohtumisen häiriöt
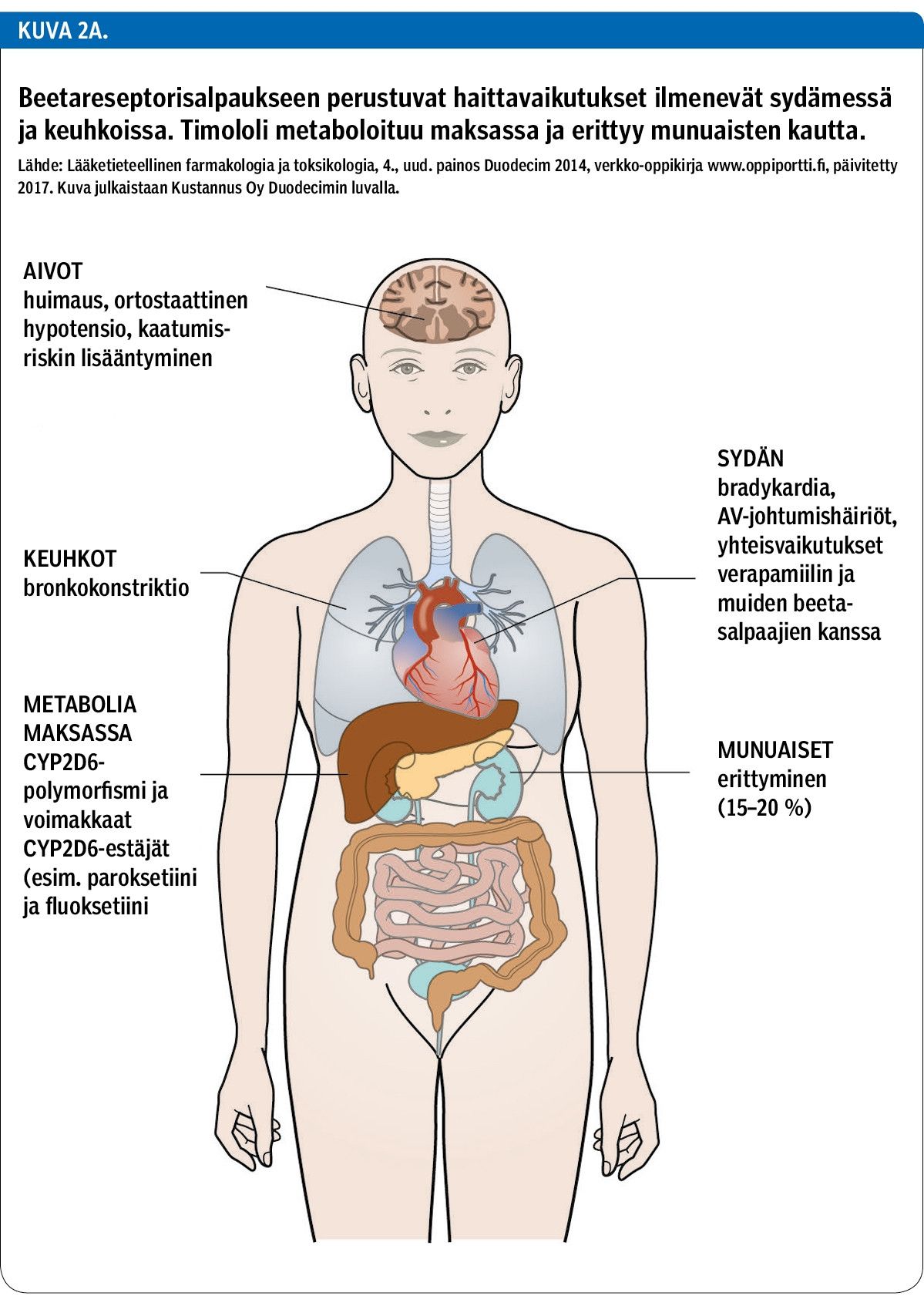
Sinusbradykardia alle 60 lyöntiä minuutissa on yleinen ja harmiton hyväkuntoisella nuorella (9). Vanhemmilla potilailla se voi johtaa vakavaan sairaalahoitoa vaativaan oireistoon. Timololi-silmätippahoitoon mahdollisesti liittyviä haittavaikutuksia ovat bradykardia, eteis-kammiokatkos ja sairas sinus -oireyhtymä (6,10) (kuva 2A), jotka lisäävät potilaan kaatumisriskiä (11). Siksi kaikilta potilailta tulee ottaa EKG ennen timololi-hoidon aloitusta ja tarvittaessa myös hoidon aikana (taulukko 2).
Satunnaistetut lumekontrolloidut kliiniset tutkimukset ovat osoittaneet, että silmätippana annosteltu timololi hidastaa merkitsevästi sydämen sykettä sekä levon että rasituksen aikana (13,14). Tutkimuksissa käytettiin lisäksi vaihtovuoroista tutkimussuunnitelmaa, jossa jokainen potilas sai yhdellä periodilla vain lumetta. Osalla potilaista leposyke ei juurikaan hidastu, mutta toisilla se saattaa hidastua jopa yli 10 yksikköä minuutissa.
Pratt työtovereineen (15) julkaisi retrospektiivisen tapaussarjatutkimuksen, jossa timololi-tippoja käyttävillä potilailla oli suurimmillaan lähes kaksinkertainen riski joutua bradykardian takia sairaalahoitoon puolen vuoden aikana timololi-hoidon aloittamisen jälkeen. On tärkeää huomata, että tähän tulokseen päädyttiin, vaikka tutkimuksessa ei otettu huomioon potilaan CYP2D6-genotyyppistatusta (ks. haittavaikutuksen riskiä lisäävät tekijät) tai muuta lääkitystä (taulukko 3), jotka lisäävät timololi-tippoja käyttävän potilaan bradykardiariskiä (16).
Annostelu silmätippoina ja kaatumisriskin lisääntyminen
Kaatumisen riski kasvaa potilaan ikääntyessä, ja suurin osa glaukoomapotilaista on yli 65-vuotiaita. Jopa joka kolmas tässä ikäryhmässä kaatuu ainakin kerran vuodessa ja 80 vuotta täyttäneistä joka toinen. Kaatumisesta voi aiheutua vakavakin vamma, mikä heikentää elämänlaatua huomattavasti. Vuosittain noin 6 % yli 65-vuotiaista tarvitsee yhteiskunnan tukemaa palvelua kaatumisen takia (17). Asia on myös terveystaloudellisesti hyvin merkittävä, sillä kalleimman murtuman eli lonkkamurtuman hoito maksaa Suomessa kokonaisuudessaan yli 20 000 euroa/ potilas (18).
Osalla potilaista kaatumisen merkittävä syy on lääkehaitta (17,19). Glynn ym. (20) osoittivat noin 500 glaukoomapotilasta käsittävässä tutkimuksessa, että beetasalpaajasilmätippoja käyttävillä potilailla oli yli kolminkertainen riski kaatua ja joutua sen takia käyttämään terveyspalveluja. Prospektiivisen kaatumisriskiä selvittävän kliinisen tutkimuksen mukaan epäselektiivisen beetasalpaajan käyttö (ryhmästä oli suljettu pois timololi-silmätippoja käyttävät potilaat) lisäsi kaatumisriskiä tilastollisesti merkitsevästi (riskisuhde 1,41). Timololi-silmätippoja käyttävien potilaiden riskisuhde oli lähes sama, mutta ei tilastollisesti merkitsevä (1,37; 95 %:n luottamusväli 0,99–1,90) (21).
Mielenkiintoinen havainto oli myös se, että masennuslääkkeiden käyttö osaltaan lisäsi kaatumisriskiä tilastollisesti merkitsevästi (21). On mahdollista, että havainnon taustalla on joidenkin masennuslääkkeiden aiheuttama CYP2D6-entsyymin estyminen, jolloin plasman timololi-pitoisuus voi suurentua (6). Tällaisia masennuslääkkeitä ovat erityisesti fluoksetiini ja paroksetiini sekä osa trisyklisistä masennuslääkkeistä, kuten desipramiini ja nortriptyliini (22).
Potilasesimerkkejä kirjallisuudesta
Esittelemme tässä kolme julkaistua potilastapausta, joissa potilaiden kaatumisriski oli lisääntynyt ja syy-yhteys timololi-silmätippoihin oli ilmeinen. Sen sijaan neljännen julkaisun potilaan tapauksessa ei aluksi osattu epäillä timololi-tippaa bradykardian aiheuttajana.
Toistuvat kaatumiset (23)
Miespotilas (74 v), joka sairasti eturauhassyöpää, verenpainetautia ja jolla oli glaukooma, oli kaatunut viikoittain kahden viime vuoden aikana. Viiden viime vuoden aikana hänellä oli ollut usein huimausta seisomaan noustessa. Potilaalla oli lääkityksenä losartaani, asetyylisalisyylihappo sekä glaukooman hoitona latanoprosti- ja 0,5-prosenttiset timololi-silmätipat (viimeksi mainittua kahdesti päivässä kumpaankin silmään).
Kun potilasta tutkittiin, hänen verenpaineensa laski seisomaan noustessa 145/95 mmHg:sta 135/87 mmHg:iin ja häntä pyörrytti. Potilaan syke oli vain 43/min. Lisätutkimukset osoittivat kallistuskokeessa voimakkaan ortostaattisen hypotension: verenpaine laski 89/74 mmHg:iin, syke hidastui 40:een/min ja potilas pyörtyi. Silmälääkärin konsultaation jälkeen timololi-silmätippojen käyttö lopetettiin, ja kallistuskokeen tulos oli sen jälkeen normaali. Vuoden seurannan aikana potilas oli oireeton.
Vakava huimaus (23)
Miespotilas (73 v) lähetettiin jatkotutkimuksiin tajuttomuuskohtauksen takia. Esitietojen mukaan hänellä oli glaukooma, insuliinihoitoinen diabetes ja hän oli sairastanut sydäninfarktin. Potilaalla oli ollut viime vuosina useita huimauskohtauksia, joihin oli liittynyt voimakasta hikoilua. Niiden aikana ei ollut mitattu matalia verensokeriarvoja.
Potilas käytti 0,5-prosenttisia timololi-tippoja kahdesti päivässä kumpaankin silmään annosteltuna. Insuliinin lisäksi hänellä oli käytössä antikoagulantti (kumariini-johdannainen) ja aflutsosiini.
Kun potilas tuli klinikalle, hänellä oli bradykardia (48/min), verenpaine oli 142/90 mmHg eikä hänellä ollut hypoglykemiaa. Hänellä ei ollut myöskään ortostaattista hypotensiota. EKG:n vuorokausiseurannassa (Holter) esiintyi useita bradykardiavaiheita. Syke oli hitaimmillaan 43/min, jolloin potilaalla oli myös tyypillinen huimauskohtaus. Silmälääkärin kehotuksesta timololi-tipat vaihdettiin latanoprostiin. Holter-seurannassa muutaman viikon kuluttua bradykardiaa ei enää todettu. Puolentoista vuoden seurantajakson aikana uusia huimauskohtauksia ei esiintynyt.
Vakava huimaus ja pyörtyily (24)
Miespotilas (60 v) tuli ensiapuun huimauksen ja pyörtyilyn takia. Hänelle oli tehty tekoläppäleikkaus viisi vuotta aiemmin, ja eteisvärinä oli todettu neljä vuotta ennen huimausta ja pyörtyilyä. Potilaalle oli 10 päivää ennen ensiapukäyntiä aloitettu glaukooman hoitoon latanoprostin ja timololin yhdistelmätippahoito (Xalcom) annoksella yksi tippa molempiin silmiin kerran päivässä (taulukko 1). Lisäksi hänellä oli käytössä varfariini.
Potilaan tullessa hänen sykkeensä oli 30/min ja verenpaine 85/50 mmHg. EKG:ssä näkyi aikaisempaan tapaan eteisvärinään liittyvät muutokset. Miehelle asennettiin väliaikainen sydämentahdistin. Tämän jälkeen EKG:ssä todettiin kammiorytmi 60/min. Potilaan hemodynamiikka parani ja sekä huimaus että pyörtyily loppuivat. Latanoprosti/timololi-silmätipan käyttö lopetettiin, ja muutaman päivän kuluttua potilaalle asennettiin pysyvä tahdistin. Potilas oli oireeton yhden ja kuuden kuukauden seurannassa.
Haastava sinusbradykardia (25)
Miespotilas (70 v) otettiin sairaalahoitoon kovan päänsäryn, kuumeen ja sekavan mielialan takia. Häneltä diagnosoitiin bakteeriperäinen meningiitti, johon aloitettiin lääkityksenä kefriaksoni, vankomysiini, ampisilliini ja deksametasoni. Kolmantena hoitopäivänä kuume ja muut oireet paranivat. Neljäntenä päivänä potilaalla todettiin sinusbradykardia (syke 40/min), johon liittyi lievää huimausta. Meningiitin takia epäiltiin kallonsisäisen paineen nousua, mutta se voitiin sulkea pois oftalmoskopian avulla. Myös EKG:n vuorokausiseurannassa (Holter) todettiin sinusbradykardia, ja syke oli hitaimmillaan 30/min. Lisäksi todettiin kolme lyhytkestoista kammiotakykardiaa. Potilaalle suunniteltiin tahdistimen asennusta.
Operaatiota edeltävänä iltana sairaalan päivystävä lääkäri huomasi sattumalta, että potilaan vaimo tiputti potilaalle silmätippoja, jotka osoittautuivat timololia sisältäviksi. Niitä oli tiputettu ensimmäisen kerran sairaalassa juuri ennen ensimmäistä bradykardiaepisodia. Kun silmätippojen käyttö lopetettiin, Holter-seurannassa ei enää todettu bradykardiaa.
Näissä potilastapauksissa oireiden yhdistäminen timololi-hoitoon vei jonkin aikaa, vaikka haittavaikutukset olivat timololille tyypilliset. Vastaavan kaltaisia tapausraportteja on julkaistu viime vuosina melko paljon (6). Kaikista lääkkeiden aiheuttamista vakavista haittatapahtumista kuitenkin vain hyvin pieni osa päätyy lääketieteelliseen kirjallisuuteen. Siten on hyvin todennäköistä, että timololi-silmätippojen aiheuttamat sydämeen kohdistuvat vakavat haittatapahtumat ja niiden seurannaisvaikutukset, kuten kaatumiset, saattavat olla verrattain tavallisia.
Haittavaikutusten riskiä lisäävät tekijät
Ikä
Kaatumisriski on lisääntynyt suurimmalla osalla glaukoomapotilaista korkean iän ja siihen liittyvien ikääntymismuutosten, sairauksien ja kaatumisvaaraa lisäävien lääkkeiden takia (1,17, 19). Toisaalta on hyvä muistaa raskaana olevat glaukoomapotilaat. Timololi läpäisee istukan ja voi aiheuttaa sikiölle sydämeen kohdistuvia haittavaikutuksia (26). Siksi on syytä miettiä, voisiko timololi-hoidon keskeyttää raskauden aikana. Timololi on myös yleisesti käytetty lääkeaine lasten glaukoomassa. Sen tehoa ja turvallisuutta ei kuitenkaan ole riittävästi tutkittu lapsilla (27).
Valmisteen vahvuus ja formulaatio
Timololin sydämeen kohdistuvat haittavaikutukset ovat suoraan verrannollisia sen pitoisuuteen plasmassa. Vahvuudeltaan pienempi valmiste (esimerkiksi 0,1-prosenttinen geelimäinen tuote) on siten turvallisempi vaihtoehto (14,28). On myös näyttöä siitä, että viskoosisempi geelituote, joka sisältää saman verran timololia kuin vesitippavalmiste, hidastaa sykettä vähemmän (13).
Farmakokinetiikka
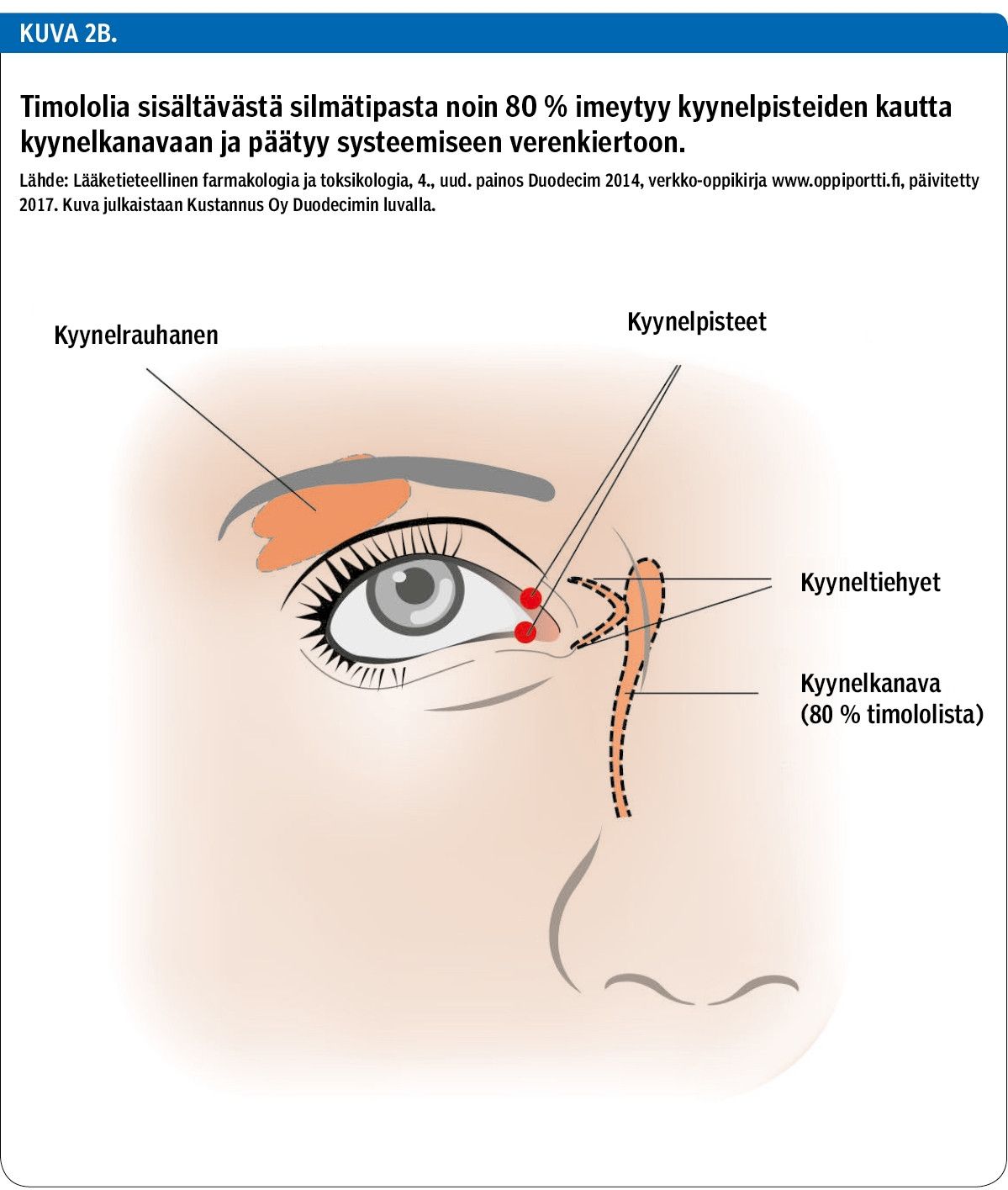
Timololi-tipasta imeytyy sarveiskalvon läpi kammionesteeseen ja sitä kautta siliaarikudokseen vaikutuskohtiinsa vain pieni osa vaikuttavasta aineesta (alle 10 %) (7). Silmätipan sisältämästä timololista noin 80 % imeytyy sen sijaan nenä-nielukanavan kautta systeemiseen verenkiertoon, jolloin vältetään ensikierron metabolia (kuva 2B). Systeemistä imeytymistä voidaan vähentää painamalla kyynelpussia silmän sisäkulmassa (29).
Timololin metaboliaa maksassa katalysoi sytokromi P450-entsyymi 2D6 (CYP2D6), joka on polymorfisesti ilmentyvä (16). Suomalaisesta väestöstä noin 5–10 % on hitaita metaboloijia, ja heillä plasman timololipitoisuudet ovat suuremmat kuin nopeilla metaboloijilla (30,31). Erittäin nopeita metaboloijia on saman verran (32), ja heillä pitoisuudet ovat pienemmät. Mitä suurempi on timololin pitoisuus potilaan plasmassa, sitä enemmän sydämen maksimisyke hidastuu rasitus-EKG:ssä (33).
Lähes 20 % timololista erittyy munuaisten kautta (34). Suurella osalla iäkkäistä glaukoomapotilaista lääkeaineiden eritys munuaisten kautta on huomattavasti heikentynyt (35), ja myös tämä voi suurentaa timololipitoisuutta (kuva 2A).
Farmakokineettiset yhteisvaikutukset muiden lääkeaineiden kanssa
Jos potilas on genotyypiltään hidas CYP2D6-metaboloija, hänen elimistönsä timololipitoisuus voi suurentua hyvin paljon jo hoidon alussa. Toisaalta on tärkeää muistaa, että jos genotyypiltään nopea tai erittäin nopea CYP2D6-metaboloija alkaa käyttää timololin kanssa yhtä aikaa voimakasta CYP2D6-entsyymin estäjää, kuten paroksetiinia, hänen nopea fenotyyppinsä muuttuu hitaaksi metaboloijaksi ja ortostaattisen hypotension riski kasvaa (taulukko 3) (28).
Farmakodynaamiset yhteisvaikutukset muiden lääkeaineiden kanssa
Verapamiili: Verapamiilia ei tulisi käyttää beetasalpaajien kanssa yhtä aikaa, koska sillä on additiivinen vaikutus beetasalpaajista johtuviin rytmihäiriöihin, kuten bradykardiaan ja eteiskammiojohtumisen pidentymiseen (36). Sama pätee diltiatseemiin. Kirjallisuudessa on raportoitu vaikeista rytmihäiriötapauksista, kun potilas on käyttänyt verapamiilia timololi-tippahoidon kanssa (6). Muiden kalsiuminestäjien kanssa tulee noudattaa varovaisuutta (taulukko 3).
Systeemisesti käytettävät beetasalpaajat: Suomessa noin 40 %:lla kroonista verenpainetautia sairastavista on käytössä beetasalpaaja (40). Australialaisessa tutkimuksessa 23 %:lla timololi-silmätippoja käyttävistä 75–84-vuotiaista oli yhtä aikaa käytössä myös systeeminen beetasalpaaja (37). Toisessa tutkimuksessa silmänpaine laski vähemmän potilailla, joilla oli samanaikaisesti käytössä systeeminen beetasalpaaja (38). Lisäksi heillä oli useammin bradykardiaa. Osasyynä kahden beetasalpaajan yhtäaikaiseen käyttöön eri käyttöaiheilla voi olla potilastietojen puutteellinen kirjaaminen. Kun Jampel ym. (41) tutkivat yleislääkärien potilastietoja glaukoomapotilaista, vain noin puolessa tapauksista oli maininta beetasalpaajasilmätippojen samanaikaisesta käytöstä.
Muistisairaat potilaat
Tuoreen tutkimuksen mukaan beetasalpaajat lisäsivät vaikea-asteista muistisairautta sairastavien vanhusten toiminnanvajausta sydäninfarktin jälkeen (42). Aineiston analysoinnissa käytettiin validoitua fyysisen toimintakyvyn mittaria. On myös näyttöä, että timololi-silmätipat voivat aiheuttaa vanhuspotilaille sekavuutta ja hallusinaatioita (43,44). Siksi on syytä harkita muistisairaan potilaan timololi-silmätippahoidon vaihtamista toiseen silmänpainetta laskevaan valmisteeseen, joka ei sisällä beetasalpaajaa.
Lopuksi
Yleisesti ajatellaan, että paikallinen lääkitys suojaa potilasta lääkkeen systeemisiltä haittavaikutuksilta. Suuri osa silmätipan timololista kuitenkin imeytyy systeemiseen verenkiertoon. Potilasta tulee opastaa painamaan kyynelpussia silmän sisäkulmassa ja pitämään silmät kiinni parin minuutin ajan tipan annostelun jälkeen. Tämä vähentää systeemistä imeytymistä silmän pinnalta.
Ennen timololihoidon aloitusta on aina rekisteröitävä EKG, jotta rytmihäiriöihin liittyvät vasta-aiheet voidaan sulkea pois. Koska useimmat potilaat ovat iäkkäitä, heillä voi olla useita liitännäissairauksia. Potilaan muu lääkitys on siksi huolellisesti tarkistettava ja tunnistettava vaikuttava aine kauppanimien takaa. Verapamiilia, diltiatseemia tai systeemisiä beetasalpaajia ei tulisi ollenkaan määrätä yhtä aikaa timololi-silmätippojen kanssa. CYP2D6-genotyypitys ennen hoidon aloittamista on myös suotavaa, jos se on saatavilla. Erityistä varovaisuutta on noudatettava käytettäessä CYP2D6-entsyymin estäjiä (esim. paroksetiini ja fluoksetiini), koska ne voivat merkittävästi nostaa timololin pitoisuuksia plasmassa.
Ei sidonnaisuuksia.
- 1
- Quigley HA. Glaucoma. Lancet 2011;377:1367–77.
- 2
- Spratt A ym. What’s in a name? New glaucoma drugs. Lancet 2006;368:826–7.
- 3
- Higginbotham EJ. Considerations in glaucoma therapy: fixed combinations versus their component medications. Clin Ophthalmol 2010;4:1–9.
- 4
- Holló G ym. Fixed-dose combination of tafluprost and timolol in the treatment of open-angle glaucoma and ocular hypertension: comparison with other fixed-combination products. Adv Ther 2014;31:932–44.
- 5
- Saini P ym. Selective reporting bias of harm outcomes within studies: findings from a cohort of systematic reviews. BMJ 2014. http://dx.doi.org/10.1136/bmj.g6501
- 6
- Mäenpää J, Pelkonen O. Cardiac safety of ophthalmic timolol. Expert Opin Drug Saf 2016;15:1549–61.
- 7
- Mäenpää J. Silmätaudeissa käytettävät lääkeaineet. Toimittajat: Pelkonen O, Ruskoaho H, Hakkola J ym. Lääketieteellinen farmakologia ja toksikologia. Helsinki: 4., uud. painos Duodecim 2014;973–84. Verkko-oppikirja www.oppiportti.fi (päivitetty 2017).
- 8
- Schmidl D ym. Pharmacotherapy of glaucoma. J. Ocul Pharmacol Ther 2015;31:63–77.
- 9
- Aro A, Parikka H. EKG-poikkeavuuksien kliininen merkitys. Suom Lääkäril 2015;70:301–7.
- 10
- Kettunen R, Mononen J, Strandberg T. Vanhus sydänpotilaana päivystyksessä. Suom Lääkäril 2015;70:1819–24.
- 11
- Faddis MN, Rich MW. Pacing interventions for falls and syncope in the elderly. Clin Geriatr Med 2002;18:279–94.
- 12
- Pharmaca Fennica (siteerattu 1.9.2017) https://pf.pharmacafennica.fi/kauppanimet/xalcom/xalcom-silmatipat-liuos-50-mikrog-ml-5-mg-ml-seloste/(from)/search/(tab)/tabFull.
- 13
- Dickstein K ym. Comparison of aqueous and gellan ophthalmic timolol with placebo on the 24-hour heart rate response in patients on treatment for glaucoma. Am J Ophthalmol 2001;132:626–32.
- 14
- Uusitalo H ym. Improved systemic safety and risk-benefit ratio of topical 0.1% timolol hydrogel compared with 0.5% timolol aqueous solution in the treatment of glaucoma. Graefes Arch Clin Exp Ophthalmol 2006;244: 1491–6.
- 15
- Pratt NL ym. Association between ophthalmic timolol and hospitalisation for bradycardia. J Ophthalmol 2015 (siteerattu 1.9.2017). doi: 10.1155/2015/567387
- 16
- Volotinen M ym. Metabolism of ophthalmic timolol: new aspects of an old drug. Basic Clin Pharmacol Toxicol 2011;108:297–303.
- 17
- Kannus P ym. Prevention of falls and consequent injuries in elderly people. Lancet 2005;366:1885–93.
- 18
- Nurmi-Lüthje I. Tapaturmien ehkäisy on kunnan tehtävä. Suom Lääkäril 2013;68:716.
- 19
- Hartikainen S ym. Medication as a risk factor for falls: critical systematic review. J Gerontol A Biol Sci Med Sci 2007;62:1172–81.
- 20
- Glynn RJ ym. Falls in elderly patients with glaucoma. Arch Ophthalmol 1991;109:205–10.
- 21
- Ham AC ym. Medication-related fall incidents in an older, ambulant population: the B-PROOF study. Drugs Aging 2014;31:917–27.
- 22
- Brown CS ym. Pharmacokinetic factors in the adverse cardiovascular effects of antipsychotic drugs. Clin Pharmacokinet 2004;43:33–56.
- 23
- Müller ME ym. Syncope and falls due to timolol eye drops. BMJ 2006;332:960–1.
- 24
- Canpolat U ym. Severe bradycardia and syncope due to topical ophthalmic timolol. Herz 2013;38:556–7.
- 25
- Ioannou P ym. Case Reports in Medicine vol. 2017, Article ID 4297372, 2017. https://doi.org/10.1155/2017/4297372.
- 26
- Johnson SM ym. Management of glaucoma in pregnancy and lactation. Surv Ophthalmol 2001;45:449–54.
- 27
- Samant M ym. Pediatric glaucoma: Pharmacotherapeutic options. Pediatr Drugs 2016, Published online 19 April 2016, doi: 10.1007/s40272-016-0174-4
- 28
- Mäenpää J ym. Paroxetine markedly increases plasma concentrations of ophthalmic timolol; CYP2D6 inhibitors may increase the risk of cardiovascular adverse effects of 0.5% timolol eye drops. Drug Metab Dispos 2014;42:2068–76.
- 29
- Goldberg I ym. Topical ophthalmic medications: what potential for systemic side effects and interactions with other medications? Med J Aust 2008;189: 356–7.
- 30
- Edeki TI ym. Pharmacogenetic explanation for excessive beta-blockade following timolol eye drops. Potential for oral-ophthalmic drug interaction. JAMA 1995;274:1611–3.
- 31
- Niemi M, Kalliokoski A. Farmakogenetiikkaa käytännön lääkärille. Suom Lääkäril 2009;64:3443–6.
- 32
- Pietarinen P ym. High frequency of CYP2D6 ultrarapid metabolizer genotype in the Finnish population. Basic Clin Pharmacol Toxicol 2016;119:291–6.
- 33
- Nieminen T ym. Association between low plasma levels of ophthalmic timolol and haemodynamics in glaucoma patients. Eur J Clin Pharmacol 2005;61:369–74.
- 34
- Fourtillan JB ym. Pharmacokinetics of oral timolol studied by mass fragmentography. Eur J Clin Pharmacol 1981;19:193–6.
- 35
- Klotz U. Pharmacokinetics and drug metabolism in the elderly. Drug Metab Rev 2009;41:67–76.
- 36
- Almenoff JS ym. Disproportionality analysis using empirical Bayes data mining: a tool for the evaluation of drug interactions in the post-marketing setting. Pharmacoepidemiol Drug Saf 2003;12:517–21.
- 37
- Goldberg I, Adena MA. Co-prescribing of topical and systemic beta-blockers in patients with glaucoma: a quality use of medicine issue in Australian practice. Clin Experiment Ophthalmol 2007;35:700–5.
- 38
- Schuman JS. Effects of systemic beta-blocker therapy on the efficacy and safety of topical brimonidine and timolol. Brimonidine Study Groups 1 and 2. Ophthalmology 2000;107: 1171–7.
- 39
- Tavassoli N. Drug interactions with cholinesterase inhibitors: an analysis of the French pharmacovigilance database and a comparison of two national drug formularies (Vidal, British National Formulary). Drug Safety 2007;30:1063–71.
- 40
- Ahola TL ym. Komplisoitumattoman hypertension lääkehoito ei vastaa hoitosuosituksia. Suom Lääkäril 2016;71:219.
- 41
- Jampel HD ym. Chart documentation by general physicians of the glaucoma medications taken by their patients. Am J Ophthalmol 2005;140:344–5.
- 42
- Steinman MA ym. Association of β-blockers with functional outcomes, death, and rehospitalization in older nursing home residents after acute myocardial infarction. JAMA Intern Med 2017;177:254–62.
- 43
- Kivisaari J. Iäkkään naisen sekavuus. Duodecim 2016;132:1671–2.
- 44
- Nanda T ym. Ophthalmic timolol hallucinations: a case series and review of the literature. J Glaucoma 2017;26:e214-6.
Timolol containing eye drops have a systemic effect and increase the risk of falls in patients
In general, many eye drops are considered safe and well tolerated because of their topical administration. However, most of the drug in the ophthalmic products is systemically absorbed and first-pass metabolism is avoided. The ophthalmic β-blocker timolol can cause serious adverse events such as symptomatic bradycardia, various conduction disorders in the heart, orthostatic hypotension and syncope. It is also contraindicated in various cardiac disorders and therefore an ECG should always be performed prior to treatment initiation. In the elderly population the events can lead to falls resulting in serious injuries from which a patient may suffer for the rest of his/her life. Furthermore, the events increase the financial burden in public health care. The article presents four well described typical patient case reports in which the patients experienced severe cardiovascular adverse effects after receiving ophthalmic timolol. In some reports the patients had experienced timolol related falls for several years before the relationship between the drug and events was clarified. Timolol is also present in various combination glaucoma eye drop products, which challenges its recognition in patients’ medication. Overall, the use of eye drops should be routinely asked about. Timolol is metabolized in the liver mainly by the enzyme cytochrome P450 2D6 (CYP2D6). Concomitantly taken CYP2D6 enzyme inhibitors such as paroxetine and fluoxetine, systemic β-blockers and verapamil increase the patients’ risk of experiencing systemic adverse events related to ophthalmic timolol. Due to many CYP2D6 polymorphisms, it would be of great value if a new patient with ophthalmic timolol could be proactively CYP2D6 genotyped. In conclusion, the risks of serious cardiac adverse effects related to the use of ophthalmic timolol are largely underestimated. In most cases they could be avoided by a careful patient history, performing appropriate tests, and providing due guidance.