BRCA-geenivirhe löytyy kymmenesosasta rinta- ja munasarjasyöpäsuvuista Tyksin erva-alueella
Lähtökohdat Perinnöllisyysselvittelyissä rinta- ja munasarjasyöpäalttiuden vuoksi käyneiden sukujen määrä on Tyksin erva-alueella nelinkertaistunut 10 vuodessa. Tutkimuksessa selvitettiin BRCA-geenivirhettä kantavien sukujen osuus.
Menetelmät Retrospektiivisessä kohorttitutkimuksessa tarkastellaan Tyksin kliinisen genetiikan tutkimuksissa rinta- ja munasarjasyöpäalttiusepäilyn vuoksi käyneitä sukuja vuodesta 1996 alkaen. Geenitutkimuksia tehtiin 904, ja tutkimustuloksen tai sukupuun perusteella suuren riskin sukuja löydettiin 852. Munasarjasyöpänäytteiden BRCA-tulokset analysoitiin vuosilta 2017–2020.
Tulokset Uusien BRCA-sukujen osuus suuren riskin suvuista oli 9,6 % (82/852). Sukukohtaisia patogeenisiä variantteja oli BRCA1-geenissä 9/38 (24 %) ja BRCA2-geenissä 8/44 (18 %), loput olivat valtamutaatioita. Kliiniseltä merkitykseltään epäselviä BRCA2-VUS-variantteja oli BRCA2-geenivirheistä noin kolmasosa (13/44). Munasarjasyöpänäytteistä 6/144 (4,2 %) oli germinaalisia.
Päätelmät BRCA-sukujen osuus on pienentynyt 20 %:sta 10 %:iin, kun testaus on laajentunut suurempaan potilasryhmään. Suuri BRCA2-VUS-löydösten määrä voi heijastaa runsasta sukukohtaisten geenivirheiden osuutta Lounais-Suomessa. Munasarjakasvaimesta todettujen germinaalisten BRCA-muutosten määrä on pieni. Alueellisen varianttiprofiilin tunteminen parantaa geenitulosten tulkintaa.

Rintasyöpään sairastuu Suomessa naisista joka kahdeksas (1). Arviolta 5–10 % rintasyövistä johtuu yksittäisestä suuren riskin perinnöllisestä (germinaalisesta) geenivirheestä (2,3). Parhaiten tunnetut alttiusgeenit ovat BRCA1 ja BRCA2: aikaisempien tutkimusten perusteella ne selittävät perinnöllisen rintasyöpäalttiuden noin 20 %:ssa suvuista (4,5). Tyksin erityisvastuualueella (erva) saadut uudet havainnot poikkeavat tästä.
BRCA1-geenivirhettä kantavilla naisilla elinikäinen rintasyöpäriski on 60–70 % ja BRCA2-kantajilla 50–70 %. Munasarjasyövän riski on BRCA1-kantajilla noin 40 % ja BRCA2-kantajilla noin 20 % (6,7). Miehillä erityisesti BRCA2-kantajuuteen liittyy eturauhassyöpäriski (8).
Sekä BRCA1- että BRCA2-geenistä tunnetaan yli 1 800 patogeenistä varianttia eli geenivirhettä (9). BRCA-geenivirheet ovat lähes aina perittyjä, vain noin 0,3 %:ssa tapauksia patogeeninen variantti on de novo eli sitä ei ole aikaisemmin esiintynyt suvussa (10).
Aikaisemmin on raportoitu, että Suomessa noin 80 % BRCA-geenivirheistä on valtamutaatioita (11). Suuri osuus johtuu perustajavaikutuksesta. Suomenniemeen tuli aikoinaan pieni joukko ihmisiä, ja heidän mutaationsa ovat rikastuneet maantieteellisesti ja kulttuurisesti eristäytyneessä maassa. Tutkimuksessamme selvitämme Tyksin erva-alueen varianttiprofiilia.
BRCA-suvut on tärkeää löytää, sillä niissä ennustetta voidaan parantaa syöpäriskiä pienentävän kirurgian avulla (12), kuten poistamalla munanjohtimet ja munasarjat. Tehostettu seuranta mahdollistaa rintasyövän varhaistoteamisen (13).
Geenitutkimusta ei tehdä kaikille rintasyöpäpotilaille, vaan se järjestetään sukupuun tai potilaan sairauden perusteella. Tämä on kustannusvaikuttava menetelmä BRCA-sukujen löytämiseksi (14). Tyksissä käytössä oleva geenipaneelitutkimus kattaa kaikki nykyään tunnetut rinta- ja munasarjasyöpäalttiuteen liittyvät geenit.
Aineisto ja menetelmät
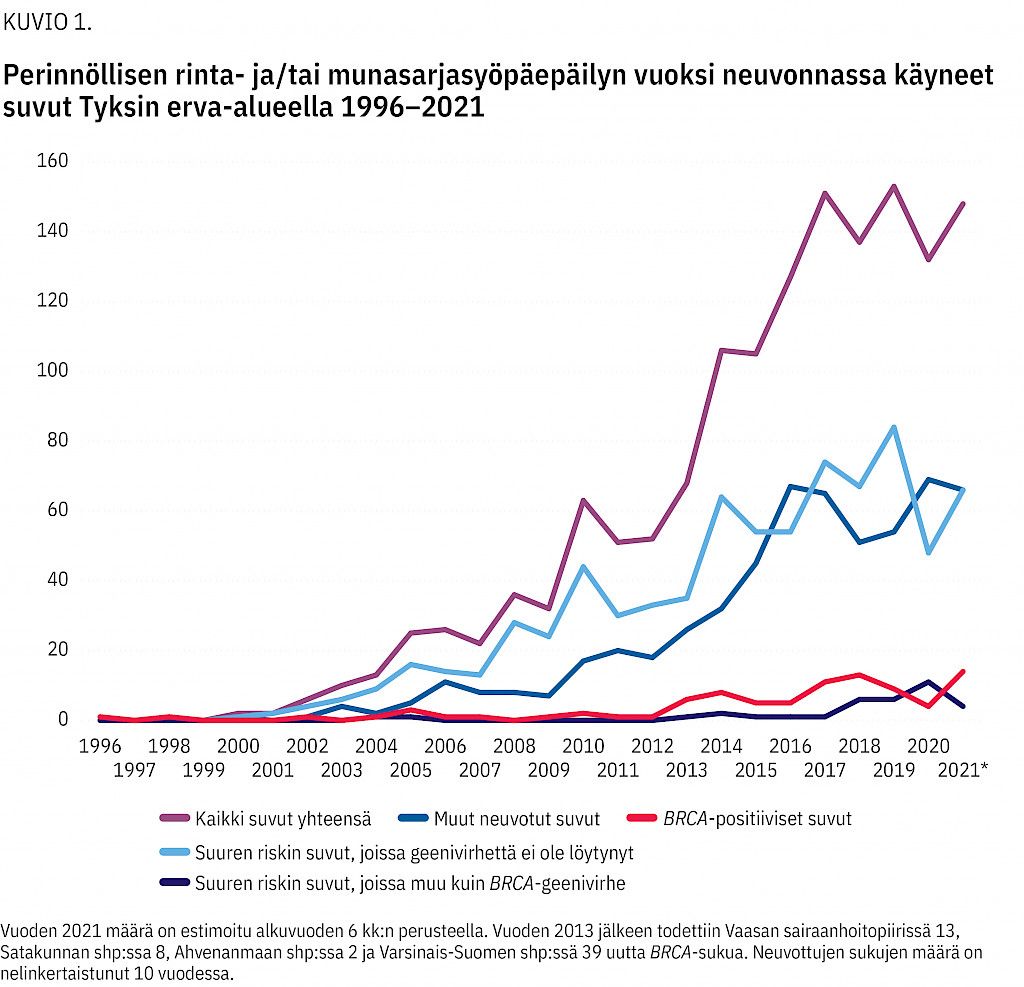
Retrospektiivinen kohorttitutkimus kattaa kaikki Tyksin perinnöllisyyslääketieteen poliklinikalla rintasyöpäalttiusepäilyn vuoksi neuvonnassa käyneet suvut 1/1996–6/2021 (kuvio 1). Tyksin erva-alue kattaa Varsinais-Suomen, Satakunnan ja vuodesta 2013 lähtien Vaasan sairaanhoitopiirin. Myös ahvenanmaalaisia sukuja on käynyt neuvonnassa.
Tutkimuksessamme selvitetään BRCA-varianttiprofiilia sukuperusteisesti. Analyysi ei raportoi BRCA-suvuissa sukulaisille tehtyjä geenitutkimuksia. Suvut on luokiteltu suuren rintasyöpäriskin suvuiksi tai muiksi suvuiksi (kuvio 1) (taulukko 1).
Rintasyöpäalttiussukujen löytämiseksi lähetekriteerit perinnöllisyyslääketieteelliseen selvittelyyn (15) ovat löysemmät kuin Lundin modifioidut kriteerit (taulukko 1), joita perinnöllisyyslääkärit käyttävät (16). Perinnöllisyyslääkäri on arvioinut sukuhistorian ja potilaan sairaustietojen perusteella germinaalisen geenivirheen todennäköisyyttä. Lähetekriteerit ja geenitestauskriteerit on mainittu Lääkärilehdessä aikaisemmin (17).
Perinnöllisyyslääkäri on arvioinut sukuhistorian ja potilaan sairaustietojen perusteella germinaalisen geenivirheen todennäköisyyttä. Suvun geenivirheen etsiminen aloitetaan sairaasta henkilöstä. DNA eristetään laskimoverinäytteen valkosoluista. Menehtyneen henkilön tutkimus voidaan tehdä kudosnäytteen DNA:sta.
Tutkimusmahdollisuudet ovat parantuneet ajan kuluessa. 1990-luvun lopulla tutkittiin pelkästään valtamutaatiot eli Suomessa yleiset BRCA-geenivirheet (3). Pian tuli mahdolliseksi BRCA-geenien tutkiminen kokonaisuudessaan Sanger-sekvensoinnilla, mutta varhaiset menetelmät eivät havainneet geenivirheitä yhtä hyvin kuin nykyiset.
Vuodesta 2011 lähtien on käytetty BRCA-geenien Sanger-sekvensoinnin lisäksi (14) geenin sisäisiä häviämiä ja kahdentumia tunnistavaa menetelmää (MLPA). Vuodesta 2017 alkaen on laajemmin käytetty uuden sukupolven sekvensointia (NGS), joka mahdollistaa usean geenin paneelitutkimuksen (17). Vuonna 2017 geenipaneeleja käytettiin 17 %:ssa diagnostisista tutkimuksista ja vuonna 2019 kaikissa seulontatutkimuksissa suvun diagnoosin saamiseksi.
Nykyään paneeli kattaa geenit, jotka on yhdistetty lisääntyneeseen rintasyöpäalttiuteen (BRCA1, BRCA2, TP53, PTEN, STK11, CDH1, PALB2, CHEK2, ATM, FANCM), munasarjasyöpäalttiuteen (BRIP1, RAD51C, RAD51D) sekä Lynchin oireyhtymään, johon liittyy hieman suurentunut munasarjasyövän riski (EPCAM, MLH1, MSH2, MSH6, PMS2) (17,18,19,20,21). Todetut variantit on kuvattu Human Genome Variation Societyn (HGVS) nomenklatuurin mukaisesti ja varianttien luokitteluun on käytetty American College of Medical Genetics and Genomicsin (ACMG) ohjeistuksia: benigni, todennäköisesti benigni, kliiniseltä merkitykseltään epäselvä (variant of unknown significance ,VUS), todennäköisesti patogeeninen tai patogeeninen) (22,23).
Vuodesta 2015 lähtien on BRCA-tutkimuksia tehty myös munasarjasyöpäpotilaiden kasvainnäytteistä sukuanamneesista riippumatta. Jos epäillään germinaalista geenivirhettä, tehdään tutkimus vielä veren valkosolujen DNA:sta. Analyysimme kattaa Tyksin genomiikan laboratoriossa 1/2017–6/2020 tutkitut kasvainnäytteet.
Tulokset
Tyksin erva-alueella todettiin 82 uutta BRCA-sukua (kuvio 1), joissa kaikissa oli patogeeniseksi luokiteltava variantti. Todennäköisesti patogeenisiä variantteja ei ollut. Uudeksi suvuksi luokiteltiin suku, jonka BRCA-geenivirhe ei ollut aiemmin tiedossa, vaan se todettiin alueella tehdyssä seulontatutkimuksessa.
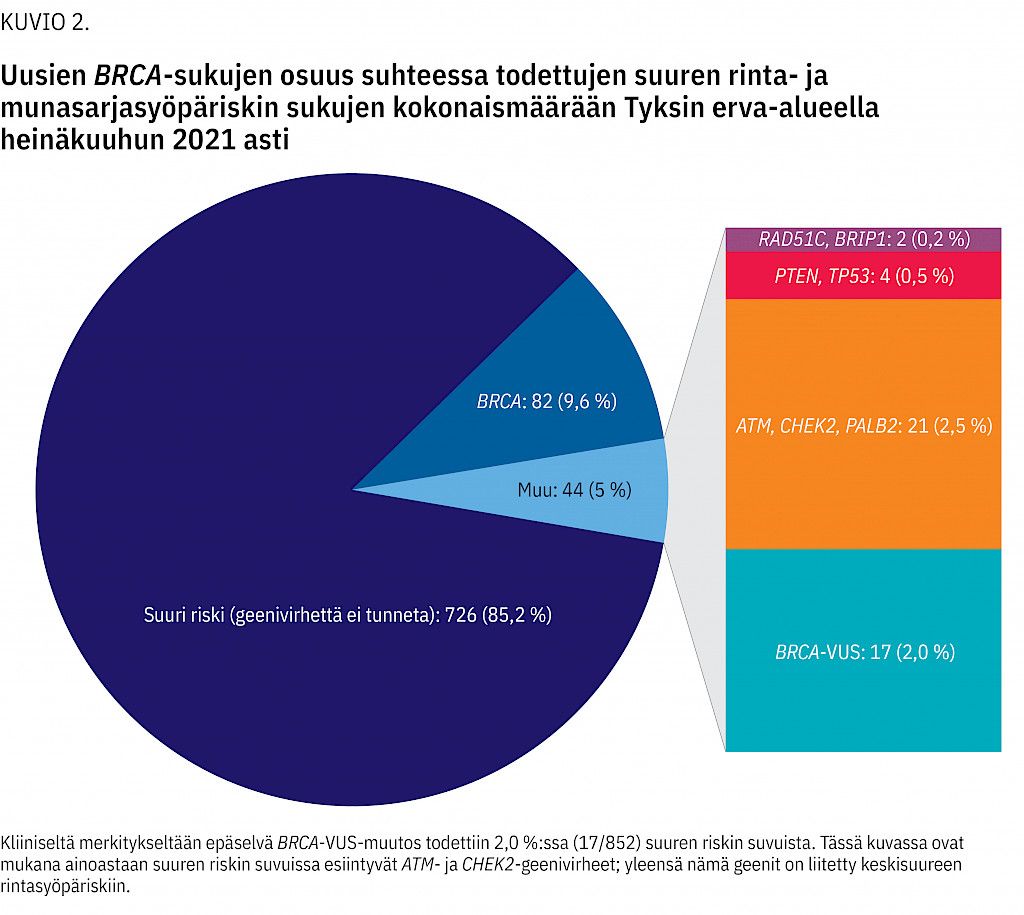
Uusien BRCA-sukujen määrä suhteessa kaikkiin geenitutkimuksella tai sukupuun perusteella todettuihin suuren sukuihin oli 9,6 % (82/852) (kuvio 2). BRCA-sukujen osuus suvuista, joissa oli sukupuun perusteella perinnöllinen rinta- ja munasarjasyöpäalttius, oli 10,7 % (82/769). Uusien sukujen määrä verrattuna kaikkiin diagnostisiin seulontatutkimuksiin oli 9,1 % (82/904).
Uusista suvuista 38 oli BRCA1-sukuja ja 44 BRCA2-sukuja, ja niissä todettiin yhteensä 38 erilaista geenivirhettä. Sukukohtaisia omia geenivirheitä oli BRCA1-geenissä 9 (24 %) ja BRCA2-geenissä 8 (18 %). Loput olivat valtamutaatioita.
Lisäksi löydettiin 17 uutta sukua, joissa todettiin BRCA-geenissä kliiniseltä merkitykseltään epäselvä eli VUS-muutos. Tällaista muutosta ei voida luokitella ACMG-kriteerein (22) harmittomaksi (benigniksi) muutokseksi tai patogeeniseksi variantiksi. Neljässä suvussa oli BRCA1-VUS ja 13:ssa BRCA2-VUS.
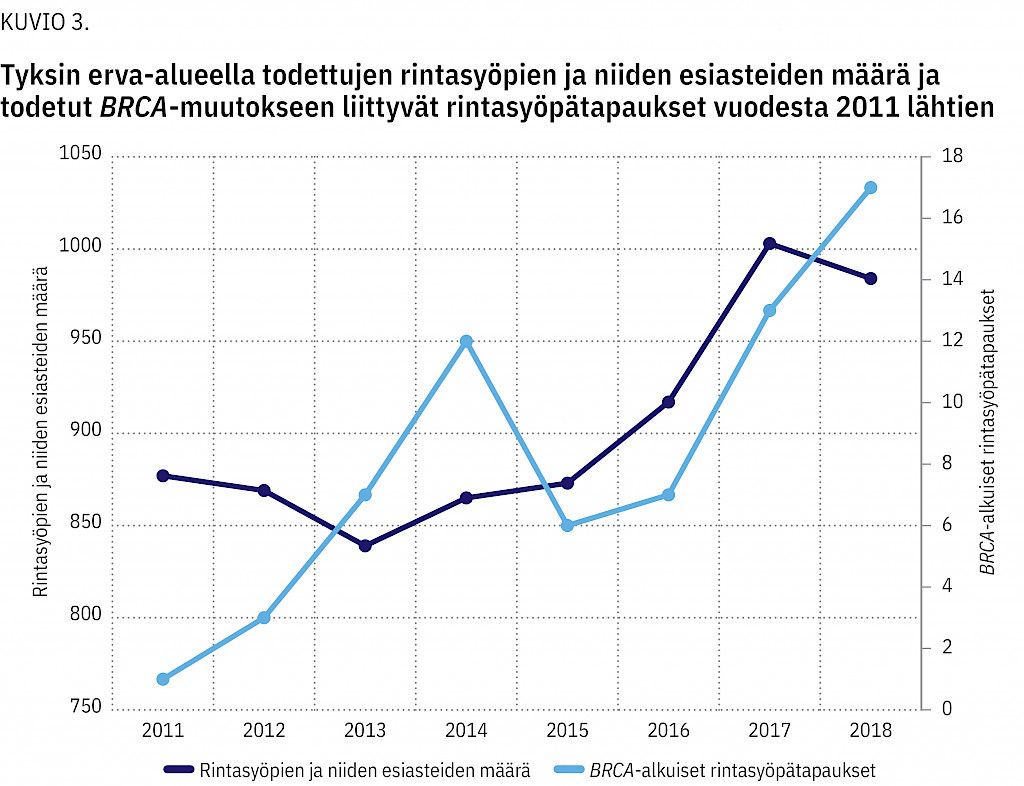
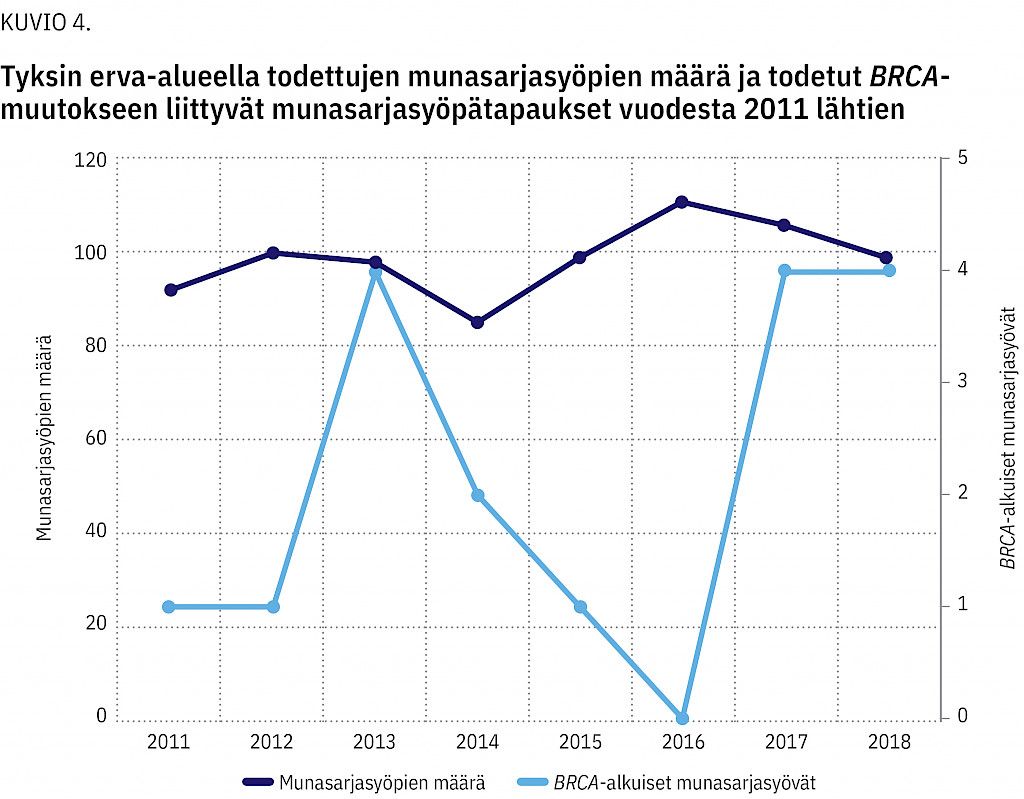
Lisäksi perinnöllisyysneuvonnassa kävi sukulaisia 129 suvusta, joissa BRCA-geenivirhe oli löydetty muussa kuin Tyksin erva-alueen yksikössä. Kuviossa 3 esitetään alueellinen rintasyövän ja sen esiasteen yhteinen ilmaantuvuuskäyrä sekä todettujen BRCA-muutokseen liittyvien rintasyöpätapauksien käyrä vuodesta 2011 lähtien. Vastaavat tiedot munasarjasyövästä ovat kuviossa 4.
Munasarjasyöpänäytteitä tutkittiin 144, ja niistä 13:ssa (9 %) todettiin BRCA-geenivirhe. Näistä kuusi todettiin myös verinäytteessä, joten ne olivat ituradassa olevia muutoksia, ja muut seitsemän olivat somaattisia, todennäköisesti tuumorigeneesin aikana syntyneitä muutoksia.
Pohdinta
Olemme tutkineet Lounais-Suomen BRCA-varianttiprofiilia. Tutkimuksessa varmistui, että BRCA-sukuja oli 9,6 % kaikista suuren riskin rinta- ja munasarjasyöpäalttiussuvuista (kuvio 2).
Kaksi vuosikymmentä sitten todettiin, että BRCA-geenivirhe esiintyy noin 20 %:ssa suomalaisista rintasyöpäsuvuista (4). Tutkimuksemme havainto vastaa kansainvälisessä kirjallisuudessa viime vuosina esitettyä havaintoa, jonka mukaan BRCA-geenivirheiden osuus on pienempi kuin kaksikymmentä vuotta sitten (24). Tätä selittää testauskriteerien muutos: testaus on yleistynyt isompaan potilasryhmään.
Tutkimuksessamme ilmeni, että löytyneiden BRCA-sukujen määrä on suurempi vuoden 2011 jälkeen kuin ennen sitä (kuvio 1). Vaasan liittyminen mukaan erva-alueeseen ei selitä tapauksien lisääntymistä. Se selittyy geeniteknologisten menetelmien parantumisella, geenitestauskriteerien muutoksella sekä lähetekriteerien tarkentumisella ja niiden helpolla löydettävyydellä verkosta (15).
Geenipaneelien käytön lisäännyttyä vuodesta 2017 lähtien muista alttiusgeeneistä on alkanut löytyä yhä useammin geenivirheitä. Näyttää myös siltä, että todettujen BRCA-muutokseen liittyvien rintasyöpien määrä on hieman suuremmassa kasvussa kuin rintasyövän ilmaantuvuus alueella (kuvio 3). BRCA-muutokseen liittyvien munasarjasyöpien määrä on pysynyt tasaisena (kuvio 4). Tarvitaan kuitenkin pidempi seuranta-aika, jotta nähdään, pysyykö trendi samanlaisena.
Munasarjasyövän esiintyminen lisää BRCA-geenivirheen todennäköisyyttä suvun mutaatiota selittävänä tekijänä (4), ja tämä on havaittu myös alueellamme. Suomen sisällä olevia varianttiprofiilin eroja on jonkin verran tutkittu (25), muttei vielä kattavasti. Tutkimuksemme mukaan Lounais-Suomessa BRCA-geenivirhe näyttää selittävän perinnöllisen rintasyöpäalttiuden harvemmin (9,6 %:ssa suuren riskin suvuista) kuin eteläsuomalaisessa väestössä (14 %:ssa seulotuista neuvonnan saaneista rintasyöpäalttiussuvuista) (26).
Aikaisemmin on arvioitu, että Suomessa noin 20 %:ssa BRCA-suvuista on valtamutaation sijasta jokin sukukohtainen geenivirhe (11). Lounais-Suomessa niitä esiintyy 21 %:ssa uusista suvuista. Myös VUS-muutoksia löydetään enemmän (24,27). Kirjallisuuden mukaan eurooppalaisissa laboratorioissa BRCA-VUS-muutoksien osuus BRCA-geenivirheistä on ollut jopa 15 % (28,29,30). Alueellamme vastaava osuus BRCA2-geenilöydöksistä on 30 % (13/44).
Alueellamme erilaisia BRCA-VUS-muutoksia on todettu paljon suhteessa muiden geenien VUS-muutoksiin. Tämä voisi heijastaa sitä, että alueellamme olisi tavallista enemmän sukukohtaisia BRCA-geenivirheitä, joita ei vielä tunnisteta patogeenisiksi. Erityisesti BRCA2-geenien sukukohtaisia geenivirheitä täytyisi oppia tuntemaan paremmin.
Sukulaisten tutkiminen tuo joskus lisätietoa VUS-muutoksen merkityksestä, kuten myös RNA-tason analyysimenetelmät lähitulevaisuudessa (30). Mitä enemmän syöpägenetiikan geenipaneeleja käytetään, sitä enemmän karttuu tietoa varianttien merkityksestä, ja ajan mittaan nykyiset VUS-muutokset voidaan luokitella patogeeniseksi tai hyvänlaatuiseksi variantiksi. VUS-suvuissa variantin merkitystä tarkastellaan muutaman vuoden kuluttua uudelleen, ja tarkentunutta tietoa voidaan tietoa käyttää suvun neuvonnassa.
VUS-muutostietoa ei voi käyttää tunnistamaan henkilöitä, jotka hyötyisivät seurannasta tai syöpäriskiä vähentävästä kirurgiasta. National Comprehensive Cancer Networkin (NCCN) suosituksen mukaisesti patogeeniset ja todennäköisesti patogeeniset variantit huomioidaan samalla tavoin hoidon ja seurannan suunnittelussa (31).
BRCA-geenin virhettä kantavalle naiselle järjestetään rintojen kuvantamisseuranta, jotta mahdollinen rintasyöpä havaittaisiin varhain. Lisäksi voidaan tehdä syöpäriskiä vähentäviä toimenpiteitä. Kun lapsiluku on täynnä, munasarjojen ja munanjohtimien poisto pienentää merkittävästi munasarjasyövän riskiä ja voi vähentää myös rintasyöpäriskiä. (32,33). Mikäli potilas ei halua munasarjojen poistoa noin 40-vuotiaana, gynekologi keskustelee potilaan kanssa seurantakäynnin ajankohdasta (34). Rintojen ihoa säästävä poisto ja samanaikainen rintarekonstruktio pienentävät merkittävästi rintasyövän riskiä (35).
BRCA-geenitietoa voidaan käyttää munasarjasyövän ja rintasyövän hoidossa lääkehoitoa suunniteltaessa (36,37) ja rintasyöpäpotilailla erityisesti leikkaushoidon suunnittelussa (12).
Munasarjakasvaimesta todettujen BRCA-geenin patogeenisten varianttien määrä 4 % (6/144) oli pienempi kuin alun perin odotettiin (38), ja niitä on todettu Suomessa vähemmän kuin esimerkiksi Keski-Euroopassa (39). Tämä sopisi kuvastamaan maantieteellisiä eroja BRCA-geenivirheiden esiintyvyydessä. Löydöstä selittää se, että Suomessa BRCA2-geenin patogeenisten varianttien osuus kaikista BRCA-muutoksista on perustajamutaatioiden vuoksi varsin suuri (noin 50 %) verrattuna muuhun maailmaan (noin 30 %) (16). BRCA2-geenin patogeenisiin variantteihin liittyy pienempi munasarjasyöpäriski kuin BRCA1-geenin (6).
Nykyään tutkitaan kaikki alle 40-vuotiaat rintasyöpäpotilaat, jotka haluavat osallistua geenitutkimukseen. Kun suvun geenivirhe on tiedossa, terveiden sukulaisten geenistä tutkitaan ainoastaan muutoskohta. Paneeleja käytetään vain suvun geenivirhettä selvittävässä seulontatutkimuksessa.
Alueellamme rintasyöpäsukujen geenitestaus toimii moniammatillisesti: onkologit, gynekologionkologit ja kirurgit testaavat potilaskohtaisilla kriteereillä rinta- ja munasarjasyöpäpotilaita ja perinnöllisyyslääkärit sukuperusteisilla kriteereillä rintasyöpä- ja munasarjasyöpäalttiussukuja. Yli 20 vuotta sitten tunnistettiin sellaiset perinnölliset suvut, joissa oli raskas rinta- ja/tai munasarjasyövän tautitaakka. Nykyään epäily herää jo lievemmillä kriteereillä.
Kaikissa sukupuun perusteella ilmeisissä perinnöllisissä tapauksissa ei vielä pystytä täsmälliseen geenidiagnostiikkaan. Suuren riskin suvuissa, joissa altistavaa geenivirhettä ei tunnisteta, pysyvä asianmukainen rintojen seuranta järjestetään kaikille rinta- ja munasarjasyövän sairastaneiden ensimmäisen asteen sukulaisnaisille sekä potilaille itselleen.
Paikallisen varianttiprofiilin selvittäminen tieteellisen tutkimustyön puitteissa jatkuu (40). Kun varianttien tulkinta tarkentuu, VUS-vastauksien määrä vähenee. Työryhmän jatkotutkimuksessa analysoidaan alueen BRCA-profiilia munasarjasyöpäsuvuissa, BRCA-geenin patogeenisten varianttien genotyyppi-fenotyyppikorrelaatiota ja geenipaneeleissa todettujen muiden alttiusgeenien variantteihin liittyviä syöpäriskejä.
Kiitos Tyksin kliinisen genetiikan yksikössä vuosina 2009–2019 ylilääkärinä toimineelle professori Jaakko Ignatiukselle, jonka kanssa tämän tutkimuksen alkuasetelma on suunniteltu. Kiitos tutkimusapulainen Juho Järviselle tilaston keruusta ja käsittelystä yhdessä työryhmän kanssa. Tyks kuuluu ERN GENTURIS -verkostoon.
Terhi Pallonen, Pia Pohjola, Salla Lempiäinen, Titta Joutsiniemi: Ei sidonnaisuuksia.
Minna Kankuri-Tammilehto: Apuraha (Tyks-evo, VTR).
Tämä tiedettiin
• Perinnöllisen rintasyöpäalttiuden geenitutkimuksia tehdään sekä potilaskohtaisten kriteerien että sukukriteerien perusteella.
• BRCA-geenit tulee tutkia kokonaisuudessaan, koska valtamutaatioiden lisäksi esiintyy myös sukukohtaisia geenivirheitä.
• Merkittävässä osassa suuren rintasyöpäriskin suvuista ei löydetä lisääntyneeseen rintasyöpäriskiin liittyvää geenivirhettä, koska kaikkia rintasyöpäalttiusgeenejä ei vielä tunneta.
Tutkimus opetti
• Suvun syöpäalttiuden syyn selvittämiseksi tehtyjen geenitutkimuksien määrä on nelinkertaistanut 10 vuodessa, ja geeniteknologian kehittymisen takia löydetään suvussa kulkeva geenivirhe aikaisempaa useammin.
• Tyksin erva-alueella BRCA-geenivirhettä kantavia sukuja on noin 10 % kaikista suuren rinta- ja/tai munasarjasyöpäriskin suvuista.
• Kliiniseltä merkitykseltään epäselviä muutoksia (variant of uncertain significance, VUS) muutoksia on todettu BRCA2-geenissä useammin kuin BRCA1-geenissä.
- 1
- Suomen Syöpärekisteri. Syöpätilastosovellus. Siteeraus 29.6.2020. https://syoparekisteri.fi/tilastot/tautitilastot/
- 2
- Nagy R, Sweet K, Eng C. Highly penetrant hereditary cancer syndromes. Oncogene 2004;23(38):6445–70.
- 3
- Vlessis K, Purington N, Chun N ym. Germline testing for patients with BRCA1/2 mutations on somatic tumor testing. JNCI Cancer Spectrum 2019.
- 4
- Vahteristo P, Eerola H, Tamminen A ym. A probability model for predicting BRCA1 and BRCA2 mutations in breast and breast-ovarian cancer families. Br J Cancer 2001;84(5):704–8.
- 5
- Melchor L, Benítez J. The complex genetic landscape of familial breast cancer. Hum Genet 2013;132(8):845–63.
- 6
- Kuchenbaecker KB, Hopper JL, Barnes DR ym. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA 2017;317(23):2402–16.
- 7
- Chen S, Parmigiani G. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol 2007;25(11):1329–33.
- 8
- Nyberg T, Frost D, Barrowdale D ym. Prostate cancer risks for male BRCA1 and BRCA2 mutation carriers: A prospective cohort study. Eur Urol 2020;77(1):24–35.
- 9
- GeneReviews. BRCA1- and BRCA2-associated hereditary breast and ovarian cancer. Päivitetty 15.12.2016. https://www.ncbi.nlm.nih.gov/books/NBK1247/
- 10
- Golmard L, Delnatte C, Laugé A ym. Breast and ovarian cancer predisposition due to de novo BRCA1 and BRCA2 mutations. Oncogene 2016;35(10):1324–7.
- 11
- Syrjäkoski K, Vahteristo P, Eerola H ym. Population-based study of BRCA1 and BRCA2 mutations in 1035 unselected Finnish breast cancer patients. J Natl Cancer Inst 2000;92(18):1529–31.
- 12
- Li X, You R, Wang X ym. Effectiveness of prophylactic surgeries in BRCA1 or BRCA2 mutation carriers: A meta-analysis and systematic review. Clin Cancer Res 2016;22(15):3971–81.
- 13
- Warner E, Plewes DB, Hill KA ym. Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination. JAMA 2004;292(11):1317–25.
- 14
- Robson ME, Bradbury AR, Arun B ym. American Society of Clinical Oncology Policy Statement Update: Genetic and genomic testing for cancer susceptibility. J Clin Oncol 2015;33(31):3660–7.
- 15
- Suomen Rintasyöpäryhmä ry. Rintasyövän valtakunnallinen diagnostiikka- ja hoitosuositus 2021. https://1587667.167.directo.fi/@Bin/928a264aa71d46c782238b77da6f3f91/1626897185/application/pdf/189289/Suomen%20Rintasy%c3%b6p%c3%a4ryhm%c3%a4n%20diagnostiikka-%20ja%20hoitosuositus%20kes%c3%a4kuu%202021.pdf
- 16
- Aittomäki K, Peltomäki P. Perinnöllinen rintasyöpäalttius. Kirjassa: Aittomäki K, Moilanen J, Perola M, toim. Lääketieteellinen genetiikka. Helsinki: Kustannus Oy Duodecim 2016.
- 17
- Kankuri-Tammilehto M, Vihinen P, Schleutker J. Syövän perinnöllisyys. Suom Lääkäril 2019;14:880–6.
- 18
- Wendt C, Margolin S. Identifying breast cancer susceptibility genes – a review of the genetic background in familial breast cancer. Acta Oncol 2019;58(2):135–46.
- 19
- Yang X, Leslie G, Doroszuk A ym. Cancer risks associated with germline PALB2 pathogenic variants: An international study of 524 families. J Clin Oncol 2020;38(7):674–85.
- 20
- Kiiski JI, Tervasmäki A, Pelttari LM ym. FANCM mutation c.5791C>T is a risk factor for triple-negative breast cancer in the Finnish population. Breast Cancer Res Treat 2017;166(1):217–26.
- 21
- Breast Cancer Association Consortium. Breast Cancer Risk Genes — Association Analysis in More than 113,000 Women. N Engl J Med 2021;384:428–39.
- 22
- Maxwell KN, Hart SN, Vijai J ym. Evaluation of ACMG-Guideline-based variant classification of cancer susceptibility and on-cancer-associated genes in families affected by breast cancer. Am J Hum Genet 2016;98(5):801–17.
- 23
- Richards S, Aziz N, Bale S ym. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015;17(5):405–24.
- 24
- Lerner-Ellis J, Khalouei S, Sopik V ym. Genetic risk assessment and prevention: the role of genetic testing panels in breast cancer. Expert Rev Anticancer Ther 2015;15:1315–26.
- 25
- Mars N, Widén E, Kerminen S ym. FinnGen. The role of polygenic risk and susceptibility genes in breast cancer over the course of life. Nat Commun 2020;11(1):6383.
- 26
- Kanniainen VM. BRCA1- ja BRCA2-geenien patogeeniset variantit rinta- ja munasarjasyöpäalttiudessa. Syventävien opintojen tutkielma, Helsingin yliopisto 18.5.2020.
- 27
- Shirts BH, Casadei S, Jacobson AL ym. Improving performance of multigene panels for genomic analysis of cancer predisposition. Genet Med 2016;18(10):974–81.
- 28
- Chang J, Seng S, Yoo J ym. Clinical management of patients at risk for hereditary breast cancer with variants of uncertain significance in the era of multigene panel testing. Ann Surg Oncol 2019;26(10):3389–96.
- 29
- Eccles BK, Copson E, Maishman T ym. Understanding of BRCA VUS genetic results by breast cancer specialists. BMC Cancer 2015;15:936.
- 30
- Li H, LaDuca H, Pesaran T ym. Classification of variants of uncertain significance in BRCA1 and BRCA2 using personal and family history of cancer from individuals in a large hereditary cancer multigene panel testing cohort. Genet Med 2020;22:701–8.
- 31
- NCCN (National Comprehensive Cancer Network). Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2021, NCNN.org.
- 32
- Tschernichovsky R, Goodman A. Risk-reducing strategies for ovarian cancer in BRCA mutation carriers: A balancing act. Oncologist 2017;22(4):450–9.
- 33
- Terry M, Daly M, Phillips K ym. Risk-reducing oophorectomy and breast cancer risk across the spectrum of familial risk. J Natl Cancer Inst 2019;111(3):331–4.
- 34
- Auranen A. Perinnöllisen syöpäalttiuden tunnistamisella on merkitystä myös gynekologisten syöpien ehkäisyssä. Duodecim 2018;134:1262–4.
- 35
- Kotsopoulos J. BRCA mutations and breast cancer prevention. Cancers (Basel). 2018;10(12):524.
- 36
- George A, Kaye S, Banerjee S. Delivering widespread BRCA testing and PARP inhibition to patients with ovarian cancer. Nat Rev Clin Oncol 2017;14(5):284–96.
- 37
- Tung N, Boughey J, Pierce L ym. Management of hereditary breast cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol 2020;38(18):2080–106.
- 38
- Leminen A. Perinnöllisyyden merkitys gynekologisissa syövissä – miten riskihenkilöt löydetään? Duodecim 2006;122(19):2394–400.
- 39
- Paradiso AV, Digennaro M, Patruno M ym. BRCA germline mutation test for all woman with ovarian cancer? BMC Cancer 2019;19(1):641.
- 40
- Pallonen T, Lempiäinen S, Joutsiniemi T ym. Genetic, clinic and histopathologic characterization of BRCA-associated hereditary breast and ovarian cancer in southwestern Finland. Sci Rep 2022;12(1):6704.
Ten percent of breast and ovarian cancer patients in Tyks expert responsibility area have pathogenic BRCA variant
Background The number of families counselled for breast and ovarian cancer in the expert responsibility area (erva) of Turku University Hospital (Tyks) has quadrupled during the past 10 years. In this study we investigated the number of BRCA families.
Methods The retrospective cohort study covers all families who have received counselling for breast or ovarian cancer by the Department of Clinical Genetics at Tyks since 1996. Altogether 904 gene analyses were done. Based on gene analyses or pedigree the number of high-risk families identified was 852. BRCA results of ovarian tumour samples (1/2017–6/2020) were analyzed.
Results The ratio of newly identified BRCA families to high-risk families was 9.6% (82/852). The number of family-specific mutations was 9 (24%) in the BRCA1 gene and 8 (18%) in the BRCA2 gene; other mutations are common in Finland. The ratio of BRCA2 gene VUS (variants of uncertain significance) to BRCA2 pathogenic variants was 30% (13/44). In addition, 144 ovarian tumour samples were analyzed, of which six were germinal (4.2%).
Conclusions The percentage of BRCA families amongst all high-risk families has decreased as test criteria have become less strict. The large number of BRCA2 VUS may reflect the large number of family-specific pathogenic variants in southwestern Finland. The number of germinal BRCA changes in ovarian cancer tumours is small. Knowledge on regional variant profiles will improve the analysis of gene results.
Terhi Pallonen, Pia Pohjola, Salla Lempiäinen, Titta Joutsiniemi, Minna Kankuri-Tammilehto
Minna Kankuri-Tammilehto
M.D., Ph.D., Specialist in Clinical Genetics
University of Turku and Turku University Hospital