ESBL:ää tuottavien suolistobakteerien oireeton kantajuus Etelä-Suomessa
Lähtökohdat Laajakirjoista beetalaktamaasia (ESBL) tuottavien bakteerien kantajuudesta tarvitaan tietoa hoitosuosituksia ja infektioiden torjuntaa varten.
Menetelmät Terveet opiskelijat ja polikliiniset potilaat antoivat ulostenäytteen ja täyttivät riskitekijäkyselyn. Näytteistä viljeltiin ESBL- tai AmpC-entsyymejä tuottavat Escherichia coli - ja Klebsiella pneumoniae -kannat.
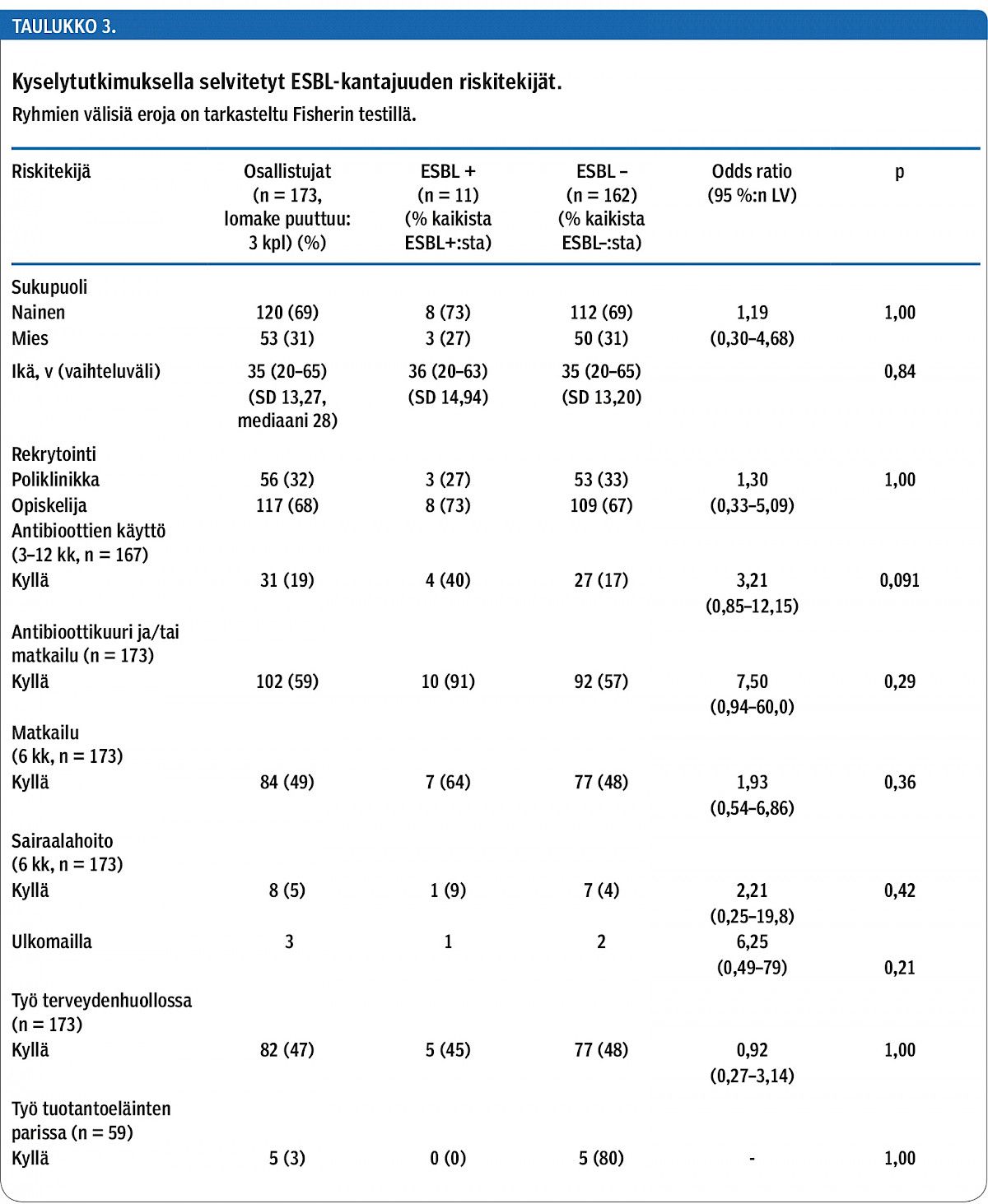
Tulokset ESBL:ää tuottava kanta oli 6,3 %:lla (11/176) tutkituista: yhdeksän oli E. coli - ja kaksi K. pneumoniae -kantaa. Yksi E. coli -kanta tuotti AmpC:tä. Kolmannen polven kefalosporiinien lisäksi E. coli -kannoista 16,6 % (26/157) oli resistenttejä trimetopriimille, 3,2 % (5/157) gentamysiinille ja 3,2 % (5/157) fluorokinoloneille. Yksi E. coli -kanta oli resistentti kolistiinille. K. pneumoniae -kannoista 6 % (2/32) oli resistenttejä trimetopriimille, mutta yksikään ei meropeneemille, fluorokinoloneille tai gentamysiinille. ESBL:n kantajista 10/11 (91 %) ja ESBL-negatiivisista 92/161 (57 %) oli matkustanut tai saanut antibiootteja (p = 0,029).
Päätelmät Oireeton ESBL-kantajuus oli aiemmin havaittua yleisempää Suomessa. Osa kannoista oli moniresistenttejä. Antibioottihoito ja matkailu olivat kantajuuden riskitekijöitä.

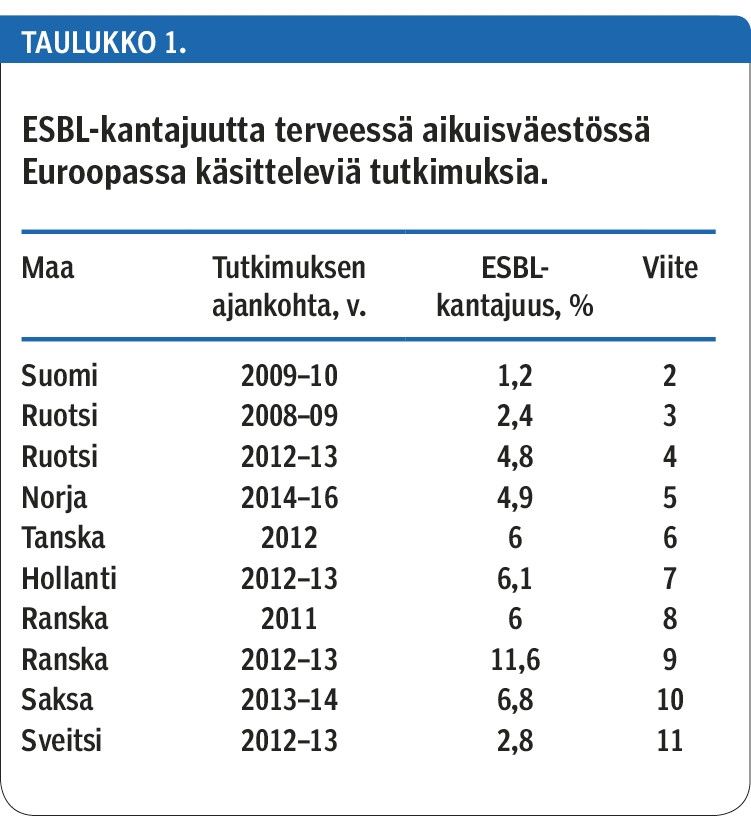
Laajakirjoisia beetalaktamaaseja (extended-spectrum β-lactamase, ESBL) tuottavien Escherichia coli - ja Klebsiella pneumoniae -bakteerien löydökset ovat lisääntyneet 2000-luvulla. Pohjoismaissa niiden kantajuus on ollut vähäistä (taulukko 1), kun taas Kaakkois-Aasiassa yli 50 % väestöstä on tällaisten bakteerien kantajia (1).
ESBL-entsyymiä tuottavien bakteerien laboratoriodiagnostiikka ei ole ongelmatonta. Enterobacteriaceae-heimon bakteerikannan voi epäillä tuottavan ESBL:ää, jos sen herkkyys 3. polven kefalosporiineille on vähentynyt. Entsyymin tuottaminen varmistetaan ns. yhdistelmäkiekkotestauksin toteamalla klavulaanihapon kyky parantaa kannan herkkyyttä. Tartuntatautirekisterin ESBL-löydökset perustuvat tähän ESBL-entsyymin tuotannon osoittamiseen.
Kantajuutta voidaan seuloa viljelemällä näytteet ESBL:ää tuottavien bakteerien kasvua suosivilla maljoilla (12). Diagnostisia ongelmia aiheuttavat ns. AmpC-luokan beetalaktamaasientsyymit, jotka eivät ole varsinaisia ESBL-entsyymeitä. Niillä on kuitenkin kyky hajottaa 3. polven beetalaktaamiantibiootteja, kuten varsinaisilla ESBL:ää tuottavilla bakteereillakin.
Kantajuuden riskiä lisäävät monet tekijät, joista tärkeimpiä ovat antibioottien käyttö (1,13), matkailu suuren ESBL-esiintyvyyden alueelle (2,14), työskentely terveydenhuoltoalalla (15) ja työskentely tuotantoeläintilalla (16). ESBL-bakteeria kantava henkilö voi saada tämän kannan aiheuttaman infektion, esim. virtsatieinfektion, johon tavanomainen antibioottihoito ei välttämättä tehoa.
Oireettoman kantajuuden yleisyyttä on Suomessa tutkittu verrattain vähän. V. 2009–10 kerättyjen ulostenäytteiden perusteella ESBL-E. coli-bakteeria kantoi suolistossaan 1,2 % matkalle lähtevistä terveistä aikuisista (2).
Tieto ESBL-entsyymiä tuottavien bakteerien yleisyydestä väestössä on tärkeää mm. siksi, että voidaan arvioida infektioiden hoitosuositusten ajantasaisuutta ja resistenssin aiheuttamaa kuormaa terveydenhuollolle sekä kohdentaa oikein torjuntatoimia.
Tämä tutkimus on osa EU:n, sosiaali- ja terveysministeriön, Turun Yliopiston ja TYKS-Sapa:n rahoittamaa kuuden Itämeren maan yhteistä NoDARS-projektia (Northern Dimension Antibiotic Resistance Study). Sen tavoitteena on selvittää bakteerien antibioottiresistenssiä väestössä.
Aineisto ja menetelmät
Tutkimukseen rekrytoitiin v. 2016 vapaaehtoisia lääketieteen, terveydenhuoltoalojen ja muiden luonnontieteiden opiskelijoita sekä Turun yliopistollisen keskussairaalan (TYKS) ortopedian poliklinikan ja TYKS:n Loimaan sairaalan potilaita.
Tutkittavan piti olla 18–65-vuotias, ja hänen piti olla asunut Suomessa vähintään edeltävät 12 kk. Hänellä ei kolmen edeltävän kuukauden aikana saanut olla ollut antibioottihoitoa eikä akuuttia ripulia.
Tutkimukseen osallistuvat antoivat ulostenäytteen ja täyttivät kantajuuden riskitekijöitä selvittävän kyselykaavakkeen (liite 1, www.laakarilehti.fi > Sisällysluettelot > SLL 43/2018).
Näytteenottoon käytettiin Copan ESwab-putkea, joka toimitettiin Turun yliopiston lääketieteellisen mikrobiologian ja immunologian oppiaineelle analysoitavaksi. Näyte viljeltiin mahdollisimman pian kolmelle selektiiviselle maljalle ja verimaljalle (liite 2). Herkkyysmääritykset ja ESBL:n fenotyypin tunnistus tehtiin noudattaen EUCAST-standardia (17). Jos maljoilta löytyi useita E. coli - tai K. pneumoniae -bakteereja, vain yksi kanta (resistentein) henkilöä kohti huomioitiin. Tutkittavat eivät saaneet tietää mahdollista ESBL-kantajuuttaan.
Löydettyjen ESBL/AmpC-entsyymejä tuottavien E. coli - ja K. pneumoniae -kantojen laji varmistettiin massaspektrometrisesti MALDI-TOF-laitteistolla. Kantojen ESBL-geenit (blaCTX-M, blaSHV ja blaTEM) varmistettiin PCR-tutkimuksella (18).
Tilastollisessa analyysissä käytettiin JMP Pro 12.0.1 -ohjelmaa (2015, SAS Institute Inc.). Ryhmien välistä eroa tarkasteltiin Fisherin testillä.
Tutkimuksella oli Varsinais-Suomen sairaanhoitopiirin (VSSHP) eettisen toimikunnan puolto (ETMK 157/18011/2015) ja VSSHP:n tutkimuslupa (T13/2016). Kaikki tutkimushenkilöt antoivat kirjallisen suostumuksen tutkimukseen.
Tulokset
Tutkimukseen rekrytoitiin yhteensä 176 henkilöä, joista 56 oli TYKS:n potilaita ja 120 opiskelijoita. Tutkittavista oli miehiä 53 (30 %).
Poliklinikalta rekrytoitujen keski-ikä oli 47 v ja opiskelijoiden 29 v. Riskitietojen kyselykaavaketiedot puuttuivat kahdelta tutkittavalta, joten riskitekijäanalyysiin saatiin 174 henkilöä.
Ulostenäytteistä (n = 176) löytyi yhteensä 189 E. coli - (n = 157) tai K. pneumoniae - (n = 32) kantaa. 26 henkilöltä eristettiin sekä E. coli - että K. pneumoniae -kanta. Kaikista eristetyistä E. coli -kannoista 16,6 % (26/157) oli resistenttejä trimetopriimille. Aminoglykosideille (gentamysiini) resistenttejä kantoja oli 3,2 % (5/157). Fluorokinoloneille (siprofloksasiini) resistenttejä kantoja löydettiin 5/157 (3,2 %). Yksi E. coli -kannoista oli resistentti kolistiinille. Yhtään meropeneemille resistenttiä E. coli -kantaa ei löydetty. K. pneumoniae -kannoista 2/32 (6,3 %) oli resistenttejä trimetopriimille ja kaksi (6,3 %) nitrofurantoiinille. Yhtään gentamysiinille, siprofloksasiinille tai meropeneemille resistenttiä K. pneumoniae -kantaa ei löydetty.
Kolmannen polven kefalosporiineille resistentti ESBL- tai AmpC-entsyymejä tuottava E. coli - tai K. pneumoniae -bakteeri löytyi viljelyllä 6,8 %:lta tutkittavista (12/176). ESBL/AmpC-löydöksistä 10 oli E. coli -kantoja ja kaksi K. pneumoniae -kantoja. Kannoista 11 varmistettiin kiekkotestauksella ESBL:n tuottajiksi (6,3 %, 11/176), ja yksi tuotti vain AmpC-entsyymiä. Opiskelijoiden näytteistä 6,7 % (8/120) oli ESBL-positiivisia. TYKS:n potilaiden 56 näytteestä ESBL-positiivisia oli kolme (5,4 %). Vain AmpC:tä tuottava kanta oli opiskelijoiden ryhmästä.
ESBL- tai AmpC-entsyymiä tuottavien E. coli -kantojen (n = 10) moniresistenssi oli melko yleistä (taulukko 2). Beetalaktaamien lisäksi yhden kannan (10 %, 1/10) herkkyys oli heikentynyt fluorokinolonille, kaksi kantaa oli resistenttejä sulfa-/trimetopriimille (20 %), ja toinen niistä myös kolistiinille. Yksi kanta oli resistentti sekä fluorokinolonille että sulfatrimetopriimille. Kaksi kantaa oli resistenttejä aminoglykosidille (20 %). Niistä toinen oli resistentti myös trimetopriimille ja toinen fluorokinolonille sekä sulfatrimetopriimille.
Kaikki 3. polven kefalosporiineille resistentit E. coli -kannat olivat herkkiä nitrofurantoiinille ja mesillinaamille. Kolistiinille resistentti kanta ei osoittautunut jatkotutkimuksissa varsinaiseksi ESBL-kannaksi, sillä siltä löytyi vain AmpC-entsyymin tuottoon liittyvä AmpC-resistenssigeeni.
Kolmannen polven kefalosporiineille resistenteistä kahdesta K. pneumoniae -kannasta toinen oli beetalaktaamien lisäksi resistentti sulfatrimetopriimille.
PCR-menetelmällä löydettiin 11:stä ESBL:ää tuottavasta kannasta beetalaktamaasi/ESBL-geenit seuraavasti: blaCTX-M-geeni yhdeksästä (81,8 %), blaTEM-geeni kuudesta (54,5 %) ja blaSHV kolmesta (27,3 %) kannasta. Kannalla saattoi olla useita beetalaktamaasigeenejä, ja yleisin geeniyhdistelmä oli blaCTX-M ja blaTEM. Se löydettiin viidestä (45,5 %) kannasta.
Antibiootteja oli saanut 19 % (31/167) kaikista tutkituista ja 16 % (9/56) poliklinikan potilaista (taulukko 3). Sairaalahoito ulkomailla tai työskentely terveydenhuoltoalalla tai tuotantotilalla eivät lisänneet ESBL-kantajuuden riskiä merkitsevästi. Sen sijaan edeltävä antibioottihoito varsinkin yhdistettynä matkailuun lisäsi kantajuuden riskiä merkitsevästi: 11 ESBL-kantajasta 10 oli joko matkustanut tai saanut antibiootteja. Matkailu Etelä-Amerikkaan oli tilastollisesti merkitsevä ESBL-kantajuuden riskitekijä (2/11).
Päätelmät
Tutkituista 6,8 % oli kolmannen polven kefalosporiineille resistenttien E. coli - ja K. pneumoniae -bakteerien (fenotyyppisesti ESBL/AmpC-entsyymin tuottaja) oireettomia kantajia. Tutkituista 6,3 %:lla oli kanta, joka tuotti ESBL:ää. Kantajuuden ilmaantuvuus on Suomessa selvästi suurempi kuin 10 vuotta sitten (2). Tuloksemme tukevat viimeaikaisia tutkimustuloksia muualta maailmasta (1,14,19).
ESBL-bakteerien kantajuuden ilmaantuvuus on lisääntynyt kaikkialla maailmassa, mutta se vaihtelee suuresti maanosittain. Kaakkois-Aasiassa arviolta 75 % väestöstä kantaa ESBL:ää suolistossaan, Euroopassa keskimäärin 5 %.
Suomessa näiden bakteerien ilmaantuvuus on suurentunut samaa tahtia kuin muualla Euroopassa (20). Vuonna 1997 alle 1 % kliinisistä infektioista eristetyistä E. coli -kannoista ja noin 2 % K. pneumoniae -kannoista oli resistenttejä 3. polven kefalosporiineille (21). Vuosituhannen vaihduttua CTX-M-tyypin ESBL-kannat rantautuivat Suomeen (yli 90 % ESBL-E. coli -bakteereista kantoi tätä geeniä), ja ESBL-positiivisten löydösten määrä kasvoi koko maassa (22).
Viime vuosina kaikista kliinisistä K. pneumoniae -kannoista on ollut ESBL:ää tuottavia noin 2–3 % (20). Tartuntatautirekisteriin ilmoitettiin v. 2008–16 kaikkiaan 35 451 uutta ESBL-E. coli - ja 2 690 ESBL-K. pneumoniae -tapausta (23).
ESBL-kantojen ilmaantuvuus on suurin yli 75-vuotiailla, mutta se on tasaisessa kasvussa myös nuoremmissa ikäryhmissä (20).
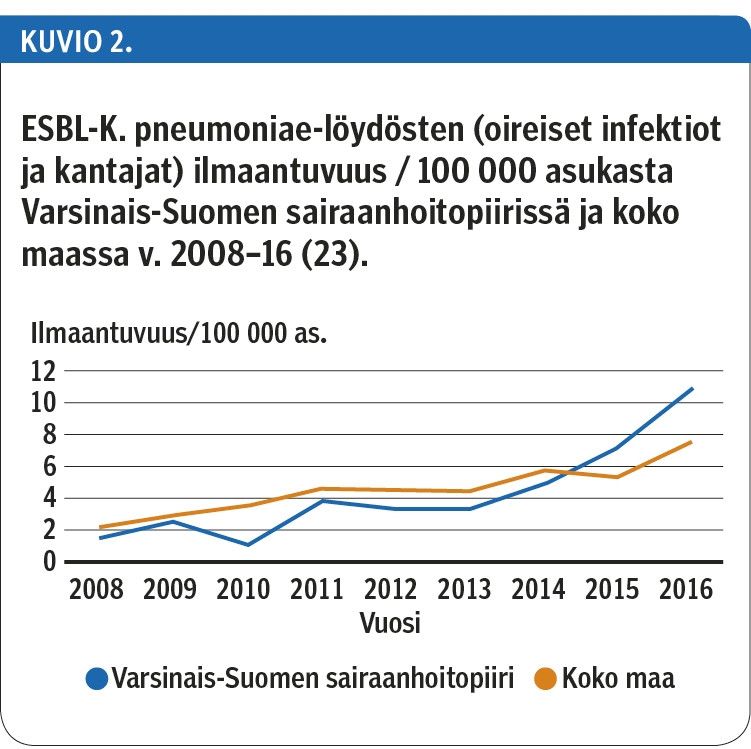
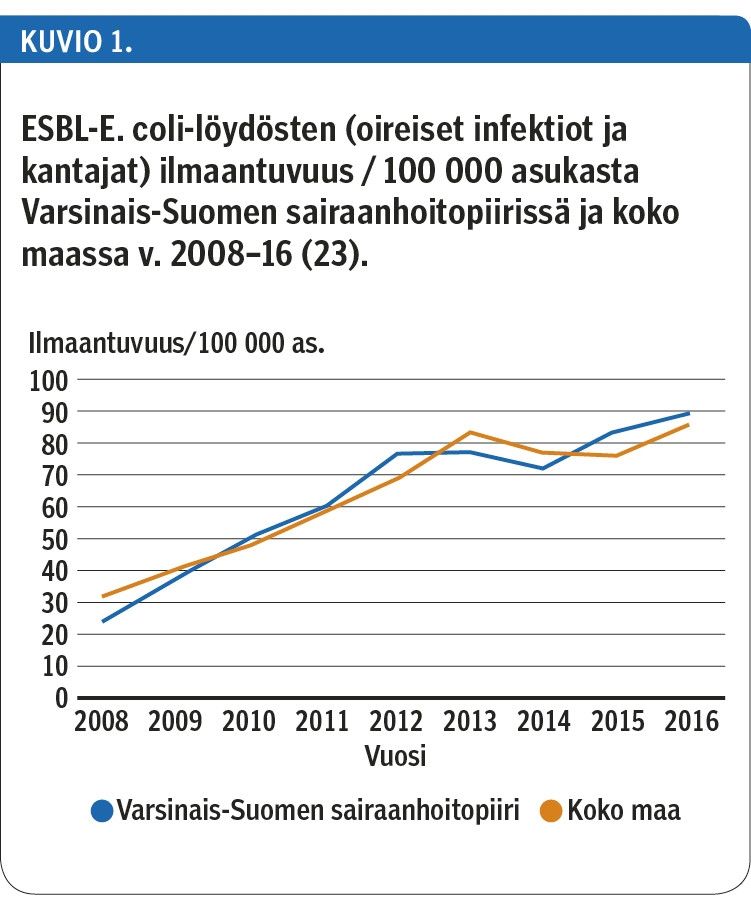
ESBL:ää tuottavien E. coli - ja K. pneumoniae -kantojen ilmaantuvuus Varsinais-Suomen sairaanhoitopiirissä noudattaa kehitystä koko Suomessa (kuvio 1, kuvio 2) (23).
Matkustaminen ja antibioottien käyttö ovat yleisiä ESBL-kantajuuden riskitekijöitä. Puolet tutkittavista oli matkustanut tutkimustamme edeltäneen puolen vuoden aikana. Myös aiemmissa tutkimuksissa valtaosa tutkittavista oli matkustanut ennen tutkimusta (5,7).
Antibioottien käyttö oli vähäisempää kuin oli odotettavissa. Niitä sai 19 % tutkituista ja poliklinikan potilaista vain 16 %. Vuoden 2016 Eurobarometri-tutkimuksen mukaan suomalaisista n. 30 % oli saanut antibioottia tutkimusta edeltäneen vuoden aikana (24).
Edeltävä antibioottihoito lisäsi ESBL-kantajuuden riskiä, varsinkin jos hoito liittyi matkailuun. Arcilla ym. (7) raportoivat noin joka kolmannen hollantilaisen matkailijan olevan ESBL:n kantaja palattuaan kotimaahan. Kanteleen ym. tutkimuksissa (2,25) havaittiin, että turistiripulin hoito mikrobilääkkeillä lisäsi merkitsevästi matkustajan riskiä saada ESBL: Intiassa antibiooteilla hoidetuista 80 % ja Kaakkois-Aasiassa hoidetuista 69 % oli Suomeen palatessaan ESBL-bakteerin kantajia.
Myös ympäristöön liittyvät tekijät, kuten ulkomailta peräisin olevan ruoka ja kotieläimet, ovat ESBL:n riskitekijöitä. Työskentely tuotantotilalla ei tosin ollut tutkimuksessamme merkitsevä riskitekijä, ja Schmithausen ym. (16) totesivat työntekijöiden ESBL-kantajuuden sikatiloilla olevan harvinaista.
Terveydenhoitoalalla työskentely ei osoittautunut ESBL:n merkitseväksi riskitekijäksi. Eurooppalaisessa tutkimuksessa 3,5 % pitkäaikaishoitolaitoksen henkilökunnasta oli ESBL:n kantajia, ja kantajuuden riskitekijänä oli potilaan lähihoito (15). Pieni aineistomme ei mahdollista monimuuttuja-analyysiä hoitohenkilöstön riskistä.
ESBL:n yleistyminen uhkaa infektioiden hoidon tuloksia. Potilaiden kuolleisuus suurenee, jos he saavat antibioottiherkkyyden perusteella arvioituna tehotonta antibioottia (26). Esimerkiksi virtsatieperäistä sepsistä sairastavien ennuste voi heikentyä, jos empiirinen antibioottihoito ei tehoa ko. bakteerikantaan (27). Sepsisinfektioiden riski kasvaa erityisesti infektioherkillä potilailla (28).
Hoitoon liittyvistä infektioista on Suomessa 14 % E. colin ja 4 % K. pneumoniaen aiheuttamia (29). Vastaavista infektioista ei v. 1999 yksikään ollut resistentti 3. polven kefalosporiineille, kun v. 2013 kannoista 17 % oli resistenttejä. Niistä 88 %:lla oli ESBL-fenotyyppi.
Moniresistentin bakteerin aiheuttamia infektioita todettiin Suomessa v. 2011 yli 2 400, mikä vastasi noin 5 %:a kaikista hoitoon liittyvistä infektioista (30). Peñan ym. mukaan ESBL-kolonisaatio oli sitä todennäköisempi, mitä kauemmin tehohoitopotilaalla oli virtsakatetri (31).
Virtsatieinfektioita aiheuttaneista E. coli -kannoista oli ESBL-kantoja 2,8 % Suomessa v. 2016 (20). Samana vuonna TYKS:n kliinisistä E. coli -virtsalöydöksistä 3,4 % oli resistenttejä 3. polven kefalosporiineille (32).
Koko Suomessa virtsan E. coli -kannoista oli v. 2016 trimetopriimille resistenttejä 18,6 % ja fluorokinoloneille 6,3 % (20). Tutkimuksemme E. coli - ja K. pneumoniae -kannat olivat herkempiä antibiooteille: E. coli -kannoista 16,6 % oli resistenttejä trimetopriimille ja 3,2 % fluorokinololille.
Sen sijaan ESBL/AmpC-E. coli -kantojen moniresistenssi oli tutkimuksessamme melko yleistä: kannoista neljä (40 %) oli resistenttejä beetalaktaamien lisäksi vähintään kahdelle muulle mikrobilääkeryhmälle. Moniresistenssiosuudet ovat samaa luokkaa kuin FinRes-raportissa (20).
Plasmidivälitteisen, siirtyvän kolistiiniresistenssin (mcr-1-geeni) löytyminen oli suuri huolenaihe v. 2016 (33,34). Kolistiinia käytetään karbapenemaaseja tuottavien bakteerien aiheuttamien infektioiden viime linjan antibioottina. Sittemmin kolistiiniresistenssiä on raportoitu useista maista.
Tutkimuksessamme löytyi yksittäinen kolistiiniresistentti E. coli -kanta, joka ei kuitenkaan osoittanut varsinaiseksi ESBL-kannaksi. Jatkossa siis myös Suomessa voi tulla yksittäisinä löydöksinä esiin suolistobakteereita, joilla on siirtyvä kolistiiniresistenssi.
Merkittävää on, että yhtään karbapeneemille resistenttiä kantaa ei löytynyt, vaikka puolet henkilöistä oli matkaillut – heistä neljäsosa Aasiassa – ja puolet oli saanut antibioottia.
ESBL-kantajuus voi osalla ihmisistä kestää pitkään. Arcillan ym. tutkimuksessa kantajuuden kesto oli keskimäärin 3 kk ja hieman yli 10 % oli kantajia vielä vuoden kuluttua (7). Hollantilaistutkimuksessa kantajuus kesti kolmasosalla terveistä koehenkilöistä yli 8 kk (35).
Kantajuus voi siirtyä lähikontakteihin. Arcillan ym. tutkimuksessa kanta siirtyi perheenjäseneen 12 %:lla koehenkilöistä (7). Adlerin ym. tutkimuksessa ESBL-positiivisten kuntoutuspotilaiden perheenjäsenistä oli kantajia 9 % (15).
ESBL-kantajuus näyttää yleistyvän. Samalla kasvaa riski, että syntyy kliinisiä ESBL-infektioita. Merkittävään osaan riskitekijöistä voidaan vaikuttaa esimerkiksi hyvällä käsihygienialla tuotantotiloilla ja sairaaloissa. Myös matkustajia voidaan informoida antibioottihoidon riskeistä ja turistiripulin hoidosta.
Tutkimusaineiston pienuuden takia emme voineet tehdä pitkälle meneviä johtopäätöksiä siitä, missä määrin ESBL-riskin syntyyn vaikuttavat yksittäiset taustalla vaikuttavat seikat. Siksi emme voineet tehdä suositusta empiirisen antibioottihoidon valinnasta, kun kyseessä on virtsainfektio nuorella, joka on matkaillut. Antibioottien käytön ohjauksen lisäksi huomiota tulisi kiinnittää myös resistenttien mikrobien torjuntapolitiikkaan sairaaloissa.
Löydöksemme viittaavat siihen, että ESBL/AmpC-bakteerien esiintyvyys suomalaisessa väestössä on kasvussa. Tällä voi olla merkitystä päivitettäessä suosituksia infektioiden antibioottihoidosta ja laadittaessa resistenttien mikrobien torjuntaohjeita esimerkiksi sairaalapotilaiden ennakkoseulontaa varten.
Kiitokset
Bioanalyytikko Mari Virta, hygieniahoitaja Anne-Mari Kaarto, FT Sari Pakkanen, professori Anu Kantele ja tutkimushenkilöt.
Esa Rintala, Kirsi Gröndahl-Yli-Hannuksela, Emilia Lönnqvist, Mikko Talja: Ei sidonnaisuuksia.
Kaisu Rantakokko-Jalava: (Artikkelin ulkopuolinen, aiheen kannalta olennainen taloudellinen toiminta) kierrosasiantuntija moniresistenttien bakteerien seulontaviljelyjen ulkoisilla laaduntarkkailukierroksilla (Labquality Oy).
Jaana Vuopio: (Artikkelin ulkopuolinen, aiheen kannalta olennainen taloudellinen toiminta) luentopalkkiot (Suomen Lääkäriliitto, Suomalainen Lääkäriseura Duodecim, Suomen Hammaslääkäriseura Apollonia, Suomen Eläinlääkäriseura), lisenssitulot ja tekijänpalkkiot (Kustannus Oy Duodecim).
Tästä asiasta tiedettiin
Euroopassa on todettu ESBL:ää tuottavien suolistobakteerien oireetonta kantajuutta ulostenäytteistä 5–6 %:lla perusterveestä väestöstä.
Suomessa on aiemmin todettu oireetonta kantajuutta 1,2 %:lla matkalle lähtevistä terveistä aikuisista.
Kantajuuden tärkeimpiä riskitekijöitä ovat matkailu ja edeltävä antibioottihoito.
Tämä tutkimus opetti
Moniresistentin suolistobakteerin (ESBL) oireeton kantajuus todettiin 6,3 %:lla opiskelijoista ja TYKS:n poliklinikan potilaista. Luku on suurempi kuin Suomessa on aiemmin todettu.
Löydettyjen ESBL-kantojen antibioottiherkkyys vastasi suomalaisten kliinisten resistenssiaineistojen tasoa. ESBL:ää tuottavien Escherichia coli -kantojen moniresistenssi oli melko yleistä.
Edeltävä antibioottihoito ja matkailu olivat ESBL-kantajuuden riskitekijöitä.
- 1
- Woerther P-L, Burdet C, Chachaty E, Andremont A. Trends in human fecal carriage of extended-spectrum β-lactamases in the community: toward the globalization of CTX-M. Clin Microbiol Rev 2013;26:744–58.
- 2
- Kantele A, Laaveri T, Mero S ym. Antimicrobials increase travelers’ risk of Ccolonization by extended-spectrum betalactamase-producing Enterobacteriaceae. Clin Infect Dis 2015;60:837–46.
- 3
- Ostholm-Balkhed A, Tärnberg M, Nilsson M, Nilsson LE, Hanberger H, Hällgren A; Travel Study Group of Southeast Sweden. Travel-associated faecal colonization with ESBL-producing Enterobacteriaceae: incidence and risk factors. J Antimicrob Chemother 2013;68:2144–53.
- 4
- Egervärn M, Rosengren Å, Englund S ym. ESBL-bildande E. coli i vår omgivning – livsmedel som spridningsväg till människa. Slutrapport från ett myndighetgemensamt projekt – antibiotikaresistens. https://www.folkhalsomyndigheten.se/globalassets/smittskydd-sjukdomar/antibiotika/esbl-studie/msb-esbl-slutrapport-12-nov-2014.pdf
- 5
- Ulstad CR, Solheim M, Berg S, Lindbæk M, Dahle UR, Wester AL. Carriage of ESBL/AmpC-producing or ciprofloxacin non-susceptible Escherichia coli and Klebsiella spp. in healthy people in Norway. Antimicrob Resist Infect Control 2016;5:57. doi: 10.1186/s13756-016-0156-x
- 6
- Jakobsen L, Kuhn KG, Hansen F ym. Fecal carriage of extended-spectrum and AmpC β-lactamase-producing Enterobacteriaceae in surgical patients before and after antibiotic prophylaxis. Diagn Microbiol Infect Dis 2016; 86:316-321. doi: 10.1016/j.diagmicrobio.2016.07.028.Epub 2016 Aug 3.
- 7
- Arcilla MS, van Hattem JM, Haverkate MR ym. Import and spread of extended-spectrum β-lactamase-producing Enterobacteriaceae by international travellers (COMBAT study):a prospective, multicentre cohort study. Lancet Infect Dis 2017;17:78–85.
- 8
- Nicolas-Chanoine MH, Gruson C, Bialek-Davenet S ym. 10-Fold increase (2006-11) in the rate of healthy subjects with extended-spectrum β-lactamase-producing Escherichia coli faecal carriage in a Parisian check-up centre.J Antimicrob Chemother 2013;68: 562–8.
- 9
- Ruppé E, Armand-Lefèvre L, Estellat C ym. High rate of acquisition but short duration of carriage of multidrug-resistant Enterobacteriaceae after travel to the tropics. Clin Infect Dis 2015;61:593–600. doi: 10.1093/cid/civ333. Epub 2015 Apr 22.
- 10
- Lübbert C, Straubea L, Steinb C ym. Colonization with extended-spectrum beta-lactamase-producing and carbapenemase-producing Enterobacteriaceae in international travelers returning to Germany. Int J Med Microbiol 2015;305:148–56.
- 11
- Kuenzli E, Jaeger VK, Frei R ym. High colonization rates of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli in Swiss travellers to South Asia – a prospective observational multicentre cohort study looking at epidemiology, microbiology and risk factors. BMC Infect Dis 2014;14:528. doi: 10.1186/1471-2334-14-528.
- 12
- Ohje moniresistenttien mikrobien tartunnantorjunnasta. THL. Ohjauskirje 22/2017.
- 13
- Pitout JD, Laupland KB. Extended-spectrum β-lactamase-producing Enterobacteriaceae: an emerging public-health concern. Lancet Infect Dis 2008;8:159–66.
- 14
- Woerther P-L, Andremont A, Kantele A. Travel-acquired ESBL-producing Enterobacteriaceae: impact of colonization at individual and community level.J Travel Med 2017;24;Suppl 1, 29–34.
- 15
- Adler A, Baraniak A, Izdebski R ym. A multinational study of colonization with extended spectrum b-lactamase-producing Enterobacteriaceae in healthcare personnel and family members of carrier patients hospitalized in rehabilitation centres. Clin Microbiol Infect 2014;20:O516–O523.
- 16
- Schmithausen RM, Schulze-Geisthoevel SV, Stemmer F ym. Analysis of transmission of MRSA and ESBL-E among pigs and farm personnel. PLoS One 2015;10:e0138173.
- 17
- European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters. www.eucast.org
- 18
- Nyberg SD, Österblad M, Hakanen AJ, Huovinen P, Jalava J & Finnish Study Group for Antimicrobial Resistance. Detection and molecular genetics of extended-spectrum beta-lactamases among cefuroxime-resistant Escherichia coli and Klebsiella spp. isolates from Finland, 2002–2004. Scand J Infect Dis 2007;39:417–24.
- 19
- Strömdahl H, Tham J, Melander E, Walder M, Edquist PJ, Odenholt I. Prevalence of faecal ESBL carriage in the community and ina hospital setting in a county of Southern Sweden. Eur J Clin Microbiol Infect Dis 2011;30:1159–62.
- 20
- Jalava J, Räisänen K. Bakteerien mikrobilääkeresistenssi Suomessa: FinRes 2016. Terveyden ja hyvinvoinnin laitos, 2017.
- 21
- Manninen R, Auvinen H, Huovinen P. Resistance to second- and third-generation cephalosporins among Escherichia coli and Klebsiella species is rare in Finland. Clin Microbiol Infect 1997;3:408–13.
- 22
- Gunell M, Hakanen A, Aittoniemi J ym. Mikrobilääkeresistenssi Suomessa – Finres 1997–2010. Terveyden ja hyvinvoinnin laitos, 2012.
- 23
- Tartuntatautirekisteri, tilastotietokanta. Terveyden ja hyvinvoinnin laitos. https://www.thl.fi/ttr/gen/rpt/tilastot.html
- 24
- Euroopan Neuvosto. Special Eurobarometer 445 – April 2016. http://ec.europa.eu/COMMFrontOffice/PublicOpinion
- 25
- Kantele A, Mero S, Kirveskari J, Lääveri T. Fluoroquinolone antibiotic users select fluoroquinolone-resistant ESBL-producing Enterobacteriaceae (ESBL-PE) – Data of a prospective traveller study. Travel Med Infect Dis 2017;16:23–30.
- 26
- Marquet K, Liesenborgs A, Bergs J, Vleugels A, Claes N. Incidence and outcome of inappropriate in-hospital empiric antibiotics for severe infection: a systematic review and meta-analysis. Crit Care 2015;19:63. doi: 10.1186/s13054-015-0795-y
- 27
- Calbo E, Romaní V, Xercavins M ym. Risk factors for community-onset urinary tract infections due to Escherichia coli harbouring extended-spectrum beta-lactamases. J Antimicrob Chemother 2006;57:780–3. Epub 2006 Feb 21.
- 28
- Vehreschild MJ, Hamprecht A, Peterson L ym. A multicentre cohort study on colonization and infection with ESBL-producing Enterobacteriaceae in high-risk patients with haematological malignancies. J Antimicrob Chemother 2014;69:3387–92.doi: 10.1093/jac/dku305. Epub 2014 Aug 6
- 29
- Martelius T, Jalava J, Kärki T ym. Nosocomial bloodstream infections caused by Escherichia coli and Klebsiella pneumoniae resistant to third-generation cephalosporins, Finland, 1999–2013: trends, patient characteristics and mortality. Infect Dis 2016;48:229–34.
- 30
- Kanerva M, Ollgren J, Hakanen AJ, Lyytikäinen O. Estimating the burden of healthcare-associated infections caused by selected multidrug-resistant bacteria Finland, 2010. Antimicrob Resist Infect Control 2012;1:33. doi: 10.1186/2047-2994-1-33.
- 31
- Peña C, Pujol M, Ricart A ym.Risk factors for faecal carriage of Klebsiella pneumoniae producing extended spectrum β-lactamase (ESBL-KP) in the intensive care unit. J Hosp Infect 1997;35:9–16.
- 32
- Tykslab, kliininen mikrobiologia ja genetiikka, tilastot. http://www.vsshp.fi/fi/toimipaikat/tyks-sapa/mg/tilastot/Sivut/default.aspx
- 33
- Liu YY, Wang Y, Walsh TR ym. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis 2016;16:161–8. doi: 10.1016/S1473-3099(15)00424-7. Epub2015 Nov 19.
- 34
- Skov RL, Monnet DL. Plasmid-mediated colistin resistance(mcr-1 gene): three months later, the story unfolds. Euro Surveill 2016;21:30155. https://doi.org/10.2807/1560-7917.ES.2016.21.9.30155
- 35
- van Duijkeren E, Wielders CCH, Dierikx CM, van Hoek AHAM, Hengeveld P. Long-term carriage of extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae in the general population in the Netherlands. Clin Infect Dis 2017; Nov 15. doi: 10.1093/cid/cix1015.[Epub ahead of print].
Asymptomatic ESBL carriagein Southern Finland
BACKGROUND The knowledge of carrier prevalence is crucial when updating recommendations on treatment and prevention of extended spectrum β-lactamase (ESBL) producing bacteria.
METHODS In the multinational NoDARS study healthy students and outpatients provided a fecal sample and answered a questionnaire. The samples were cultured for ESBL producing Escherichia coli and Klebsiella pneumoniae.
RESULTS An ESBL or AmpC producing strain was found in 6.8% of the study subjects. Antimicrobial treatment and travel abroad were identified as risk factors for ESBL/AmpC carriage, but not work on a livestock farm or in healthcare. Altogether 157 E. coli and 32 K. pneumoniae strains were detected. Of the E. coli strains 16.6% (26/157) were resistant to trimethoprim, 3.2% (5/157) to gentamicin, 3.2% (5/157) to fluoroquinolones, and none to meropenem. Of the K. pneumoniae strains 6.3% (2/32) were resistant to trimethoprim but none to gentamicin, fluoroquinolones or meropenem.
CONCLUSIONS The prevalence of asymptomatic carriage of ESBL producing bacteria was higher than previously found in Finland. Antimicrobial treatment and travel abroad were identified as risk factors for ESBL/AmpC carriage.