Kirurginen savu toimenpiteissä – henkilöstön riskit ja suojaus
• Monia sähkökirurgisia instrumentteja käytettäessä syntyy kirurgista savua.
• Henkilöstö voi altistua kumulatiivisesti savun haitallisille komponenteille.
• Tavallinen kirurginen hengityssuojain antaa yli 90-prosenttisen suojan. Lisäksi tulisi käyttää asianmukaisella suodattimella varustettua paikallista savunpoistolaitteistoa.
• Savulle altistumisen ei ole osoitettu lisäävän sairastavuutta tai syöpäriskiä.

Lääkärit ja muu hoitohenkilöstö altistuvat työssään useille karsinogeenisille aineille ja säteilylle, jotka voivat lisätä syöpäriskiä (1). Vuosittain noin 500 000 työntekijää altistuu kirurgiselle savulle, joka voi altistaa henkilöstön useille kumulatiivisille riskeille (2,3,4).
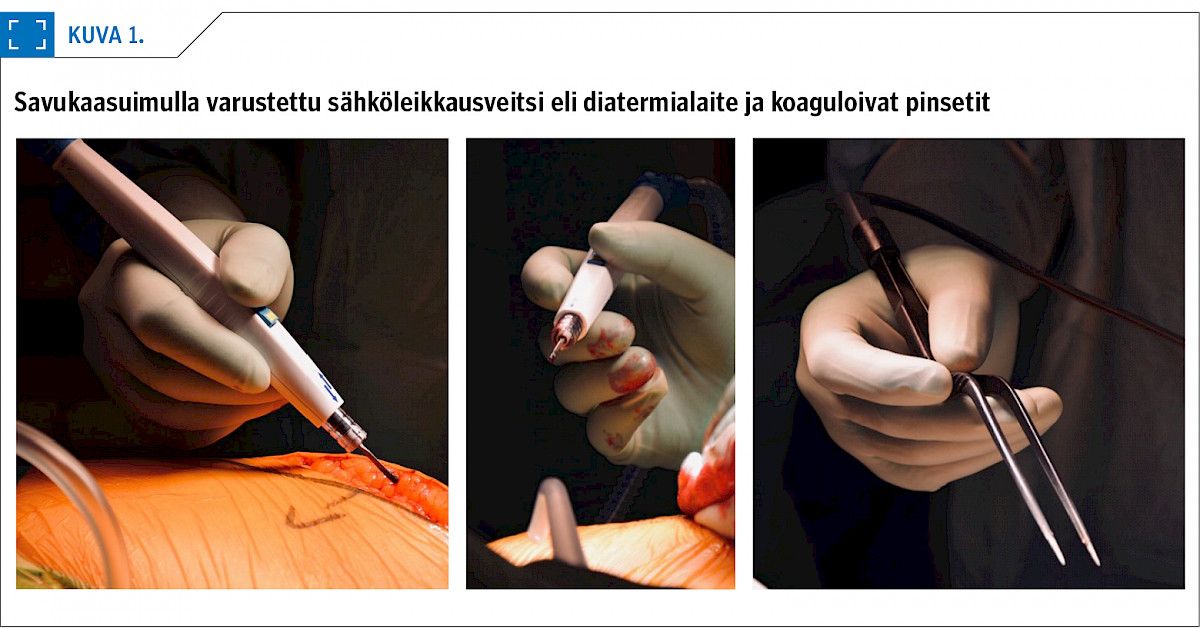
Kirurgista savua syntyy monien kirurgisten sähköinstrumenttien käytön yhteydessä, esimerkiksi käytettäessä sähköleikkausveitsiä eli diatermialaitetta ja koaguloivia pinsettejä (kuva 1), laserveitsiä, ultraääniveitsiä (kuva 2) sekä käytettäessä korkeakierrosporia ja sahoja.
Sähkökirurgisia veitsiä ja pinsettejä sekä laserveitsiä käytettäessä kohdekudoksen solut kuumenevat kiehumispisteeseen. Tämä vaurioittaa solurakenteita ja syntyy kirurgista savua (5).
Ultraääneen perustuvissa instrumenteissa kirurginen savu syntyy, kun värähtelevät levyt vaurioittavat soluja. Vauriot syntyvät selvästi matalammassa lämpötilassa kuin sähkökirurgisia instrumentteja käytettäessä, eikä sähkövirta kulkeudu kudoksessa (6).
Tässä kirjallisuuskatsauksessa tarkastellaan kirurgisen savun aiheuttamia potentiaalisia vaaroja henkilökunnalle ja keinoja suojautua haitallisilta komponenteilta.
Savun komponenttien merkitys terveydelle
Henkilökunta voi altistua leikkaussaleissa kirurgiselle savulle ja siten savun haihtuvien yhdisteiden kemiallisille ja biologisille vaaroille, biologista alkuperää oleville partikkeleille sekä viruksille, bakteereille tai niiden osille (7,8,9,10). Kirurgisessa savussa on havaittu tunnettuja karsinogeeneja (11,12,13), ja on esitetty, että yhdisteillä voisi olla myös yhteys sydän- ja verisuonisairauksien syntymiseen (14,15,16).
Leikkauksissa syntyvän kirurgisen savun määrä ja koostumus riippuvat esimerkiksi savua muodostavan instrumentin tyypistä ja käytön määrästä, valitusta tehoasetuksesta sekä kohdekudoksesta (kasvainkudos, infektiotilanne) (8,10,17,18,19,20,21).
Kirurgiselle savulle altistuminen on esitetty olevan yhteydessä muun muassa päänsärkyyn, pahoinvointiin, lihasheikkouteen, silmien, nenän ja kurkun ärsytykseen sekä akuutteihin ja kroonisiin hengitystieoireisiin (22,23).
Henkilöstön savukaasualtistumisen vaikutuksia on arvioitu vain muutamissa tutkimuksissa: sairaanhoitajien pidempiaikainen pitkäaikainen altistuminen leikkaussalin kirurgiselle savulle ei lisännyt keuhkosyövän riskiä, mutta lisäsi hengitystieoireita (24,23,22,21,20,19,18,17,16,15,14,13,12,11,10,9,8,7,6).
Pienhiukkaset
Kirurginen savu sisältää erityisen pieniä hiukkasia (ultrafine particles, UFP) (9,27,28). Noin 77 % kirurgisen savun hiukkasista on kooltaan alle 1,1 μm. Savussa voi siten esiintyä kokoluokan 10 nm–1 μm hiukkasia suurina pitoisuuksina (16,29,30).
Leikkauksissa tavallisesti käytettävät kirurgiset hengityssuojaimet eivät kykene suodattamaan alle 5 μm:n hiukkasia. Tällöin nämä hiukkaset saattavat päätyä hengityselimistöön (6). Erityisen pienillä hiukkasilla on suuri pinta-ala suhteessa niiden massaan (31,32). Ne kertyvät keuhkojen syvempiin osiin, ja alveolit altistuvat niiden välittämälle toksiselle vaikutukselle (33,34).
Altistuminen erityisen pienille hiukkasille vaihtelee ammattiryhmittäin ja toimenpiteittäin. Suurinta altistuminen on vatsan muotoiluleikkauksessa ja vähäisintä lonkan tekonivelleikkauksessa. Rinnan pienennysleikkauksessa avustavan kirurgin altistus pienhiukkasille oli kymmenkertainen verrattuna anestesiahoitajan altistukseen. Sähkökirurgisen veitsen käyttö aiheutti lyhytaikaisesti suuren altistumisen pienhiukkasille.
Altistumisen määrää työympäristössä on tarkkailtava, vaikka kirurgisen savun synnyttämien pienhiukkasten merkitys terveydelle on vielä epäselvä (35).
Kirurgisen savun aiheuttama altistuminen on kuitenkin vähäistä verrattuna monien muiden ammattiryhmien altistumiseen pienhiukkasille muualla kuin terveydenhuollossa (35). Koska kirurginen savu syntyy biologisen materiaalin kuumetessa, sen aiheuttamaa altistusta voidaan verrata ruuanlaitossa syntyvään altistukseen. Lihan paistaminen pannulla synnytti jopa kolminkertaisen pienhiukkasaltistuksen verrattuna altistukseen leikkaussalissa (36). Leikkaussalihenkilöstön pienhiukkasaltistus oli vähäinen myös verrattuna hitsauksesta, asfaltoinnista ja alumiinin työstöstä raportoituihin arvoihin (37,38,39).
Mikrobiologiset riskit ja kasvainsolujen leviäminen
Kirurgisessa savussa esiintyy virusperäistä materiaalia (23). Virus-DNA:ta on osoitettu olevan enemmän laserinstrumenttien ja ultraääniveitsien tuottamassa savussa kuin sähköisten koagulaatioinstrumenttien tuottamassa savussa, joka syntyy korkeammassa lämpötilassa (40,41).
Diatermiaa käytettäessä savuun vapautuu enemmän kokonaisia soluja kuin laserkirurgisia instrumentteja käytettäessä (42). Savu voi sisältää kokonaisia maligneja soluja, kun sähkökirurgisia instrumentteja käytetään lyhyissä jaksoissa matalalla virralla (43).
Ei ole kuitenkaan pystytty osoittamaan, että tällaisten instrumenttien käyttöön liittyisi virusten aiheuttamia tartuntoja tai kasvainsolujen siirtymistä leikkaussalihenkilökuntaan (24,44). Bakteerien leviämistä leikkausalueen viereisiin kudoksiin tai leikkaussaliin on havaittu tapahtuvan, kun sähkökirurgisissa instrumenteissa on käytetty sekoitettua virtaa (leikkaavan ja koaguloivan virran välimuoto). Koaguloivaa virtaa käytettäessä vastaavaa ei ole havaittu (45).
On esitetty, että potilaan anogenitaalisen papilloomaviruksen (HPV) aiheuttaman kondylooman hoidossa käytetty laser on aiheuttanut kirurgille kurkunpään kondylooman (40,46). Laajemmassa tutkimuksessa papilloomavirus-DNA:ta havaittiin yli puolessa hiilidioksidilaserin tuottamista savunäytteistä, mutta ei hoitavan lääkärin hengityssuojaimista otetuissa näytteissä. Vaikka laser mahdollisesti vapauttaa virus-DNA:ta genitaalisen papilloomainfektion leikkauksessa, lääkärin kontaminoituminen on epätodennäköistä, jos käytetään asianmukaista savunpoistolaitteistoa (47).
Kemialliset yhdisteet
Kirurgisen savun hajun aiheuttavat savun sisältämät useat kemialliset yhdisteet. Suurimpina pitoisuuksina havaitaan hiilivetyjä, nitriilejä, rasvahappoja ja fenoleja (4,7,8,11). Suurimmat terveysriskit aiheutuvat savun sisältämistä formaldehydistä, bentseenistä ja vetysyanidista (7).
Myrkyllisiä kaasuja on havaittavissa sitä enemmän, mitä korkeampi kirurgisen instrumentin lämpötila on (48). Tupakansavuun verrattuna kirurgisessa savussa on selvästi vähemmän hiilivetyjä. Sen sijaan tolueenin, etyylibentseenin ja ksyleenin pitoisuuksien on raportoitu olevan samaa luokkaa kuin tupakansavussa (10).
Diatermian käyttö lihaskudokseen tuottaa enemmän aldehydejä ja ketoneja kuin muiden kohteiden käsittely. Maksan ja rasvakudoksen koaguloiminen sen sijaan vapauttaa ilmaan hiilimonoksidia ja vetysyanidihappoa (10,48). Epidermaalisen kudoksen poisto tuottaa suurempia määriä ksyleeniä, tolueenia ja etyylibentseeniä (49).
Formaldehydi ja muut aldehydit luokitellaan hengitysteitä ärsyttäviksi aineiksi ja potentiaalisiksi työperäisiksi karsinogeeneiksi, joille altistumista tulee seurata. Bentseeni on luokiteltu potentiaaliseksi työperäiseksi karsinogeeniksi, jolle altistumisen pitäisi olla mahdollisimman vähäistä. Bentseenille altistuminen saattaa myös aiheuttaa päänsärkyä, huimausta, pahoinvointia ja limakalvojen ärsytystä (50).
Kirurginen savu voi lisäksi sisältää vetysyanidia, asetyleeniä ja 1,3-butadieeniä (49). Vetysyanidi toimii kuten hiilimonoksidi ja vaikuttaa kudosten hapettumiseen. Lisäksi sillä on vaikutuksia keskushermostoon sekä sydän- ja verenkiertoelimistöön (24). Kirurginen savu saattaa sisältää myös teratogeeniksi ja karsinogeeniksi luokiteltua styreeniä, joka voi vaikuttaa keskushermostoon sekä aiheuttaa ihoärsytystä ja vaurioita hengitysteissä.
Suojautuminen
Kirurgiselta savulta voidaan suojautua joko paikallisella kaasunpoistolaitteistolla tai käyttämällä hengityssuojaimia. Leikkausalueelta savukaasu poistetaan paikallisesti mekaanisella savukaasuimurilla (local exhaust ventilation). Imuri voi kiinnittyä savua muodostavaan instrumenttiin suoraan tai integroidusti, tai se voi olla erillinen laite.
Leikkaussalin yleisimu riittää poistamaan vähäiset määrät savukaasua, mutta suurempien määrien poistamiseen tarvitaan paikallinen savukaasuimuri (51,52,53,54).
Useat ammattiyhdistykset, konsensusjärjestöt ja julkishallinnolliset tahot suosittavat paikallisen savukaasunpoistojärjestelmän käyttöä työntekijöiden suojaamiseksi (51,55,56,57,58,59,60,61).
Poistolaitteiston imutehon tulisi olla vähintään 30,5–45,7 m/s. Lisäksi järjestelmään pitäisi olla asennettuna suodatin, joka pystyy suodattamaan 0,1 μm:n kokoiset partikkelit. Se tulisi asentaa alle 5 cm:n päähän kirurgisen savun lähteestä.
Oikein käytetty paikallinen savukaasunpoistolaitteisto vähentää sähkökirurgisten instrumenttien ympäristöön vapauttamien bakteerien määrää (45). Paikallisen savukaasuimun käytön on myös osoitettu vähentävän mm. asetaldehydin, asetonin, bentseenin, tolueenin, styreenin ja haihtuvien orgaanisten yhdisteiden (VOC) pitoisuudet alle asetettujen turvarajojen (62).
Tavanomaiset kirurgiset hengityssuojaimet eivät suojaa käyttäjää alle 5 μm:n partikkeleilta, joten HEPA-hengityssuojaimia (esimerkiksi N95-suojaimia) tulisi käyttää aina kun mahdollista (3,63,64).
Ongelmana saattaa kuitenkin olla hengityssuojainten huono istuvuus, jonka vuoksi savukaasut voivat päästä hengitysilmaan (91). Vaikka suojaimet antavat oikein käytettynä hyvän suojan kirurgisen savun haittoja vastaan, niitä tulisi käyttää yhdessä paikallisen kaasunpoistojärjestelmän kanssa (23).
Ainoa luotettava menetelmä suojautua savulta on käyttää paikallista savukaasuimuria (26,65). Toimenpiteissä, joissa muodostuu runsaasti pienhiukkasia – kuten maksa- tai munuaiskudokseen ja lihasrakenteisiin kohdistuvassa kirurgiassa – tulisi paikallisen savukaasuimurin lisäksi käyttää N95-tyyppisiä hengityssuojaimia (19).
Silmäsuojaimien käyttöä ei ole tutkittu kliinisissä kokeissa, mutta savukaasulle altistumisen tiedetään voivan aiheuttaa silmien ärsytystä ja polttelun tunnetta (23,26). Suojausta on kuitenkin hyödyllistä käyttää erityisesti, jos havaitaan silmien ärsytystä toimenpidettä suoritettaessa tai sen jälkeen. Asianmukainen paikallinen savukaasuimuri kuitenkin poistaa savun, ennen kuin se pääsee vaikuttamaan henkilökunnan silmiin.
Lopuksi
Leikkaustoiminnassa syntyvä kirurginen savu haittaa näkyvyyttä toimenpiteessä. Lisäksi se on epämiellyttävän hajuista ja vapauttaa ilmaan haitallisia aineita. Pelkän kirurgiselle savulle altistumisen ei ole osoitettu aiheuttavan lisääntynyttä sairastavuutta tai syöpäriskiä, mutta savun komponentit saattavat osaltaan vaikuttaa riskeihin.
Savulle altistumisen merkityksen arvioimiseksi tarvitaan lisää tutkimuksia. Työntekijöiden altistumista tulisi selvittää ja kerätä tietoa savukaasujen poistojärjestelmien tehokkuudesta käytännön olosuhteissa.
Ei sidonnaisuuksia.
- 1
- Eriksson M, Hardell L, Malker H, Weiner J. Increased cancer incidence in physicians, dentists, and health care workers. Oncology Reports 1998;5:1413–8.
- 2
- Choi SH, Kwon TG, Chung SK, Kim TH. Surgical smoke may be a biohazard to surgeons performing laparoscopic surgery. Surgical Endoscopy 2014;28:2374–80.
- 3
- Georgesen C, Lipner SR. Surgical smoke: Risk assessment and mitigation strategies. J Am Acad Dermatol 2018;79:746–55.
- 4
- Lewin JM, Brauer JA, Ostad A. Surgical smoke and the dermatologist. J Am Acad Dermatol 2011;65:636–41.
- 5
- Massarweh NN, Cosgriff N, Slakey P. Electrosurgery: history, principles, and current and future uses. J Am Coll Surg 2006;202:520–30.
- 6
- Mowbray N, Ansell J, Warren N, Wall P, Torkington J. Is surgical smoke harmful to theater staff? A systematic review. Surg Endosc 2013;27:3100–7.
- 7
- Hill DS, O’Neill JK, Powell RJ, Oliver DW. Surgical smoke — a health hazard in the operating theatre: a study to quantify exposure and a survey of the use of smoke extractor systems in UK plastic surgery units. J Plast Reconstr Aesthet Surg 2012;65:911–6.
- 8
- Barrett WL, Garber SM. Surgical smoke: a review of the literature. Is this just a lot of hot air? Surg Endosc 2003;17:979–87.
- 9
- Gonzalez-Bayon L, Gonzalez-Moreno S, Ortega-Perez G. Safety considerations for operating room personnel during hyperthermic intraoperative intraperitoneal chemotherapy perfusion. Eur J Surg Oncol 2006;32:619–24.
- 10
- Al Sahaf OS, Vega-Carrascal I, Cunningham FO, McGrath JP, Bloomfield FJ. Chemical composition of smoke produced by high-frequency electrosurgery. Ir J Med Sci 2007;176:229–32.
- 11
- Wu JS, Luttmann DR, Meininger TA, Soper NJ. Production and systemic absorption of toxic byproducts of tissue combustion during laparoscopic surgery. Surg Endosc 1997;11:1075–9.
- 12
- Hollmann R, Hort CE, Kammer E, Naegele M, Sigrist MW, Meuli- Simmen C. Smoke in the operating theater: An unregarded source of danger. Plast Rec Surg 2004;114:458–63.
- 13
- Weston R, Stephenson RN, Kutarski PW, Parr NJ. Chemical composition of gases surgeons are exposed to during endoscopic urological resections. Urology 2009;74:1152–4.
- 14
- Meade TW, Mellows S, Brozovic M ym. Haemostatic function and ischaemic heart disease: principal results of the Northwick Park Heart Study. Lancet 1986;2:533–7.
- 15
- Ishii H, Hayashi S, Hogg JC ym. Alveolar macrophageepithelial cell interaction following exposure to atmospheric particles induces the release of mediators involved in monocyte mobilization and recruitment. Respir Res 2005;6:87.
- 16
- Saber AT, Jacobsen NR, Jackson P ym. Particle induced pulmonary acute phase response may be the causal link between particle inhalation and cardiovascular disease. Wiley Interdiscip Rev Nanomed Nanobiotechnol 2014;6:517–31.
- 17
- Gatti JE, Bryant CJ, Noone RB, Murphy JB. The mutagenicity of electrocautery smoke. Plast Reconstr Surg 1992;89:781–4; discussion 785–6.
- 18
- Wu YC, Tang CS, Huang HY ym. Chemical production in electrocautery smoke by a novel predictive model. Eur Surg Res 2011;46:102–7.
- 19
- Karjalainen M, Kontunen A, Saari S ym. The characterization of surgical smoke from various tissues and its implications for occupational safety. PLoS One 2018;13(4):e0195274.
- 20
- Nicola JH, Nicola EM, Vieira R, Braile DM, Tanabe MM, Baldin DH. Speed of particles ejected from animal skin by CO2 laser pulses, measured by laser Doppler velocimetry. Phys Med Biol 2002;47:847–56.
- 21
- Sood AK, Bahrani-Mostafavi Z, Stoerker J, Stone IK. Human papillomavirus DNA in LEEP Plume. Infect Dis Obstet Gynecol 1994;2:167–70.
- 22
- Alp E, Bijl D, Bleichrodt RP, Hansson B, Voss A. Surgical smoke and infection control. J Hosp Infect 2006;62:1–5.
- 23
- Okoshi K, Kobayashi K, Kinoshita K, Tomizawa Y, Hasegawa S, Sakai Y. Health risks associated with exposure to surgical smoke for surgeons and operation room personnel. Surg Today 2015;45:957–65.
- 24
- Lindsey C, Hutchinson M, Mellor G. The nature and hazards of diathermy plumes: a review. AORN J 2015;101:428–42.
- 25
- Gates MA, Feskanich D, Speizer FE, Hankinson SE. Operating room nursing and lung cancer risk in a cohort of female registered nurses. Scand J Work Environ Health 2007;33:140–7.
- 26
- Ball K. Compliance with surgical smoke evacuation guidelines: implications for practice. AORN J 2010;92:142–9.
- 27
- Heinsohn P, Jewett DL. Exposure to blood-containing aerosols in the operating room: a preliminary study. Am Ind Hyg Assoc J 1993;54:446–53.
- 28
- Andreasson SN, Anundi H, Sahlberg B ym. Peritonectomy with high voltage electrocautery generates higher levels of ultrafine smoke particles. Eur J Surg Oncol 2009;35:780–4.
- 29
- Tomita Y, Mihashi S, Nagata K ym. Mutagenicity of smoke condensates induced by CO2-laser irradiation and electrocauterization. Mutat Res 1981;89:145–9.
- 30
- Brüske-Hohlfeld I, Preissler G, Jauch KW ym. Surgical smoke and ultrafine particles. Occup Med Toxicol 2008;3:31.
- 31
- Peters A, Wichmann HE, Tuch T, Heinrich J, Heyder J. Respiratory effects are associated with the number of ultrafine particles. Am J Respir Crit Care Med 1997;155:1376–83.
- 32
- Oberdörster G , Oberdörster E, Oberdörster J. Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles. Environ Health Perspect 2005;113:823–39.
- 33
- Daigle CC, Chalupa DC, Gibb FR ym. Ultrafine particle deposition in humans during rest and exercise. Inhal Toxicol 2003;15:539–52.
- 34
- Chalupa DC, Morrow PE, Oberdörster G, Utell MJ, Frampton MW. Ultrafine particle deposition in subjects with asthma. Environ Health Perspect 2004;112: 879–82.
- 35
- Ragde FS, Jorgensen BR, Foreland S. Characterisation of exposure to ultrafine particles from surgical smoke by use of a fast mobility particle sizer. Ann Occup Hyg 2016;60:860–74.
- 36
- Sjaastad AK, Jørgensen RB, Svendsen K. Exposure to polycyclic aromatic hydrocarbons (PAHs), mutagenic aldehydes and particulate matter during pan frying of beefsteak. Occup Environ Med 2010;67:228–32.
- 37
- Brand P, Lenz K, Reisgen U, Kraus T. Number size distribution of fine and ultrafine fume particles from various welding processes. Ann Occup Hyg 2013;57:305–13.
- 38
- Elihn K, Ulvestad B, Hetland S, Wallen A, Randem BG. Exposure to ultrafine particles in asphalt work. J Occup Environ Hyg 2008;5:771–9.
- 39
- Elihn K, Berg P. Ultrafine particle characteristics in seven industrial plants. Ann Occup Hyg 2009;53:475–84.
- 40
- Sawchuk WS, Weber PJ, Lowy DR, Dzubow LM. Infectious papillomavirus in the vapor of warts treated with carbon dioxide laser or electrocoagulation: detection and protection. J Am Acad Dermatol. 1989;21:41–9.
- 41
- Johnson GK, Robinson WS. Human immunodeficiency virus-1 (HIV-1) in the vapors of surgical power instruments. J Med Virol 1991;33:47–50.
- 42
- Champault G, Taffinder N, Ziol M, Riskalla H, Catheline JM. Cells are present in the smoke created during laparoscopic surgery. Br J Surg 1997;84:993–5.
- 43
- Fletcher JN, Mew D, DesCôteaux JG. Dissemination of melanoma cells within electrocautery plume. Am J Surg 1999;178:57–9.
- 44
- Bree K, Barnhill S, Rundell W. The dangers of electrosurgical smoke to operating room personnel: A review. Workplace Health Saf 2017;65:517–26.
- 45
- Schultz L. Can efficient smoke evacuation limit aerosolization of bacteria? AORN Journal 2015;102:7–14
- 46
- Hallmo P, Naess O. Laryngeal papillomatosis with human papillomavirus DNA contracted by a laser surgeon. Eur Arch Otorhinolaryngol 1991;248:425–7.
- 47
- Ferenczy A, Bergeron C, Richart RM. Human papillomavirus DNA in CO2 laser-generated plume of smoke and its consequences to the surgeon. Obstet Gynecol 1990;75:114–8.
- 48
- Krones CJ, Conze J, Hoelzl E ym. Chemical composition of surgical smoke produced by electrocautery, harmonic scalpel and argon beaming - a short study. Eur Surg 2007;39:118–21.
- 49
- Moot AR, Ledingham KM, Wilson PF ym. Composition of volatile organic compounds in diathermy plume as detected by selected ion flow tube mass spectrometry. ANZ J Surg 2007;77:20–3.
- 50
- Sagar PM, Meagher A, Sobczak S, Wolff WG. Chemical composition and potential hazards of electrocautery smoke. Br J Surg 1996;83:1792.
- 51
- National Institute for Occupational Safety and Health (NIOSH), 1996. Control of smoke from laser/electric surgical procedures. NIOSH Pub. No. 96-128. http://www.cdc.gov/niosh/docs/hazardcontrol/hc11.html.
- 52
- American National Standard Institute (ANSI): American national standard for safe use of lasers in health care facilities. 2005 ANSI Z136.3-2005. http://webstore.ansi.org/RecordDetail.aspx?sku=ANSI+Z136.3-2011.
- 53
- Novak DA, Benson SM. Understanding and controlling the hazards of surgical smoke. Prev Infect Ambul Care 2010;1:3–5.
- 54
- Edwards BE, Reiman RE. Comparison of current and past surgical smoke control practices. AORN J 2012;95:337–50.
- 55
- Association of periOperative Registered Nurses (AORN). Recommended practices for laser safety in perioperative practice settings. Kirjassa: Standards, recommended practices, and guidelines. Denver, CO: AORN, Inc. 2014:141–54.
- 56
- Association of periOperative Registered Nurses (AORN) 2014. Recommended practices for electrosurgery. Kirjassa: Ramona Connor, toim. Perioperative standards and recommended practices. Denver, CO: AORN, Inc. 2014:123–39.
- 57
- Association of Surgical Technologists (AST), 2012. AST Standards of Practice for use of electrosurgery. http://www.ast.org/uploadedFiles/Main_Site/Content/About_Us/Standard%20Electrosurgery.pdf.
- 58
- Occupational Safety and Health Administration (OSHA), 2015. Laser/electrosurgery plume. https://www.osha.gov/SLTC/etools/hospital/surgical/surgical.html
- 59
- Emergency Care Research Institute (ECRI), 2007. Laser use and safety. Kirjassa: Healthcare risk control. Vol. 1. Plymouth Meeting, PA: ECRI, November 2007.
- 60
- Ministry of Health, New South Wales, Australia, 2015. Government Guideline GL 2015-002. Work health and safety — Controlling exposure to surgical plume. https://www1.health.nsw.gov.au/pds/ActivePDSDocuments/GL2015_002.pdf
- 61
- Canadian Centre for Occupational Health and Safety, 2014. Laser plumes — Health care facilities. http://www.ccohs.ca/oshanswers/phys_agents/laser_plume.html.
- 62
- Lee T, Soo JC, LeBouf RF ym. Surgical smoke control with local exhaust ventilation: Experimental study. J Occup Environ Hyg 2018;15:341–50.
- 63
- Chen CC, Willeke K. Aerosol penetration through surgical masks. Am J Infect Control 1992;20:177–84.
- 64
- Smith JD, MacDougall CC, Johnstone J, Copes RA, Schwartz B, Garber GE. Effectiveness of N95 respirators versus surgical masks in protecting health care workers from acute respiratory infection: a systematic review and meta-analysis. CMAJ 2016;188: 567–74.
- 65
- Sanderson C. Surgical smoke. J Perioper Pract 2012;22:122–8.
Surgical smoke during operations – the risks to personnel, and the protective measures needed
In this article, we review the evidence on potential hazards of surgical smoke. The purpose is to review the literature and summarize current recommendations for protection against hazards of surgical plume. Operating room personnel are exposed to various hazardous substances and radiation in their work, and the cumulative exposure may lead to increased risk of adverse health events. Due to the possible occupational health and safety risk there is a growing interest in identifying the composition of surgical smoke and the necessary protective measures.
Surgical smoke is formed when electrosurgical instruments are used in cutting and coagulating. The composition and the amount of surgical smoke produced vary. The factors influencing the formation of surgical plume include the type of surgery, the target tissue and its pathology, the type of instrument used and the amount of cutting and coagulating performed. Surgical smoke is composed of gases and vapours, as well as particles of biological origin, including potentially viable pathogens. In addition, surgical smoke contains ultrafine particles which may deposit in the respiratory tract. Although there is currently no evidence that exposure to surgical smoke causes increased morbidity and mortality, attention to potential hazards of surgical smoke is warranted. General room ventilation and the use of room suction units, primarily designed for capture of liquids, are not sufficient alone to control more substantial exposure to hazards of surgical smoke. The most effective way to control exposure to surgical smoke is to remove smoke at the surgical site using local exhaust ventilation (LEV). Personal filtration masks, such as surgical masks and high filtration masks, are efficient and their use alongside LEV systems is recommended. Petteri LankinenM.D., Specialist in Orthopaedics and Traumatology
Turku University Hospital, Operational Division of Diseases of the Musculoskeletal System
Hospital District of Southwest Finland, Administrative Centre, Development Services
Anna-Kaisa ParkkilaRisto P. Roine
Miia Turpeinen