Milloin rintasyövän immunologisesta hoidosta on hyötyä?
Immuunipuolustusta aktivoivat PD-1- ja PD-L1-vasta-aineet on otettu menestyksekkäästi käyttöön useiden levinneiden syöpien hoitomuotona.
Rintasyöpien hoitotulokset immunologisilla vasta-aineilla ovat olleet vaatimattomampia.
Kaksi immunologisen järjestelmän kiihdyttämiseen perustuvaa vasta-ainetta on saanut käyttöaiheen Suomessa immunogeenisyydeltään voimakkaimman levinneen rintasyövän alaryhmän hoidossa yhdessä solunsalpaajan kanssa.
Käyttöaiheen on saanut myös immunologinen hoito rintasyöpäkasvaimen pienentämiseen tarkoitetussa neoadjuvanttihoidossa.
Huomioiden immunologisen hoidon haitat ja kustannukset sekä kohtalaisen vaatimattomat hoitotulokset, parempia hoidon tehoa ennustavia tekijöitä kaivattaisiin.

Rintasyöpä on edelleen ylivoimaisesti yleisin naisten syöpä, ja Suomessa todetaan vuosittain yli 5 000 uutta tapausta (1). Ennuste on Suomessa huipputasoa sekä maailmanlaajuisessa että pohjoismaisessa vertailussa. Hyvään hoitotulokseen ovat olleet merkittävästi vaikuttamassa toimivat diagnostiikka- ja hoitoketjut sekä moniammatillisuus.
Tähän saakka rintasyövän lääkkeellisinä hoitoina ovat olleet pääasiassa solunsalpaajat, hormonaaliset hoidot, HER2 (human epidermal growth factor receptor 2) -kohdennetut hoidot ja uudet sykliiniriippuvaisten kinaasien estäjät. Kuitenkin yli 800 rintasyöpäpotilasta menehtyy vuosittain syöpäänsä, ja uusia tehokkaita lääkkeitä rintasyövän liitännäishoitoon ja levinneen syövän hoitoon tarvitaan edelleen. Immunologiset hoidot ovat useiden syöpien kohdalla tehneet merkittävän läpimurron erityisesti levinneen taudin hoidossa – harvemmissa syövissä myös varhaisvaiheen hoidossa.
Rintasyöpä on hyvin heterogeeninen sairaus. Molekulaarisella tasolla rintasyöpä voidaan jakaa karkeasti viiteen eri alaryhmään: luminaalinen A, luminaalinen B (HER2-negatiivinen), luminaalinen B (HER2-positiivinen), HER2-positiivinen (hormonireseptorinegatiivinen) ja kolmoisnegatiivinen (HER2-negatiivinen, hormonireseptorinegatiivinen) (2). Luminaaliset kasvaimet ovat aina hormonireseptoripositiivisia. Alatyyppeihin liittyy erilaisia kasvaimen immuuniprofiileja: eroja voi olla kasvaimen mikroympäristön lymfosyyteissä (TIL-solut), immuunivastetta heikentävässä PD-L1 (programmed cell death ligand 1) -tuotannossa, kasvaimeen liittyvissä antigeeneissä ja kasvaimen mutaatiotaakassa. Yleisesti rintasyöpä tulee taudin edetessä ja levitessä vähemmän immunogeeniseksi verrattuna alkuperäiseen kasvaimeen (3). Tämä on osaltaan hidastanut immunologisten hoitojen käyttöönottoa rintasyövässä, koska perinteisesti kliininen lääkekehitys aloitetaan muille hoidoille resistenteistä potilaista.
Immunologisen hoidon taustaa
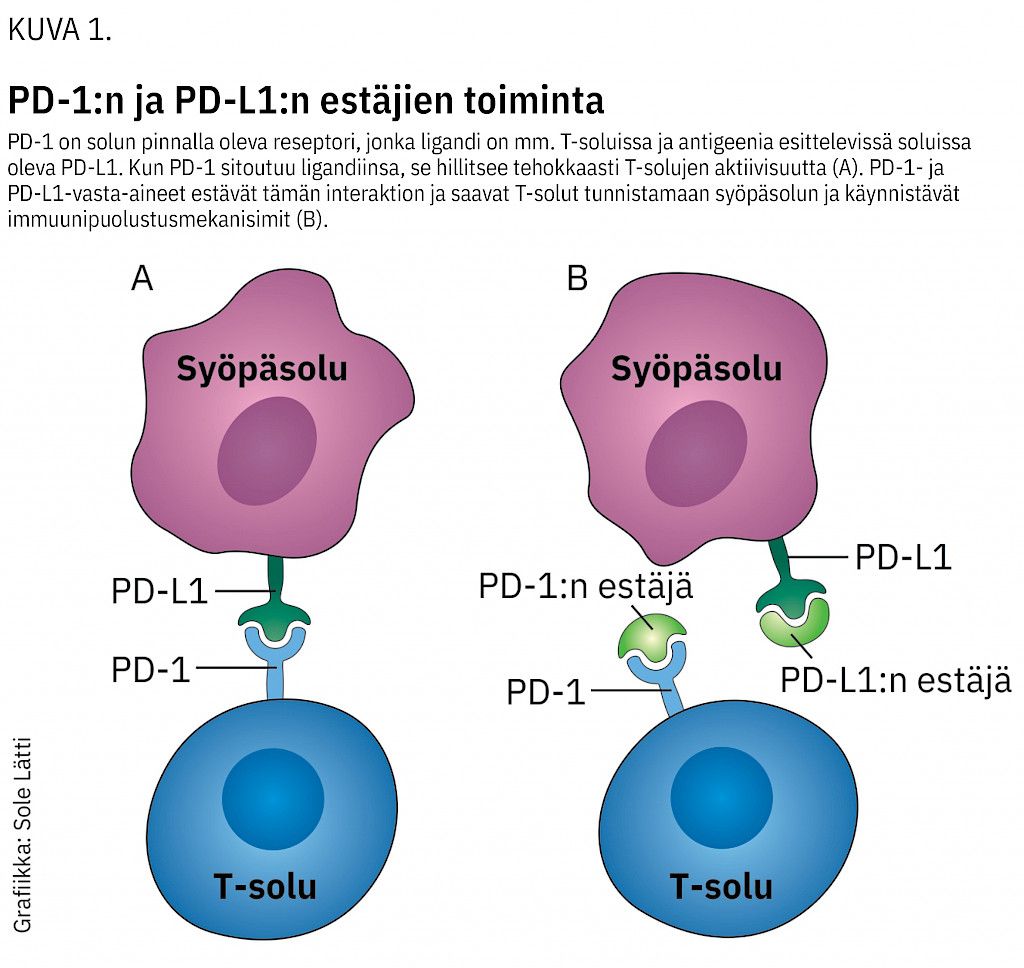
Syöpäsolujen ja immuunipuolustusjärjestelmän vuorovaikutus on monimutkainen. Osa syöpäpotilaista saa erittäin pitkäkestoisia vasteita immunologiseen hoitoon, kun taas osa ei hyödy hoidoista lainkaan. Toistaiseksi lähinnä PD-L1-proteiinin runsaan ilmentymisen on osoitettu yhdistyvän parempaan vasteeseen (kuva 1). Ongelmia esiintyy kuitenkin kyseisen merkkiaineen immunohistokemiallisten määritysten kanssa, sillä niissä käytetään erilaisia vasta-aineita ja arvioinnin katkaisuarvoja. Lisäksi PD-L1:n ilmentymistä voidaan arvioida sekä syöpä- että immuunisoluista. Suurin osa rintasyövistä on PD-L1-negatiivisia, ja PD-L1-ilmentymä on vahvasti riippuvainen siitä, mitataanko sitä esimerkiksi primaarikasvaimesta vai maksan tai imusolmukkeen etäpesäkkeestä (4).
Haasteista huolimatta PD-L1-ilmentymä on rintasyövissä kuitenkin tullut käyttöön ensivaiheen levinneen kolmoisnegatiivisen rintasyövän hoitoa valittaessa (5). Runsas TIL-solujen määrä on yhdistetty parempaan rintasyövän ennusteeseen ja solunsalpaajahoidon vasteeseen HER-2 positiivisessa ja kolmoisnegatiivisessa rintasyövässä (6).
Hormonireseptoripositiivisissa rintasyövissä on vain vähän TIL-soluja, ja näissä syövissä tilanne on epäselvempi (7). TIL-solujen käyttö merkkiaineena tässä kasvaintyypissä on epäselvää ja kliinisessä työssä se ei vielä ole merkittävää.
Useissa prekliinisissä tutkimuksissa eri solunsalpaajilla on todettu olevan immunogeenisyyttä lisäävä vaikutus siten, että ne joko estävät immunosuppressiivisia soluja ja/tai aktivoivat vastaanottajasoluja tai lisäävät T-solujen invaasiota ja siten immunogeenisyyttä (8). Sädehoidon tiedetään myös stimuloivan T-solujen vastetta. Parhaillaan on menossa useita tutkimuksia immunologisen hoidon ja sädehoidon yhdistelmähoidosta erilaisissa rintasyövän alatyypeissä (9).
Hoidot käytännössä
Tällä hetkellä käytetyimpiä immunologisia hoitoja ovat PD-1:n (programmed cell death 1) ja PD-L1:n estäjät, joista eniten käyttöaiheita on atetsolitsumabilla, nivolumabilla ja pembrolitsumabilla. Näiden hoitojen käyttö on laajinta melanoomien lisäksi levinneissä ei-pienisoluisissa keuhkosyövissä ja munuaissyövissä. Jossain määrin immunologisia hoitoja ollaan ottamassa käyttöön myös parantavalla tarkoituksella tehdyn leikkauksen jälkeen tai sädehoidon jälkeisenä liitännäishoitona.
Kliininen tutkimusnäyttö neoadjuvanttihoidossa
Rintasyövän alatyypeistä eniten immunologisia hoitoja on tutkittu kolmoisnegatiivisessa rintasyövässä, sekä neoadjuvanttihoitona että levinneen syövän yhteydessä (taulukko 1). Tämän syövän alatyypin tiedetään olevan immunologisesti aktiivinen johtuen suuresta PD-L1-tuotannosta, genomin epästabiiliudesta ja runsaasta mutaatioiden määrästä. IMpassion 031-tutkimuksessa tutkittiin immuunipuolustusta aktivoivan PD-L1-vasta-aine atetsolitsumabin ja solunsalpaaja nab-paklitakselin yhdistelmää neoadjuvanttihoidossa. Täydellinen patologinen vaste todettiin 58 %:lla myös atetsolitsumabia saaneista potilaista ja 41 %:lla pelkkää solunsalpaajahoitoa saaneista potilaista. Hieman erikoisesti PD-L1-positiivisuus ei vaikuttanut tuloksiin (11).
Myös toista hyvin samankaltaisella tavalla immuunijärjestelmää aktivoivaa lääkettä, PD-1:n estäjä pembrolitsumabia, on tutkittu rintasyövän neoadjuvanttihoitona. Kuten atetsolitsumabi, myös pembrolitsumabi lisäsi solunsalpaajaan liitettynä kolmoisnegatiivisten rintasyöpäpotilaiden neoadjuvanttihoidossa täydellisten hoitovasteiden määrää ja vähensi lisäksi syövän uusiutumia (13). Pembrolitsumabi on hiljattain saanut käyttöaiheen rintasyövän neoadjuvanttihoidossa tavanomaisen solunsalpaajahoidon lisänä. On huomattava, että mainituissa neoadjuvanttihoitotutkimuksissa merkittävä osa kasvaimista on ollut varsin pieniä ja paikallisia.
Tällaisten hyväennusteisten syöpien hoitovaste on hyvä myös perinteisillä platinapohjaisilla solunsalpaajahoidoilla, ja on oleellista pohtia tarkoin, missä potilasryhmissä lisähoidon aiheuttamat mahdolliset haitat ylittävät sen potentiaaliset hyödyt. Lisäksi on huomattava, että pembolitsumabia jatkettiin mainitussa neoadjuvanttitutkimuksessa vielä puolen vuoden ajan leikkaushoidon jälkeen, eikä voida olla varmoja, olisiko samaan tulokseen päästy ilman tätä kallista ja mahdollisesti toksista liitännäishoitovaihetta.
Kliininen tutkimusnäyttö levinneessä rintasyövässä
Levinneen rintasyövän hoitokäytäntöihin on Suomessakin vaikuttanut IMpassion130-tutkimus. Siinä nab-paklitakseli yhdistettiin atetsolitsumabiin kolmoisnegatiivisten rintasyöpäpotilaiden levinneen syövän ensilinjan hoidossa ja tätä yhdistelmää verrattiin pelkkään nab-paklitakselihoitoon. Taudin etenemättömyysaika koko tutkitussa joukossa oli atetsolitsumabia saaneilla 7,2 kk ja vertailuryhmässä 5,5 kk (riskisuhde 0,80; 95 %:n luottamusväli (LV) 0,69–0,92). Vastaavasti PD-L1-positiivisessa potilasryhmässä etenemättömyysaika oli 7,5 kk / 5 kk (riskisuhde 0,62; 95 %:n LV 0,49–0,78) (5). Kliinisesti merkittävä 7,5 kuukauden hyöty kokonaiselossaolossa saavutettiin PD-L1-positiivisilla potilailla, jotka saivat atetsolitsumabia (HR 0,67; 95 %:n LV 0,53–0,86). Kokonaiselossaoloajan piteneminen ei kuitenkaan ollut käytettyjen tilastollisten menetelmien mukaan merkitsevä.
Tämä lääkeyhdistelmä on saanut käyttöaiheen ja myös käyttöluvan Suomessa kolmoisnegatiivisen rintasyövän ensilinjan hoitoon levinneessä PD-L1-positiivisessa rintasyövässä. Kun atetsolitsumabi yhdistettiin vastaavassa asetelmassa enemmän kliinisessä käytössä olevaan solunsalpaajaan, paklitakseliin, vastaavaa hyötyä ei saatu. Syy tähän on avoin (10).
Myös pembrolitsumabi on saanut Euroopassa myyntiluvan levinneen kolmoisnegatiivisen rintasyövän hoitoon. Tämän käyttöaiheen taustalla on tutkimus, jossa pembrolitsumabin yhdistäminen solunsalpaajahoitoon (taksaani tai gemsitabiini-karboplatiini) ensilinjan hoidossa paikallisesti levinneessä tai etäpesäkkeisessä kolmoisnegatiivisessa syövässä pidensi PD-L1-positiivisilla potilailla taudin etenemättömyysaikaa neljällä kuukaudella verrattuna pelkkää solunsalpaajaa saaneisiin (12). Julkaistujen tutkimusten tulokset pääsääntöisesti vahvistavat hypoteesia, että rintasyövän mikroympäristö on vastaanottavaisimmillaan immunologisille hoidoille syövän varhaisessa vaiheessa.
Hormonireseptoripositiivisen rintasyövän on ajateltu olevan immunologisesti ”kylmä syöpä”, jossa TIL-solujen määrä sekä PD-L1-tuotanto ovat vähäisiä. Hormonireseptoripositiiviset rintasyövät ovat kuitenkin immunologialtaankin hyvin heterogeeninen tautiryhmä (14,15). Usein voimakkaasti hormonireseptoripositiiviset rintasyövät reagoivat huonosti solunsalpaajiin, ja jäännöstaudin osuus neoadjuvanttihoidon jälkeen on suuri (16). Immunologiset hoidot eivät ole vielä vakiinnuttaneet asemaa tässä alaryhmässä sen paremmin neoadjuvanttihoidossa kuin levinneen rintasyövän hoidossa.
Haittavaikutukset
Immunologiset hoidot ovat yleisesti ottaen paremmin siedettyjä verrattuna esimerkiksi solunsalpaajiin, ja akuutit haitat ovat harvinaisia. PD-1:n ja PD-L1:n estäjähoitoihin liittyy kuitenkin 5–10 %:lla potilaista hyvinkin vakavia autoimmuunipohjaisia haittavaikutuksia, jotka voivat ilmaantua jopa vasta kuukausia hoidon päättymisen jälkeen. Autoimmuunireaktiot voivat ilmetä missä tahansa elimessä, mutta tavallisimpia ovat dermatiitti, koliitti ja pneumoniitti.
Erityisesti varhaisvaiheen hoidoissa immunologisilla lääkkeillä on muistettava immunologisten hoitojen aiheuttamat pitkäaikaisetkin haittavaikutukset, kuten kilpirauhasen vajaa- tai liikatoiminta, tyypin 1 diabetes, lisämunuaisen vajaatoiminta ja aivolisäkkeen tulehdus (17).
Vakavien autoimmuunireaktioiden pitäminen mielessä on oleellisen tärkeää, kun immunologisia hoitoja saavat tai vasta saaneet potilaat hakeutuvat vastaanotolle epäselvien oireiden vuoksi. Autoimmuunireaktioiden ensisijaisena hoitona on yleensä suuriannoksinen kortisonihoito usean viikon ajan. Väheksyä ei myöskään sovi immunologisten hoitojen aiheuttamaa taloudellista kuormitusta.
Lopuksi
Immunologisten hoitojen läpimurto ei rintasyövän yhteydessä ole ollut niin vaikuttava kuin esimerkiksi melanoomissa, munuaissyövässä ja ei-pienisoluisissa keuhkosyövissä. Immunoterapian vasteeseen näyttävät jonkin verran vaikuttavan PD-L1-status, syövän mutaatiotaakka ja TIL-solujen määrä, mutta vain harvoissa tilanteissa on käytettävissä selkeitä biomerkkiaineita, jotka ennustaisivat immunologisen lääkkeen tehoa.
Rintasyöpä on pääsääntöisesti immunologisesti kuumempi ja vastaanottavaisempi immunologisille hoidoille taudin varhaisemmassa vaiheessa ja erityisesti kolmoisnegatiivisessa syövän alatyypissä. Atetsolitsumabi ja pembrolitsumabi yhdistettyinä tiettyihin solunsalpaajiin ovat saaneet Suomessa käyttöaiheen levinneen kolmoisnegatiivisen rintasyövän ensilinjan hoidossa PD-L1-positiivisilla potilailla.
Levinnyttä kolmoisnegatiivista rintasyöpää sairastavien potilaiden hoitovaihtoehdot ovat vähissä, ja uudet elinaikaa pidentävät hoidot ovat tervetulleita. Nämä potilaat ovat lisäksi keskimäärin nuorempia kuin muiden rintasyöpätyyppien potilaat. Pembrolitsumabia voidaan käyttää kolmoisnegatiivisissa rintasyövissä tavallisen neoadjuvanttihoidon lisänä, mutta tästä ajoittain hyvinkin toksisesta lisähoidosta eniten hyötyviä potilaita ei vielä osata tunnistaa etukäteen. Tuloksia muista immunologisista lääkkeistä vielä odotetaan.
Suurin osa rintasyöpäpotilaista paranee nykyisillä hoidoilla. Uudet hoidot ovat tuoneet merkittävää parannusta levinneenkin syövän ennusteeseen. Immunologisten hoitojen lopullinen merkitys rintasyövän hoidossa jää edelleen auki ja niiden kliininen käyttö on Suomessa vielä vähäistä. Immunologiset lääkkeet ovat kalliita, mutta toisaalta vasteet ovat olleet osalla potilaista hyvinkin pitkiä syöpätyypeissä, joista pitkäaikaisseurantaa on aiemmin raportoitu.
Useita tutkimuksia on menossa immunologisista ja muista rintasyövän hoidossa käytetyistä biologisista ja vasta-ainehoidoista. Vastattavia kysymyksiä on vielä paljon: kuka hyötyy immunologisista hoidoista eniten, onko löydettävissä parempia biomerkkiaineita hyvän hoitovasteen saajille tai immunologiselle toksisuudelle, mikä on oikea annostelu tai hoidon kesto tai voisivatko yhteishoidot solunsalpaajan tai sädehoidon kanssa herkistää rintasyöpiä immunologisille hoidoille.
Arja Jukkola: Ei sidonnaisuuksia.
Peeter Karihtala: Asiantuntijalausunto (AstraZeneca), luentopalkkiot (Novartis, Lilly, Sandoz), advisory board (Gilead, Roche, Pfizer, Lilly, Sandoz, Novartis, Pierre-Fabre), tutkijana yrityslähtöisessä tutkimuksessa (Lilly, Roche, Sanofi, Faron).
- 1
- Suomen Syöpärekisteri, Syöpätilastosovellus. (siteerattu 29.3.2022). www.syoparekisteri.fi/tilastot/tautitilastot
- 2
- Senkus E, Kyriakides S, Ohno S ym. ESMO Guidelines Committee. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015;26(suppl 5):v8–30.
- 3
- Szekely B, Bossuyt V, Lix ym. Immunological differences between primary and metastatic breast cancer. Ann Oncol 2019;30:219–35.
- 4
- Sobral-Leite M, van de Vijver K ym. Assesment of PD-L1 expression across breast cancer molecular subtypes, in relation to mutation rate, BRCA 1-like status, tumor-infiltrating immune cells and survival. Oncoimmunology 2018;7:e1509820.
- 5
- Emens LA, Adams S, Barrios CH ym. First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol 2021;32:983–93.
- 6
- Franzol MA, Romano E, Piccart M. immunotherapy for early breast cancer: too soon, too superspeficial, or just right? Ann Oncol 2021;32:323–35.
- 7
- Denkert C, von Minckwitz G, Darb-Esfahani S ym. Tumor-infiltrating lymphocytes and prognosis in different subtypes of breast cancer: a pooled analysis of 3771 patients treated with neoadjuvant therapy. Lancet Oncol 2018;19:40–50.
- 8
- Galluzzi L, Buque A, Kepp O ym. Immunological effects of conventional chemotherapy and targeted anticancer agents. Cancer Cell 2015;28:690–714.
- 9
- Ye JC, Formenti SC. Integration of radiation and immunotherapy in breast cancer; treatment implications. Breast 2018:38;66–74.
- 10
- Miles D, Gligorov J, André F ym. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. IMpassion131 investigators. Ann Oncol 2021;32:994–1004.
- 11
- Mittendorf EA, Zhang H,Barrios CH ym. Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (Impassion031). A randomized, double-blind, phase 3 trial. Lancet 2020;396:1090–100.
- 12
- Cortes J, Cescon DW, Rugo HS ym. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020;396:1817–28.
- 13
- Schmid P, Cortes J, Dent R JF ym. Event-free survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med 2022;386:556–67.
- 14
- Haricharan S,Bainbridge MN, Scheet P ym. Somatic mutation load of estrogen receptor-positive breast tumors predicts overall survival: an analysis of genome sequence data. Breast Cancer Res Treat 2014;146:211–20.
- 15
- Waks AG, Stover DG, Guierriero JL ym. The immune microenvironmet in hormone receptor-positive breast cancer before and after preoperative chemotherapy. Clin Cancer Res 2019;25:4644.
- 16
- Postow MA, Sidlow R, Hellman MD. Immune-related adverse events associated with immune checkpoint blockade. N Eng J Med 2018;378:158–68.
Immunological treatments in breast cancer
Breast cancer is a highly heterogeneous disease, also from the immunological perspective. Compared to other cancer types, the treatment results with immuno-oncological drugs have so far been rather modest in breast cancer. Currently, atezolizumab and pembrolizumab have been approved for the neoadjuvant or first-line treatment of metastatic triple-negative breast cancer in Finland. The mechanism of action of both drugs is based on targeting PD-1-PD-L1 interaction between tumour cells and lymphocytes, leading to enhancement of the host immune system. Since immunological drugs can sometimes cause severe long-term adverse events and are also costly, more accurate predictive factors to identify the patients who will benefit most from these drugs are desperately needed.
Arja Jukkola, Peeter Karihtala
Arja Jukkola
Professor of Oncology, Chief Physician
Tampere University Hospital and Tampere University
Peeter Karihtala
Professor of Oncology, Research Director
HUS Comprehensive Cancer Center and University of Helsinki