Munasarjojen toiminnan ennenaikainen hiipuminen
• Yhdellä sadasta alle 40-vuotiaasta naisesta munasarjatoiminta hiipuu ennenaikaisesti. Syy voi olla geneettinen, autoimmuuniprosessiin liittyvä tai iatrogeeninen, mutta useimmiten etiologia jää tuntemattomaksi.
• Munasarjojen toiminnan ennenaikainen hiipuminen altistaa luun haurastumiselle, sydän- ja verisuoni-taudeille sekä kognition huononemiselle.
• Hoidoksi suositellaan hormonikorvaushoitoa luonnolliseen vaihdevuosi-ikään asti ja seurantaa yksikössä, jossa on riittävä asiantuntemus.
• Munasarjojen toiminnan ennenaikaisen hiipumisen aiheuttaman lapsettomuuden hoitomuodoksi jää usein koeputkihedelmöitys luovutetuilla munasoluilla.

Munasarjat ovat munasolujen varasto, jonka pieneneminen alkaa jo ennen syntymää. Munasoluja arvioidaan olevan syntymän aikaan noin 700 000 (1) ja menopaussin aikaan jäljellä on vielä noin tuhat (2). Mikäli alkumunarakkuloita on alkujaan niukalti tai niiden hävikki on kiihtynyt ulkoisista tai sisäisistä syistä tai mikäli munasolujen kypsymisen mekanismit ovat puutteelliset, munasarjojen toiminta sammuu liian varhain.
Munasarjojen toiminnan ennenaikainen hiipuminen (premature ovarian insufficiency, POI) on tila, jossa kuukautiset loppuvat kokonaan tai yli 4 kuukaudeksi alle 40 vuoden iässä, estrogeenipitoisuus on pieni ja follikkelia stimuloivan hormonin (FSH) pitoisuus on postmenopausaalisella tasolla (yli 25 U/l) vähintään kuukauden välein toistetuissa mittauksissa (3). Alle 40-vuotiailla sen esiintyvyys on 1/100, alle 30-vuotiailla 1/1 000 ja alle 20-vuotiailla 1/10 000.
Tilaan liittyvä estrogeenivaje aiheuttaa emättimen limakalvojen kuivuutta, yhdyntäkipuja ja vasomotorisia oireita (yöhikoilut, kuumat aallot) sekä altistaa jo varhain osteoporoosille ja sydän- ja verisuonisairauksille, joiden vuoksi eliniän ennuste on lyhentynyt, jos hormonihoitoa ei ole käytössä (4,5).
Seksuaalihäiriöt ja hedelmättömyys ovat yleisiä (3,6). Hedelmällisyys heikkenee oleellisesti yli kymmenen vuotta ennen munasarjatoiminnan sammumista (7), mikä on merkittävää erityisesti nykyään, kun perheen perustamista lykätään yhä myöhempään ikään.
Estrogeenivaje, hedelmättömyys ja liian varhainen kokemus vanhenemiseen kuuluvasta ilmiöstä heikentävät elämänlaatua ja aiheuttavat usein ahdistusta ja masennusta (8).
Etiologia
POI:n tausta voi olla iatrogeeninen, autoimmuuniprosessiin liittyvä tai geneettinen (9,10). Suvuittaista esiintymistä on raportoitu 4–30 %:ssa tapauksista (5). Tapauksista jää selittämättömiksi jopa 65–90 %.
Yleisin geneettinen syy on Turnerin oireyhtymä, jossa kaikista tai osasta soluja puuttuu toinen X-kromosomi tai se on rakenteeltaan poikkeava. X-kromosomien ylimäärä (47,XXX), mosaikismit, deleetiot ja translokaatiot voivat myös häiritä munasarjojen toimintaa (11,12).
POI:hin liitetyistä lukuisista kandidaattigeeneistä (13) kliinisesti tärkein on FMR1-geenin premutaatio, jonka kantajista 16 %:lle kehityy POI. Premutaation pidentyminen yli 200 toistojaksoon aiheuttaa miehille kehitysvammaisuutta, särö-X-oireyhtymää. Premutaatio löytyy 13 %:lta familiaalisista POI-potilaista, sporadisista 0,8–7,5 %:lta, (9). Autosomisista geenivirheistä mm. suomalaiseen tautiperintöön kuuluvat FSH-reseptorigeenin (FSHR) mutaatio (14) ja APECED-oireyhtymään johtava AIRE-geenin mutaatio altistavat POI:lle.
Joka viidenneltä POI-potilaalta löytyy jo diagnoosivaiheessa jokin autoimmuunitauti (15). POI voi esiintyä osana laajempia polyendokrinopatioita (APECED-tyypit 1 ja 2), ja se kehittyy jopa 10–20 %:lle Addisonin tautia sairastavista potilaista (15). Lisämunuaisen autoimmuniteettiin liittyviä steroidisoluvasta-aineita löytyy 4–5 %:lta POI-potilaista (16). Nämä vasta-aineet tuhoavat munarakkuloiden teekasoluja, ja tämä johtaa estrogeeninpuutteeseen ja korkeaan FSH-tasoon, mutta Müllerin tiehyitä surkastuttavan peptidin (AMH) arvo pysyy pitkään normaalina.
POI näyttää assosioituvan myös sellaisiin autoimmuunisairauksiin, joissa steroidisoluvasta-aineita ei esiinny. POI:hin liitettyjä autoimmuunisairauksia ovat mm. tyypin 1 diabetes, myasthenia gravis ja kilpirauhassairaudet, Crohnin tauti, vitiligo, nivelreuma ja systeeminen lupus.
Iatrogeenisista syistä merkittävimpiä ovat munasarjoihin kohdistuneet leikkaukset ja sädehoito sekä syövän hoitoon käytetyt alkyloivat solunsalpaajat. Ennen syövän hoitoja nuorille potilaille tulee tarjota mahdollisuutta hedelmällisyysneuvontaan ja ennakoivaan munasolujen tai munasarjakudoksen pakastukseen, ja hoitojen päätyttyä on seurattava munasarjojen toimintaa. Erityisesti endometrioomien poisto pienentää munasarjan toimintakapasiteettia (17,18). Munasarjoja leikatessa tekniikan pitää aina olla atraumaattinen ja leikkauspäätöksen huolellisesti harkittu. Muissa lantion alueen leikkauksissa munasarjavaurion riski on pieni, mutta komplisoituneissa leikkauksissa se on mahdollinen verenkierron huonontumisen tai tulehdusreaktion pohjalta.
Virusinfektioiden jälkeisiä POI-tapauksia on kuvattu, mutta selvää kausaalista suhdetta ei kuitenkaan ole pystytty osoittamaan. Ympäristösaasteiden on todettu lisäävän munarakkuloiden atresiaa ja alkumunarakkuloiden siirtymistä kasvuvaiheeseen (19). Muoveissa esiintyvien ftalaattien metaboliitin monobutyyliftalaatin pitoisuuden seerumissa todettiin olevan POI-potilailla merkitsevästi suurempi kuin verrokeilla 60 potilaan tapaus-verrokkitutkimuksessa (20). Vaikka tupakoinnin ei ole todettu aiheuttavan munasarjojen ennenaikaista hiipumista, se aikaistaa vaihdevuosi-ikää 1–2 vuodella (21).
Kehittyminen
Mikäli munasarjan toiminta hiipuu jo lapsuudessa, puberteettikehitys voi jäädä kesken tai käynnistymättä, jolloin se pitää indusoida estrogeenihoidolla.
Puberteetin jälkeen kehittyvää munasarjojen vajaatoimintaa edeltää vuosien jakso, jolloin munasarjojen toiminta asteittain heikkenee. Kuukautiskierron lyheneminen 2–3 päivällä on usein ensimmäinen oire (22). Ajan myötä kierrot pitenevät ja muuttuvat epäsäännöllisemmiksi (23) ja vuodot niukentuvat. Vajaatoimintaa ennakoivia kiertohäiriöitä ei kuitenkaan välttämättä ole havaittavissa, mikäli kuukautisten poisjääntiä on edeltänyt yhdistelmäehkäisyn käyttö tai raskaus.
Kuukautiskiertojen väliaikaista palautumista on kuvattu jopa 24–50 %:lla POI-diagnoosin jälkeen (9,24). Osan selittää diagnoosin virheellisyys, mutta erityisesti taudin alkuvaiheessa munasarjojen aktiivisuus voi vaihdella.
Diagnostiikka
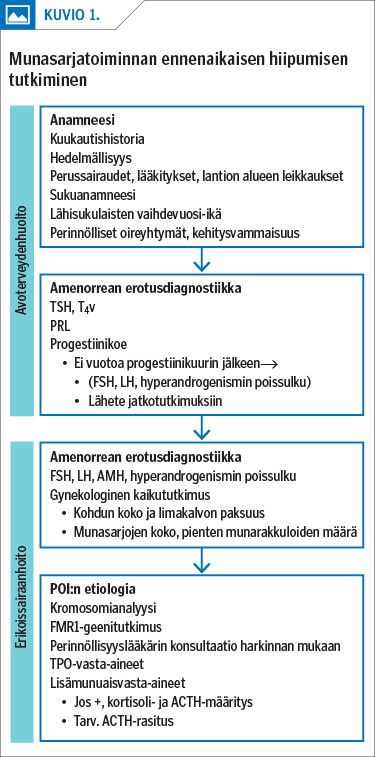
Kuukautisten loppuessa kartoitetaan huolellisesti potilaan gynekologinen ja obstetrinen historia, lantion alueen leikkaukset sekä yleissairaudet ja niiden hoidot. Sukuanamneesissa kiinnitetään huomio lähisukulaisten vaihdevuosi-ikään ja hedelmällisyysongelmiin sekä perinnöllisiin sairauksiin ja oireyhtymiin suvussa. Kliinisessä tutkimuksessa kiinnitetään huomiota hormonivaikutukseen emättimen limakalvoilla, viitteisiin autoimmuunisairauksista ja poikkeaviin piirteisiin, kuten lyhytkasvuisuuteen.
Kuukautisten jäädessä pois selvittelyt aloitetaan perusterveydenhuollossa sulkemalla pois raskauden mahdollisuus, tutkimalla kilpirauhastoiminta ja prolaktiiniarvot sekä testaamalla vaste keltarauhashormoniin. Mikäli vuotoa ei hormonikuurin jälkeen tule, määritetään gonadotropiinitasot. Mikäli FSH:n pitoisuus on suurentunut (yli 25 U/l), arvo kontrolloidaan aikaisintaan 4 viikon kuluttua, jolloin voidaan määrittää myös estradioli- ja AMH-pitoisuudet. Munasarjatoiminnan hiipuessa AMH:n tuotanto vähenee yleensä ennen FSH-tason nousua, mutta teekasoluihin kohdistuvan autoimmuuniprosessin aikana AMH-pitoisuus voi olla pitkään normaali (16).
Erikoissairaanhoidossa tehtävässä gynekologisessa kaikututkimuksessa nähdään tyypillisesti ohut kohdun limakalvo ja pienet munasarjat, joissa on niukalti pieniä antraalifollikkeleita. Normaali näkymä munasarjoissa ei kuitenkaan sulje pois POI:n mahdollisuutta, ja autoimmuuniperäisessä taudissa munasarjat voivat olla jopa suuret ja kystiset.
Etiologisiin tutkimuksiin kuuluvat kromosomianalyysi, FMR1-geenin tutkimus, autoimmuunitautien kartoitus ja harkinnan mukaan perinnöllisyyslääkärin konsultaatio. Autoimmuniteetin tutkimuksessa etsitään ensisijaisesti lisämunuais- ja tyreoideaperoksidaasivasta-aineita. Eri vasta-aineiden ennustemerkitys on pitkälti epäselvä, mutta noin puolelle potilaista, joilta löytyy lisämunuaisvasta-aineita, kehittyy myöhemmin Addisonin tauti (15). Siksi lisämunuaisten toimintaa tulee heiltä seurata määrittämällä ajoittain kortisoli- ja ACTH-pitoisuudet ja tekemällä tarvittaessa ACTH-rasitus (kuvio 1).
Hedelmällisyys
Vajaatoiminnan alkuvaiheessa munasarjojen aktiivisuus vaihtelee. Satunnaisia ovulaatioita tapahtuu ajoittain, ja spontaanit raskaudet ovat siksi mahdollisia, joskin harvinaisia. Raskauksia on raportoitu 5–10 %:lla potilaista (9,24), ja niitä voi alkaa myös hormonikorvaushoidon aikana. Raskautta toivottaessa hormonikorvausta ei tarvitse välttää, ja raskauden ehkäisystäkin on tarvittaessa huolehdittava.
Mikäli raskaus ei ala itsestään, omilla sukusoluilla tehdyt hedelmöityshoidot ovat yleensä tehottomia, sillä vaste hormonistimulaatioon jää niukaksi. Koeputkihedelmöitys luovutetuilla munasoluilla on ainoa tehokas hoitomuoto, ja se kuuluu nykyään myös julkisen terveydenhuollon palveluvalikoimaan. Ennen hoitoa on tärkeää huolehtia riittävästä hormonikorvaushoidosta, jotta kohtu tarjoaisi alkiolle optimaalisen kiinnittymisympäristön (25,26). Osa potilaista perustaa perheen adoption tai sijaisvanhemmuuden avulla.
Hedelmällisyyden menettäminen on kuormittava kokemus, johon tulee tarjota tukea. Keinoja munasarjatoiminnan säilyttämiseen tai sen palautumisen ennustamiseen ei tunneta (9).
Mikäli POI on ennakoitavissa, voidaan harkita munasolujen, alkioiden tai munasarjakudoksen ennakoivaa pakastamista. Kokemusta hiipuvan munasarjareservin vuoksi pakastettujen sukusolujen tai kudosten käytöstä lapsettomuushoidoissa on kuitenkin rajallisesti. Todennäköisesti toiminta on tuloksellisinta, kun uhkana on iatrogeeninen POI syövän hoidon tai munasarjoihin kohdistuvan kirurgian vuoksi, mutta mikäli sukusoluja säilyttävään toimenpiteeseen päästään vasta hedelmällisyyden merkittävästi heikennyttyä, voi stimulaatiolla saatava munasolumäärä jäädä niukaksi ja raskauden todennäköisyys näin ollen vähäiseksi.
Vaikutus terveyteen
Ennenaikaiseen estrogeenin puutokseen liittyy terveysriskejä, jotka yleistyvät tavallisesti vasta luonnollisen menopaussi-iän jälkeen (27). Potilaiden lipidiprofiili ja endoteelitoiminta on todettu huonommiksi kuin verrokeilla, ja sen vuoksi riski sairastua ja kuolla iskeemiseen sydänsairauteen on suurentunut ja eliniän ennuste lyhentynyt (4,5). Laskimotukosten riskin on esitetty myös lisääntyneen (28), mutta tästä tarvitaan vielä lisää tutkimuksia.
Verenkiertoelimistön riskitekijöitä tulisi seurata ja kannustaa potilaita terveellisiin elämäntapoihin. Liikunta, tupakoimattomuus ja monipuolinen ravinto ovat tärkeitä. Jos ruokavalio ei sisällä riittävästi kalkkia ja D-vitamiinia, näitä suositellaan lisäravinteina.
POI-potilaiden luuntiheys on keskimääräistä pienempi, ja siten riski osteoporoottisille murtumille on todennäköisesti lisääntynyt. Diagnoosivaiheessa tulisi määrittää luuntiheys DEXA-mittauksella, jos estrogeenivaje on jatkunut pitkään tai on muita alhaiselle luuntiheydelle altistavia riskitekijöitä. Osteoporoositilanteessa mittaus tulisi uusia viiden vuoden välein hormonikorvaushoidon aikana, mutta luuntiheyden ollessa normaali toistettujen mittauksien hyöty on epäselvä.
POI tai sen hormonikorvaushoito ei lisää syöpäriskiä, ja mammografiatutkimukset tehdään normaalin ikäperusteisen seulontaohjelman mukaisesti (29).
Mielialaoireet, vasomotoriset oireet, emättimen kuivuus ja seksuaalitoimintojen häiriöt voivat heikentää POI-potilaiden elämänlaatua (30). Varhaiseen estrogeenivajeeseen on liittynyt kognition huononemisen riski, jota pyritään estämään hormonikorvaushoidolla (31).
Koska POI voi olla ensimmäinen oire kehittyvästä polyendokrinopatiasta, seurannassa tulee etsiä autoimmuunitautien oireita. Kilpirauhastoimintaa tulee seurata vuosittain, mikäli on todettu kilpirauhasvasta-aineita, ja raskautta suunnitteleville kilpirauhasarvojen tihennetty seuranta on suositeltavaa (taulukko 1).
Hoito
Estrogeenikorvaushoitoa suositellaan luontaiseen vaihdevuosi-ikään asti. Mikäli kohtu on tallella, hoitoon liitetään keltarauhashormoni. Estrogeenihoito yleensä helpottaa vasomotorisia oireita, joskin tarvittavat hormoniannokset saattavat olla melko suuria. Limakalvo- ja virtsatieoireisiin tehoaa hyvin sekä systeeminen että paikallinen hormonikorvaushoito. Kela korvaa hormonikorvaushoidot 50-vuotiaaksi saakka, jos munasarjojen vajaatoiminta todetaan ennen 40 ikävuotta tai se syntyy iatrogeenisesti alle 45-vuotiaana.
Hormonikorvaushoitoa suositellaan pitkälti teoreettiselta pohjalta, sillä tutkimusnäyttö hoidon hyödyistä POI-potilaiden elämänlaadulle, pitkäaikaisterveydelle tai kognitiivisille toiminnoille on puutteellista. Laadukkaita tutkimuksia hormonihoidon vaikutuksista sydän- ja verisuonielimistön sairauksiin on niukalti, mutta näyttö viittaa siihen, että hormonikorvaushoito vähentää POI-potilaiden ennenaikaista kuolleisuutta (32,33). Tutkimustieto hormonikorvaushoidon vaikutuksesta POI-potilaiden aivotapahtumien tai laskimotukosten riskiin puuttuu, mutta yhdistelmäehkäisyn tiedetään lisäävän aivohalvauksen riskiä.
Tutkimusnäyttöä hormonihoidon tehosta POI-potilaiden luuston suojaamisessa on vähän. Tuoreen suomalaisen tutkimuksen mukaan luuston tiheys on heikentynyt pitkäaikaisesta hormonikorvaushoidosta huolimatta potilailla, joilla POI:n taustalla on FSHR-mutaatio (6). Tämän syy jää avoimeksi, sillä estrogeenin vaikutus luun metaboliaan tunnetaan hyvin ja tutkimusnäyttö vaihdevuosihormonihoidon hyödystä on vahva. Nykykäsityksen mukaan luonnollinen estrogeeni saattaa olla synteettistä etinyyliestradiolia sisältäviä ehkäisypillereitä edullisempi luuston terveydelle (34). Varsinaiset osteoporoosilääkkeet ovat tehokkaita murtumien ehkäisyssä, mutta vähäisen tutkimusnäytön ja pitkäaikaisvaikutusten riskin vuoksi ne eivät ole nuorten potilaiden ensisijaisia lääkkeitä.
Hormonikorvaushoidon valinnassa hoitomyöntyvyys on tärkeää, ja antoreitti valitaan yhdessä potilaan kanssa riskitekijät huomioiden. Ihon kautta annettu luonnollinen estradioli on fysiologisin valinta, ja sen ajatellaan olevan edullinen sekä luuston että kardiovaskulaariterveyden kannalta (35). Varsinkin hedelmöityshoitoihin suuntaavan naisen on suotuisaa käyttää luonnollista estradiolia ja progesteronia syklisesti (25,26). Raskauden ehkäisyn tarve tai vuotohäiriöt voivat kuitenkin puoltaa synteettistä etinyyliestradiolia sisältävien yhdistelmäpillerien käyttöä. Keltarauhashormonin tyypillä on vaikutusta lähinnä vuotokontrolliin ja laskimotukosriskiin, mutta kohdun limakalvon suojatehon suhteen johdoksilla ei katsota olevan merkittävää eroa, kunhan annos on riittävä.
Lopuksi
Munasarjatoiminnan ennenaikainen hiipuminen vaikuttaa merkittävästi potilaan psyykkiseen ja fyysiseen hyvinvointiin. Koska etiologia tunnetaan vain osittain, syy jää usein auki tutkimuksista huolimatta.
Toiminnan hiipumista voi olla vaikea tunnistaa, ja siksi potilaat saattavat menettää mahdollisuuden raskauteen ja alkio- tai munasolupakastukseen. Tehokkain lapsettomuuden hoitomuoto on koeputkihoito luovutetuilla munasoluilla.
Hormonikorvaushoitoa suositellaan POI-potilaille pitkäaikaisesta estrogeenivajeesta aiheutuvien terveyshaittojen estämiseksi. Hoito tulee suunnitella huolella, ja potilaalla tulee olla hoitokontakti riittävän asiantuntevaan yksikköön.
Sanna Oksjoki, Marianne Hallamaa, Varpu Jokimaa: Ei sidonnaisuuksia.
Potilastapaus 1
38-vuotias nainen hakeutui tutkimuksiin sekundaariamenorrean vuoksi. Kierron pituus oli pitkään ollut 21–28 vrk, kunnes vuodot muuttuivat ensin epäsäännölliseksi ja sittemmin loppuivat kokonaan.
Toistetuissa progestiinitesteissä vaste puuttui tai ajoittui väärin. Potilaan kilpirauhaslääkitys oli tasapainossa ja PRL- ja testosteronipitoisuus olivat normaalit. Yksityisvastaanotolla tutkittujen gonadotropiiniarvojen tulkintaa vaikeutti näytteenottojen vaihteleva ajoittuminen suhteessa satunnaisesti tuleviin vuotoihin: FSH-arvo vaihteli välillä 6–14 U/l ja LH-taso välillä 22–44 U/l. Estrogeeni- ja testosteronipitoisuudet vastasivat normaalia alkukiertoa.
Erikoissairaanhoidossa kuukautiskiertoa kartoitettiin viikon välein otetuilla näytteillä, joissa FSH-tasot vaihtelivat (8–16 U/l), LH-taso oli koholla (19–43 U/l) ja E2-taso vastasi alkukiertoa ilman normaalia vaihtelua. Kaikututkimuksessa nähtiin ohut kohdun limakalvo, normaalikokoiset munasarjat ja normaali määrä antraalifollikkeleita (AFC 13). AMH-pitoisuus oli normaali (2,1 µg/l).
Kolmen kuukauden kuluttua amenorreatilanteessa antraalifollikkeleita ei enää nähty ja FSH- (130 U/l) ja E2-pitoisuudet (< 0,1 nmol/l) olivat postmenopausaaliset. Lisämunuaisvasta-aineet todettiin positiivisiksi, mikä viittasi autoimmuniteettiin POI:n syynä. Seurannassa ACTH-tasot ovat olleet koholla, mutta lisämunuaisten kortisolineritys on ollut riittävää.
Potilastapaus 2
22-vuotias nainen tuli tutkimuksiin sisarella todetun POI:n vuoksi. Kuukautiset olivat alkaneet 12 vuoden iässä ja tulivat säännöllisesti 23 päivän välein.
Potilaalla oli esiintynyt kuumia aaltoja ennen hiljattain aloitettua yhdistelmäehkäisyä. Ehkäisyn taukoviikkoina FSH oli lievästi koholla (14–16 U/l), LH 4 U/l ja AMH matalahko 0,6 µg/l (ikävakioitu viitealue 1,2–11,7 µg/l). Kaikututkimuksessa munasarjat näkyivät pieninä ja vailla antraalisia munarakkuloita.
Kromosomianalyysi ja FraX-tutkimus olivat normaalit eikä autoimmuniteettiin viittaavia vasta-ainelöydöksiä ollut. Myöhemmin sisaruksilla todettiin peittyvästi periytyvä FANC-geenin mutaatio, joka homotsygoottina kiihdyttää munasolujen katoa.
Potilaan ollessa 23-vuotias hänelle tehtiin viiden kuukauden ehkäisytauon jälkeen munasarjastimulaatio ennakoivaa munasolujen pakastusta varten. Maksimaalisista lääkeannoksista huolimatta keräyksessä saatiin vain yksi munasolu kolmesta kasvaneesta munarakkulasta. Niukan vasteen vuoksi jatkoyrityksistä pidättäydyttiin. Vuoden kuluttua potilas tuli spontaanisti raskaaksi ja synnytti ongelmitta normaalin raskauden päätteeksi.
- 1
- Faddy MJ, Gosden RG. A mathematical model of follicle dynamics in the human ovary. Hum Reprod 1995;10:770–5.
- 2
- Wallace WH, Kelsey TW. Ovarian reserve and reproductive age may be determined from measurement of ovarian volume by transvaginal sonography. Hum Reprod 2004;19:1612–7.
- 3
- European Society of Human Reproduction and Embryology. Guideline on the management of premature ovarian insufficiency (2015). https://www.eshre.eu/Guidelines-and-Legal/Guidelines/Management-of-premature-ovarian-insufficiency.
- 4
- Jacobsen BK, Heuch I, Kvåle G. Age at natural menopause and all-cause mortality: a 37-year follow-up of 19,731 Norwegian women. Am J Epidemiol 2003;157:923–9.
- 5
- Goswami D, Conway GS. Premature ovarian failure. Hum Reprod Update 2005;11:391–410.
- 6
- Luiro K, Aittomäki K, Jousilahti P, Tapanainen JS. Long-term health of women with genetic POI due to FSH-resistant ovaries. Endocr Connect 2019;8:1354–62.
- 7
- Broekmans FJ, Knauff EA, te Velde ER, Macklon NS, Fauser BC. Female reproductive ageing: current knowledge and future trends. Trends Endocrinol Metab 2007;18:58–65.
- 8
- Groff AA, Covington SN, Halverson LR ym. Assessing the emotional needs of women with spontaneous premature ovarian failure. Fertil Steril 2005;83:1734–41.
- 9
- Nelson LM. Clinical practice. Primary ovarian insufficiency. N Engl J Med 2009; 360:606–14.
- 10
- Shelling AN. Premature ovarian failure. Reproduction 2010;140:633–41.
- 11
- Persani L, Rossetti R, Cacciatore C. Genes involved in human premature ovarian failure. J Mol Endocrinol 2010;45:257–79.
- 12
- Cordts EB, Christofolini DM, Dos Santos AA, Bianco B, Barbosa CP. Genetic aspects of premature ovarian failure: a literature review. Arch Gynecol Obstet 2011;283:635–43.
- 13
- Chapman C, Cree L, Shelling AN. The genetics of premature ovarian failure: current perspectives. Int J Women health 2015;7:799–810.
- 14
- Aittomäki K, Lucena JL, Pakarinen P ym. Mutation in the follicle-stimulating hormone receptor gene causes hereditary hypergonadotropic ovarian failure. Cell 1995;82:959–68.
- 15
- Domniz N, Meirow D. Premature ovarian insufficiency and autoimmune diseases. Best Pract Res Clin Obstet Gynaecol 2019;60:42–55.
- 16
- La Marca A, Brozetti A, Sighinolfi G, Marzotti S, Volpe A, Falorni A. Primary ovarian insufficiency: autoimmune causes. Curr Opin Obstet Gynecol 2010;22:277–82.
- 17
- Iwase A, Hirokawa W, Goto M ym. Serum anti-Müllerian hormone level is a useful marker for evaluating the impact of laparoscopic cystectomy on ovarian reserve. Fertil Steril 2010;94:2846–9.
- 18
- Coccia ME, Rizzello F, Mariani G, Bulletti C, Palagiano A, Scarselli G. Ovarian surgery for bilateral endometriomas influences age at menopause. Hum Reprod 2011;26:3000–7.
- 19
- Vabre P, Gatimel N, Moreau J ym. Environmental pollutants, a possible etiology for premature ovarian insufficiency: a narrative review of animal and human data. Environ Health 2017;16:37. doi: 10.1186/s12940-017-0242-4.
- 20
- Özel S, Tokmak A, Aykut O, Aktulay A, Hancerliogullari N, Engin Ustun Y. Serum levels of phtalates and bisphenol-A in patients with primary ovarian insufficiency. Gynecol Endocrinol 2019;35:364–7.
- 21
- Pokoradi AJ, Iversen L, Hannaford PC. Factors accociated with age of onset and type of menopause in a cohort of UK women. Am J Obstet Gynecol 2011;205:34.e1-13. doi: 10.1016/j.ajog.2011.02.059
- 22
- Jokimaa V. Munasarja ikääntyy – mikä muuttuu? Suom Lääkäril 2010;65:3115–21.
- 23
- Guzel Y, Aba YA, Yakin K, Oktem O. Menstrual cycle characteristics of young females with occult primary ovarian insufficiency at initial diagnosis and one- year follow-up with serum amh level and antral follicle count. PLoS One 2017; 12(11): e0188334. doi: 10.1371/journal.pone.0188334
- 24
- Bidet M, Bachelot A, Bissauge E ym. Resumption of ovarian function and pregnancies in 358 patients with premature ovarian failure. J Clin Endocrinol Metab 2011;96:3864–72.
- 25
- Fatemi HM, Bourgain C, Donoso P ym. Effect of oral administration of dydrogestrone versus vaginal administration of natural micronized progesterone on the secretory transformation of endometrium and luteal endocrine profile in patients with premature ovarian failure: a proof of concept. Hum Reprod 2007;22:1260–3.
- 26
- O’Donnell RL, Warner P, Lee RJ ym. Physiological sex steroid replacement in premature ovarian failure: randomized crossover trial of effect on uterine volume, endometrial thickness and blood flow, compared with a standard regimen. Hum Reprod 2012;27:1130–8.
- 27
- Shuster LT, Rhodes DJ, Gostout BS, Grossardt BR, Rocca WA. Premature menopause or early menopause: long-term health consequences. Maturitas 2010;65:161–6.
- 28
- Canonico M, Plu-Bureau G, O’Sullivan MJ ym. Age at menopause, reproductive history, and venous thromboembolism risk among postmenopausal women: the Women’s Health Initiative Hormone Therapy Clinical Trials. Menopause 2014;21:214–20.
- 29
- Ewertz M, Mellemkjaer L, Poulsen AH ym. Hormone use for menopausal symptoms and risk of breast cancer. A Danish cohort study. Br J Cancer 2005;92:1293–7.
- 30
- de Almeida DM, Benetti-Pinto CL, Makuch MY. Sexual function of women with premature ovarian failure. Menopause 2011;18:262–6.
- 31
- Ryan J, Scali J, Carrière I ym. Impact of a premature menopause on cognitive function in later life. BJOG 2014;121:1729–39.
- 32
- Rivera CM, Grossardt BR, Rhodes DJ ym. Increased cardiovascular mortality after early bilateral oophorectomy. Menopause 2009;16:15–23.
- 33
- Rossouw JE, Prentice RL, Manson JE ym. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA 2007;297:1465–77.
- 34
- Crofton PM, Evans N, Bath LE ym. Physiological versus standard sex steroid replacement in young women with premature ovarian failure: effects on bone mass acquisition and turnover. Clin Endocrinol (Oxf) 2010;73:707–14.
- 35
- Langrish JP, Mills NL, Bath LE ym. Cardiovascular effects of physiological and standard sex steroid replacement regimens in premature ovarian failure. Hypertension 2009;53:805–11.
Premature ovarian insufficiency (POI)
Premature ovarian insufficiency (POI) is characterized by oligo/amenorrhoea for at least 4 months and by elevated FSH levels (> 25 IU/l) on two occasions > 4 weeks apart before the age of 40. The underlying causes can be genetic, autoimmune-based or iatrogenic, but most cases are idiopathic. Untreated POI is associated with reduced life expectancy, largely due to cardiovascular diseases. Additionally, long-lasting hypoestrogenism has negative implications for bone health and cognition. Therefore, hormone replacement therapy until the normal age of menopause is recommended even though the scientific evidence is limited.
Furthermore, a diagnosis of POI may have a significant negative impact on sexuality, psychological well-being and quality of life. In women with established POI, fertility is severely impaired, and the only effective infertility treatment is often in vitro fertilization with donated oocytes. Because of the long-term health consequences of POI, follow-up should be provided by health care professionals with adequate experience in the field.