Synnynnäisiä aineenvaihduntatauteja on seulottu Suomessa jo lähes neljännesmiljoonalta vauvalta
• Synnynnäisiä aineenvaihduntasairauksia on seulottu Suomessa vuodesta 2015.
• Seulonta tehdään hiussuoniverinäytteestä, joka otetaan kantapään ihopistolla 2–5 päivän iässä.
• Noin yhdeltä lapselta viidestätuhannesta löydetään synnynnäinen aineenvaihduntasairaus tai lisämunuaiskuoren hyperplasia.
• Fenyyliketonuria on Suomessa poikkeuksellisen harvinainen, mutta mm. pitkäketjuisten rasvahappojen oksidaatiohäiriö ja tyypin 1 tyrosinemia ovat meillä jopa yleisempiä kuin muualla.
• Seulonnan mahdollistama varhainen hoito turvaa joka vuosi usean lapsen tulevaisuuden.

Synnynnäiset aineenvaihduntasairaudet ovat harvinaisia ja vaikeita tunnistaa ajoissa. Niistä maailmalla yleisintä, fenyyliketonuriaa (PKU), opittiin seulomaan muutaman päivän ikäisiltä vauvoilta jo 1960-luvulla Robert Guthrien kehittämällä menetelmällä imupaperiin otetusta hiussuoniverinäytteestä (1). Suomalaisilla PKU:n on todettu olevan erittäin harvinainen (2,3). Suomessa on vuodesta 1980 alkaen seulottu kilpirauhasen synnynnäistä vajaatoimintaa napaverestä (4), mutta se ei sovellu aineenvaihduntatautien seulontanäytteeksi.
Menetelmien kehittyessä eri maissa on lisätty seulontoihin useita sairauksia. Aineenvaihduntatautien seulontaa edisti erityisesti massaspektrometristen menetelmien kehitys 1990-luvulla, sillä se mahdollisti kymmenien sairauksien seulonnan yhdessä analyysissä (5,6,7).
2000-luvun alussa Suomessakin pohdittiin laajemman vastasyntyneiden seulonnan tarvetta (8,9). Turussa vuonna 2007 alkaneessa Neopilot-tutkimuksessa saatiin kokemusta koko seulontaprosessista. Sosiaali- ja terveysministeriö suositti viiden sairauden seulontaa kaikilta Suomessa syntyneiltä lapsilta alkaen vuodesta 2015: PKU, synnynnäinen lisämunuaiskuoren hyperplasia (CAH), keskipitkäketjuisten rasvahappojen asyyli-CoA-dehydrogenaasin puutos (MCAD-puutos), pitkäketjuisten rasvahappojen hydroksiasyyli-CoA-dehydrogenaasin puutos (LCHAD-puutos) ja glutaarihappovirtsaisuus tyyppi 1 (GA1) (10).
Koska samasta näytteestä voidaan yhdellä kerralla seuloa useampikin sairaus, on Suomessa päädytty seulomaan noin 20 sairautta (taulukko 1) (11,12). Napaveren hypotyreoosiseulontaa on jatkettu edelleen. Kaikki sairaanhoitopiirit ovat asteittain liittyneet seulontaan.
Käytännön toteutus
Suomessa laajennettu vastasyntyneiden seulonta on perustunut vanhemmilta saatuun, tietoon perustuvaan suostumukseen, kuten useissa muissakin maissa. Neuvolakäynnillä tai synnytyssairaalassa saatua suullista suostumusta on pidetty riittävänä. Suostumus kirjataan usein sähköiseen neuvolakorttiin tai synnytyssairaalan tietojärjestelmään. Kirjallista informaatiota on saatavana mm. kansallisen seulontakeskuksen Sasken verkkosivuilla (www.saske.fi) ja Terveyskylässä (www.terveyskyla.fi).
Seulontanäyte otetaan ihopistolla lapsen kantapäästä. Muutamia veripisaroita kerätään imupaperille 3–5 pieneksi täpläksi ja annetaan kuivua (kuva 1). Yhteen kuivaveritäplään tarvittava näytemäärä on noin 75 µl. Näyte otetaan 2–5 vrk:n iässä tavallisesti synnytyssairaalassa tai sitten erillisellä laboratoriokäynnillä, mikäli lapsi on kotiutunut nopeasti. COVID-19-pandemian aikana varhain kotiutuvien lasten näytteenoton alaraja laskettiin 48 tunnista 36 tuntiin, ja sen on suunniteltu jäävän pysyväksi käytännöksi. Lapsen oman aineenvaihdunnan tulee olla käynnistynyt näytettä otettaessa, mikä edellyttää 1–2 vrk:n ikää. Toisaalta jotkin seulottavista sairauksista, kuten LCHAD-puutos tai vaahterasiirappitauti (MSUD), voivat vaatia hoitoa jo hyvin varhain.
Veritäplien kuivuttua näytekortit lähetetään Saskeen, missä saapumispäivänä tai seuraavana arkipäivänä veritäplistä lävistetään muutaman millimetrin kokoisia kiekkoja (kuva 1). CAH-seulonnan merkkiaine 17-hydroksiprogesteroni (17OHP) määritetään immunologisella menetelmällä ja amino- ja rasvahappoaineenvaihduntatuotteiden pitoisuudet massaspektrometrisellä menetelmällä. Yhdessä massaspektrometrianalyysissä määritetään useiden kymmenien yhdisteiden pitoisuudet. Poikkeavat seulontatulokset varmistetaan aina samasta näytekortista uusinta-analyysillä.
Seulontatulokset ovat yleensä valmiit 1–3 arkipäivässä näytteiden saapumisesta, minkä jälkeen ne siirtyvät laboratorioiden tietojärjestelmiin. Myös tutkimuspyynnöt ja tarvittavat esitiedot välittyvät suoraan seulontakeskuksen tietojärjestelmään. Sähköinen tiedonsiirto vähentää kirjausvirheitä ja nopeuttaa seulontaprosessia. Seulontatulokset siirtyvät Omakantaan vanhempien nähtäville 21 vrk:n viiveellä.
Jos lapsen seulontatulos on poikkeava, Sasken lastenlääkäri soittaa synnytyssairaalan lääkärille ja antaa ohjeita jatkotutkimuksista ja mahdollisesta hoidosta. CAH-seulontaan liittyvä korkea 17OHP-taso on varsin tavallinen ilmiö keskosilla, vaikka seulontaraja on raskausviikoista riippuvainen. Mikäli kyseessä on keskonen tai 17OHP-arvo on vain hieman yli seulontarajan ja lapsi on oireeton, pitoisuus määritetään uudesta imupaperinäytteestä yleensä 1–2 viikon kuluttua. Kontrollinäytteessä pitoisuuden tulee olla pienentynyt selvästi. Mikäli seulontanäytteen 17OHP-arvo on hyvin korkea tai lapsella on oireita, lapsi pyydetään välittömästi seurantaan. Hänestä otetaan myös muita laboratoriotutkimuksia (mm. plasman kalium, natrium, kortisoli ja 17OHP), ja korvaushoito saatetaan aloittaa jo tällöin (hydro- ja fludrokortisoni ja p.o. NaCl).
Myös muiden poikkeavien seulontalöydösten suhteen jatkotoimenpiteet vaihtelevat riippuen sairaudesta ja epäilyn vahvuudesta. Seulontalöydöksen ollessa lievästi poikkeava oireettomalla lapsella saattaa riittää Saskeen lähetetty kontrollinäyte. Mikäli epäily on vahva, esimerkiksi korkea suksinyyliasetonitaso (tyrosinemia-epäily), lapsi otetaan osastoseurantaan. Hänestä otetaan diagnostisia jatkotutkimuksia, jotka sisältävät sairausepäilystä riippuen esimerkiksi plasman aminohapot, virtsan orgaaniset hapot tai veritäplän asyylikarnitiinimäärityksen. Tarvittaessa aloitetaan jo sairauden hoito.
Seulontaa tukee alan asiantuntijalääkärien verkosto, johon kuuluu jäseniä kaikista yliopistosairaaloista.
Seulonnan tuloksia
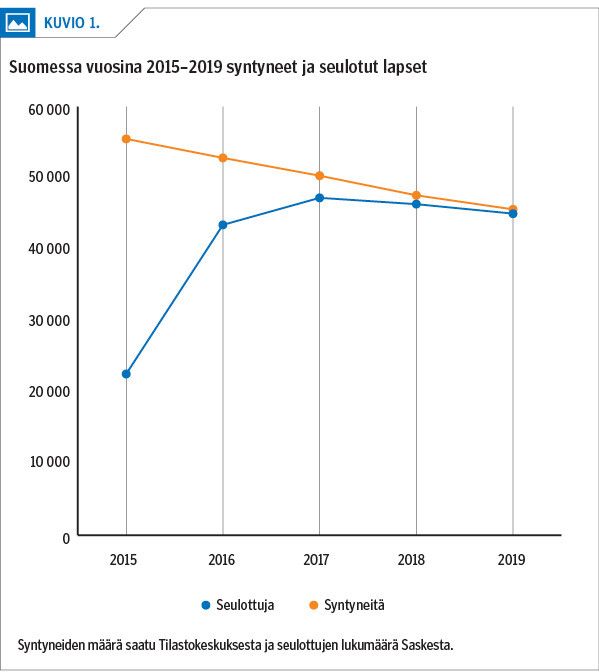
Suurin osa sairaanhoitopiireistä aloitti seulonnan vuosina 2015–2016 ja viimeinenkin 2018. Koko maa on ollut mukana vasta 2019, jolloin seulonnan kattavuus oli noin 99 % (kuvio 1).
Lasten mediaani-ikä vastausten valmistuttua on ollut 7 vuorokautta. Yli 99 % vastauksista on raportoitu viimeistään lapsen ollessa 2 viikon ikäinen. Yksittäiset pidemmät viiveet ovat johtuneet näytteenoton, lähetyksen tai kuljetuksen viivästymisestä.
Kaikkien seulontapositiivisten osuus 2015–2019 on ollut noin 0,3 %. Valtaosassa tapauksista jatkotoimenpiteeksi on riittänyt Saskessa analysoitu kontrollinäyte. Diagnostisia jatkotutkimuksia on suositeltu noin 20 %:lle seulontapositiivisista (0,06 %:lle kaikista seulotuista).
Noin puolet poikkeavista löydöksistä on liittynyt CAH-seulontaan. Raskausviikkoihin suhteutettuja seulontarajoja on muokattu kertyneen kokemuksen perusteella, ja CAH-hälytysten määrä on vähentynyt 0,32 %:sta 0,11 %:iin. Täysiaikaisten seulontarajoja on laskettu hieman, jotta suurempi osa lievemmistäkin tautimuodoista löytyisi.
Massaspektrometrianalyysissä noin 20 sairauden seulontapositiivisten yhteenlaskettu osuus on ollut noin 0,15 %. Valtaosa on liittynyt joko isovaleriaanahappovirtsaisuuden (IVA) tai propioni- (PA) ja metyylimalonihappovirtsaisuuden (MMA) seulontaan. IVA-hälytykset ovat valtaosin johtuneet äidin pivmesillinaamilääkityksen häiriövaikutuksesta. Muissa massaspektrometrianalyysiin perustuvissa sairauksissa positiivisia löydöksiä on ollut vähän, 0–5 vuodessa (≤ 0,01 % seulotuista). Suksinyyliasetoniin perustuvassa tyypin 1 tyrosinemian, arginosuksinaattiin perustuvassa arginiinimeripihkahappovirtsaisuuden (ASAuria) sekä LCHAD-puutoksen seulonnassa kaikki hälytykset ovat olleet oikeita. Trifunktionaalisen proteiinin puutosta (TFP-puutos), joka on LCHAD-puutosta harvinaisempi, ei seulonnassa pystytä erottamaan LCHAD-puutoksesta.
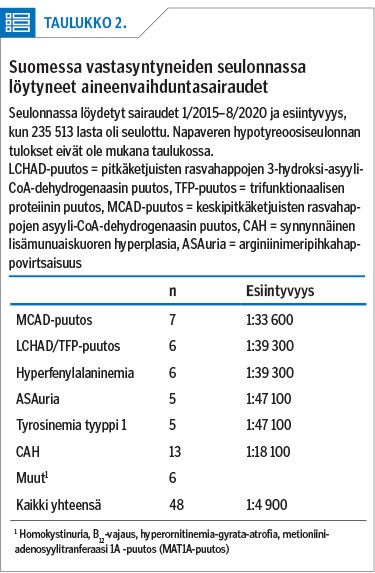
Elokuuhun 2020 mennessä seulonnassa oli löytynyt 48 sairasta lasta (taulukko 2). Suurin yksittäinen ryhmä oli CAH, jota sairastavia löytyi 13. Heistä 12 oli täysiaikaisia ja yksi oli syntynyt 35. raskausviikolla. Kaikille aloitettiin omassa sairaalassa hormonikorvaushoito alle 10 päivän iässä, eikä merkittävää suolanmenetystä ehtinyt kehittyä.
Rasvahappojen oksidaatiohäiriö todettiin kaikkiaan 13 lapsella: seitsemällä todettiin MCAD-puutos ja yhteensä kuudella LCHAD- tai TFP-puutos. Potilaille aloitettiin diagnoosin mukainen ravitsemushoito. TFP-puutosta sairastavat kaksi lasta menehtyivät hoidosta huolimatta. LCHAD-puutoksen esiintyvyys on odotettu, mutta MCAD-puutoksen esiintyvyys (1:33 600) on suurempi kuin maassamme aiemmin, joskin pienempi kuin esimerkiksi Keski-Euroopassa (13).
Hyperfenyylialaninemian ja PKU:n esiintyvyys on Suomessa aiempiin raportteihin sopien pieni. Seulonnassa löytyi vain 6 hyperfenyylialaninemiapotilasta. Suurella osalla tautimuoto oli lievä. Suurin seulonnan fenyylialaniinipitoisuus (n. 800 µmol/l) todettiin 6-pyruvoyyli-tetrahydropteriinisyntaasin (PTPS) puutosta sairastavalla lapsella, jolle aloitettiin karbidopa/levodopa-, 5-hydroksitryptofaani- sekä sapropteriini-dihydrokloridilääkitykset. Viidellä lapsella todettiin tyypin 1 tyrosinemia ja heille aloitettiin ruokavalio sekä nitisinonilääkehoito, ja viideltä löytyi ASAuria, johon aloitettiin ruokavalio- ja lääkehoito. Yhdellä ASAuriaa sairastavista lapsista ammoniakkipitoisuus oli suurentunut jo diagnosointihetkellä, mutta lapsi oli niin vähäoireinen, ettei ollut päätynyt tutkimuksiin ennen seulontavastausta. Ammoniakkipitoisuus pieneni nopeasti hoidon avulla.
Lisäksi yksittäisillä potilailla on todettu homokystinuria, B12-vitamiinin vajaus, metioniini-adenosyylitransferaasin 1A (MAT1A) puutos tai hyperornitinemia-gyrata-atrofia (HOGA). Yhtään varmaa orgaanishapposairautta ei seulonnassa ole löytynyt. Yhdellä kaksosparilla todettiin viikkoja kestänyt pieni karnitiinipitoisuus. He saivat runsaan vuoden ajan karnitiiniliuosta. Koska geenitestit olivat negatiiviset, hoito lopetettiin runsaan vuoden iässä, ja sittemmin karnitiinipitoisuus on pysynyt normaalina. Tässä tapauksessa äiti oli saanut pivmesillinaamia, ja se lienee ollut lasten karnitiininpuutoksen aiheuttaja.
Seulonnan haasteet
Seulontatulokset eivät ole koskaan diagnostisia, ja väärät positiiviset löydökset ovat väistämätön osa seulontaa. Ne aiheuttavat huolta perheelle ja kuormittavat terveydenhuoltoa, joten niitä pyritään minimoimaan (15).
Seulonnan poikkeavan tuloksen ilmoittaa perheelle aina lääkäri. Hänen antamansa informaation ei pidä liikaa lisätä perheen huolta. Seulonnassa havaitaan joskus myös sairauksia, jotka eivät olleet seulonnan kohteita, sillä joitakin sairauksia ei pystytä seulonta-analyysin perusteella ilman jatkotutkimuksia erottamaan toisistaan.
Seulontatulosten tulkinta ei aina ole yksiselitteistä. Seulottavat sairaudet ovat harvinaisia ja tulkintarajojen asettaminen seulontaa aloitettaessa on haastavaa. Tulosten tulkinnassa hyödynnetään kansainvälisiä tietokantoja (16,17,18). Esimerkiksi osa MCAD-puutoksen tautimutaation terveistä kantajista jää kiinni seulonnassa, mikäli tulkintarajat on asetettu mataliksi. Jos rajat ovat korkeat, jäävät lievemmät tautimuodot havaitsematta.
Monista sairauksista esiintyy eriasteisia tautimuotoja, joista varsinaisia seulonnan kohteita ovat vaikeimmat varhaislapsuudessa ilmenevät muodot. Myöhemmin ilmenevät, lievät muodot eivät välttämättä löydy seulonnassa. Näin voi käydä mm. vaahterasiirappitaudin (MSUD) intermittoivien muotojen kanssa; sellainen on löytynyt Suomessakin. Tämän vuoksi on oleellista, että seulontakeskus saa tiedot diagnostisten näytteiden tuloksista ja myöhemmin ilmenneistä vääristä negatiivisista löydöksistä. Tämä tiedonkeruu on pyritty toteuttamaan lääkäriverkoston avulla.
Pienet keskoset ja tehohoitopotilaat monine ongelmineen ovat haasteellinen potilasryhmä. Monissa maissa näistä lapsista otetaan rutiininomaisesti useampia seulontanäytteitä.
Vaikka seulontaraja vaihtelee raskauden keston mukaan, keskosen korkea 17OHP-arvo on yleisin yksittäinen väärän hälytyksen syy. Vastikään julkaistiin Ruotsin CAH-seulontaprotokollan käytäntö ja tulokset, jossa korostetaan seulontalaboratorion ja kliinikkojen yhteistyön tärkeyttä (19). Suomessa keskosen korkea 17OHP-taso on kontrolloitu 1–2 viikon kuluttua. Mikäli pitoisuus on kontrollissa pienentynyt selvästi, löydös on tulkittu keskosuuteen liittyväksi.
CAH-seulonnan pyrkimyksenä on kaikkialla maailmassa löytää suolan menetystä aiheuttava lisämunuaiskuoren vajaatoiminta, ja siinä se on meilläkin onnistunut hyvin. Seulonta ei kuitenkaan varmuudella löydä taudin virilisoivaa muotoa, joka tulee yleensä esiin pituuskasvun kiihtymisenä ja murrosiän kehityksen käynnistymiseen viittaavina löydöksinä muutaman vuoden iässä. Myös Suomessa on seulonnan aikana löytynyt muutama tällainen lapsi. Oireiden ilmaantuessa 17OHP-pitoisuus tulee määrittää muiden tarvittavien tutkimusten ohella, vaikka se seulonnassa olisi ollut normaali.
Valtaosa muista vääristä hälytyksistä on liittynyt IVA:n tai PA:n ja MMA:n seulontaan. Äidin raskaudenaikainen pivmesillinaamilääkitys häiritsee IVA-seulontaa. PA:n ja MMA:n seulonnassa käytetty merkkiaine on puolestaan epäspesifinen. Väärien positiivisten löydösten vähentämiseksi käytetäänkin yleisesti seulontanäytteestä tehtäviä spesifisempiä jatkoanalyysejä (second tier -testejä). Näin mm. IVA-seulontaa häiritsevä lääkeainevaikutus voidaan poissulkea. Saskessa tänä vuonna käyttöön suunnitellut jatkoanalyysit vähentänevät väärien positiivisten osuutta merkittävästi kuten muissakin maissa (15,17,18). Geneettisiäkin menetelmiä on jo käytössä tähän tarkoitukseen mm. Norjassa (18), mutta niihin liittyy mm. tulkinnallisia ja eettisiä ongelmia.
Merkitys ja kehittäminen
Synnynnäisten aineenvaihduntatautien seulonnassa on vuosittain löytynyt 6–15 sairasta lasta. Kaikkia seulottavia sairauksia ei vielä ole löytynyt lainkaan, mutta monet sairauksista ovat odotetustikin erittäin harvinaisia. Siksi tässä vaiheessa, kun lapsia on seulottu vasta noin 250 000, on vaikeaa arvioida, onko kaikkien sairauksien seulontaa perusteltua jatkaa.
Aiempien raporttien kaltaisesti klassista PKU:ta esiintyy Suomessa hyvin vähän muihin länsimaihin verrattuna (14). Tähän mennessä suurimmalla osalla löytyneistä on ollut varsin lievä hyperfenyylialaninemia ja yhdellä hyvin harvinainen tetrahydrobiopteriinin vajaus (PTPS-puutos). Hyperfenyylialaninemian esiintyvyys on meillä luokkaa 1:40 000, kun se tuoreen selvityksen mukaan ilman lieviä hyperfenyylialaninemioitakin on esimerkiksi Saksassa 1:10 600 (13). Tyrosinemiaa ja ASAuriaa esiintyy meillä suunnilleen yhtä paljon kuin hyperfenyylialaninemiaa.
Seulonnan perusteella MCAD-puutos näyttää meillä olevan yleisempi kuin LCHAD-puutos. Aiemmin MCAD-puutos oli Suomessa lähes tuntematon. Saattaa olla, että tauti on aiemmin jäänyt diagnosoimatta, sillä osa potilaista oireilee vain muiden sairauksien yhteydessä, ja toisaalta MCAD-puutos saattaa joskus jopa jäädä diagnosoimatta lapsen epäselvän kuoleman yhteydessä. MCAD-puutoksen esiintyvyyden on muuallakin todettu lisääntyneen seulontojen alettua (17,18). Muualla maailmassa LCHAD-puutos on hyvin harvinainen (Britanniassa ja Saksassa 1:125 000–1:150 000) (13). LCHAD/TFP-puutos on Suomessa suhteellisen yleinen (noin 1:40 000). CAH:n esiintyvyys on meillä seulonnassa ollut noin 1:18 000. Ruotsissa esiintyvyys on noin 1:11 200 (20).
Seulonnan ansiosta sairaat lapset on saatu hoitoon ajoissa, mutta TFP-puutos on johtanut kahden lapsen kuolemaan hoidosta huolimatta. Osalla seulotuista on ollut laboratoriotutkimuksissa jo merkkejä sairaudesta, mutta ilman seulontaa nämä oireettomat lapset eivät vielä olisi päätyneet tutkimuksiin. Tuoreessa saksalaisessa seurantatutkimuksessa seulonnassa löydettyjen potilaiden ennuste on ollut hyvä: 306:sta vuosina 1999–2016 seulonnassa löydetystä lapsesta yli 89 %:lla oli normaali kehitys ja 95 % kävi normaalia koulua (13). Seulottujen suomalaislasten ennustetta ei vielä pystytä arvioimaan.
Vastasyntyneiltä seulottavien sairauksien joukko maailmalla on kasvanut seulontamenetelmien ja hoitojen kehittyessä. Suomessakin käynnistyi vuoden 2019 alussa vaikean kombinoituneen immuunivajeen, SCID-oireyhtymän, seulontapilotti Turun ja Helsingin alueilla. Terveydenhuollon palveluvalikoimaneuvoston Palkon suositus oireyhtymän lisäämisestä valtakunnalliseen seulontaohjelmaan muutamin edellytyksin on julkaistu 25.9.2020 (21). SCID-seulonnalla pyritään nopean diagnoosin ja parantavan kantasolusiirron avulla pelastamaan lapsen henki.
Yhdysvalloissa lysosomaalisten kertymäsairauksien rutiiniseulonta on jo varsin yleistä. Suomessa vaikuttaviksi todettujen hoitojen saatavuutta on pidetty yhtenä seulonnan tärkeimmistä edellytyksistä, eikä muuallakaan Euroopassa ole näitä sairauksia juuri ryhdytty seulomaan. Sen sijaan spinaaliseen lihasatrofiaan (SMA) on tullut sairauden ennustetta parantavia, joskin kalliita hoitoja, ja seulonnasta käydäänkin runsaasti keskustelua. Joissakin Euroopan maissa (22) on käynnistetty jo SMA-seulontapilotteja.
Myös synnynnäinen hypotyreoosi olisi mahdollista liittää kuivaverinäyteseulontaan, kuten muissakin länsimaissa (23). Toistaiseksi napaveriseulontaa ovat puoltaneet nopeus, helppous ja hyvä kattavuus, joskin kuivaverinäyteseulonnan kattavuus alkaa olla lähes samaa luokkaa.
Aineenvaihduntatautien seulontaan valittujen sairauksien listaa tulisi arvioida, kun seulottujen lasten määrä ja kokemus sairauksien esiintyvyydestä, seulonnasta ja hoidosta kasvavat riittävän suureksi. Tätä ja muuta seulonnan arviointia varten tarvitaan kansallinen ohjausryhmä.
Lopuksi
Suomessa vuonna 2015 alkanut kansallinen vastasyntyneiden aineenvaihduntatautien seulonta on käynnistynyt varsin hyvin. Ensimmäisten vuosien kokemuksen perusteella seulonnassa löydettyjen aineenvaihduntatautien kokonaisesiintyvyys on noin 1:4 900 lasta eli hieman pienempi kuin monissa muissa maissa. Tätä selittää parhaiten PKU:n vähäinen esiintyvyys Suomessa, ja myös MCAD-puutos on meillä harvinaisempi kuin monissa maissa. Toisaalta LCHAD-puutos, ASAuria ja tyypin 1 tyrosinemia näyttävät olevan meillä yleisempiä kuin muualla.
Seulonnan mahdollistama varhainen diagnostiikka ja hoito turvaavat joka vuosi usean lapsen tulevaisuuden, joskin sairauksien tehokas hoito vaatii elinikäisen ruokavalion tai lääkityksen.
Harri Niinikoski: Luentopalkkiot (Alexion, Sanofi-Genzyme, Takeda), kongressimatkat (Novo Nordisk, Sanofi-Genzyme), Lihavuus ja Dyslipidemiat Käypä hoito -työryhmän jäsen.
Sinikka Karppinen, Britt-Marie Loo, Riikka Kurkijärvi: Ei sidonnaisuuksia.
- 1
- Guthrie R, Susi A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics 1963;32:338–43.
- 2
- Simell O. PKU-sjukdomen i Finland – en populationsgenetisk kuriositet. Läkartidningen 1974;71:1170.
- 3
- Niinikoski H, Heikkilä J, Näntö-Salonen K. Fenyyliketonuria. Duodecim 2009;125:1069–75.
- 4
- Virtanen M, Perheentupa J, Mäenpää J ym. Finnish national screening for hypothyroidism. Few false positives, early therapy. Eur J Pediatr 1984;143:2–5.
- 5
- Almannai M, Marom R, Sutton VR. Newborn screening: a review of history, recent advancements, and future perspectives in the era of next generation sequencing. Curr Opin Pediatr 2016;28:694–9.
- 6
- Millington DS, Kodo N, Norwood DL, Roe CR. Tandem mass spectrometry: a new method for acylcarnitine profiling with potential for neonatal screening for inborn errors of metabolism. J Inherit Metab Dis 1990;13:321–4.
- 7
- Schulze A, Lindner M, Kohlmuller D, Olgemoller K, Mayatepek E, Hoffmann GF. Expanded newborn screening for inborn errors of metabolism by electrospray ionization-tandem mass spectrometry: Results, outcome, and implications. Pediatrics 2003;111:1399–406.
- 8
- Näntö-Salonen K, Renlund M, Penttinen M, ym. Suomen laajennettu vastasyntyneiden aineenvaihduntaseula. Suom Lääkäril 2003;58:1291–7.
- 9
- Autti-Rämö I, Laajalahti L, Koskinen H ym. Vastasyntyneiden harvinaisten aineenvaihduntatautien seulonta. Helsinki: FinOHTAn raportti 22/2004.
- 10
- Vastasyntyneiden aineenvaihduntasairauksien seulonta. STM:n suositus. Sosiaali- ja terveysministeriö 5.5.2014.
- 11
- Loeber JG, Burgard P, Cornel MC ym. Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 1. From blood spot to screening result. J Inherit Metab Dis 2012;35:603–11.
- 12
- Lapatto R, Niinikoski H, Näntö-Salonen K, Mononen I. Vastasyntyneiden aineenvaihduntasairauksien seulonta. Duodecim 2018;164:263–9.
- 13
- Mutze U, Garbade SF, Gramer G ym. Long-term outcomes of individuals with metabolic diseases identified through newborn screening. Pediatrics, verkossa 13.10.2020. doi: 10.1542/peds.2020-0444.
- 14
- Saudubray J-M, Baumgartner M, Walter JH. Inborn metabolic diseases. Diagnosis and treatment, 6. painos. Heidelberg: Springer 2016.
- 15
- Malvagia S, Forni D, Ombrone D, La Marca G. Development of strategies to decrease false positive results in newborn screening. Int J Neonatal Screen 2020;6:84.
- 16
- Hall PL, Marquardt G, McHugh DM ym. Postanalytical tools improve performance of newborn screening by tandem mass spectrometry. Genet Med 2014;16:889–95.
- 17
- Sörensen L, von Döbeln U, Åhlman H ym. Expanded screening of one million Swedish babies with R4S and CLIR for post-analytical evaluation of data. Int J Neonatal Screen 2020;6:42.
- 18
- Tangeraas T, Sæves I, Klingenberg C ym. Performance of expanded newborn screening in Norway supported by post-analytical bioinformatics tools and rapid second-tier DNA analyses. Int J Neonatal Screen 2020;6:51.
- 19
- Lajic S, Karlsson L, Zetterström RH, Falhammat H, Nordenström A. The success of a screening program is largely dependent on close collaboration between the laboratory and the clinical follow-up of the patients. Int J Neonatal Screen 2020;6(3):68. doi: 10.3390/ijns6030068
- 20
- Zetterström RH, Karlsson L, Falhammar H, Lajic S, Nordenström A. Update on the Swedish newborn screening for congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Int J Neonatal Screen 2020;6:71. doi: 10.3390/ijns6030071
- 21
- https://palveluvalikoima.fi/scid-seulonta
- 22
- Boemer F, Caberg J-H, Dideberg V ym. Newborn screening for SMA in Southern Belgium. Neuromuscul Disord 2019;29:34–9.
- 23
- Linko-Parvinen A, Kouki A, Uitto J ym. Synnynnäisen hypotyreoosin seulonta vastasyntyneiltä kuiva- ja napaverinäytteistä. Suom Lääkäril 2018;73:512–7.
Neonatal metabolic screening in Finland – nearly 250 000 infants screened
Neonatal metabolic screening has been used for detection of phenylketonuria (PKU) in many Western countries for many decades. In Finland, neonatal metabolic screening started in 2015 and is today included in the routine investigations for all Finnish newborns. A heel prick sample is taken at 2–5 days of age to screen for approximately 20 metabolic diseases and congenital adrenal hyperplasia (CAH). In Finland, screening has identified a metabolic disease or CAH in approximately one per 5000 infants screened. PKU is exceptionally rare in Finland but long chain 3-hydroxyacyl-CoA dehydrogenase deficiency (LCHAD) and tyrosinaemia type 1, for example, are more common than in several other countries. Every year early identification and treatment improve the prognosis of many Finnish children with metabolic disease.