Kliininen epidemiologia hoidon tehon arvioinnissa
• Luotettavin arvio hoidon tehosta saadaan meta-analyysistä, joka perustuu satunnaistettuihin hoitokokeisiin.
• Päätetapahtumanäytön tulisi olla potilaalle merkityksellistä, kuten ennaltaehkäisevässä hoidossa vähenemä sairastavuudessa tai kuolleisuudessa, eikä pelkkä muutos tapahtumien riskiä kuvaavissa korvikemuuttujissa.
• Absoluuttisena vaikutuksena mitattuna ennaltaehkäisevästä hoidosta hyötyy todennäköisemmin suuremman kuin pienemmän sairastumisriskin potilas.

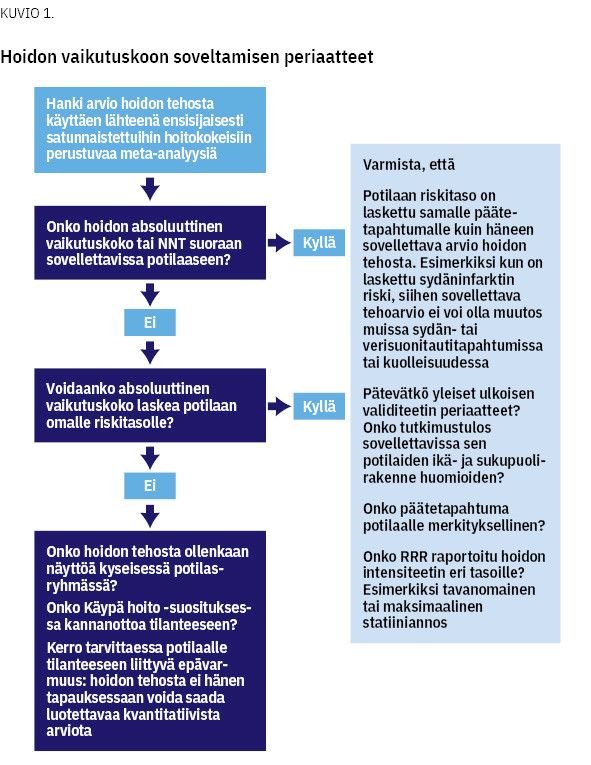
Kliinisen epidemiologian menetelmiä käyttäen on mahdollista arvioida potilaan todennäköisyys hyötyä hoidosta (kuvio 1). Tässä katsauksessa esittelemme hoidon tehon tulkinnan perusteita (1,2,3). Lääkärillä on hyvä olla käsitys erikoisalansa tärkeimpien hoitojen vaikutuskoosta (4). Vaikutuskoot voidaan myös esittää potilaalle numeerisesti ja käyttäen päätöksenteon tukena esimerkiksi kuvia (5). Aihe on rajattu yksinkertaisimpiin tilanteisiin, eli kaksiluokkaisiin päätetapahtumiin, kuten sairastuminen tai kuolema.
Absoluuttinen ja suhteellinen riski
Satunnaistetussa hoitokokeessa sairaus kehittyi hoitoryhmässä 2 %:lle ja verrokkiryhmässä 4 %:lle potilaista. Hoito vähentää sairastumisen riskiä absoluuttisesti kaksi prosenttiyksikköä ja suhteellisesti 50 %. Sama hoito tavataan mieltää tehokkaammaksi, kun sen tehoa kuvaillaan suuremmalta kuulostavana suhteellisena kuin absoluuttisena muutoksena (3,5). Lääkemainonnassa onkin usein korostettu suhteellista vaikutusta sitomatta sitä sairastumisriskiin (6).
Päätetapahtuman absoluuttinen riski (AR) lasketaan jakamalla päätetapahtuman kohdanneiden lukumäärä niiden määrällä, joilla on riski kohdata päätetapahtuma (liitetaulukko 1). Todennäköisyyttä hyötyä hoidosta välttämällä päätetapahtuma kutsutaan absoluuttisen riskin vähenemäksi (ARR). ARR on hoitokokeen verrokki- ja hoitoryhmien absoluuttisten riskien erotus (3).
Kun potilas täyttää satunnaistetun hoitokokeen sisäänottokriteerit, hänen ennustettaan ilman hoitoa kuvaa karkeasti verrokkiryhmä. Aiheesta riippuen sairastumisriskin arvioimiseen voi olla myös käytettävissä riskilaskuri, kuten Finriski. Sitä käytetään sydän- tai aivotapahtuman tai kuoleman todennäköisyyden arvioimiseksi primaaripreventiossa (7).
Number needed to treat
NNT-luku eli number needed to treat -luku tarkoittaa potilasmäärää, joka on keskimäärin hoidettava, jotta vältetään yksi haitallinen päätetapahtuma (8). Mitä pienempi NNT-luku, sitä todennäköisemmin potilas hyötyy hoidosta. NNT:n merkitys potilaalle ei riipu vain luvun pienuudesta, vaan myös päätetapahtuman vakavuudesta. NNT kuvastaa sitä, ettei aiheellisestikaan määrätty hoito hyödytä kaikkia. Ennalta ehkäisevää hoitoa käyttävistä osa ei koskaan sairastu ehkäistävään sairauteen, ja osa sairastuu siihen hoidosta huolimatta.
Esimerkki 1: Endarterektomia
Potilaan TIA-kohtauksen syyksi paljastuu merkittävä kaulavaltimon ahtauma. Leikkaushoito pelottaa, ja potilas haluaa tietää todennäköisyytensä hyötyä hoidosta. Cochrane-katsauksen mukaan aivohalvauksen tai kuoleman yhdistelmäpäätetapahtuman koki sataa potilasta kohden 23 verrokkiryhmän potilasta (ei leikkausta) ja 10 endarterektomiaryhmän potilasta 5 vuoden seurannassa (9). Absoluuttisesti endarterektomia vähentää riskiä 13 prosenttiyksikköä:
ARR = riski verrokit – riski hoito
= AR v – AR h = 0,23 – 0,10 = 0,13 eli 13 %
Kyseessä on suuri todennäköisyys välttää vakava yhdistelmäpäätetapahtuma. NNT-lukuna ilmaistuna keskimäärin kahdeksan potilasta leikkaamalla yksi välttää aivoinfarktin tai kuoleman:
NNT = 1/ARR = 1/0,13 ≈ 8
Absoluuttisen muutoksen laskeminen suhteellisen riskin avulla
Ennaltaehkäisevästä hoidosta hyötyy todennäköisemmin suuren kuin pienen sairastumisriskin potilas. Potilaan oman sairastumisriskin huomioiva ARR voidaan laskea kertomalla sairastumisriski (AR v ) hoitoon liittyvällä suhteellisen riskin vähenemällä (relative risk reduction, RRR) (8,10). RRR tarkoittaa sitä osuutta alkuperäisestä sairastumisriskistä, jonka hoito poistaa.
Sydän- ja verisuonisairauksien primaaripreventiossa hoitosuositukset pitävät suuren riskin rajana 10 %:n todennäköisyyttä saada verisuonitautitapahtuma seuraavan 10 vuoden kuluessa. Hoitokokeissa on havaittu, että korkean kolesteroliarvon tai verenpaineen lääkehoitoon liittyvä suhteellisen riskin vähenemä on lähes vakio riippumatta sairastumisriskin suuruudesta (11,12,13). Hoidon absoluuttinen teho siis lisääntyy sairastumisriskin kasvaessa.
Tämä RRR:n ominaisuus on havaittu myös useilla muilla lääketieteen osa-alueilla. Parhaimmillaan ominaisuus mahdollistaa tulosten ekstrapoloinnin sellaisille riskitasoille, joita alkuperäisissä tutkimuksissa ei ollut mukana. Laskuissa esitetyt tehoarviot perustuvat keskeisimpiin peruskaavoihin. Tarkemmat arviot ovat tietyissä tapauksissa mahdollisia käyttäen monimutkaisempia menetelmiä.
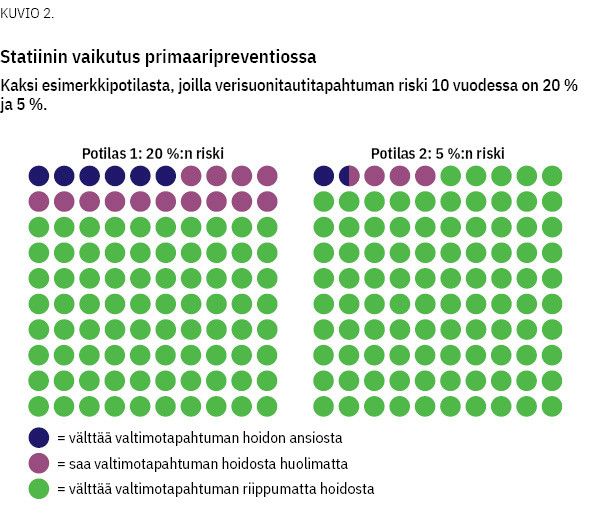
Esimerkki 2: Statiinit primaaripreventiossa
Potilas haluaa tietää, kuinka suurella todennäköisyydellä hän hyötyy statiinilääkityksestä. Hänellä on Finriski-laskurilla arvioituna erityisen suuri verisuonitautitapahtuman riski: 20 % seuraavan 10 vuoden aikana. Meta-analyysissä verisuonitautitapahtuman suhteellinen riski (relative risk, RR) statiini- ja lumelääkeryhmän välillä on 0,70 ja 95 %:n luottamusväli on 0,63–0,78 (14).
Tämä tarkoittaa, että statiinihoitoa käytettäessä alkuperäisestä riskistä jää jäljelle 70 %. Tehoarvion virhemarginaalia kuvaavat luottamusvälit kertovat, että jos tutkimuksia vastaava potilasotanta toistettaisiin 100 kertaa, päädyttäisiin 95 tapauksessa lukuun välillä 0,63 ja 0,78.
Statiinihoidolla 20 %:n riski pienenee 14 %:iin.
AR h = riski ilman hoitoa ∙ suhteellinen riski hoito
= AR v ∙ RR = 0,20 ∙ 0,70 = 0,14 eli 14 %
ARR lasketaan hoitamattoman ja hoidetun riskitason erotuksena:
ARR = riski ilman hoitoa – riski hoidettuna
= AR v – AR h = 0,20 – 0,14 = 0,06 eli 6 %
ARR voidaan myös laskea RRR:n avulla. Koska alkuperäisestä riskistä jää hoidon jälkeen jäljelle 70 %, hoito vähentää alkuperäistä riskiä 30 %, eli RRR on 0,30.
ARR = AR v ∙ RRR = 0,20 ∙ 0,30 = 0,06 eli 6 %
Potilaalla on 6 %:n todennäköisyys välttää verisuonitautitapahtuma käyttämällä statiinia 10 vuoden ajan. Sairastumisriskin pienentyminen 20 %:sta 14 %:iin tarkoittaa, että väestötasolla tämänkaltaisessa potilasjoukossa 14 % saisi verisuonitautitapahtuman statiinin käytöstä huolimatta. NNT-luku on 17:
NNT = 1/ARR = 1/0,06 ≈ 17
Käyttämällä meta-analyysissä ilmoitettuja 95 %:n luottamusvälejä voidaan huomioida hoidon tehoon liittyvä epätarkkuus. Luottamusväleistä vastaavasti laskettuna arvio NNT:n suuruudesta on välillä 14–23. Kun sairastumisriski on suuri, hoito on hyväksyttävämpää, vaikka osa potilaista hoidetaan ns. turhaan. Näin on varsinkin silloin, kun hoito on kustannuksiltaan edullista ja jos potilaalle ei koidu seurannassa merkittäviä haittavaikutuksia. Tilanne on erilainen, jos sairastumisriski on huomattavasti pienempi (kuvio 2), hoito on erityisen kallis tai potilas saa siitä haittavaikutuksia.
Esimerkki 3: LDL-kolesterolin laskun vaikutus
Kun lääkehoito pienentää LDL-kolesterolipitoisuutta yhden yksikön, verisuonitautitapahtuman riski pienenee lähtötasostaan suhteessa saman verran (11,13). Meta-analyysi osoittaa, että kun statiinihoito pienentää LDL-kolesterolipitoisuutta 1 mmol/l, verisuonitapahtuman riski vähenee 21 %. RRR on siis 0,21 ja RR on 0,79. Verikokeissa statiinihoidon aloittamisen jälkeen potilaan LDL-kolesterolipitoisuuden havaitaan pienentyneen 2 mmol/l. Tällöin RR on 0,79 ∙ 0,79 eli 0,79 2 ≈ 0,62. Potilaan 20 %:n sairastumisriskillä tämä tarkoittaisi:
AR h = AR v ∙ RR = 0,20 ∙ 0,62 = 0,124
ARR = AR v - AR h = 0,20 – 0,124 = 0,076
NNT = 1/0,076 ≈ 13
Esimerkki 4: Verenpaineen laskun vaikutus
Verenpaineen laskun vaikutus arvioidaan matemaattisesti samoin periaattein kuin LDL-pitoisuuden muutoksen vaikutus. Meta-analyysin mukaan verisuonitapahtuman riski pienenee lähtötasostaan 20 %, kun systolinen verenpaine laskee lääkityksellä 10 mmHg (12). Systolinen verenpaine on lähtötilanteessa keskimäärin 150 mmHg ja lääkityksen aloituksen jälkeisellä seurantakäynnillä 135 mmHg. Koska lasku 15 mmHg on 1,5 kertaa 10 mmHg, tulee eksponenttiin luku 1,5 ja RR on 0,80 1,5 ≈ 0,72. Potilaan 20 %:n riskillä tämä tarkoittaisi:
AR h = AR v ∙ RR = 0,20 ∙ 0,72 = 0,144
ARR = AR v – AR h = 0,20 – 0,144 = 0,056
NNT = 1/0,056 ≈ 18
Päätetapahtumien laadun merkitys
Ennaltaehkäisevässä hoidossa tärkeimpiin päätetapahtumiin kuuluvat ns. kovat päätetapahtumat (hard endpoint), eli sairastavuus ja kuolleisuus (taulukko 1). Potilaalle merkitykselliset päätetapahtumat ovat laajempi käsite, joka sisältää myös subjektiivisia mittareita, kuten muutoksen elämänlaadussa tai oireissa (15). Hoidon vaikutusta koviin päätetapahtumiin pyritään ennustamaan korvikemuuttujilla (surrogate outcome), kuten pitkäaikaisella verensokerilla (B-HbA 1c ). Suotuisa muutos korvikemuuttujassa ei itsessään riitä näytöksi hoidon nettohyödystä (16).
Esimerkki 5: Pelkästään korvikemuuttujiin ei voida luottaa
Flekainidi on sen vasta-aiheet huomioiden turvallinen eteisvärinäkohtausten estohoidossa. Lääkkeen historia on tärkeä muistutus haitoista, joita aiheutui, kun hoitokäytäntö omaksuttiin vain korvikemuuttujan suotuisan muutoksen perusteella. Sydäninfarktin jälkeinen kammiolisälyöntisyys suurentaa kuoleman riskiä. Siksi ajateltiin, että lisälyöntien (korvikemuuttuja) vaimentaminen 1C-ryhmän rytmihäiriölääkkeillä, kuten flekainidilla, vähentää kuolleisuutta. Satunnaistetussa hoitokokeessa (10 kk) lääkeryhmän 755 potilaasta kuoli 63 (8,3 %) ja lumeryhmän 743 potilaasta 26 (3,5 %) (17). Koska kuolemia oli hoitoryhmässä enemmän, tilanne ilmaistaan number needed to harm eli NNH-lukuna:
Absoluuttisen riskin lisääntyminen = AR h – AR v = 0,083 – 0,035 = 0,048
NNH = 1/0,048 ≈ 21
Kymmenessä kuukaudessa jokaista 21 hoidettua potilasta kohden yksi kuoli. Ensimmäiset tulokset lisääntyneestä kuolleisuudesta julkaistiin vuonna 1989. Flekainidia ehdittiin käyttää paljon potilaille, joille sen käyttö olisi nykyään ehdottoman vasta-aiheista. Sen silloiseen käyttöön kuoli pahimman arvion mukaan enemmän yhdysvaltalaisia kuin Vietnamin sodassa (18).
Esimerkki 6: Gliptiinit diabeteksen hoidossa
Lääkäreille suunnatuissa lääkemainoksissa korostetaan gliptiinien turvallisuusprofiilia, vähäisiä haittoja ja laajaa käyttökokemusta tyypin 2 diabeteksen hoidossa. Mainoksissa gliptiinien teho jää kuitenkin epäselväksi. Käypä hoito -suosituksen mukaan gliptiinit ovat ”kohtalaisen tehokkaita ja turvallisia” (19).
Miten gliptiini vaikuttaa ennusteeseen? Meta-analyysissä gliptiini- ja verrokkiryhmien välillä ei ole havaittu tilastollisesti merkitsevää eroa kuolleisuudessa (RR 1,02, 95 %:n luottamusväli 0,94–1,11) (20). Arvion epätarkkuus huomioiden gliptiinit voivat vähentää kuolleisuutta 6 % tai jopa lisätä sitä 11 %.
Lopuksi
Kliinisen lääketieteen kaikilla erikoisaloilla on tarve soveltaa kliinisen epidemiologian perusperiaatteita. Tämä tulisi huomioida lisäämällä ja integroimalla aihealueen opetusta lääkärien muuhun perus- ja jatkokoulutukseen. Erityisesti kannattaisi panostaa vaikutuksen suuruuden, tulosten sovellettavuuden ja näytön varmuuden ymmärtämiseen (21).
Lääkärin käytännön työssä kliinisen epidemiologian menetelmiä on perinteisesti sovellettu vähän. Ei lienekään yllättävää, että terveydenhuollon ammattilaiset ja potilaat usein yliarvioivat hoitojen hyötyjä ja aliarvioivat haittoja (4,22,23).
Myös jaettu hoitopäätös edellyttää ihanteellisessa tilanteessa potilaan informointia hoitovaihtoehtojen hyödyistä, haitoista ja kustannuksista (24). Hoidon tehoa kuvaavat suureet esitetään kuitenkin hoitosuosituksissa vain harvoin suoraan käyttöön sovellettavassa muodossa (25,26).
Hoitovaihtoehtoja valittaessa on huomioitava päätetapahtumanäytön merkitys potilaalle. Hintavat gliptiinit nousivat Suomessa 2010-luvulla toiseksi käytetyimmäksi diabeteslääkeryhmäksi, vaikka vaikutusta sairauden ennusteeseen ei ole osoitettu. Hoidon kohteena tulisi olla potilas, ei glukoosin mittaustulos. Aihealueen soveltaminen nivoutuu myös laajemmin terveystaloustieteeseen ja terveydenhuollon priorisointiin liittyviin kysymyksiin.
Kiitämme professori Kari Tikkistä kommenteista artikkelia suunniteltaessa ja kirjoittaessa.
Liitetaulukko 1. Laskukaavat kaksiluokkaisille päätetapahtumille.
Olli Nevalainen, Markku Myllykangas: Ei sidonnaisuuksia.
- 1
- Furukawa TA, Guyatt GH, Griffith LE. Can we individualize the ‘number needed to treat’? An empirical study of summary effect measures in meta-analyses. Int J Epidemiol 2002;31:72–76.
- 2
- Berlin JA, Golub RM. Meta-analysis as evidence: building a better pyramid. JAMA 2014;312:603–6. doi:10.1001/jama.2014.8167
- 3
- Barratt A, Wyer PC, Hatala R ym. Tips for learners of evidence-based medicine: 1. Relative risk reduction, absolute risk reduction and number needed to treat. Can Med Assoc J 2004;171:353–8.
- 4
- Morgan DJ, Pineles L, Owczarzak J ym. Clinician conceptualization of the benefits of treatments for Individual patients. JAMA Netw Open 2021;4(7):e2119747. doi:10.1001/jamanetworkopen.2021.19747
- 5
- Akl EA, Oxman AD, Herrin J ym. Using alternative statistical formats for presenting risks and risk reductions. Cochrane Database Syst Rev 2011:CD006776.
- 6
- Othman N, Vitry A, Roughead EE. Quality of pharmaceutical advertisements in medical journals: a systematic review. PLoS One 2009 Jul 22;4(7):e6350.
- 7
- Vartiainen E, Laatikainen T, Salomaa V ym. Sydäninfarkti- ja aivohalvausriskin arviointi Finriski-tutkimuksessa. Suom Lääkäril 2007;62:4507–13.
- 8
- Walter SD. Choice of effect measure for epidemiological data. J Clin Epidemiol 2000;53:931–9. doi: 10.1016/s0895-4356(00)00210-9. PMID: 11004419.
- 9
- Orrapin S, Rerkasem K. Carotid endarterectomy for symptomatic carotid stenosis. Cochrane Database Syst Rev 2017:CD001081.
- 10
- Newcombe RG, Bender R. Implementing Grade: calculating the risk difference from the baseline risk and the relative risk. BMJ Evidence-Based Medicine 2014;19:6–8.
- 11
- Collins R, Reith C, Emberson J ym. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016;388:2532–61. doi: 10.1016/S0140- 6736(16)31357-5. Epub 2016 Sep 8. Erratum in: Lancet 2017;389:602. PMID: 27616593.
- 12
- Ettehad D, Emdin CA, Kiran A ym. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387:957–67. doi: 10.1016/S0140-6736(15)01225-8. Epub 2015 Dec 24. PMID: 26724178.
- 13
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L ym. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376:1670–81. doi: 10.1016/S0140-6736(10)61350-5. Epub 2010 Nov 8. PMID: 21067804; PMCID: PMC2988224.
- 14
- US Preventive Services Task Force, Bibbins-Domingo K, Grossman DC ym. Statin Use for the Primary Prevention of Cardiovascular Disease in Adults: US Preventive Services Task Force Recommendation Statement [published correction appears in JAMA. 2020 Feb 18;323(7):669] [published correction appears in JAMA. 2020 Feb 18;323(7):669-670]. JAMA.
- 15
- Guyatt G, Montori V, Devereaux PJ ym. Patients at the centre: in our practice, and in our use of language. BMJ Evidence-Based Medicine 2004;9:6–7.
- 16
- Svensson S, Menkes DB, Lexchin J. Surrogate outcomes in clinical trials: A cautionary tale. JAMA Intern Med 2013;173:611–12.
- 17
- Echt DS, Liebson PR, Mitchell LB ym. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991;324:781–8.
- 18
- Moore T. Deadly medicine: Why tens of thousands of patients died in America’s worst drug disaster. New York: Simon & Shuster, 1995.
- 19
- Tyypin 2 diabetes. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Sisätautilääkärien yhdistyksen ja Diabetesliiton Lääkärineuvoston asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim 2018 (päivitetty 7.2.2018). www.kaypahoito.fi
- 20
- Zheng SL, Roddick AJ, Aghar-Jaffar R ym. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes: a systematic review and meta-analysis. JAMA 2018;319:1580–91.
- 21
- Tikkinen KAO, Guyatt GH. Understanding of research results, evidence summaries and their applicability – not critical appraisal – are core skills of medical curriculum. BMJ Evid Based Med 2021;26:231–3. doi:10.1136/bmjebm-2020-111542
- 22
- Hoffmann TC, Del Mar C. Clinicians’ Expectations of the benefits and harms of treatments, screening, and tests: a systematic review. JAMA Intern Med 2017;177:407–19. doi:10.1001/jamainternmed.2016.8254
- 23
- Treadwell JS, Wong G, Milburn-Curtis C ym. GPs’ understanding of the benefits and harms of treatments for long-term conditions: an online survey. BJGP Open 2020 Apr; 4(1): bjgpopen20X101016. doi: 10.3399/bjgpopen20X101016. PMID: 32127362; PMCID: PMC7330197.
- 24
- Reito R, Tikkinen K. Potilaslähtöisyys avuksi myös tarpeettomien hoitojen vähentämiseen. Suom Lääkäril 2020;50:2737.
- 25
- Raittio E, Raittio L. Statements considering intervention effects in Finnish clinical practice guidelines: Recommending interventions with non-numeric effect-sizes or unspecified outcomes. J Eval Clin Pract 2020 Jul 31. doi: 10.1111/jep.13455.
- 26
- Morgott M, Heinmüller S, Hueber S ym. Do guidelines help us to deviate from their recommendations when appropriate for the individual patient? A systematic survey of clinical practice guidelines. J Eval Clin Pract 2020;26:709–17. doi: 10.1111/jep.13187. Epub 2019 Jun 17. PMID: 31206241.
Basics of clinical epidemiology in evaluating treatment effects
Meta-analyses of randomized controlled trials provide the most reliable estimates of treatment effects that could be applied in clinical practice. A patient's probability of benefiting from treatment is largely dependent on the baseline risk. In contrast, the relative effect size of treatment may remain constant across different baseline risks. The absolute risk reduction due to treatment is calculated by multiplying the patient's risk level without treatment with the relative risk reduction related to the treatment. The treatment outcome should be patient-important; in the case of preventive treatment, for example, a reduction in morbidity or mortality.
Olli Nevalainen
M.D., Ph.D. in specialist training in general practice
City of Tampere, Hatanpää Health Centre
University of Helsinki, Faculty of Medicine
Tampere University, Faculty of Social Sciences, Health Sciences
olli.neval@gmail.com
Markku Myllykangas