Syväaivostimulaatio lasten ja nuorten dystonioiden hoidossa
Lasten liikehäiriöt ovat etiologialtaan ja taudinkuvaltaan heterogeeninen ryhmä.
Vaikeissa häiriöissä vaste lääkehoitoon on usein vähäinen.
Syväaivostimulaatio voi merkittävästi auttaa osaa potilaista.
Hoitopäätös vaatii moniammatillisen työryhmän arvion liikehäiriön laadusta, neurofysiologiset tutkimukset ja korkealaatuisen kuvantamisen.
Lapsia ja nuoria hoitavien yksiköiden on tärkeää verkostoitua kansallisesti ja kansainvälisesti.

Liikehäiriöt ovat lapsilla harvinaisia ja eroavat sekä kliinisiltä piirteiltään että etiologialtaan aikuisten taudinkuvista. Tämä johtaa alidiagnostiikkaan lapsiväestössä.
Lapsen kehittyvä keskushermosto vaikuttaa liikehäiriön ilmiasuun. Toisaalta liikehäiriö vaikuttaa lapsen kasvavaan tukirankaan kokonaisvaltaisesti, mikä aiheuttaa riskin niveljäykistymien ja virheasentojen kehittymiselle.
Liikehäiriöiden hoitomuotoja ovat suun kautta otettavat ja selkäydinnestetilaan annosteltavat lääkehoidot, lihaksensisäinen botuliinitoksiini, syväaivostimulaatio (DBS, deep brain stimulation) sekä kuntouttavat toimenpiteet (1).
Syväaivostimulaatio on vakiintunut liikehäiriöiden neuromodulaatiohoito aikuisilla, ja sen käyttö on vähitellen lisääntynyt myös lasten liikehäiriöiden hoidossa.
Potilaat hyötyvät eniten varhain aloitetusta hoidosta, joten potilaiden oikea-aikainen tunnistaminen on tärkeää (2). Tässä katsauksessa käymme läpi lasten ja nuorten dystonioiden hoitoa syväaivostimulaatiolla.
Mitä ovat liikehäiriöt?
Tavallisimpia liikehäiriöitä lapsilla ovat hyperkineettiset liikehäiriöt, jotka ilmentyvät tahattomina tai liiallisina liikkeinä. Lapsilla nämä liikehäiriöt liittyvät tyvitumakkeiden, isoaivokuoren, pikkuaivojen ja muiden motoristen ratojen toimintahäiriöön. Hyperkineettisillä liikehäiriöillä tarkoitetaan yleensä dystoniaa, koreaa, atetoosia, myoklonusta, vapinaa, nykimisoireita tai stereotypioita.
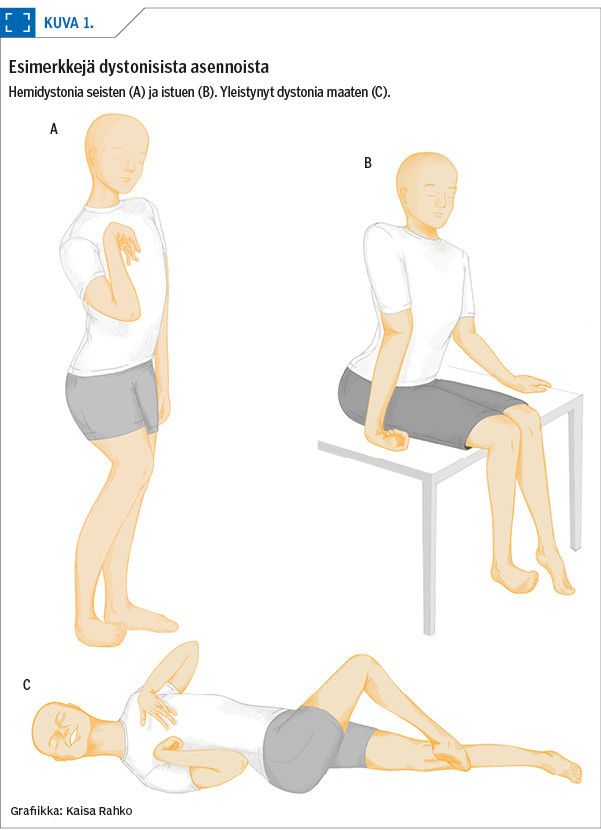
Dystonia on aivojen liikesäätelyn häiriö, jossa tahdonalaiset lihakset supistuvat hallitsemattomasti ja toistuvasti aiheuttaen poikkeavia asentoja (3). Dystoninen oire voi esiintyä vaihdellen eri kehonosissa (kuva 1), ja tahdonalainen liike pahentaa sitä. Unen aikana dystoninen vääntö kuitenkin helpottaa, mikäli pysyviä jäykistymiä ei ole syntynyt.
Negatiiviset liikehäiriöoireet lapsilla ovat vähentynyt lihasjänteys, heikentynyt selektiivinen motorinen kontrolli, ataksia ja apraksia/kehityksellinen dyspraksia. Usein nämä oireet ovat hankalampia määritellä ja tunnistaa kuin positiiviset oireet. Lisäksi hoitovaihtoehtoja on vähemmän (4).
Dystoniat voidaan luokitella useammalla eri tavalla, kuten kliinisten piirteiden tai taudin etiologian mukaan (peritty tai hankinnainen, aiemmin primaari- tai sekundaaridystonia). Nykyisin suositeltu dystonioiden jaottelu on kuvattu taulukossa 1 (3).
Autosomaalisesti vallitsevasti periytyviä dystonioita ovat esimerkiksi torsiodystonia (DYT1), dopaherkkä dystonia (DYT5) ja myokloninen dystonia (DYT11), joita kaikkia on tavattu myös Suomessa.
Dystonian esiintyvyyttä ei ole tutkittu Suomessa. Vuoden 2012 systemaattisen katsauksen ja meta-analyysin mukaan perinnöllisen (primaarin) dystonian esiintyvyys on 16,43/100 000. Meta-analyysissa olivat mukana englannin- ja ranskankieliset julkaisut vuosilta 1985–2010. Kolme julkaisuista oli väestöpohjaisia, loput 12 diagnoosipohjaisia (5).
Hankinnaiset (sekundaariset) dystoniat voivat syntyä esim. akuutin aivovamman, aivoinfarktin, metabolisen ongelman, infektion, autoimmuunitaudin tai neoplasian seurauksena, jos tyvitumakkeet tai muut aivojen liikkeitä säätelevät alueet vaurioituvat. Myös toksiinit tai lääkkeet, kuten neuroleptit, voivat aiheuttaa dystoniaa (6).
CP-oireyhtymä (cerebral palsy) on yleisin lasten hankinnaisen liikehäiriön syy. CP-oireyhtymät voidaan jaotella vallitsevan liikehäiriön mukaan spastiseen, dyskineettiseen (dystonia, atetoosi ja korea) ja ataktiseen muotoon (cp-hanke.fi/materiaalit/cp-vamma/).
Dystonian tunnistaminen voi olla haastavaa ja se voidaan virheellisesti luokitella spastisuudeksi (7). Spastisuudella tarkoitetaan lihasjäntevyyden lisääntymistä lihasta nopeasti venytettäessä, mikä johtuu ylemmän motoneuronin vauriosta. Spastinen CP on yleisin CP:n muoto.
Lapsuusiän tavallisin dystonia liittyy dyskineettiseen CP-oireyhtymään (1,8). Suomessa on arviolta 6 000–7 000 henkilöä, joilla on CP-diagnoosi, ja heistä 9–13 %:lla on dyskineettinen CP (cp-hanke.fi/materiaalit/cp-vamma/).
Lasten liikehäiriöiden luokittelu on haastavaa, koska usein neurologisiin sairauksiin liittyvissä liikehäiriöissä potilaalla voi esiintyä samanaikaisesti useampia liikehäiriötyyppejä etiologiasta riippuen. Esimerkiksi spastisen CP-oireyhtymän yhteydessä potilaalla voi olla dystoniaa, hypotoniaa ja koreoatetoosia (9).
Dystonian hoitovaihtoehdot
Liikehäiriöiden hoito on oireenmukaista ja perustuu tarkkaan ilmiasun luokitteluun. Esimerkiksi spastisuuden ja dystonian hoidot eroavat toisistaan siten, että syväaivostimulaatio lievittää dystoniaa, muttei spastisuutta (3,7), koska ylemmän motoneuronin (pyramidiradan) vaurioon ei syväaivostimulaatiolla saada vastetta. Toisin sanoen syväaivostimulaatio kykenee vaimentamaan vain ekstrapyramidaalisia liikehäiriöitä.
Dystonioiden hoidossa käytetään kuntoutuksen lisäksi lääkehoitoa annosteltuna suun kautta tai suoraan selkäydinnestetilaan, sekä syväaivostimulaatiota. Paikallisessa dystoniassa lääkehoitona voidaan käyttää lihaksensisäisiä botuliinitoksiinipistoksia, dopaherkässä dystoniassa levodopa-karbidopaa ja yleistyneessä dystoniassa triheksifenidyyliä, tetrabenatsiinia, baklofeenia, klonidiinia tai gabapentiiniä (1,10).
Vaste lääkehoitoon on yleensä vain osittainen. Haittavaikutukset estävät usein lääkeannoksen suurentamisen riittävän tehokkaaksi (11). Mikäli dystonia ei reagoi lääkehoitoon riittävästi, tulisi syväaivostimulaatiota harkita.
Mitä on syväaivostimulaatio?
Syväaivostimulaatio on oireita lievittävä neuromodulaatiohoito, jossa aivojen syvissä rakenteissa olevia tumakkeita ja/tai neuraalisia radastoja stimuloidaan heikolla sähkövirralla. Hoito on vakiintunut aikuisten vaikeiden liikehäiriöiden tehokkaaksi ja turvalliseksi hoitomuodoksi 1990-luvun alusta lähtien. Lasten ensimmäinen DBS-operaatio on tehty Ranskassa 1996, ja tällä hetkellä potilassarjoja on julkaistu useista eri keskuksista (12,13,14,15,16).
Stimulointi tapahtuu aivoihin asennettujen elektrodien kautta. Aivoelektrodit asennetaan neurokirurgisessa operaatiossa stereotaktisen laitteiston avulla. Oirekuvan mukaan valittu kohdealue määritetään korkealaatuisten, yleisanestesiassa kuvattujen 3 teslan magneettikuvien perusteella.
Anatomisten kuvien lisäksi käytetään diffuusiokuvatiedosta laskettuja neuraalisia yhteyksiä esittäviä traktografiakuvia. Lisäinformaatiota kohdealueen anatomiasta ja solutason sähköisestä aktiivisuudesta saadaan leikkauksen aikaisesta mikroelektrodirekisteröinnistä (17).
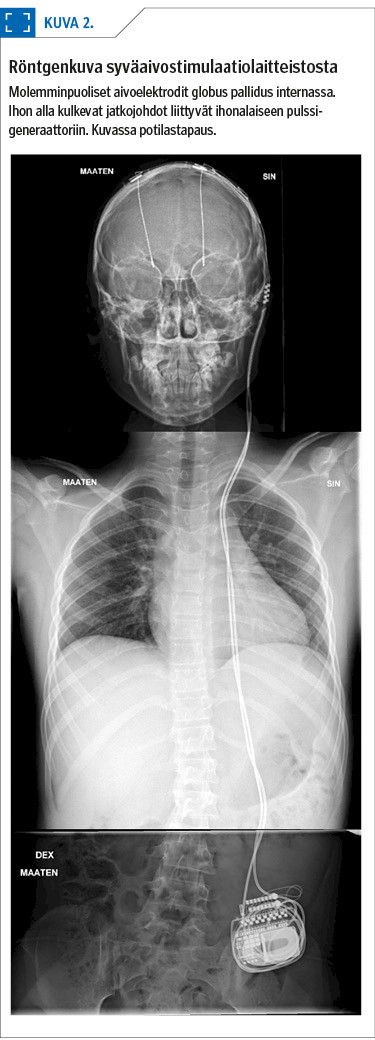
Dystoniassa tavallisin kohdealue on linssitumakkeen pallon sisempi osa (globus pallidus interna, GPi). Lopulliset aivoelektrodit kiinnitetään kallonluuhun poranreiän peittävällä suojakorkilla. Toimenpiteen lopuksi molempiin aivopuoliskoihin asennetut elektrodit yhdistetään kaulalla kulkevien ihonalaisten jatkojohtojen kautta rinnalle tai vatsalle asennettavaan virtalähteeseen (kuva 2).
DBS-toimenpide tehdään lapsille aina yleisanestesiassa. Dystonian hoitoon käytettävällä DBS-laitteistolla on CE-hyväksyntä.
Nykytiedon mukaan pitkäkestoinen DBS-hoito muokkaa neuraalisia yhteyksiä, joten hoitovaste voi parantua pitkänkin ajan kuluttua (18). Stimulaatiota (sähkökentän muotoa ja voimakkuutta) voidaan muuttaa ulkoisella säätölaitteella kliinisen vasteen mukaan. Hoidon keskeytyminen voi johtaa oirekuvan äkilliseen pahenemiseen.
Kenelle hoito sopii?
Koska syväaivostimulaatio on invasiivinen hoitomuoto, tulisi lääkkeellisiä hoitovaihtoehtoja kokeilla ennen neurokirurgista hoitoa (2,10). On kuitenkin huomioitava, että mitä kauemmin dystonia on kestänyt, sitä hitaammin hoitovaste saavutetaan, ja se voi jäädä heikommaksi.
Syväaivostimulaatiota tulisi harkita potilaan hoidossa ennen pysyvien tuki- ja liikuntaelimistön muutosten ilmaantumista (2). Tämän vuoksi lääkehoitokokeilut tai etiologiset selvittelyt eivät saisi viivästyttää syväaivostimulaation harkintaa yhtenä hoitovaihtoehtona.
Hoidon valinnassa huomioon otettavia tekijöitä ovat potilaaseen liittyvät tekijät (ikä, liikehäiriön kesto ja liitännäissairaudet), liikehäiriön kliiniset piirteet (dystonian tyyppi ja vaikeusaste), aiempi dystonian lääkehoito, aiemmat neurokirurgiset hoidot ja geneettiset tekijät (19).
Hoitovaste on yksilöllinen. Hoidon lopullinen teho saattaa näkyä vasta kuukausien tai jopa vuosien kuluttua etenkin, jos dystonia on kestänyt hyvin pitkään. Synnynnäiset (geneettiset) dystoniat vaikuttavat reagoivan hoitoon suotuisammin kuin hankinnaiset dystoniat (1). Meta-analyysissa (16) havaittiin, että syväaivostimulaation parempaa vaikuttavuutta ennakoivat dystonian myöhempi alkamisikä sekä etiologialtaan tuntematon tai peritty dystonia ilman keskushermostopoikkeavuutta.
Varhaisessa vaiheessa aloitettu hoito on liitetty parempaan vasteeseen (2,16). Hyvän vasteen ennusmerkkejä ovat kuvattu DYT-geenivirhe, dystonian lyhyt kesto, nuori ikä ja hyvä kognitiivinen kapasiteetti (20,21). Normaalit motoriset ja sensoriset herätevasteet sekä kortikospinaaliradan normaali anatomia ovat yhteydessä parempaan hoitovasteeseen (22).
Toisessa dystonisen CP:n farmakologisia ja neurologisia hoitoja käsittelevässä systemaattisessa katsauksessa (23) todettiin, että syväaivostimulaatio mahdollisesti vähentää yleistynyttä dystoniaa, mutta teho kipuun ja potilaan hoidettavuuteen vaatii laajempia tutkimuksia.
Osa potilaista, joilla on dyskineettinen/dystoninen CP, hyötyy myös neurostimulaatiohoidosta (24,25,26). Vaikea-asteinen dystonia ja yhtäaikainen spastisuus ennustavat kuitenkin huonompaa hoitovastetta (27).
Status dystonicus on akuutti hätätila, jossa laaja-alaiset lihassupistukset jatkuvat pitkäkestoisesti ja voivat pitkittyessään aiheuttaa rabdomyolyysin ja kuolemaan johtavan monielinvaurion. Status dystonicus voi esiintyä spontaanisti, mutta yleensä sen laukaisee jokin tavallisuudesta poikkeava tilanne, kuten infektio, vaikea ummetus tai äkillinen dystonialääkityksen tai DBS-hoidon keskeytyminen (1,28,29). Elkaimin meta-analyysissa 18 potilaan dystonista kriisiä hoidettiin syväaivostimulaatiolla, ja potilaista 16 hyötyi hoidosta (16).
Syväaivostimulaatiota on käytetty nuorillakin potilailla myös muissa hyperkineettisissä liikehäiriöissä, kuten vaikea-asteisen vapinan tai lääkehoitoon reagoimattoman Touretten oireyhtymän hoidossa (30). Oikean stimulaatiopaikan valinnalla ja elektrodien tarkalla kohdentamisella on suuri merkitys parhaan hoitovasteen saavuttamisessa (31,32).
Kirurgiset haasteet lapsilla
Hoidossa tulee huomioida kehittyvän lapsen ja nuoren rakenteelliset erot, kasvu ja pidempi odotettu elinikä verrattuna aikuispotilaisiin. Lapsen ja nuoren pienempi koko, pehmeä iho ja usein ohut ihonalainen rasvakerros ovat haaste implanttikirurgialle.
Lapsilla käytetään samoja DBS-laitteistoja kuin aikuisilla, mutta laitteisto tulee valita siten, että se on mahdollisimman pienikokoinen ja malliltaan mahdollisimman hyvin potilaan kudoksiin mukautuva. Kulmikkaita reunoja ja hankaukselle alttiita ulokkeita ei saisi olla. Elektrodien ja välijohtojen täytyy mukautua lapsen ja nuoren pituuskasvuun sekä aikuista suurempaan liikkuvuuteen (14,33).
Koska kyse on elinikäisestä hoidosta, tulee DBS-laitteiston mahdollistaa magneettikuvaus (34,35). Virtalähteeksi suositellaan ladattavaa pulssigeneraattoria toistuvien vaihtoleikkausten välttämiseksi, koska jokainen virtalähteen vaihto lisää infektioriskiä (36). Leikkauksen jälkeisiä infektioita on lapsipotilailla kuvattu enemmän kuin aikuisilla (14,15).
Kallo kasvaa merkittävästi seitsemään ikävuoteen saakka, mikä saattaa vaikuttaa elektrodien paikkaan aivoissa; tämä tulee huomioida leikkausta toteutettaessa. Seitsemän ikävuoden jälkeen kasvulla ei ole havaittu olevan merkittävää vaikutusta aivoelektrodien liikkumiseen (37).
Komplikaatiot lapsilla
Pitkäaikaisseurannassa DBS-laitteen teknisiä ongelmia esiintyi lapsilla useammin kuin aikuisilla. Lontoolaisessa 129 lapsipotilaan aineistossa todettiin elektrodeihin liittyviä vikoja 18,4 %:lla potilaista keskimäärin 3,3 vuoden seurannassa (vaihteluväli 0,5–10,3 v). Kirurgisen alueen infektio tuli 4,7–10,3 %:lle lapsista lapsen iästä ja asennettavasta laitteistosta riippuen. Yhdellä potilaalla (0,8 %) todettiin kliinisesti merkityksetön kallonsisäinen vuoto (14).
Saksalais-itävaltalaisen monikeskustutkimuksen mukaan komplikaatiot ovat hoidollisesti haasteellisia ja niiden vähentämiseksi suositellaan yhtenäistettyä hoitoprotokollaa ja seurantaa (38).
Syväaivostimulaatio Suomessa
Suomessa lapsipotilaiden hoito syväaivostimulaatiolla on viime vuosina käynnistynyt. Omassa yksikössämme on arvioitu syväaivostimulaatiohoidon mahdollisuutta yhdeksälle potilaalle, hoitomuotoa on tarjottu kuudelle potilaalle ja neljä DBS-laitteistoa on asennettu. Muualla Suomessa alaikäisille potilaille on tietojemme mukaan tehty viime vuosien aikana kolme DBS-asennusta. Nämä kaikki on tehty Helsingissä.
Valtakunnallisia tilastoja syväaivostimulaatiolla hoidetuista lapsi- eikä aikuispotilaista ei ole. On mahdollista, että osa potilaista, jotka voisivat hyötyä syväaivostimulaatiosta, jäävät vaille hoitoa systemaattisen arvioinnin puutteen vuoksi.
Potilastapaus
Tällä hetkellä 13-vuotias poika tuli DBS-arvioon 11-vuotiaana vaikean yleistyneen dystonian vuoksi. Neurometabolisen taudin oireet olivat alkaneet 2-vuotiaana ja edenneet aaltomaisesti, mikä oli johtanut itsenäisen liikuntakyvyn lähes täydelliseen menettämiseen. Myös käsien käyttö ja syöminen olivat vaikeutuneet (liitevideo 1). Kognitiivinen kapasiteetti oli normaali. Lääkehoito baklofeenilla ei tuonut merkittävää hyötyä.
Liitevideo 1. Preoperatiivinen tilanne. Potilastapaus
Pään magneettikuvauksessa todettiin aivokuorukan (putamen) atrofia. Motoriset herätevasteet olivat lievästi poikkeavat. Aineenvaihduntatutkimusten perusteella epäiltiin mitokondriotautia, mutta eksomisekvensoinnin tulos jäi negatiiviseksi.
DBS asennettiin molemmin puolin globus pallidus internan sensomotoriselle alueelle (kuva 2). Seurannassa dystonian oireet ovat lievittyneet, mikä on helpottanut liikkumista, käden toimintoja ja syömistä (liitevideo 2). Yleinen jaksaminen on parantunut, ja 18 kk:n seurantakäynnillä muun muassa psykologin tutkimus saatiin suoritettua istuen ilman lepohetkiä makuulla. Puheterapeutin arviossa todettiin parempi katseen kohdistaminen, mikä on sujuvoittanut lukemista.
Liitevideo 2. Postoperatiivinen tilanne. Potilastapaus.
Liikehäiriön lieventyessä paino on kääntynyt nousuun ja täydennysravintovalmisteista on voitu luopua. Liikkumisen ja käsien yhteiskäytön parantuessa myös osallistuminen sosiaalisiin tilanteisiin on mahdollistunut.
Hoidon tehon mittaaminen
Lasten liikehäiriöiden hoidon kokonaistavoitteena tulisi olla elämänlaadun paraneminen, arjen toimintakyvyn lisääminen, mahdollisen kivun lievittyminen sekä liikehäiriön aiheuttamien sekundaaristen tukirankamuutosten ilmaantumisen estäminen (39). Kontrolloituja hoitotutkimuksia lasten liikehäiriöistä on kuitenkin niukasti (1,21).
Dystonioiden hoitotutkimusten haasteena on ollut löytää potilaille ja perheille merkityksellinen hoidon tehon mittari. Hoitotutkimuksissa käytetyt mittarit ovat perinteisesti kuvanneet liikehäiriön (dystonian) vaikeusastetta ottamatta huomioon muutosta arjen toimintakyvyssä (39).
Useissa tutkimuksissa hoidon tehon mittarina on käytetty toimintavajetta mittaavia asteikkoja (impairment scales), kuten Burke–Fahn–Marsden Dystonia Rating Scale (BFMDRS) ja Unified Dystonia Rating Scale (UDRS) (41). Vain murto-osassa tutkimuksista on arvioitu perheiden ja potilaiden esiin nostamia huolenaiheita, kuten kipua, päivittäisten toimintojen haasteellisuutta, käsien käytön vaikeutta ja istumista (39).
Dystonian vaikeusasteen mittaaminen nykyisillä menetelmillä (esim. BFMDRS) ei välttämättä kuvaa potilaan arjen toimintakykyä eikä elämänlaatua. Tutkimuksissa on todettu, että vaikka BFMDRS-pisteet muuttuvat vain vähän, potilaat kokevat toimintakykynsä ja elämänlaatunsa parantuneen.
Elia työtovereineen analysoi vastetta DBS-hoitoon dystonisen CP:n hoidossa. Kahdestatoista analysoitavasta tutkimuksesta kahdessa potilaiden elämänlaatu parani merkittävästi hoidon jälkeen (26,40).
Dystoniamittareiden lisäksi voidaan käyttää CP-potilaiden toimintakyvyn luokitteluun kehitettyjä mittareita, jotka mittaavat karkeamotoriikkaa (Gross Motor Function Classification Scale, GMFCS), hienomotoriikkaa (Manual Ability Classification Scale, MACS) ja puhekommunikaatiota (Communication Function Classification Scale, CFCS) (42).
Canadian Occupational Performance Measure (COPM) on puolistrukturoitu haastattelumenetelmä, joka on suunniteltu tunnistamaan potilaan havaitsema muutos toimintakyvyssään. Syväaivostimulaatiolla on saavutettu COPM:n mukaan asetettuja toiminnallisia tavoitteita riippumatta dystonian etiologiasta (43).
Lopuksi
Mahdollisuudet vaikeiden liikehäiriöiden lääkehoitoon ovat usein rajalliset. Syväaivostimulaatio voi merkittävästi lievittää potilaan oireita ja parantaa elämänlaatua silloinkin, kun muut hoitovaihtoehdot ovat osoittautuneet riittämättömiksi.
Syväaivostimulaatiota suunniteltaessa potilasvalinnalla ja hoidon ajankohdalla on tärkeä merkitys. Haasteena on sellaisten potilaiden tunnistaminen, joille hoito mahdollisesti sopii. Hoidon tavoitteiden määrittely yhdessä potilaan ja perheen kanssa on oleellista.
Kyseessä on vaativa hoitomuoto, jossa tarvitaan moniammatillisen työryhmän arviota ja pitkäaikaisseurantaa. Tämän vuoksi hoidot tulisi keskittää lasten liikehäiriöiden hoitoon ja lasten DBS-kirurgiaan perehtyneisiin yksiköihin. Pienen potilasmäärän vuoksi näiden yksiköiden verkostoituminen kansallisesti ja kansainvälisesti on laadukkaan hoidon kannalta tärkeää.
Työryhmä on saanut lasten syväaivostimulaatioprojektiin rahoitusta PPSHP:n Terttu-säätiöltä.
Kiitokset sairaanhoitaja Kaisa Rahkolle kuvan 1 piirtämisestä.
Maija Lahtinen: Koulutus- ja kongressimatkat (Medtronic Boston Scientific).
Jani Katisko: Koulutus- ja kongressimatkat (Medtronic Boston Scientific).
Johanna Uusimaa: Apurahat (Lastentautien tutkimussäätiö).
Heli Helander ja Päivi Vieira: Ei sidonnaisuuksia.
- 1
- Koy A, Lin JP, Sanger TD, Marks WA, Mink JW, Timmermann L. Advances in management of movement disorders in children. Lancet Neurol 2016;15:719–35.
- 2
- Lumsden DE, Kaminska M, Gimeno H ym. Proportion of life lived with dystonia inversely correlates with response to pallidal deep brain stimulation in both primary and secondary childhood dystonia. Dev Med Child Neurol 2013;55:567–74.
- 3
- Albanese A, Di Giovanni M, Lalli S. Dystonia: diagnosis and management. Eur J Neurol 2019;26:5–17.
- 4
- Sanger TD, Chen D, Delgado MR, Gaebler-Spira D, Hallett M, Mink JW. Task force on childhood motor disorders. Definition and classification of negative motor signs in childhood. Pediatrics 2006;118:2159–67.
- 5
- Steeves TD, Day L, Dykeman J, Jette N, Pringsheim T. The prevalence of primary dystonia: a systematic review and meta-analysis. Mov Disord 2012;27:1789–96.
- 6
- Sheehan R, Horsfall L, Strydom A, Osborn D, Walters K, Hassiotis A. Movement side effects of antipsychotic drugs in adults with and without intellectual disability: UK population-based study. BMJ Open 2017;7:e017406
- 7
- Eggink H Kremer D, Brouwer OF ym. Spasticity, dyskinesia and ataxia in cerebral palsy: Are we sure we can differentiate them? Eur J Paediatr Neurol 2017;21:703–6.
- 8
- Mink J. Special concerns in defining, studying, and treating dystonia in children. Mov Disord 2013;28:921–5.
- 9
- Sanger TD, Chen D, Fehlings DL ym. Definition and classification of hyperkinetic movements in childhood. Mov Disord 2010;25:1538–49.
- 10
- Woopen C, Pauls KA, Koy A, Moro E, Timmermann L. Early application of deep brain stimulation: clinical and ethical aspects. Prog Neurobiol 2013;110:74–88.
- 11
- Masson R, Pagliano E, Baranello G. Efficacy of oral pharmacological treatments in dyskinetic cerebral palsy: a systematic review. Dev Med Child Neurol 2017;59:1237–48.
- 12
- Coubes P, Echenne B, Roubertie A ym. Treatment of early-onset generalized dystonia by chronic bilateral stimulation of the internal globus pallidus. Apropos of a case. Neurochirurgie 1999;45:139–44.
- 13
- Air EL, Ostrem JL, Sanger TD, Starr PA. Deep brain stimulation in children: experience and technical pearls. J Neurosurg Pediatr 2011;8:566–74.
- 14
- Kaminska M, Perides S, Lumsden DE ym. Complications of deep brain stimulation (DBS) for dystonia in children – The challenges and 10 year experience in a large paediatric cohort. Eur J Paediatr Neurol 2017;21:168–75.
- 15
- Koy A, Weinsheimer M, Pauls KA ym. German registry of paediatric deep brain stimulation in patients with childhood-onset dystonia (GEPESTIM). Eur J Paediatr Neurol 2017;21:136–46.
- 16
- Elkaim LM, Alotaibi NM, Sigal A ym. Deep brain stimulation for pediatric dystonia: a meta-analysis with individual participant data. North American Pediatric DBS Collaboration. Dev Med Child Neurol 2019;61:49–56.
- 17
- Lozano CS, Ranjan M, Boutet A ym. Imaging alone versus microelectrode recording-guided targeting of the STN in patients with Parkinson’s disease. J Neurosurg 2018:3:1–6.
- 18
- Ni Z, Kim SJ, Phielipp N ym. Pallidal deep brain stimulation modulates cortical excitability and plasticity. Ann Neurol 2018;83:352–62.
- 19
- Bronte-Stewart H, Taira T, Valldeoriola F ym. Inclusion and exclusion criteria for DBS in dystonia. Mov Disord 2011;26(suppl 1):S5–16.
- 20
- Andrews C, Aviles-Olmos I, Hariz M, Foltynie T. Which patients with dystonia benefit from deep brain stimulation? A metaregression of individual patient outcomes. J Neurol Neurosurg Psychiatry 2010;81:1383–9.
- 21
- Hale AT, Monsour MA, Rolston JD, Naftel RP, Englot DJ. Deep brain stimulation in pediatric dystonia: a systematic review. Neurosurg Rev 2018; doi: 10.1007/s10143-018-1047-9.
- 22
- McClelland VM, Fialho D, Flexney-Briscoe D ym. Somatosensory evoked potentials and central motor conduction times in children with dystonia and their correlation with outcomes from deep brain stimulation of the globus pallidus internus. Clin Neurophysiol 2018;129:473–86.
- 23
- Fehlings D, Brown L, Harvey A ym. Pharmacological and neurosurgical interventions for managing dystonia in cerebral palsy: a systematic review. Dev Med Child Neurol 2018;60:356–66.
- 24
- Koy A, Hellmich M, Pauls KA ym. Effects of deep brain stimulation in dyskinetic cerebral palsy: a meta-analysis. Mov Disord 2013;28:647–54.
- 25
- Monbaliu E, Himmelmann K, Lin JP ym. Clinical presentation and management of dyskinetic cerebral palsy. Lancet Neurol 2017;16:741–9.
- 26
- Elia AE, Bagella CF, Ferré F, Zorzi G, Calandrella D, Romito LM. Deep brain stimulation for dystonia due to cerebral palsy: A review. Eur J Paediatr Neurol 2018;22:308–15.
- 27
- Romito LM, Zorzi G, Marras CE, Franzini A, Nardocci N, Albanese A. Pallidal stimulation for acquired dystonia due to cerebral palsy: beyond 5 years. Eur J Neurol 2015;22:426–e32.
- 28
- Lumsden DE, King MD, Allen NM. Status dystonicus in childhood. Curr Opin Pediatr 2017;29:674–82.
- 29
- Allen NM, Lin JP, Lynch T, King MD. Status dystonicus: a practise guide. Dev Med Child Neurol 2014;56:105–12.
- 30
- Martinez-Ramirez D, Jimenez-Shahed J, Leckman JF ym. Efficacy and safety of deep brain stimulation in Tourette syndrome: the international Tourette syndrome deep brain stimulation public database and registry. JAMA Neurol 2018;75:353–9.
- 31
- Lumsden DE, Kaminska M, Ashkan K, Selway R, Lin JP. Deep brain stimulation for childhood dystonia: Is ‘where’ as important as in ‘whom’? Eur J Paediatr Neurol 2017;21:176–84.
- 32
- Katisko J, Lahtinen M. Deep brain stimulation for childhoos dystonia: is “where” as important as in “whom”? Editorial. Eur J Paediatr Neurol 2017; 21:11–12.
- 33
- Lahtinen M. A child is not a small adult: Complications in deep brain stimulation in children: Surgical safety and complications of deep brain stimulation for childhood dystonia. Editorial. Eur J Paediatr Neurol 2017;21:13.
- 34
- Thornton JS. Technical challenges and safety of magnetic resonance imaging with in situ neuromodulation from spine to brain. Eur J Paediatr Neurol 2017;21:232–41.
- 35
- Katisko J. Technical challenges and safety of magnetic resonance imaging with in situ neuromodulation from spine to brain. Editorial. Eur J Paediatr Neurol 2017;21:21–2.
- 36
- Fytagoridis A, Heard T, Samuelsson J ym. Surgical replacement of implantable pulse generators in deep brain stimulation: Adverse events and risk factors in a multicenter cohort. Stereotact Funct Neurosurg 2016;94:235–9.
- 37
- Lumsden DE, Ashmore J, Charles-Edwards G, Selway R, Lin JP, Ashkan K. Observation and modeling of deep brain stimulation electrode depth in the pallidal target of the developing brain. World Neurosurg 2015;83:438–46.
- 38
- Koy A, Bockhorn N, Kühn AA ym.; GEPESTIM consortium. Adverse events associated with deep brain stimulation in patients with childhood-onset dystonia Brain Stimul 2019;12:1111–20.
- 39
- Lumsden DE, Gimeno H, Tustin K, Kaminska M, Lin JP. Interventional studies in childhood dystonia do not address the concerns of children and their carers. Eur J Paediatr Neurol 2015;19:327–36.
- 40
- Vidailhet M, Yelnik J, Lagrange C ym. Bilateral pallidal deep brain stimulation for the treatment of patients with dystonia-choreoathetosis cerebral palsy: a prospective pilot study. Lancet Neurol 2009;8:709–17.
- 41
- Albanese A, Del Sorbo F, Comella C ym. Dystonia rating scales: critique and recommendations. Mov Disord 2013;28:874–83.
- 42
- Elze MC, Gimeno H, Tustin K ym. Burke-Fahn-Marsden dystonia severity, gross motor, manual ability, and communication function classification scales in childhood hyperkinetic movement disorders including cerebral palsy: a ’Rosetta Stone’ study. Dev Med Child Neurol 2016;58:145–53.
- 43
- Gimeno H, Tustin K, Lumsden D, Ashkan K, Selway R, Lin JP. Evaluation of functional goal outcomes using the Canadian Occupational Performance Measure (COPM) following deep brain stimulation (DBS) in childhood dystonia. Eur J Paediatr Neurol 2014;18:308–16.
Deep brain stimulation in the treatment of dystonia in children
Movement disorders are disabling conditions that can cause abnormal posture, torsion, repetitive movement or tremor via the disruption of regulatory areas in the brain. Among paediatric patients, generalised dystonia is the most common primary movement disorder, and dyskinetic CP the most common secondary phenotype, both with limited or unsatisfactory traditional treatment options. The prevalence of dystonia is suggested to be higher than reported since it is not always easy to recognise. Deep brain stimulation (DBS) is an established treatment method for movement disorders in adults, and it has emerged as a significant option for children as well. Treatment seems to be more beneficial when initiated early, since the time spent with dystonia is inversely correlated with the effectiveness of treatment. DBS modifies the basal ganglia-thalamocortical pathways, resulting in alleviation of symptoms. The careful selection of patients and accurate location of the electrodes are important contributors to treatment success. The most prevalent adverse effects are infections or hardware failure; however, these complications are not more prevalent in DBS than in other surgical procedures.
DBS is an effective treatment option for severe paediatric movement disorders and it should be offered in a timely manner to patients with severe symptoms.